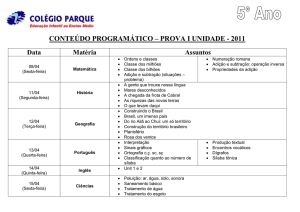
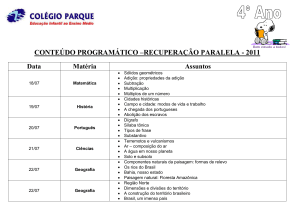
Universidade Federal de Ouro Preto
Compostos Carbonílicos II
(Aldeídos e Cetonas)
Reações no carbono alfa à carbonila
Aula 4
Flaviane Francisco Hilário
1
1 - Acidez do hidrogênio alfa
Hidrogênio α
pKa=19-22
Hidrogênio β
pKa= 40-50
• O hidrogênio recebe a mesma designação do carbono ao
qual está ligado.
• Bases fortes podem remover um Hα para formar os íons
enolato.
2
Efeito de ressonância
Ânion enolato estabilizado por ressonância
3
4
Exercício:
Coloque os compostos abaixo em ordem crescente de
acidez:
5
• Aldeídos e cetonas são totalmente convertidos em seus
enolatos quando se utiliza bases muito fortes.
Ácido mais forte
Ácido mais fraco
• LDA é uma base forte, mas um nucleófilo fraco.
6
Preparação do LDA
7
2 - Tautomerismo ceto-enólico
tautômero ceto
tautômero enol
As formas ceto e enol são isômeros constitucionais (um tipo
especial).
São chamados de tautômeros
8
Estabilidade do enol
Força de ligação:
C=O (720kJ/ mol); C=C (620 kJ/mol)
C-H (440 kJ/mol) ; O-H (500 kJ/mol)
• Para a maioria das cetonas, o tautômero enol é muito
menos estável que o tautômero ceto. Por exemplo, uma
solução aquosa da cetona existe como uma mistura em
equilíbrio de mais de 99,9% do tautômero ceto e menos que
0,1% do tautômero enol.
9
• A fração de um tautômero enol em uma solução aquosa é
consideravelmente maior para uma β-dicetona porque o
tautômero enol é estabilizado pela ligação de hidrogênio
intramolecular.
Ligação de hidrogênio
10
• O fenol é incomum de modo que o seu tautômero enol é
mais estável do que o seu tautômero ceto porque a forma
enol é aromática, mas forma ceto não.
• A interconversão ceto-enol é também chamada
tautomerização ceto-enol ou enolização. A interconversão
de tautômeros pode ser catalisada tanto por ácidos quanto
por bases.
11
Exercício:
Apenas 15% da 2,4-pentanodiona existe como tautômero enol
em água, mas existe 92% na forma enol quando o solvente é
hexano. Explique.
12
Interconversão ceto-enólica catalisada por base
13
Interconversão ceto-enólica catalisada por ácido
14
Exercício:
Desenhe os tautômeros enol para cada um dos compostos
abaixo. Para aquelas substâncias que possuem mais de um
tautômero enol, indique qual é o mais estável.
15
3 - Sítios reativos do ânion enolato (ânion ambidentado/
nucleófilo)
oxigênio rico em elétrons
carbono rico em elétrons
16
Reações de SUBSTITUIÇÃO alfa à carbonila
3.1 - Halogenação
Catalisada por ácido
• Sob condições ácidas, um hidrogênio α é substituído por um
bromo.
17
Catalisada por base
• Sob condições básicas, todos os hidrogênios α são
substituídos por bromo.
18
Aplicação Sintética
• As α-bromo-cetonas são úteis
em síntese orgânica porque
perdem HBr em meio básico
para
dar
cetonas
α,βinsaturadas.
19
3.2 - Alquilação
SN2
• A formação do íon enolato é favorecida pelo uso de bases
fortes: LDA, KH, NaNH2, LiNH2 e KNH2.
• Na prática: usa-se haloalcanos primários para evitar E2, pois
o enolato é uma base razoavelmente forte.
• Pode ocorrer polialquilações. Portanto, a reação é ideal
quando a cetona apresentar um único Hα.
20
Se a cetona não é simétrica – pode-se obter 2 produtos.
21
Exemplos:
1) Preparação da 4-metil-3-hexanona, a partir de uma cetona
contendo não mais que 6 carbonos.
Materiais de partida:
OU
22
• 3-pentanona é simétrica – apenas um produto formado.
23
2)
3)
24
4)
25
3.3 - Alquilação e Acilação do carbono α via intermediário
enamina
• Enamina - reage com eletrófilos da mesma maneira que o
enolato.
• Formação de um único produto alquilado.
26
• Alquilação
Exercício:
Represente o mecanismo das reações a seguir.
27
• OBS.: quando se usa o composto carbonílico, pode-se obter
mistura de produtos.
28
• Acilação
29
3.4 - Adição de Aldol
30
Mecanismo:
• Aldeído – reage mais rapidamente que cetona.
• Cetona
31
3.5 - Condensação aldólica
• Aldol pode sofrer desidratação em altas temperatura e
formar os compostos carbonílicos α,β-insaturdos.
32
Mecanismo:
33
Adição aldólica cruzada
34
Métodos de valor:
35
Adição aldólica intramolecular
Condensação aldólica intramolecular
36
Exercício:
Quais produtos serão obtidos da reação de adição de aldol
para os compostos abaixo:
37
3.6 - Condensação de Claisen
• Condensação de dois ésteres – produto é um β-cetoéster.
38
Mecanismo
39
• Excesso de base torna a reação irreversível
• Em seguida, tratamento com ácido.
40
Condensação de Claisen mista
• Reação entre dois ésteres diferentes.
• Um dos ésteres não possui hidrogênio alfa e o outro é
adicionado lentamente.
41
• A condensação pode ocorrer entre um éster e uma cetona.
42
Exercícios:
Dê o(s) produto(s) para as seguintes reações.
43
• Como preparar os seguintes compostos a partir da 3cianociclo-hexanona?
44
Condensação de Claisen intramolecular (Condensação de
Dieckmann)
Mecanismo
45
• Quais produtos podem ser obtidos se o seguinte cetoaldeído
for tratado com uma base?
46
4 - Adição nucleofílica a aldeídos e cetonas α,βinsaturados
• Dois sítios eletrofílicos
47
Adição nucleofílica direta
48
Adição nucleofílica conjugada
49
Qual produto será majoritário?
Depente da natureza do nucleófilo,
da estrutura do composto
carbonílico
e das condições de reação
50
• Natureza do nucleófilo
51
52
• Estrutura do composto carbonílico
Produto de adição direta
se não há impedimento estérico.
53
• Condições de reação
Utilizar a base adequada.
54
A reação de Michael
• Adição conjugada de um enolato a um composto
carbonílico α,β-insaturado.
55
56
Mecanismo
57
A reação de Stork
• Adição conjugada de um enamina a um composto
carbonílico α,β-insaturado.
58
Anelação de Robinson
• É uma adição de Michael seguida por uma condensação
aldólica simples.
59
Exercício:
Como preparar os compostos a seguir:
60
5 – Bibliografia
• SOLOMONS, G.; FRYHLE, C. Química Orgânica, vol. 2,
7ed. Rio de Janeiro: LTC, 2001. 474p.
• BRUICE, P. Química Orgânica, vol. 2, 4ed. São Paulo:
Pearson, 2006. 641p.
61