ESCOLA SALESIANA DE MANIQUE
TESTE DE AVALIAÇÃO DE QUÍMICA
ANO LECTIVO 2010/2011
Nome: ______________________________________________________ 12.º Ano Turma _____ Nº: _____
Encarregado de Educação: _________________________________________________________________
Classificação: _________________________________________ Professor: _________________________
1. Considere o espectro de absorção de uma solução quando iluminada com luz branca. Os valores dos comprimentos de onda
para algumas radiações visíveis estão indicados no quadro.
Radiação
Vermelho
λ (nm)
> 605
Laranja
595 – 605
Amarelo
570 – 595
Verde
490 – 490
azul
435 – 490
Violeta
< 435
1.1. Indique a cor com que se observa quando iluminada com luz branca.
A) Azul.
B) Amarelo.
C) Verde.
D) Negra.
1.2. Considere que a solução apresenta uma concentração de 0,0025 mol/dm3 e ε = 22000 dm3.mol-1.m-1. Qual a espessura
da célula que contém esta solução?
2. O iodeto de prata, AgI (s), é um sal muito pouco solúvel em água e o seu equilíbrio de solubilidade pode ser traduzido pela
seguinte equação:
( )
(
)
(
)
Seleccione os termos que completam a frase seguinte: “Quando se adiciona uma solução aquosa de cianeto de potássio,
KCN (aq), a uma solução saturada em equilíbrio com AgI, a solubilidade deste sal __________, formando-se o ião complexo
dicianoargentato. A constante relativa ao equilíbrio gerado tem o valor de __________”.
A) … aumenta … 8,3 × 104 …
B) … diminui … 8,3 × 104 …
C) … aumenta … 1,0 ×
1021
…
𝐾𝑠 = 8,3 × 10
17
𝐾𝑓 [𝐴𝑔(𝐶𝑁)2 ] = 1,0 × 1021
D) … não se altera … 1,0 × 1021 …
1
3. Considere uma solução saturada de hidróxido de manganês, Mn(OH)2 a 25 °C. Determine:
3.1. A solubilidade do hidróxido em água.
𝐾𝑤 = 1,0 × 10
14
𝐾𝑠 [𝑀𝑛(𝑂𝐻)2 ] = 1,9 × 10
13
3.2. O pH da solução.
4. Titulou-se 40 cm3 de uma solução de nitrato de amónio, NH4NO3 (aq) com 25 cm3 de uma solução de hidróxido de sódio,
NaOH, 0,001 mol.dm-3.
4.1. Escreva as equações que traduzem a reacção que ocorre durante a titulação.
4.2. Determine a concentração do titulado.
4.3. Indique, justificando, o carácter que terá a solução resultante da titulação no ponto de equivalência.
4.4. Calcule o pH no ponto de equivalência.
4.5. À solução de nitrato de amónio adicionou-se o mesmo volume de uma solução de amoníaco e com a mesma
concentração.
𝐾𝑏 (𝑁𝐻3 ) = 1,7 × 10
5
4.5.1. Justifique o efeito tampão desta nova solução.
4.5.2. Determine o pH da solução tampão.
5. Identifique as proposições verdadeiras.
A) Os sais podem originar soluções alcalinas se os catiões se hidrolisarem.
B) Se um ácido tem uma constante de acidez baixa, a sua base conjugada hidrolisa-se.
C) Quanto maior é a concentração de H3O+ numa solução, menor é o pH da solução.
D) A variação do pH ao longo de uma titulação ácido-base é mais abrupta quando se trata de um ácido forte e de uma base
fraca.
E) Uma base com constante de basicidade alta tem elevado grau de dissociação.
6. Identifique as proposições verdadeiras.
A) Para o mesmo solvente e para o mesmo soluto, o abaixamento crioscópico da solução aumenta quando aumenta a
quantidade de soluto por quilograma de solvente.
B) Para a mesma quantidade de soluto, quanto maior for a massa do solvente maior é o abaixamento crioscópico da
solução.
C) A mesma quantidade de soluto dissolvida em igual massa de diferentes solventes provoca iguais abaixamentos
crioscópicos.
D) A temperatura de solidificação da solução é inferior à temperatura de solidificação do solvente puro.
E) A pressão de vapor de uma solução de um soluto não volátil é maior do que a pressão de vapor do solvente puro.
2
7. Estabeleça a correspondência entre as moléculas e os elementos convenientes das colunas A, B e C.
Moléculas / Iões
A (Geometria)
B (Ângulos de ligação)
C (Estrutura de acordo com a regra do octeto)
1. BeCℓ2
a. Linear
i. 109,5º
1’. Sim
2. CH4
b. Angular
ii. 180º
2’. Não
3. NH3
c. Tetraédrica
iii. 107,3º
4. PH3
d. Triangular plana
iv. 120º
5. BF3
e. Piramidal trigonal
v. 119º
6. SO2
f. Octaédrica
vi. 92º
8. Considere um hidrocarboneto com 6 átomos de carbono.
8.1. Indique a fórmula molecular, considerando que é:
A) Um alcano.
B) Um alceno.
C) Um alcino.
D) Um cicloalcano.
E) Um aromático.
8.2. Classifique os hidrocarbonetos anteriores em saturados e insaturados.
8.3. Represente a fórmula de estrutura dos cinco isómeros estruturais do alcano e indique os seus nomes.
9. As fórmulas gerais R – O – R, R – CHO, R – COOH, R – COO – R correspondem, respectivamente às classes funcionais:
A) Éster, ácido carboxílico, aldeído e éter.
B) Éster, aldeído, ácido carboxílico e éter.
C) Éter, aldeído, ácido carboxílico e cetona.
D) Éter, aldeído, ácido carboxílico e éster.
10. A asparagina, de fórmula O = C (NH2) CH2 CH (NH2) COOH apresenta os grupos funcionais:
A) Amina, amida e aldeído.
B) Amida, amina e éster.
C) Amida, amina e ácido carboxílico.
D) Amina, ácido carboxílico e éster.
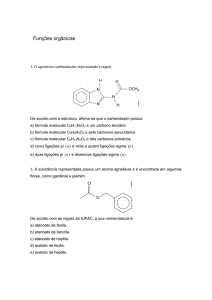
11. Das hipóteses A, B, C e D, seleccione a que corresponde à designação do composto seguinte:
CH3 (CH2)4 CH (CH3) C (CH3) (CH2CH2CH3) CH2 CH3
A) 4-etil-6,7-dimetildecano.
B) 4-etil-4,5-dimetildecano.
C) 7-etil-6,7-dimetildecano.
D) 3,4-dimetil-3-etilnonano.
3
12. Escreva a fórmula de estrutura dos seguintes compostos.
12.1. Éter difenílico.
12.2. 3-etil-3-propil-1,4-pentadieno.
12.3. 1-bromo-5-cloro-4-metil-2-hexeno.
12.4. 3,6-dibromo-6-metil-1,4-heptadiino.
12.5. 3,4-dibromo-ciclo-hexeno.
12.6. Ciclopentino.
12.7. 1,2-propenodiol.
12.8. Benzoato de etilo.
12.9. Fenol.
12.10. 3-bromo-2-etilbutanamida.
13. Considere a fórmula molecular C4H10O. Represente a fórmula de estrutura e indique o nome de:
13.1. Dois isómeros funcionais.
13.2. Dois isómeros de posição.
13.3. Dois isómeros de cadeia.
14. Considere as seguintes fórmulas moleculares dos compostos orgânicos:
A) C2H2.
B) C2H6O.
C) C2H2Cℓ2.
D) CH2Cℓ2.
E) C4H10.
Seleccione, justificando com exemplos, um composto que possa apresentar isómeros.
14.1. Estruturais de cadeia.
14.2. Estruturais de grupo funcional.
4
14.3. Geométricos.
15. Considere os seguintes conjuntos de compostos:
A) Pentanal e 2-pentanona.
B) Butanoato de etilo e Metilpropanoato de etilo.
C) 3-metil-3-cloropentano e 2-metil-3-cloropentano.
D) Ácido butanóico e Propanoato de metilo.
Indique o tipo de isomeria presente em cada conjunto de A a D.
16. Analise a estrutura da molécula de propeno e classifique de verdadeiras (V) ou falsas (F), as seguintes afirmações.
A) Existem apenas átomos de carbono com hibridação sp.
B) Existem dois carbonos com hibridação sp e outro com hibridação sp2.
C) Dois carbonos possuem hibridação sp3.
D) Há apenas um átomo de carbono com hibridação sp3.
E) Dois carbonos possuem hibridação sp2.
17. Considere a molécula de azoto,
2,
e o ião molecular N2+. De acordo com a Teoria das Orbitais Moleculares, a configuração
electrónica de valência da molécula de azoto, no estado de menor energia, é representada por:
(σ2s)2 (σ2s*)2 (π2py)2 (π2pz)2 (σ2px)2
17.1. Escreva a configuração electrónica de valência do ião N2+, no estado de menor energia.
17.2. O ião N2+ tem uma ligação mais forte ou mais fraca que N2. Justifique.
18. F2 e O22- são espécies isoelectrónicas.
18.1. Indique o número de electrões ligantes e antiligantes que há no ião peróxido.
18.2. Os electrões de valência a mais em O22- em relação a O2 são ligantes ou antiligantes?
18.3. Qual a ordem de ligação em O22-?
18.4. Represente a fórmula de estrutura do ião peróxido.
19. O hexafluoreto de urânio, UF6 (M = 352 g.mol-1), é um dos gases mais densos e é utilizado no processo de separação dos
isótopos do urânio.
R = 0,082 atm.dm3.mol-1.K-1
19.1. Que volume ocuparia 1,2 mol deste gás, a 75 °C e a 1,0 atm, se ele fosse um gás ideal?
19.2. Determine um valor aproximado para a densidade do UF6, naquelas condições.
5
6