Gabriela Silva Cesca
Pênfigo foliáceo em cão:
Relato e estudo de caso
Curitiba/PR
2016
Gabriela Silva Cesca
Pênfigo foliáceo em cão:
Relato e estudo de caso
Monografia apresentada como requisito
final à obtenção do Título de Especialista
no curso de Pós-Graduação Especialização
em Clínica e Cirurgia de pequenos animais,
do Centro de Ensino e qualificação
Superior Equalis, do Centro Universitário –
CESMAC, orientada pelo Prof. Me.
Dheywid Karlos Mattos Silva
Curitiba/PR
2016
Gabriela Silva Cesca
Pênfigo foliáceo em cão:
Relato e estudo de caso
Monografia apresentada como requisito
final à obtenção do Título de Especialista
no curso de Pós-Graduação Especialização
em Clínica e Cirurgia de pequenos animais,
do Centro de Ensino e qualificação
Superior Equalis, do Centro Universitário –
CESMAC, orientada pelo Prof. Me.
Dheywid Karlos Mattos Silva
Curitiba, PR 20 de janeiro de 2016
– Orientador –
Curitiba, PR
2016
RESUMO
O pênfigo foliáceo é a doença autoimune mais comum em cães dentro do complexo
pênfigo. O tratamento de escolha para as doenças autoimunes é uso de glicocorticoides
associado ou não a azatioprina, dependendo da gravidade e da evolução dos sinais clínicos,
sendo prescritos também antibióticos sistêmicos e tratamentos tópicos sempre que
necessários. Em decorrência da alta taxa de efeitos adversos com o uso de imunossupressores,
muitos cães evoluem mal clinicamente com o aparecimento de sinais sistêmicos graves,
necessitando de outras terapias de suporte, internamento, e muitas vezes essas alterações
diminuem significantemente a qualidade de vida dos cães ou levam seus responsáveis a
optarem pela eutanásia. É de grande importância que no momento do diagnóstico seja
esclarecido aos proprietários que a doença depende da participação dos responsáveis para que
se tenha um sucesso no tratamento, tanto em relação à administração correta dos
medicamentos quanto à rotina de retornos e realização de exames de acompanhamento. A
paciente do relato foi diagnosticada com pênfigo foliáceo através de exame histopatológico e
tratada com associação de glicocorticoide e azatioprina, respondeu bem inicialmente à terapia,
mas evoluiu mal decorrente dos efeitos colaterais das medicações, evoluindo para óbito.
Palavras chaves: doença autoimune, glicocorticoide, azatioprina.
LISTA DE ABREVIATURAS
ALT
Alanina aminotransferase
BID
Bis in die (leia-se duas vezes ao dia)
DNA
Ácido desoxirribonucleico
IV
Intravenoso
Kg
Quilogramas
L
Litros
Mg
Miligramas
Mm
Milímetros
Mmol
Milimolar
RNA
Ácido ribonucleico
SID
Semel in die (leia-se uma vez ao dia)
TID
Ter in die (leia-se três vezes ao dia)
UI
Unidades internacionais
VO
Via oral
°C
Graus Celsius
%
Porcentagem
>
Acima de
SUMÁRIO
1
INTRODUÇÃO
5
2
REVISÃO DE LITERAURA
6
2.1
Epiderme
6
2.1.1
Camada basal
6
2.1.2
Camada espinhosa
7
2.1.3
Camada granular
7
2.1.4
Extrato córneo
7
2.2
Terapia com Corticóides
7
2.2.1
Classificação
8
2.2.2
Mecanismo de ação
8
2.2.3
Importância do fígado na terapia com glicocorticoides
9
2.2.4
Efeitos imunossupressores
9
2.2.5
O uso de glicocorticoides na terapia de doenças autoimunes
9
2.2.6
Efeitos colaterais
10
2.3
Terapia com azatioprina
10
2.4
Pênfigo Foliáceo
10
2.4.1
Etiopatogenia
10
2.4.2
Sinais clínicos
11
2.4.3
Diagnóstico
12
2.4.4
Tratamento
13
3
RELATO DE CASO
15
4
DISCUSSÃO
17
5
CONCLUSÃO
20
REFERENCIAS
21
5
INTRODUÇÃO
O pênfigo foliáceo é a doença autoimune do complexo pênfigo mais comum em
medicina veterinária (CRAIG, 2013). O primeiro relato em cães desta enfermidade ocorreu
em 1977 (GOMEZ et al, 2004). A doença é caracterizada por lesões em epiderme,
principalmente acometendo os desmossomos, estruturas de adesão da pele (MILLER et al,
2013). Este trabalho visa realizar uma revisão bibliográfica sobre o pênfigo foliáceo canino,
enfatizando as características clínicas, o tratamento e o prognóstico. Além disso, é realizado
um relato de caso de um cão diagnosticado com pênfigo, seguido de uma discussão sobre as
dificuldades encontradas no tratamento deste paciente.
6
2 REVISÃO DE LITERATURA
2.1 Epiderme
A pele é o maior órgão conhecido em mamíferos e possui várias funções como formar
uma barreira protetora, manter forma, auxílio no movimento, produção glandular anexa,
termorregulação, estoque (eletrólitos, água, vitaminas, gordura, carboidratos, proteínas e
outros), percepção sensorial, proteção imunológica, secreção, excreção e produção de
vitamina D (MILLER et al, 2013).
Este grande órgão é dividido em 3 camadas: a epiderme, a derme e o subcutâneo ou
hipoderme. Será realizada uma breve revisão sobre a estrutura da epiderme, já que esta é a
camada mais acometida no pênfigo foliáceo.
A epiderme é a camada mais externa da pele e é composta por várias camadas de
células, agrupadas segundo sua morfologia, forma, polaridade e estado de diferenciação dos
queratinócitos (MILLER et al, 2013).
As camadas da epiderme são divididas, da região mais interna para mais externa, em:
camada basal, camada espinhosa, camada granular e estrato córneo. A epiderme, em cães e
gatos, é fina, possuindo entre 2 a 3 camadas de células nucleadas, sem contar o extrato
córneo. A epiderme possui de 0,1 a 0,5 mm de espessura na maior parte da cobertura dérmica,
entretanto, existem regiões mais espessas como os coxins e o plano nasal, que podem chegar a
uma espessura de 1,5 mm (MILLER et al, 2013).
Existem 4 tipos celulares predominantes na epiderme. Os ceratinócitos, praticamente
as células constituintes da epiderme, perfazendo 85% do total de células desta camada da
pele; os melanócitos, células pigmentares sintetizadoras de tirosina; células de Langerhans,
grupo de células dendríticas com função imunológica local; e células de Merkel, localizadas
na camada basal, possuem tenofilamentos de ceratina e desmossomos, sua principal função é
sensorial (MILLER et al, 2013).
2.1.1 Camada Basal
É a camada mais próxima da derme. Essa região é composta por uma única linha de
células em forma de coluna ou cubo. A maior parte dessas células são ceratinóticos em
constante proliferação, empurrando as células mais velhas no sentido externo, substituindo as
células mortas da pele.
As células são mantidas ligadas por filamentos de queratina K5 e K14 através de
desmossomos, além disso, hemidesmossomos mantém a união entre a epiderme e a derme
(MILLER et al, 2013).
Os desmossomos são o principal componente de ligação na epiderme, é composto por
duas partes, uma delas na membrana de uma das células e a outra, na membrana da célula
vizinha (MILLER et al, 2013). Os componentes dos desmossomos são estruturados em duas
placas circulares de proteínas, as placoglobinas e as desmoplaquinas, uma em cada célula.
Das placas são emitidos filamentos de ligação constituídos por desmogleínas e desmocolinas,
formando assim um complexo adesivo entre as células (BREIKREUTZ et al, 2009;
SONNENBERG et al, 2007).
7
Os hemidesmossomos tem por função manter a união entre a derme e a epiderme. São
complexos juncionais distribuídos ao longo da face interna dos ceratinócitos (PRIESTLEY,
1993). A união entre os ceratinócitos da epiderme e as células da derme é realizada por vários
componentes como as plaqueínas, antígeno penfigóide bolhoso tipo 1 e as plaquetinas. Além
dessas, fazem parte da estrutura moléculas do grupo das integrinas (LEIGH et al, 1994).
2.1.2 Camada Espinhosa
É a camada imediatamente acima da camada basal, composta pelas “células filhas”
desta última camada (SCHWARZ et al, 1979). A camada espinhosa é fina e composta,
geralmente, por duas linhas de células na maior parte da epiderme, mas torna-se muito mais
espessa em regiões de coxins e plano nasal, podendo chegar até 20 linhas de células
(MILLER et al, 2013).
A adesão entre as células da camada espinhosa é realizada por quatro componentes
aderentes: os desmossomos, hemidesmossomos, junções adesivas e adesões focais (SUTTER
et al, 1997).
2.1.3 Camada Granular
Essa camada tem presença variada na epiderme, normalmente contendo até duas linhas
de células, mas pode chegar até 8 linhas de células em regiões sem pelo ou no infundíbulo
piloso do pelo (PRIESTLEY, 1993).
As células dessa camada são achatadas e basofílicas, possuem um núcleo em forma de
estrela e vários grânulos de ceratohialina basofílica no citoplasma (MILLER et al, 2013). Essa
camada tem uma grande capacidade de filtrar os raios ultravioleta.
2.1.4 Extrato Córneo
A camada mais externa da epiderme é o extrato córneo. Nesta camada existem células
anucledas, achatadas e eosinofílicas denominadas corneócitos, essas são o ponto final da
queratinização, sendo constituídas por filamentos de ceratina, proteína matriz e membrana
plasmática reforçada com proteína com lipídeos de superfície associados (FREEDBERG et al,
2003). A principal função do extrato córneo é protetora, formando uma barreira biológica
(MILLER et al, 2013)
2.2 Terapia com corticóides
Os glicocorticóides sintéticos são também denominados anti-inflamatórios esteroidais,
já mencionando um dos seus principais efeitos farmacológicos, o controle do processo
inflamatório, local e sistêmico. Além desta utilização, os glicocorticóides são muito
empregados no controle da atuação do sistema imunológico, dado seu potencial
imunossupressor, sendo, portanto, utilizado em terapias de doenças autoimunes como o
pênfigo foliáceo.
8
2.2.1 Classificação
Os glicocorticóides podem ser classificados de acordo com o período de duração de
seus efeitos em: rápido, intermediário e prolongado. Essa classificação assume como base a
hidrocortisona, glicocorticóide com características farmacológicas semelhantes aos
corticóides endógenos (JERICÓ & DE MARCO, 2010). A tabela 1 demonstra os principais
compostos glicocorticóides, sua potência e utilização em medicina veterinária.
TABELA 1 - Comparação dos principais glicocorticóides de utilidade farmacológica (tendo
como padrão a hidrocortisona)
Composto
Afinidade por Potência
Utilização farmacológica
receptor
glicocorticoide
glicocorticoide
Ação rápida
Hidrocortisona
1,0
1,0
Reposição
emergencial
de
corticoide / Controle de choque
anafilático
Cortisona
0,01
0,8
É convertida em hidrocortisona,
possui ação inativa até a conversão
Ação intermediária
Prednisolona
2,2
4,0
Terapias
sistêmicas
antiinflamatórias e imunossupressoras
crônicas.
Prednisona
0,05
4,0
Inativa até sua conversão em
prednisolona
Metilprednisolona 11,9
5,0
Ação
anti-inflamatória
e
imunossupressiva, quando em
forma de acetato promove
depósito em cães e gatos.
Triancinolona
1,9
5
Ação
anti-inflamatório
e
imunossupressiva. Relativamente
mais tóxica.
Ação prolongada
Dexametasona
7,1
30
Terapias
anti-inflamatórias
e
imunossupressivas
agudas.
Indicada em testes de supressão
adrenal
Betametasona
5,4
30
Semelhante à dexametasona
FONTE: JERICÓ & DE MARCO, 2010
2.2.2 Mecanismo de Ação
Os glicocorticóides interagem com a superfamília dos receptores nucleares. Esses
agentes farmacológicos conseguem atravessar a membrana celular livremente, graças a sua
característica lipossolúvel. No interior celular, a molécula se liga ao seu receptor no núcleo,
forma-se então um complexo funcional, com exposição de um domínio de ligação com o
ácido desoxirribonucleico (DNA). Este complexo (receptor-esteróide/DNA) interfere na
9
transcrição de RNA mensageiros, tanto estimulando quanto inibindo, interferindo portanto, na
produção de proteínas.
É conhecido que parte dos efeitos dos glicocorticóides é devido a uma atuação
inibitória com um ativador de transcrição de DNA. Este ativador, um heterodímero conhecido
como AP-1, está envolvido na indução de vários genes como: do ácido araquidônico e, por
consequência, da cicloxigenase; da colagenase; da interleucina 2 e dos receptores da
interleucina 2.
2.2.3 Importância do fígado na terapia com glicocorticóides
O fígado promove a inativação da maioria dos glicocorticóides, produzindo processos
de oxidação, redução, hidroxilação e conjugação. Vale ressaltar que no caso da prednisona,
fármaco muito utilizado no controle dos sinais clínicos do pênfigo, o fígado possui a
importante função de ativação farmacológica, portanto, é necessário a correta função hepática
para a terapia com prednisona.
O fígado contribui com 70 % da biotransformação dos corticóides, locais extrahepáticos, como os rins, também participam do processo de inativação desses compostos.
A principal via de excreção dos glicocorticóides é a via renal, entretanto, parte dessas
moléculas, após biotransformação, pode ser adicionada à bile e excretada pela via intestinal.
2.2.4 Efeitos imunossupressores
Os glicocorticóides são utilizados na terapia do pênfigo pelo seu efeito
imunomodulador. A imunidade celular é afetada pois os glicocorticóides interferem na
apresentação dos antígenos aos receptores de membrana dos monócitos fagocitários.
Doses farmacológicas de glicocorticóides promovem linfopenia nas espécies
domésticas. Essa linfopenia deve-se a redistribuição dos linfócitos, contidos no
compartimento intravascular, para os compartimentos extracelulares como linfonodos, baço,
medula óssea e ducto torácico. Linfocitólise ocorre apenas em células linfoides de linhagem
neoplásica. A redução dos linfócitos no compartimento intravascular promove uma
diminuição da atuação dessas células no processo imunológico e inflamatório.
A modulação imunológica dos glicocorticóides também ocorre de maneira indireta. As
células B sofrem um processo de ativação, promovendo sua proliferação em resposta a
produção de fatores de crescimento produzidos pelos linfócitos T, como a interleucina-4, os
glicocorticóides inibem acentuadamente a produção desses fatores.
2.2.5 O uso de glicocorticoides na terapia de doenças autoimunes
As doenças imunomediadas, como o pênfigo foleáceo, são relativamente comuns na
medicina veterinária. O uso de glicocorticóides, em muitas ocasiões, é necessário para o
controle dos sinais clínicos da doença de forma crônica.
As doses necessárias para obter a imunossupressão podem variar de 2,2 a 6,6
mg/Kg/dia por via oral de prednisona e prednisolona (JERICÓ & DE MARCO, 2010). A
terapia inicia-se com uma fase de indução, que pode durar de 7 a 10 dias, mas em muitos
10
casos pode se estender até o momento da remissão dos sinais clínicos apresentados. Ao
estabilizar o quadro clínico passa-se a uma fase de manutenção, com o objetivo de reduzir a
dose dos glicocorticóides. Inicialmente, na fase de manutenção, utiliza-se a dose máxima de
2,2 mg/Kg cada 24 horas nos primeiros 7 a 10 dias, após tenta-se instituir a terapia em dias
alternados na menor dose efetiva possível.
2.2.6 Efeitos colaterais
A utilização dos glicocorticóides normalmente atinge o objetivo do controle dos sinais
clínicos do pênfigo foliáceo, mas o uso, em doses suprafisiológicos, desses fármacos promove
o aparecimento de efeitos colaterais importantes, em algumas ocasiões, trazendo efeitos que
dificultam a sobrevida do paciente.
Os efeitos colaterais podem compreender o aparecimento de infecções recorrentes
devido a ação imunossupressora, hemorragias ou perfurações gástricas, diabetes melito,
pancreatite, doenças renais, insuficiência adrenal iatrogênica e hiperadrenocorticismo
iatrogênico.
2.3 Terapia com azatioprina
É um agente imunomodulador comumente utilizado em associação aos
glicocorticóides no tratamento de doenças autoimunes. A azatioprina é um bloqueador da
síntese purina, substâncias constituintes do DNA. Esse fármaco, portanto, promove a
diminuição da produção de DNA, o que reflete em uma diminuição da transcrição de RNA.
Esse efeito é mais importante nos linfócitos T do que em linfócitos B, mas ocorre
interferência nas respostas imunológicas celulares e humorais. A azatioprina ainda, pode
diminuir o número de neutrófilos e monócitos circulantes (DAGLI & LUCAS, 2010).
Os efeitos colaterais mais frequentes podem envolver irritação gastrointestinal,
alterações hepáticas, depressão da medula óssea, maior suscetibilidade à infecções e maior
predisposição ao aparecimento de neoplasias.
2.4 Pênfigo Foliáceo
O Complexo Pênfigo é um grupo de doenças autoimunes raras descrita em cães e
gatos e que é comparada à doença em humanos. Dentre as doenças incluídas no Complexo
Pênfigo, estão pênfigo vulvar, pênfigo vegetante, pênfigo pustular pan-epidérmico, pênfigo
foliáceo, pênfigo eritematoso, pênfigo paraneoplásico, penfigóide bolhoso, sendo que em cães
e gatos são mais comuns cinco tipos de pênfigo dos citados acima. Apesar da similaridade,
existem diferenças significativas entre a doença de cães, gatos e humano (SCOTT et al,
2001).
Dentre as doenças do complexo pênfigo, o pênfigo foliáceo é a doença autoimune
mais comum nos cães (OLIVRY et al, 2009), tendo sido relatado pela primeira vez em 1977
(GOMEZ et al, 2004).
2.4.1 Etiopatogenia
O pênfigo é uma dermatose autoimune onde anticorpos são dirigidos a glicoproteínas
dos desmossomos, principalmente a desmogleína, uma glicoproteína do grupo das caderinas
11
de moléculas de adesão, gerando a perda da adesão entre as células, processo conhecido como
acantólise, gerando ceratinócitos soltos, ou células acantolíticas (AOKI et al, 2005; SCOTT et
al, 2001). Desmossomos são estruturas complexas envolvidas na adesão intercelular e estão
presentes no epitélio e músculo cardíaco (OLIVRY et al, 2009).
Acreditava-se que o alvo dos autoanticorpos, assim como acontece no pênfigo foliáceo
humano, seria a desmogleína 1, mas estudos mostram que menos de 10% dos cães acometidos
foram positivos para autoanticorpo da desmogleina 1. Em um cão com autoanticorpos não
reativos a desmogleína 1, foi encontrado IgG ligando-se a uma região extracelular do
desmossomo do ceratinócito. A natureza dos antígenos alvos dos autoanticorpos permanece
desconhecida (OLIVRY et al, 2009).
Em 1986 comprovou-se que a desmogleína 1 é o autoantígeno do pênfigo foliáceo
clássico e endêmico nos humanos sendo esta desmogleína uma molécula calciodependente
responsável pela adesão e integridade celular (AOKI et al, 2005).
2.4.2 Sinais Clínicos
Em humanos, caracteriza-se por uma doença vesículo-bolhosa e eritematosa, enquanto
que em cães caracteriza-se por uma apresentação pustular (CRAIG, 2013; SCOTT et al,
2001). As lesões principais são pústulas superficiais (MEDLEAU, 2006) mas por serem
frágeis, rapidamente evoluem para sinais secundários como erosões, crostas e alopecia
(OLIVRY et al, 2009; CRAIG, 2013).
Há três forma de pênfigo foliáceo nos cães. A primeira é o pênfigo foliáceo canino
espontâneo, onde Akita e Chow Chow parecem ser mais predispostos e a doença desenvolvese sem histórico prévio de exposição a drogas ou doenças de pele. A segunda forma, pênfigo
foliáceo induzido por drogas, parece ser mais comum em Labrador e Doberman Pinscher. A
terceira forma ocorre em cães com histórico de doenças crônicas de pele (prurido ou alergia)
há 1 ou mais anos. Esses cães com pênfigo induzido por doença crônica de pele também
foram expostos a múltiplas drogas, podendo ser ocasionalmente cães com pênfigo induzido
por drogas (SCOTT et al, 2001).
Lesões muito recentes consistem de máculas eritematosas que rapidamente progridem
para a fase pustular e crostas (SCOTT et al, 2001). Sinais clínicos iniciam-se em face, plano
nasal, narina, periocular e pina (GOMEZ et al, 2004) e depois podem se generalizar. Os pés,
coxins e virilha são frequentemente afetados e raramente há lesões em cavidade oral, regiões
mucocutâneas ou mucosas, ou despigmentação em narinas (CRAIG, 2013). Hiperqueratose de
região plantar é comum e pode ser o único sinal em alguns cães (MEDLEAU, 2006).
Simultaneamente aos sinais dermatológicos, alguns cães poderão apresentar linfadenopatia,
febre, dor, prurido, anorexia, depressão (CRAIG, 2013).
O pênfigo foliáceo atinge normalmente animais adultos a idosos, entre 4 e 8 anos de
idade (GOMEZ et al, 2004), sendo 65% dos casos em cães com 5 anos ou menos (SCOTT et
al (2001). Não há predisposição sexual segundo CRAIG (2013) mas em estudo de GOMEZ et
al (2004), foi demonstrado que machos foram mais acometidos. Algumas raças são mais
predispostas, como Akita, Cocker Spaniel, Husky Siberiano, Chow Chow, Pastor Alemão e
Labrador (GOMEZ et al, 2004). Segundo SCOTT et al (2001) Akita, Chow Chow,
Dachshunds, Doberman Pinscher, Terranova também são raças predispostas.
12
Grande parte dos casos são idiopáticos, mas já se sabe que pode ser decorrente do uso
de medicações, picada de inseto e doenças crônica da pele (CRAIG, 2013). Fatores
ambientais podem iniciar desenvolvimento de sinais clínicos em indivíduos predispostos
(OLIVRY et al, 2009). Em humanos, já foi observado que pacientes que apresentaram
pênfigo foliáceo endêmico eram mais expostos a picada de simulídeos, e que insetos
transmissores de Leishmaniose e Doenças de Chagas também podem aumentar as chances do
aparecimento da doença nos indivíduos predispostos ao pênfigo foliáceo, por um mimetismo
antigênico desencadeando uma resposta autoimune (AOKI et al, 2005). Estudos demonstram
que o uso de produtos tópicos antiparasiticidas podem levar ao aparecimento de lesões de pele
em cães semelhantes ao pênfigo foliáceo, tanto imunologicamente quanto histologicamente.
BISIKOVA et al (2014) demonstraram aparecimento de lesões semelhantes ao pênfigo
foliáceo em cães após o uso de produtos à base de Fipronil + Amitraz + S-metopreno e relata
que as lesões podem estar restritas ao local da aplicação (29% dos cães em seu estudo) ou em
regiões distantes ao local da aplicação (71%) e que em 33% dos cães foi necessária apenas 1
aplicação do produto para o início dos sinais clínicos. OBERKIRCHNER et al (2011)
relataram aparecimento de dermatose pustular acantolítica associada a utilização de
Metaflumizona + Amitraz (Promeris duo), que também foi semelhante ao pênfigo foliáceo
clinicamente, morfologicamente, imunologicamente, e também quanto aos resultados ao
tratamento. Neste estudo, a maioria dos cães apresentaram lesões distantes ao pontos de
aplicação do produto (aproximadamente 63%) e destes, a grande maioria apresentou sinais
sistêmicos (apatia, anorexia, dor, febre, claudicação) e necessitou de medicação
imunossupressora.
2.4.3 Diagnóstico
Devem ser realizados diagnósticos diferenciais para demodicose, piodermite
superficial, dermatofitose, lúpus eritematoso sistêmico, dermatose pustular subcorneana,
erupção medicamentosa, dermatomiosite, dermatose responsiva a zinco, linfoma
epiteliotrópico cutânea (MEDLEAU, 2006), pênfigo eritematoso, lúpus eritematoso discoide,
doenças seborreicas, leishmaniose (SCOTT et al, 2001).
O diagnóstico definitivo é feito baseando-se em histórico, sinais clínicos, associados a
histopatologia e citologia, imunoistoquimica e imunofluorescência (SCOTT et al, 2001).
Presença de pústulas em cabeça, pina e coxins podem ser indícios de que não se trata de
piodermite, além da baixa resposta a antibióticos e baixas doses de corticoide (CRAIG, 2013).
A citologia e imprint deverá ser realizado através de pústulas intactas ou crostas
recentemente formadas e poderá ser observado presença de neutrófilos, células acantolíticas e
eosinófilos (MEDLEAU, 2006). A pústulas são neutrofílicas, podendo ter presença de
eosinófilos, subcorneal, intragranular e subgranular (CRAIG, 2013). As pústulas são estéreis e
cultura bacteriana poderá ser positiva devido a bactérias contaminantes (MEDLEAU, 2006).
Em um estudo de VAUGHAN et al (2010), 63% dos cães tinham infiltrado eosinofílico em
pústulas/crostas, infundíbulo do folículo piloso ou na derme, mas não houve diferença
estatística no aspecto da lesão quando comparado a cães em infiltrado eosinofílico.
Segundo VAUGHAN et al (2010), cães com doenças concomitantes tem mais chance
de ter infiltrado eosinofílico, não sendo atribuído as medicações utilizadas previamente ao
diagnóstico do pênfigo.
13
A histopatologia de preferência deverá incluir pústulas intactas e apresentará pústulas/
vesículas/ fendas subcorneanas contendo neutrófilos e células acantolíticas, com quantidade
variável de eosinófilos (MEDLEAU, 2006; SCOTT et al, 2001).
Há possibilidade de realização de imunoistoquimica e imunofluorescência, mas são
comuns resultados falsos positivos e falsos negativos (MEDLEAU, 2006).
2.4.4 Tratamento
O tratamento depende dos sinais clínicos apresentados. Casos localizados e brandos
poderão ser tratados com esteróides tópicos, enquanto que lesões mais extensas necessitam de
tratamento com prednisona oral. A dose de indução deverá ser mantida até a remissão dos
sinais, embora a alopecia e crostas podem ainda estar presentes. Após a indução, a dose é
reduzida até chegar a dias alternados (SCOTT et al, 2001).
O tratamento em cães inicialmente baseia-se no uso de prednisona ou prednisolona em
altas doses (2-6 mg/kg SID ou BID), tentando reduzir para 1 mg/kg em dias alternados ou a
menor dose que mantenha o paciente sem recidivas dos sinais clínicos. A azatioprina pode ser
usada em cães juntamente com o corticóide, na dose de 1,5-2,5 mg/kg para tentar reduzir a
dose de corticóide (CRAIG, 2013) ou em situações que não houve melhora clínica
significativa em 4 semanas de tratamento apenas com corticosteróide (MEDLEAU, 2006).
Clorambucil, ciclosporina e ciclofosfamida também poderá ser utilizado (MEDLEAU, 2006).
Segundo CRAIG (2013), ciclosporina parece ser ineficiente no tratamento do pênfigo.
GOMEZ et al (2004) indicam iniciar terapia com corticóide associado a azatioprina, com a
menor dose possível, para diminuir os efeitos colaterais. Segundo BISIKOVA et al (2015), o
tratamento pode ser realizado com corticóide (dose acima de 2 mg/Kg), corticóide +
azatioprina ou azatioprina + ciclosporina. A tabela 2 mostra as doses de indução e
manutenção das medicações imunossupressoras esteróides e não-esteróides.
TABELA 2 - TERAPIA COM GLICOCORTICOIDES PARA DOENÇAS DE PELE
AUTOIMUNE E IMUNOMEDIADAS
Fármaco
Dose de indução
Dose de manutenção
Prednisona
1-3 mg/Kg VO q 12-24
0,5-2 mg/Kg VO q 48
horas
horas
Prednisolona
1-3 mg/Kg VO q 12-24
0,5-2 mg/Kg VO q 48
horas
horas
Metilprednisolona
0,8-2,4 mg/Kg VO q 12-24 0,4-0,8 mg/Kg VO q 48
horas
horas
Triancinolona
0,1-0,3 mg/Kg VO q 12-24 0,1-0,2 mg/KG VO q 48horas
72 horas
Dexametasona
0,1-0,2 mg/Kg VO q 12-24 0,05-0,1 mg/Kg VO q 48horas
72 horas
Succinato sódico de
1 mg/Kg IV por um
Outro glicocorticoide em
metilprednisolona terapia
período de 3-4 horas q 24
dias alternados
de pulso
horas por 2-3 dias
consecutivos
Dexametasona terapia de
1 mg/Kg IV uma a duas
Outro glicocorticoide em
pulso
vezes com 24 horas de
dias alternados
intervalo entre as doses.
FONTE: MEDLEAU, 2006 MODIFICADO
14
Tratamento com tetraciclina associada a niancinamida pode ser uma opção terapêutica
no tratamento de pênfigo foliáceo, já que a remissão dos sinais clínicos é comparada ao uso de
glicocorticóide com ou sem azatioprina, e apresenta menores efeitos colaterais. Entretanto, o
início dos efeitos pode ocorrer em 3 a 6 semanas, necessitando muitas vezes do uso de outros
agentes terapêuticos (glicocorticóides tópicos e sistêmicos) durante as primeiras semanas de
tratamento (EDGINTON et al, 2011).
BISIKOVA e colaboradores (2015) demonstraram que o uso de terapia em pulso com
corticóide fizeram com que 61% dos cães do estudo alcançassem remissão completa do
pênfigo foliáceo nas primeiras 12 semanas de tratamento, com menores efeitos colaterais.
Não houve diferença estatística na sobrevivência de cães que utilizaram prednisolona
com os que utilizaram prednisolona associado a azatioprina (GOMEZ et al, 2004). Não houve
diferença estatística entre os cães com e sem infiltrado eosinofílico na resposta ao tratamento
e no resultado final mas cães com infiltrado eosinofílico tem mais chance de ter reações
adversas ao tratamento imunossupressor (VAUGHAN et al, 2010).
Cães com pênfigo foliáceo, induzidos por drogas podem ter remissão da doença
utilizando por pouco tempo corticoide, sem recidiva após desmame (GOMEZ et al, 2004).
É reportado que crianças tem melhor resposta ao tratamento e maior tempo de vida
quando comparado a adultos com pênfigo, mas isso não é observado em cães jovens quando
comparados a cães adultos (GOMEZ et al, 2004).
Segundo GOMEZ e colaboradores (2004), quanto maior o tempo de tratamento e
maior o aparecimento de efeitos adversos, menor o tempo de sobrevivência dos cães e em seu
estudo, a maioria dos cães morreram nos primeiros 10 meses de tratamento.
Utilização de xampus antissépticos (a base de clorexidine ou peróxido de benzoíla) e
antibióticos sistêmicos para controle de piodermite secundária até o controle do pênfigo é
importante (MEDLEAU, 2006). Segundo GOMEZ e colaboradores (2004), a adição de
antibióticos no início do tratamento imunossupressor teve significância na taxa de
sobrevivência.
Os efeitos adversos, devido ao uso crônico de corticóide, muitas vezes em altas doses,
incluem poliúria, polidipsia, pancreatite, ganho de peso, perde de massa muscular, aumento da
ALT, infecções recorrente de pele e bexigas e em menor frequência, insuficiência hepática,
diabetes melito, calcinose cutânea, demodicose, coagulação intravascular disseminada,
convulsões. Muitos desses sinais levam ao proprietário por optar por eutanásia ou os levam a
descontinuar o tratamento de seus cães (GOMEZ et al, 2004).
15
3 RELATO DE CASO
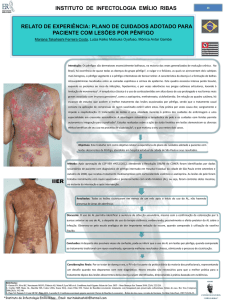
No dia 31/07/15 foi atendida em uma clínica veterinária particular na região de
Curitiba um cão do sexo feminino, aproximadamente 3 anos de idade, mestiça de Doberman
Pinscher, pesando 35,7 kg, não castrada. Seus proprietários relatam lesões crostosas pelo
corpo, especialmente em face, muito dolorido e levemente pruriginosa de evolução de 6
meses. Relatam que paciente já havia passado por consulta em outro estabelecimento
veterinário e foi diagnosticado, segundo os proprietários, uma doença dermatológica que
necessitaria de glicocorticóides para seu controle, mas não foi realizado nenhum exame na
época ou dito o nome da doença a eles. Na época, foi prescrito à paciente Deflazacorte que
estava sendo administrado à paciente desde então. Segundo os proprietários, as lesões
regrediram parcialmente mas se tentavam retirar a medicação, as lesões pioravam em questão
de dias. O exame físico demonstrou lesões crostosas em plano nasal, presença de
despigmentação em narina, crostas em pavilhão auricular, cabeça, periocular, membros. Havia
presença de vesículas e pústulas perioculares, pescoço, dispersas em várias regiões do corpo,
perivulvar. Paciente apresentava piodermite, descamação por todo corpo e segundo a
proprietária o prurido era leve e mais acentuado em região de narina e já relata poliúria,
polidipsia e polifagia. Paciente com febre (40°C) no momento do exame físico, linfonodos
não reativos, ausculta cardiorrespiratória sem alterações, mucosa normocorada, paciente
obesa. Foi realizado raspado de pele, negativo para ácaros mas não realizou-se citologia das
pústulas. Realizado exame de sangue, que demonstrou alterações apenas em ALT (430UI/L) e
Fosfatase Alcalina (1234 UI/L). Indicado suspender as medicações, sendo mantida apenas a
dipirona (25mg/kg TID) para controle da febre e indicado histopatologia da lesão 3 dias
depois, pois seria necessário sedação com paciente em jejum.
No dia 03/08/15 as lesões já haviam progredido bastante, paciente estava pesando 36
kg e foi realizado sedação com propofol para coleta de amostra de pele para histopatologia,
sendo coletado amostra de plano nasal, cabeça, orelha, abdome, sempre que possível sendo
coletado pústulas intactas, totalizando 5 fragmentos. Neste mesmo dia, foi realizado
ultrassonografia abdominal, que não demonstrou alterações, apenas leve reatividade hepática
mas sem alteração em tamanho/ volume do órgão. Foi prescrito cefalexina 30 mg/kg BID,
dipirona 25mg/kg TID, omeprazol 2 mg/kg SID, shampoo à base de clorexidene, pomada
cicatrizante na região dos pontos da biópsia, recomendação de uso de colar elisabetano. Não
foi prescrito glicocorticóide até resultado da histopatologia.
No dia 06/08/15 foi recebido o resultado da histopatologia que concluiu Dermatite de
interface liquenóide e intra-epidermal pustular subcorneal com acantólise, bastante
compatível com pênfigo foleáceo. Havia presença de neutrófilos e eosinófilos e formação de
coleções subcorneais e de crostas queratoleucocitárias nas quais se observam queratinócitos
acantolíticos.
Paciente retornou dia 07/08/15 e foi entregue aos proprietários o laudo da
histopatologia. As lesões neste retorno estavam bem mais extensas, e paciente não podia
permanecer sem colar elisabetano, pois demonstrava muito incômodo com lesões em face, e
proprietária manteve o uso da dipirona pois sem a medicação paciente ficava mais apática. Foi
prescrito prednisolona 2 mg/kg BID e azatioprina 2 mg/kg SID, ambas manipuladas devido ao
peso da paciente. Foram mantidos a cefalexina, omeprazol, dipirona e banhos antissépticos.
16
No dia 12/08/15 paciente retornou para retirada dos pontos da biópsia e proprietários
não haviam iniciado as medicações imunossupressoras ainda, pois demoraram a pedir a
manipulação das drogas.
Paciente retornou apenas no dia 01/09/15, pois havia tido piora clínica segundo
proprietários e foi constatado que os mesmos pararam de forma abrupta a prednisolona
manipulada, pois havia acabado e não tinham entendido que seu uso era continuo, mesmo
estando esta informação presente na prescrição médica. Paciente estava apenas com
azatioprina. Proprietários suspenderam também o antibiótico sem consentimento da médica
veterinária. Lesões haviam regredido parcialmente, mas com a suspensão da prednisolona, as
lesões retornaram, assim como a febre. Foi realizado exame de sangue, que demonstrou
aumento da ALT (719 UI/L) e Fosfatase Alcalina (> 2000 UI/L) em relação ao exame anterior
e o leucograma apresentou linfócitos no limite inferior da normalidade. Solicitado ao
proprietário o retorno das medicações como prescritas já que os sinais clínicos haviam
piorado.
No dia 21/09/15 paciente retornou, sem febre, feridas bem cicatrizadas, apenas com
descamação no local onde haviam crostas, sem piodermite nem prurido nas lesões, já podia
ser mantida sem colar elisabetano. Ainda apresentava-se com poliúria, polidipsia, polifagia,
levemente ofegante. Mantido as doses das medicações imunossupressoras e suspenso
antibiótico, recomendado banhos com xampus hidratantes e hidratantes tópicos na pele, pois
havia muita descamação.
Solicitou-se retorno da paciente em 20 dias com expectativa de iniciar a redução da
dose dos imunossupressores mas paciente retornou apenas no dia 15/10/15, com alterações
clínicas como apatia, respiração ofegante, perda de apetite e hipertensão, outras avaliações
físicas estavam dentro de valores de referência. Exame de sangue demonstrou intensa
leucocitose com neutrofilia e monocitose, aumento da ALT (1214 UI/L), AST aumentada
(279 UI/L), Fosfatase Alcalina aumentada (>2000 UI/L), Glicemia 161 mg/dl, Bilirrubina
aumentada (3,5 mg/dl), Uréia baixa (6mg/dl), Creatinina baixa (0,2 mg/dl). O ultrassom
abdominal demonstrou fígado severamente aumentado de tamanho (alcançando região
mesogástrica) e ecogenicidade aumentada e demais órgãos dentro do padrão de normalidade.
Paciente foi internada com suspeita de insuficiência hepática podendo evoluir para
encefalopatia hepática. Foi realizado sondagem nasogástrica para alimentação e durante o
internamento passou a apresentar taquipnéia, taquicardia, padrão respiratório abdominal e
demais parâmetros dentro da normalidade. No dia 16/10/15 foi realizado hemogasometria,
que demonstrou pH dentro da normalidade, hipercalemia, e apresentou diminuição de
bicarbonato. Durante o internamento do dia 17/10/15 paciente estava muito apática, não se
levantava, foi necessário colocação de sonda nasal para oxigenioterapia e manteve-se na
alimentação via sonda nasogástrica. Demais parâmetros apresentava-se dentro da
normalidade. Paciente também apresentava níveis elevados nos valores de Lactato (7,87
mmol/L) e Bilirrubina (3,7 mg/dl) e Albumina no limite inferior (2,3 g/dl). Proprietários já
estavam cogitando a possibilidade de eutanásia pois não queriam suspender as medicações
imunossupressoras, mesmo sabendo que paciente estava com graves efeitos colaterais.
No dia 18/10/15 paciente veio à óbito.
17
4 DISCUSSÃO
O caso relatado envolve uma paciente mestiça Doberman pinscher, corroborando com
SCOTT e colaboradores (2001). Além disso, a idade da paciente é condizente com o relatado
por GOMEZ e colaboradores (2004) e SCOTT e colaboradores (2001). Foi iniciado o
tratamento com Deflazacorte, prescrito em outro estabelecimento veterinário, mas apesar da
remissão das lesões, vale ressaltar que esta molécula de corticóide não faz parte dos
tratamentos clássicos em casos de doenças auto-imunes, dando-se preferência, para
prednisona ou prednisolona associada ou não a azatioprina (CRAIG, 2013). Além disso, o
tratamento foi iniciado sem uma confirmação histológica, apenas pelo exame dermatológico
(inspeção). É importante considerar os diagnósticos diferenciais para doenças crostosas e
pustulares nas regiões afetadas, como demodicose, dermatofitose, leishmaniose, lúpus
eritematoso sistêmico e discóide, piodermites superficial, doenças seborréicas (MEDLEAU,
2006; SCOTT et al, 2001), sendo que doenças auto-imunes são raras.
Este caso demonstra um grande problema dentro da dermatologia veterinária. Muitos
clínicos sabem que diversas lesões dermatológicas respondem bem à terapia com
glicocorticóides e, portanto, muitas vezes, a terapia é prescrita antes da realização de exames
diagnósticos. Além disso, não é repassado aos responsáveis os riscos inerentes ao uso
contínuo dos glicocorticóides nem são recomendados exames de acompanhamento.
A paciente apresentou localização e aspecto de lesões características da doença, como
descrito por GOMEZ e colaboradores (2004). Entretanto, a paciente apresentou
despigmentação nasal, lesão raramente observado (CRAIG, 2003). Além das lesões
dermatológicas, paciente no momento da primeira consulta, já apresentava sinais de poliúria,
polidipsia, poliúria e obesidade, o que pode ser decorrente do uso crônico de corticóide, já que
estava sendo tratada com Deflazacorte há 6 meses. Também apresentava hipertermia e dor nas
lesões, sinais comuns em casos de envolvimento sistêmico do pênfigo (CRAIG, 2003). A
avaliação bioquímica do sangue demonstrou alterações em enzimas hepáticas, também
ocasionado, possivelmente, pelo uso crônico de corticóides.
Foi prescrito antibióticos sistêmicos e banhos antissépticos para controle da infecção
bacteriana secundária, até resolução das lesões. Segundo GOMEZ e colaboradores (2004), a
adição de antibióticos no início do tratamento imunossupressor teve significância na taxa de
sobrevivência.
O resultado histopatológico demonstrou alterações compatíveis com pênfigo foliáceo
(MEDLEAU, 2006) e neste caso houve infiltrado eosinofílico (VAUGHAN et al, 2010).
Confirmado o diagnóstico de pênfigo foliáceo através do exame histopatológico, fezse necessário o tratamento imunossupressor com uso de glicocorticóides associado a
azatioprina. A escolha por esta associação foi realizada com o objetivo de, no futuro, diminuir
a dose de glicocorticóide o máximo possível, contando com a manutenção da remissão pela
azatioprina. Esta estratégia tem como base terapêutica manter a imunossupressão necessária
para a manutenção da paciente com o mínimo de efeitos colaterais sistêmicos possíveis, como
descrito por BISIKOVA e colaboradores (2015). Além disso, o uso da azatioprina é
recomendado neste caso, pois a paciente não apresentou remissão completa em 4 semanas
apenas com o uso de corticóide, como citado por MEDLEAU (2006).
18
Optou-se pela utilização de prednisolona (fármaco ativo) ao invés da prednisona (um
pró-fármaco que necessita de metabolização hepática para ser ativado), pelo fato da paciente
já apresentar alterações em enzimas hepáticas e reatividade hepática no ultrassom.
Todo tratamento crônico é dependente do responsável pelo animal. Neste caso houve
descontinuidade do tratamento com glicocorticóide, sem consentimento do clínico
responsável, por um período de uma semana, o que foi suficiente para o retorno das lesões.
Além disso, vale ressaltar que a suspensão abrupta do uso de glicocorticóides pode gerar
consequências severas, como hipoadrenocorticismo iatrogênico. A importância da realização
da medicação segundo a indicação foi reenfatizada para os responsáveis pelo paciente durante
o retorno.
Como a paciente permaneceu um período de uma semana apenas com azatioprina, mas
não manteve a remissão dos sinais, foi necessário a reintrodução da terapia com
glicocorticóide sistêmico, apesar do aumento de extravasamento de enzimas hepáticos
avaliado em novos exames.
No retorno deste segundo início de tratamento, a paciente apresentou melhora clínica
em relação as lesões penfigóides, ou seja, remissão num período inferior a quatro semanas de
tratamento, pode-se, portanto, dizer que o tratamento foi eficaz (MEDLEAU, 2006). Os sinais
sistêmicos, no entanto, permaneciam excetuando-se a dor e a febre.
A paciente evolui mal sistemicamente, iniciando sinais clínicos que ainda não haviam
sido observados no caso. Em nova avaliação hematológica, a paciente apresentou alterações
condizentes com a utilização crônica de glicocorticóides (GOMEZ et al, 2004). Além disso, a
paciente demonstrou aumento de extravasamento de enzimas hepáticas associada à
diminuição sérica de uréia e creatinina, podendo indicar insuficiência hepática. Em avaliação
ultrassonográfica, foi possível observar um grande aumento do volume hepático, podendo ser
esta a causa da dispnéia apresentada pela paciente, a hepatomegalia deslocando o diafragma
no sentido cranial, limitando a expansão torácica e obrigando o paciente a compensar
expansão com frequência.
A sequência do internamento foi realizada com tratamento e manobras de manutenção
da homeostase da paciente. Foi realizado exame de hemogasometria, que apesar de
demonstrar pH normal, indicava diminuição de bases (base excess) e de bicarbonato, portanto,
a taquipnéia pode ser compensatória a este fato (RABELO & RIBEIRO, 2012).
Os níveis aumentados de lactato indicam hipoperfusão periférica (RABELO &
RIBEIRO, 2012) e podem ser explicados por dois fatores neste paciente. O primeiro é a
dispnéia em si. No exame de hemogasometria constatou-se que a paciente apresentava uma
saturação de oxigênio de 90% (referência 95% segundo HASKINS, 2015), ou seja, não havia
uma quantidade de oxigênio normal sendo transportado pelo sangue. O segundo fator que
deve ser considerado, é a compressão das estruturas abdominais causada pela hepatomegalia,
incluindo a compressão da veia cava abdominal e aorta caudal. Esse último fato, além de
dificultar a perfusão tecidual, promove um acúmulo de líquido na região cranial do paciente,
podendo aumentar valores de pressão arterial sistêmica.
A paciente veio a óbito naturalmente com a piora do quadro no internamento, apesar
do tratamento realizado. Os responsáveis já cogitavam a realização de eutanásia, pois havia a
necessidade da descontinuidade do tratamento com os glicocorticóides, o que poderia
19
propiciar o reaparecimento das lesões de pele e, consequentemente, do desconforto da
paciente. Este caso clínico se assemelha ao desfecho descrito por GOMEZ e colaboradores
(2004), tanto em tempo de sobrevida após o tratamento, sendo que este paciente já foi
atendido com 6 meses de tratamento prévio, quanto pelo fato de que as complicações
decorrentes do tratamento com glicocorticóides poderem gerar dificuldade à vida, à ponto de
levarem os responsáveis a requisitar a eutanásia.
O tratamento de doenças crônicas em medicina veterinária é complexo, dispendioso e,
em algumas situações, pode ser frustrante. O clínico é dependente dos responsáveis no
tratamento, já que o uso correto das medicações melhora a sobrevida e diminui a incidência
de efeitos colaterais. No caso específico do pênfigo é citado que muitos pacientes não tem um
período prolongado de sobrevida ou apresentam efeitos colaterais ao tratamento severos,
diminuindo a qualidade de vida (GOMEZ et al, 2004). É importante conscientizar os
responsáveis sobre o tratamento no momento do diagnóstico, ressaltando a dose a ser
utilizada, o período de tratamento, a importância do comparecimento nos retornos marcados e
a atenção ao início de sinais clínicos durante o tratamento.
A terapia com corticóides ainda é a principal arma no tratamento do pênfigo (MILLER
et al, 2013), mas também é um grande limitador na sobrevida dos pacientes devido a
frequente incidência de efeitos colaterais.
Deve-se tomar cuidado ao utilizar novas moléculas de glicocorticóides,
principalmente, pela falta de pesquisa na eficiência das moléculas no tratamento do pênfigo e
da gravidade de possíveis efeitos colaterais descritos ou não descritos.
20
5 CONCLUSÃO
As doenças auto-imunes são raras na clínica de pequenos animais sendo essencial a
realização de diagnósticos diferenciais para as doenças pustulares, crostosas e descamativas
nessas espécies. Raspado de pele, histopatologia e citologia são úteis nessa investigação e não
se recomenda iniciar um tratamento apenas pela inspeção médica e localização das lesões. A
maioria dos casos de pênfigo foliáceo tem uma evolução desfavorável, não só pela doença em
si mas também pelos efeitos colaterais das medicações utilizadas. Desta forma, é importante
que haja um acompanhamento clínico dos pacientes e que seja introduzido um tratamento de
manutenção com as menores doses possíveis que se mantenha o quadro em remissão ou
realização de associações de imunossupressores. Deve-se deixar claro aos proprietários os
riscos inerentes ao tratamento e a importância de realiza-lo conforme a recomendação do
médico veterinário, sem alterações ou suspensões das medicações.
21
REFERÊNCIAS
AOKI, V.; RIVITTI, E. A.; ITO, L. M.; HANS-FILHO, G.; DIAZ, L. A. Perfil histórico da
imunopatogenia do pênfigo foleáceo endêmico (fogo selvagem). Anais Brasileiros de
Dermatologia. v. 80. n. 3. p. 287-292. 2005.
BISIKOVA, P.; LINDER, K. E.; OLIVRY, T. Fipronil-amitraz-S-methoprene-triggered
pemphigus foliaceus in 21 dogs: clinical, histological and immunological characteristics.
Veterinary Dermatology. v. 25. p. 103-e30. 2014.
BISIKOVA, P.; OLIVRY, T. Oral glucocorticoid pulse therapy for induction of treatment of
canine pemphigus foliaceus – a comparative study. Veterinary Dermatology. v. 26. p. 354e77. 2015.
BREIKREUTZ, D.; MIRANCEA, N; NISCHT, R. Basement membranes in skin: unique
matrix structures with diverse functions? Histochemistry Cell Biology. v.132, p.1–10. 2009.
CRAIG, M. Disease facts: pemphigus foliaceus in the dog e cats. Companion animal. v.18,
n.8, p. 374-377, outubro. 2013.
DAGLI, M. L. Z.; LUCAS, S. R. C. Agentes antineopláciso e imunomoduladores in
SPINOSA, H. S.; GORNIÁK, S. L.; BERNARDI, M. M. Farmacologia Aplicada à Medicina
Veterinária. 5. ed Rio de Janeiro: Guanabara Kooguen, p. 641-660. 2011.
EDGINTON, H. D.; SCOTT, D. W.; MILLER, W. H.; GRIFFIN, J. S.; ERB, H. N. Efficacy
of tetracycline and niacinamide for the treatment of superficial pemphigus (pemphigus
foliaceus, pemphigus erythematosus) in 34 dogs (1995-2010). The Japanese Journal of
Veterinary Dermatology. v.17. n. 4. p. 241-246. 2011.
FREEDBERG, I. M.; EISEN, A. Z.; WOLFF, K.; AUSTEN, K.F.; GOLDSMITH, L. A.;
KATZ, S. I. Fitzpatrick's Dermatology In General Medicine. New York: Global publishing,
2003.
GOMEZ, S. M.; MORRIS, D. O.; ROSENBAUM, M. R.; GOLDSCHMIDT, M. H. Outcome
and complications associated with treatment of pemphigus foliaceus in dogs: 43 cases (19942000). Journal of the American Veterinary Medical Association. v. 224, n. 8, p. 13121316, abril. 2004.
HASKINS, S. C. Monitoring Anesthetized Patients in GRIMM, K. A.; LAMONT, L. A.;
TRANQUILLI, W. J.; GREENE, S. A.; ROBERTSON, S. A. Lumb & Jones Veterinary
Anesthesia and Analgesia. 5. ed. Hoboken: Jonh Wiley and Sons, p. 86-113. 2015.
JERICÓ, M. M.; DE MARCO, V. Anti-inflamatórios esteroidais in SPINOSA, H. S.;
GORNIÁK, S. L.; BERNARDI, M. M. Farmacologia Aplicada à Medicina Veterinária. 5. ed
Rio de Janeiro: Guanabara Kooguen, p. 261-271. 2011.
LEIGH, I. M.; BIRGITTE, L. E.; WATT, F. M. The Keratinocyte Handbook, New York:
Cambridge University Press, 1994.
22
MEDLEAU, L.; HNILICA, K. A. Small animal dermatology: a color atlas and therapeutic
guide. 2. ed. Philadelphia: Elsevier. 2006.
MILLER, W. H.; GRIFFIN, C. E.; CAMPBELL, K. L. Muller & Kirk´s small animal
dermatology. 6.ed. Philadelphia: Elsevier, 2013.
OBERKIRCHNER, U.; LINDER, K. E.; DUNSTON, S.; BISIKOVA, P.; OLIVRY, T.
Metaflumizone-amitraz (Promeris)-associated pustular acantholytic dermatites in 22 dogs:
evidence suggests contact drug-triggered pemphigus foliaceus. Veterinary Dermatology. v.
22. p. 436-448. 2011.
OLIVRY, T.; LINDER, K. E. Dermatoses affecting desmosomes in animals: a mechanistic
review of acantholytic blistering skin diseases. Veterinary Dermatology. v. 20. p. 313-326.
2009.
PRIESTLEY G. C. Molecular Aspects of Dermatology. New York: John Wiley and Sons,
1993.
RABELO, R. C.; RIBEIRO, C. A. Conceitos de hemodinâmica e microcirculação in
RABELO, R. C. Emergências de pequenos animais: condutas clínicas e cirúrgicas. Rio de
Janeiro: Elsevier, p. 25-31. 2012.
SCOTT, D.W. et al. Muller & Kirk´s - Dermatologia dos pequenos animais. 6.ed.
Philadelphia: Saunders, 2001.
SCHWARZ, R.; LE ROUX, J. M.; SCHALLER, R.; NEURAND, K. Micromorphology of
the skin (epidermis, dermis, subcutis) of the dog. Onderstepoort Journal Veterinary
Research. v. 46, p. 105, 1979.
SONNENBERG, A.; LIEM, R. K. H. Plakins in development and disease. Experimental
Cell Research. v. 313, p. 2189–2203. 2007.
SUTER, M. M.; CRAMERI, F. M.; OLIVRY, T.; MUELLER, E.; VON TSCHARNER, C.;
JENSEN, P. J. Keratinocyte biology and pathology. Veterinary Dermatology. v. 8, n. 2, p.
67-100, junho 1997.
VAUGHAN, D. F.; HODGIN, E. C.; HOSGOOD, G. L.; BERNSTEIN, J. A. Clinical and
histopathological features pemphigus foliaceus with and without eosinophilic infiltrates: a
retrospective evaluation of 40 dogs. Veterinary Dermatology. v. 21. p. 166-174. 2010.