Questões do ENEM de
Química
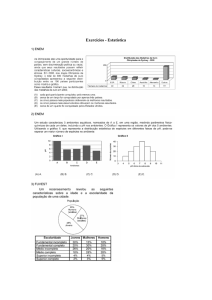
01. (Enem-MEC) Pelas normas vigentes,
o litro de álcool hidratado que abastece os veículos
deve ser constituído de 96% de álcool puro e 4% de
água (em volume). As densidades desses
componentes são dados abaixo:
Um técnico de um órgão de defesa do
consumidor inspecionou cinco postos suspeitos de
venderem álcool hidratado fora das normas. Colheu
uma amostra do produto em cada posto, mediu a
densidade de cada uma, obtendo:
A partir desses dados, o técnico pôde
concluir que estavam com o combustível adequado
somente os postos:
a) I e II.
b) b) I e III.
c) c) II e IV.
d) III e V.
e) IV e V.
02. (Enem-MEC) Um dos problemas ambientais
decorrentes da industrialização é a poluição atmosférica.
Chaminés altas lançam ao ar, entre outros materiais, o
dióxido de enxofre (SO2) que pode ser transportado por
muitos quilômetros em poucos dias. Dessa forma, podem
ocorrer precipitações ácidas em regiões distantes,
causando vários danos ao meio ambiente (chuva ácida).
Um dos danos ao meio ambiente diz respeito à corrosão
de certos materiais. Considere as seguintes obras:
I. monumento Itamarati – Brasília (mármore).
II. esculturas do Aleijadinho – MG (pedrasabão, contém carbonato de cálcio).
III. grades de ferro ou alumínio de edifícios.
A ação da chuva ácida pode acontecer em:
a) I, apenas.
b) I e II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II, III.
03. (ENEM–MEC) Combustão ou queima é
uma reação química exotérmica entre uma substância (o
combustível) e um gás (o comburente), geralmente o
oxigênio, para liberar calor e luz. Durante a reação de
combustão são formados diversos produtos resultantes da
combinação dos átomos dos reagentes. No caso da
queima em ar de hidrocarbonetos (metano, propano,
gasolina, etanol, diesel, etc).
Os processos de combustão são responsáveis pela
produção de cerca de 85 % da energia do mundo,
inclusive o Brasil, em transporte (carros, aviões, trens,
navios, etc), usinas termelétricas, processos industriais,
aquecimento doméstico, geradores, cozimento de
alimentos e outros. Podemos concluir que a relação
entre as massas de gás oxigênio consumido na
combustão completa de um mol, respectivamente, de
metanol, etanol e octano é:
a) 3 : 6 : 24
c) 4 : 7 : 25
e) 6 : 10 : 34
b) 3 : 6 : 25
d) 6 : 9 : 27
04. (ENEM – 2004) Em setembro de
1998, cerca de 10.000 toneladas de ácido sulfúrico
(H2SO4) foram derramadas pelo navio Bahamas no
litoral do Rio Grande do Sul. Para minimizar o
impacto ambiental de um desastre desse tipo, é
preciso neutralizar a acidez resultante. Para isso
pode-se, por exemplo, lançar calcário, minério rico
em carbonato de cálcio (CaCO3), na região atingida.
A equação química que representa
a neutralização do H2SO4 por CaCO3, com a
proporção aproximada entre as massas
dessas substâncias é:
Pode-se avaliar o esforço de mobilização que
deveria ser empreendido para enfrentar tal situação,
estimando a quantidade de caminhões necessária para
carregar o material neutralizante. Para transportar certo
calcário que tem 80% de CaCO3, esse número de
caminhões, cada um com carga de 30 toneladas, seria
próximo de:
a) 100.
b) 200.
c) 300. d) 400. e) 500.
05. (UFPI) A reação de X com Y é representada
abaixo. Indique qual das equações melhor representa a
equação química balanceada.
a) 2X + Y2 2XY
b) 6X + 8Y 6XY + 2Y
c) 3X + Y2 3XY + Y
d) X + Y XY
e) 3X + 2Y2 3XY + Y2
06. (UFPI) 0,54 g de alumínio reagem com
2,13g de cloro, dando 2,67g de cloreto de alumínio. Se,
numa outra experiência, adicionarmos 2,70g de
alumínio a 15g de cloro, qual será a massa, em excesso,
do reagente?
a)13,35g
b)10,65g
c) 5,64g
d) 3,56g
e) 4,35g
07.(UFC) Por uma célula
eletrolítica passou uma carga
correspondente a 0,20 faraday. Num dos
eletrodos ocorreu a reação seguinte:
1 MnO41- + 8 H1+ + 5 é Mn2+ + 4H2O
A quantidade de água produzida
nesse eletrodo, em virtude dessa reação de
eletrodo, é:
a) (0,20 . 4) mol
b) (0,20 . 4/5) mol
c) (0,20 . 5/4) mol
d) (0,20 . 5) mol
e) (0,20 . 4 . 5) mol
08. (ENEM) Um problema ainda não resolvido
da geração nuclear de eletricidade é a destinação dos
rejeitos radiativos, o chamado “lixo atômico”. Os rejeitos
mais ativos ficam por um período em piscinas de aço
inoxidável nas próprias usinas antes de ser, como os
demais rejeitos, acondicionados em tambores que são
dispostos em áreas cercadas ou encerrados em depósitos
subterrâneos secos, como antigas minas de sal.
A complexidade do problema do lixo
atômico, comparativamente a outros
lixos com substâncias tóxicas, se deve
ao fato de.
a) emitir radiações nocivas, por milhares de anos, em um
processo que não tem como ser interrompido
artificialmente.
b) acumular-se em quantidades bem maiores do
que o lixo industrial convencional, faltando
assim locais para reunir tanto material.
c) ser constituído de materiais orgânicos que
podem contaminar muitas espécies vivas,
incluindo os próprios seres humanos.
d) exalar continuamente gases venenosos, que
tornariam o ar irrespirável por milhares de anos.
e) emitir radiações e gases que podem destruir a
camada de ozônio e agravar o efeito estufa
09. (ENEM) O ferro pode ser obtido
a partir da hematita, minério rico em óxido
de ferro, pela reação com carvão e oxigênio. A
tabela a seguir apresenta dados da análise de
minério de ferro (hematita) obtido de várias
regiões da Serra de Carajás.
Minério
da
Região
Teor de Enxofre
(S) % em Massa
Teor de Ferro
(Fe) % em
Massa
Teor de Sílica (Sio²)
% em Massa
1
0,019
63,5
0,97
2
0,020
68,1
0,47
3
0,003
67,6
0,61
No processo de produção do ferro, a sílica é removida
do minério por reação com calcário (CaCO3). Sabe-se,
teoricamente (cálculo estequiométrico), que são
necessários 100 g de calcário para reagir com 60 g de
sílica. Dessa forma, pode-se prever que, para a
remoção de toda a sílica presente em 200 toneladas do
minério na região 1, a massa de calcário necessária é,
aproximadamente, em toneladas, igual a:
a) 1,9.
b) 3,2.
c) 5,1.
d) 6,4.
e) 8,0.
10. (ENEM) Pesquisas indicam que a
capacidade de memorizar fatos ou informações no
cérebro humano esta relacionada com a liberação
de adrenalina das glândulas para a circulação
sanguínea, dentre outros fatores. Isto explica a
grande capacidade de recordarmos fatos vividos
em situações de fortes emoções. Dada a formula
estrutural da adrenalina.
Pode-se afirmar que a
porcentagem em massa de carbono
na molécula, aproximadamente, e:
a) 30%
d) 74%
b) 45%
e) 85%
c) 59%