Fisiologia Humana
Organização geral do corpo humano
Um organismo vivo está organizado em pequenas unidades chamadas células. Estas,
estão integradas estrutural e funcionalmente. Algumas células são mais especializadas.
Compartimentos:
Os líquidos corporais são encontrados dentro ou fora das células (meio intra e
extracelular). O espaço extracelular é dividido em compartimento vascular (ou plasma), e
compartimento intersticial (intercelular).
Aproximadamente 65% do peso corporal consistem de água (3/4 são intracelulares).
Homeostase
Para funcionarem perfeitamente, as células necessitam de um meio ambiente constante.
O líquido intersticial (derivado da corrente sangüínea) que circunda cada célula, é
chamado de meio interno do corpo. Para um bom funcionamento celular, é necessário
manter esse meio interno constante.
O termo homeostase define as condições de equilíbrio, que são mantidas por processos
fisiológicos coordenados.
Alguns mecanismos de controle homeostático são aqueles responsáveis pela
manutenção das concentrações normais dos elementos sangüíneos, da temperatura
corporal, do volume e pH dos líquidos corporais, da pressão arterial e da freqüência
cardíaca.
Todos os mecanismos de homeostase do corpo, atuam por um processo de feedback
negativo. O feedback é um sinal informativo, que expressa o mecanismo utilizado para
estabelecer ou manter alguma variável no nível desejado. O feedback é chamado
negativo porque a resposta induzida é negativa em relação à alteração inicial.
Regulação das funções
Coordenação do corpo
A coordenação das funções do corpo ocorre por mecanismos internos de regulação.
Estes podem ser classificados em: nervoso e hormonal. O sistema nervoso central (SNC)
age como um integrado, recebendo mensagens da sua rede de nervos sensitivos e
enviando-as, através de seus nervos motores para compensar qualquer distúrbio ou
desequilíbrio detectado.
O sistema hormonal é composto por um certo número de glândulas endócrinas, que
secretam substâncias químicas chamados hormônios. Estes são transportados dos
líquidos extracelulares para todas as partes do corpo, auxiliando na regulação das
funções.
O SNC trabalha através de reações rápidas. O S. Endócrino atua por meio de reações de
duração mais longa. O S. Endócrino complementa o SNC. O hipotálamo atua na
comunicação entre o endócrino.
obs.: o feedback positivo ocorre, por exemplo, no controle de hemorragias
(tamponamento plaquetário).
Transporte através da membrana
O transporte através da membrana celular, por meio da bicamada lipídica ou por meio das
proteínas, ocorre por dois processos básicos: difusão (ou transporte passivo) e transporte
ativo.
Difusão significa o movimento aleatório de substâncias, molécula a molécula, seja pelos
espaços intermoleculares da membrana, seja em combinação com uma proteína
carreadora.
O transporte ativo é o movimento de íons, ou de outras substâncias, através da
membrana, em combinação com uma proteínas carreadora, porém, contra um gradiente
de energia.
Todas as moléculas e íons nos líquidos corporais (moléculas de água como as das
substâncias dissolvidas), estão em movimentação constante.
Difusão
A difusão através da membrana celular é dividida em: difusão simples e difusão facilitada.
Difusão simples significa que o movimento cinético das moléculas ou íons ocorre pelos
orifícios ou pelos espaços intermoleculares da membrana, sem necessidade de fixação a
proteínas carreadoras. A velocidade ( ou intensidade) dessa difusão é determinada pela
quantidade de substâncias disponíveis, pela velocidade do movimento cinético e pelo
número de orifícios na membrana celular.
A difusão facilitada exige a interação de proteínas carreadoras com a molécula ou íon, a
ser transportado. A proteína carreadora facilita a passagem das moléculas ou íons,
através da membrana, por se prenderem quimicamente a eles.
A difusão simples pode ocorrer de duas maneiras: pelos intertícios da bicamada lipídica e
por canais aquosos.
Difusão por canais protéicos
Esses canais protéicos tem forma tubular e, vão da extremidade extracelular até a
intracelular. Dessa forma, as substâncias passam por difusão simples, de forma direta, de
um lado da membrana para outro.
Esses canais protéicos costumam ser seletivamente permeáveis a certas substâncias e,
podem ser abertos ou fechados por “comportas”.
A maioria dos canais protéicos é muito seletiva para o transporte de um ou mais íons ou
moléculas específicas. Isso acontece devido as características do próprio canal, como seu
diâmetro, sua forma e natureza das cargas elétricas ao longo de sua superfície interna.
Um dos mais importantes de todos os canais protéicos, é o canal de sódio (canal rápido).
As superfícies internas desse canal são revestidos intensamente por cargas negativas.
Outro grupo de canais protéicos, são os canais de potássio ( canais lentos). Esses canais,
caracterizam-se por não terem cargas negativas.
As “comportas” dos canais protéicos são um mecanismo de controle da permeabilidade
dos canais. Acredita-se que as comportas sejam projeções da molécula protéica de
transporte, que podem abrir ou fechar a entrada do canal, por alterações conformacionais
(da forma) da molécula de proteína.
canais leak: são formados por proteínas, que permitem a passagem de moléculas. São
geralmente muito específicos.
canais dependentes de voltagem: em estado de repouso, estão fechados. Numa alteração
de voltagem da membrana celular esses canais se abrem/fecham rapidamente. O tempo
que esse canal permanecerá aberto, varia.
Canais dependentes de receptor: esses canais protéicos são abertos pela fixação de
outra molécula à proteína. Isso causa alteração conformacional da molécula protéica, que
abre/fecha o canal.
Junções gap: são formados por proteínas (6 conexinas) que formam o conexônio. São
junções poucos seletivas e, são importantes durante o estágio de desenvolvimento
embrionário.
Difusão facilitada
Também chamada de difusão mediada por carreador. Uma substância transportada
dessa forma não pode, na maioria dos casos, atravessar a membrana sem a participação
de uma proteína carreadora específica. O carreador facilita a difusão da substância.
A diferença básica entre difusão simples e difusão facilitada é: conforme aumenta a
concentração da substância, a velocidade (ou intensidade) da difusão simples aumenta
proporcionalmente. Na difusão facilitada há uma limitação na velocidade de passagem
(difusão).
Alguns fatores que podem alterar a intensidade efetiva da difusão são: permeabilidade da
membrana, coeficiente de difusão, diferença de concentração, efeito do potencial elétrico,
diferença de pressão.
Osmose (difusão efetiva de água):
A mais abundante substância a se difundir através da membrana celular é a água.
O processo de movimento efetivo da água, causado por diferença de concentração (da
própria água) é chamado de osmose.
Pressão osmótica: é a força que puxa água de uma solução concentrada.
A pressão osmótica exercida pelas partículas de uma solução (moléculas ou íons), é
determinada pelo número de partículas / volume unitário do líquido.
Cada partícula em solução, independentemente de sua massa, exerce a mesma
quantidade de pressão sobre a membrana. Ou seja, todas as partículas estão se
chocando umas com as outras, em média com a mesma energia.
O fator que determina a pressão osmótica de uma solução é a concentração da solução
em termos do número de partículas e, não em função da massa do soluto.
. osmolaridade: é a concentração osmolar expressa em osmóis por litro de solução.
Transporte ativo
Quando a membrana celular transporta molécula ou íons contra a corrente, contra um
gradiente de concentração, o processo é chamado transporte ativo.
Entre as substâncias que são ativamente transportadas através da membrana temos: os
íons sódio, potássio, cálcio, ferro, hidrogênio, vários açúcares diferentes e a maior parte
dos aminoácidos.
O transporte ativo é dividido em dois tipos, de acordo com a fonte de energia usada para
provocar o transporte. São eles, o transporte ativo primário e o secundário.
No transporte ativo primário, a energia é derivada da degradação de ATP ou de algum
outro composto de fosfato com alta energia.
No transporte ativo secundário, a energia deriva da energia que foi armazenada sob a
forma de diferenças de concentração iônica, criadas por transporte ativo primário.
O transporte ativo também depende de proteínas carreadoras. Estas, neste caso, são
capazes de transferir energia para a substância transportadora, movendo-a contra o
gradiente eletroquímico.
Transporte ativo primário
A bomba de sódio e potássio: é um processo de transporte que bombeia os íons sódio
para fora e, ao mesmo tempo, bombeia os íons potássio de fora para dentro da célula.
Essa bomba existe em todas as células do corpo e é a responsável pela manutenção das
concentrações de sódio e potássio através da membrana celular, bem como o
estabelecimento do potencial negativo intracelular.
A proteína carreadora é um complexo formado por duas proteínas globulares distintas:
uma maior, chamada de subunidade ( e, outra menor, chamada de subunidade (. Esta
última possui características importantes para o funcionamento da bomba: possui 3 sítios
receptores para a fixação de íons sódio (na parte protéica que se projeta para o interior da
célula); tem 2 sítios receptores para os íons potássio, em sua parte externa; a porção
interna dessa proteína próxima aos sítios de fixação de sódio (Na+), possui atividade
ATPásica.
Funcionamento da bomba: quando 3 íons sódio se fixam à parte interna da proteína
carreadora, a função ATPásica (da mesma) é ativada. Uma molécula de ATP é quebrada
em ADP, havendo liberação de energia. Essa energia é usada para provocar alteração
conformacional na molécula da proteína carreadora, levando os íons sódio para o exterior
e trazendo os íons potássio para o interior da célula.
Uma das funções mais importantes da bomba é controlar o volume das células. Sem o
funcionamento dessa bomba, as células do corpo iriam inchar até estourar.
Outro mecanismo importante de transporte ativo primário é a bomba de cálcio. Os íons
cálcio são mantidos em concentrações baixas no citosol intracelular de praticamente
todas as células do corpo.
Transporte ativo secundário
Quando íons sódio são transportados para fora das células por transporte ativo primário,
há um grande gradiente de concentração de sódio (concentração aumenta fora da célula
e diminuiu em seu interior). Esse gradiente representa armazenamento de energia. Em
condições apropriadas, essa energia de difusão do sódio pode, atrair outras substâncias
(junto com o próprio sódio) através da membrana celular. Esse fenômeno é chamado de
co-transporte.
No contratransporte, os íons sódio tentam difundir-se para dentro da célula, devido ao seu
aumento no gradiente de concentração. O íon sódio fixa-se à proteína carreadora (na sua
projeção para a superfície externa da membrana), enquanto a substância a ser
contratransportada se fixa às projeções internas da proteína carreadora. Ocorre uma
alteração conformacional, com a energia do íon sódio movendo-o para o interior, fazendo
com que, ao mesmo tempo, a outra substância passe para o exterior.
POTENCIAL DE MEMBRANA
Existem potenciais elétricos através das membranas de todas as células do corpo.
Algumas células, como as neurais e as musculares, são “excitáveis” , ou seja, são
capazes de autogeração de impulsos eletroquímicos em suas membranas.
O potencial de membrana é a diferença elétrica entre o meio intra e extracelular.
Potenciais de membrana, resultantes da difusão:
Graças ao grande gradiente de concentração do potássio de dentro para fora, há uma
forte tendência para que os íons potássio se difundam para o exterior. Essa difusão é
auxiliada pelos canais leak de sódio e potássio, que são muito mais permeáveis ao
potássio. Devido à saída de muitas cargas positivas, o exterior da célula fica carregado
eletropositivamente, o interior da célula fica carregado eletronegativamente. Essa
diferença de potencial ( + fora, - dentro), repele os íons potássio (que estão se difundindo
para fora) na direção oposta; de fora para dentro. Essa alteração do potencial, é suficiente
para bloquear qualquer difusão para o exterior, devido ao alto gradiente de concentração
do íon potássio.
A bomba de sódio e potássio ajuda a manter a diferença de concentração entre sódio Na+
e potássio K+.
O potencial de membrana depende da bomba e dos canais leak.
Quando a membrana for permeável a vários íons diferentes, o potencial de difusão
estabelecido, depende de 3 fatores: da polaridade da carga elétrica de cada íon, da
permeabilidade da membrana a cada íon e das concentrações dos íons respectivos
dentro e fora da membrana.
A bomba de sódio e potássio é uma bomba eletrogênica, porque um número maior de
cargas positivas é bombeado para fora do que para dentro da fibra nervosa.
Gradientes químicos: referentes a concentrações.
Gradientes eletroquímicos: faz com que o potássio permaneça na célula.
O equilíbrio dinâmico se estabelece quando o número de cargas elétricas que sai é o
mesmo que entra.
A bomba de sódio e potássio, mantém o volume celular. Ela mantém mais sódio fora do
que potássio dentro.
A bom eletrogênica de sódio e potássio mais o papel da difusão, estabelecem um
potencial de membrana de aproximadamente – 90mV.
POTENCIAL DE AÇÃO
Os sinais nervosos são transmitidos por potenciais de ação, que são variações rápidas do
potencial de membrana. Cada potencial de ação começa por uma alteração abrupta do
potencial de repouso (negativo), para um potencial de membrana positivo, retornando
depois, rapidamente, ao potencial negativo.
Etapas do potencial de ação:
Estado de repouso: corresponde ao potencial de repouso da membrana, antes que
comece o potencial de ação. A membrana está “polarizada”, devido o grande potencial
negativo da membrana.
Etapa de despolarização: a membrana fica permeável aos íons sódio, permitindo o fluxo
destes (em grande quantidade) para o interior da célula. O estado polarizado de –90mV,
desaparece, com o potencial variando no sentido positivo. Isso é chamado de
despolarização.
Etapa de repolarização: após a membrana ficar muito permeável ao sódio, os canais
deste íon começam a se fechar, enquanto os canais de potássio se abrem mais do que o
normal. Há a rápida difusão de íons potássio para o exterior, o que restabelece o
potencial normal (negativo) de repouso da membrana. Isso é chamado de repolarização
da membrana.
Canais de sódio e potássio dependentes de voltagem:
O agente necessário para a produção da despolarização e da repolarização da
membrana, é o canal de sódio dependente de voltagem. O canal de potássio dependente
de voltagem, tem participação no aumento da velocidade de repolarização da membrana.
Esses canais dependentes de voltagem atuam junto com a bomba de sódio e potássio e
com os canais de vazamento (sódio/potássio).
Ativação do canal de sódio: quando o potencial de membrana varia de –90mV para zero,
ele atinge uma voltagem entre –70 e –50mV. Essa variação provoca alteração
conformacional da comporta de ativação, abrindo-a. Durante este estado há um aumento
da permeabilidade da membrana ao sódio.
Inativação dos canais de sódio: após o canal de sódio ficar aberto por certo tempo, ele se
fecha e os íons sódio não podem mais passar para dentro da membrana. Então, o
potencial de membrana começa a voltar ao estado de repouso, o que constitui o processo
de repolarização.
Canais de potássio dependentes de voltagem e sua ativação: durante o estado de
repouso, a comporta do canal de potássio está fechada e, os íons potássio ficam
impedidos de passar para o exterior. Quando o potencial de membrana varia de –90mV
em direção ao zero, essa variação produz uma alteração (lenta) conformacional, abrindo a
comporta e permitindo a difusão de maior quantidade de potássio para o exterior. Os
canais lentos de potássio só se abrem após o fechamento dos canais rápidos de sódio.
A diminuição do fluxo de sódio para dentro da célula e o aumento, simultâneo, do fluxo de
potássio para fora da célula, aceleram a repolarização, levando à recuperação do
potencial de repouso da membrana.
O platô de alguns potenciais de ação:
A causa do platô é uma combinação de vários fatores. Primeiro, dois tipos de canais
atuam no processo de despolarização: os canais rápidos de sódio e os lentos de cálcio
(permitem a difusão de íons cálcio e, também, de alguns íons sódio). A abertura dos
canais rápidos produz o componente rápido do potencial de ação, enquanto a abertura
dos canais lentos é a principal responsável pela parte do platô do potencial de ação.
Um segundo fator, responsável às vezes, pelo platô, é a abertura (mais lento que o usual
) dos canais de potássio. Eles se abrem, geralmente, próximo ao fim do platô. Isso retarda
o retorno do potencial de membrana ao seu valor de repouso.
CONTRAÇÃO MUSCULAR
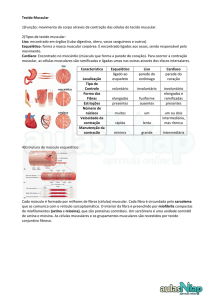
Anatomia do músculo esquelético:
O sarcolema é a membrana celular da fibra muscular. O sarcolema (ou membrana
plasmática ) possui um revestimento externo e é composta por fina camada de material
polissacarídeo, contendo numerosas fibrilas delgadas de colágeno.
Miofibrilas (filamentos de actina e miosina): cada fibra muscular contém muitas miofibrilas.
Cada miofibrila, contém, dispostas lado a lado, milhares de filamentos de miosina e
actina. Os filamentos de miosina são grossos e os de actina são finos. Os filamentos de
miosina e de actina ficam parcialmente interdigitados, o que faz com que a miofibrila
apresente faixas claras e escuras. As faixas claras contém apenas os filamentos de actina
e, as faixas escuras contém os filamentos de miosina e, as extremidades dos filamentos
de actina, que se entremeiam com os de miosina.
Sarcoplasma: as miofibrilas estão suspensas no interior da fibra muscular, em uma matriz
chamada de sarcoplasma. O líquido do sarcoplasma contém grande quantidade de
potássio, magnésio, fosfato e enzimas protéicas. Também há um grande número de
mitocôndrias, situadas entre as miofibrilas. Essas mitocôndrias indicam a necessidade
das miofibrilas, de quantidades elevadas de ATP (formada pelas mitocôndrias).
Retículo sarcoplasmático: possui organização especializada, muito importante para o
controle da contração muscular. Os músculos de contração mais rápida apresentam o
retículo sarcoplasmático (RS) muito extenso.
Cerca de 40% do corpo são compostos por músculo esquelético e, outros 10% por
músculo liso e cardíaco.
Mecanismo geral da contração muscular:
Etapas da contração muscular:
Um potencial de ação trafega ao longo de um nervo motor até suas terminações nas
fibras musculares.
Em cada terminação, o nervo secreta pequena quantidade de neurotransmissor
(acetilcolina).
Essa acetilcolina atua sobre a membrana da fibra muscular, abrindo vários canais
acetilcolina-dependentes dentro de moléculas protéicas na membrana da fibra muscular.
A abertura dos canais de acetilcolina permite que grande quantidade de íons de sódio flua
para dentro da membrana da fibra muscular (na região do terminal neural). Isso
desencadeia um potencial de ação na fibra muscular.
O potencial de ação se propaga ao longo da membrana da fibra muscular.
O potencial de ação despolariza a membrana da fibra muscular e, passa para o interior da
fibra muscular, onde estimula o retículo sarcoplasmático a liberar grande quantidade de
íons cálcio para as miofibrilas.
Os íons cálcio provocam forças atrativas entre os filamentos de actina e miosina, fazendo
com que eles deslizem entre si, o que constitui o processo contrátil.
Os íons cálcio são bombeados de volta para o retículo sarcoplasmático, onde ficam
armazenados até um novo potencial de ação chegar. Essa retirada dos íons cálcio das
miofibrilas, finaliza a contração.
Mecanismo molecular da contração muscular:
A contração muscular ocorre por um mecanismo de deslizamento dos filamentos. Quando
um potencial de ação passa pela membrana da fibra muscular, estimula o retículo
sarcoplasmático libere grandes quantidades de íons cálcio, que rapidamente, chegam as
miofibrilas. Esses íons cálcio ativam as forças entre os filamentos de miosina e de actina,
iniciando a contração. Mas, é necessária energia para a realização do processo contrátil.
Essa energia deriva das ligações ricas em energia do ATP, que é degradado em ADP
para liberar energia.
Características moleculares dos filamentos contráteis:
O filamento de miosina: este filamento é formado por muitas moléculas de miosina. A
molécula de miosina é formada por 6 cadeias polipeptídicas (duas cadeias pesadas e
quatro cadeias leves). As cadeias leves se dobram, formando uma estrutura polipeptídica
globular, chamada de cabeça da miosina. O comprimento total de cada filamento da
miosina é uniforme.
O filamento de actina: este filamento é formado por 3 componentes protéicos: actina,
tropomiosina e troponina. O filamento de actina é uma molécula protéica com duas
cadeias de actina-F. Essas duas cadeias são enroladas em hélice.
Cada cadeia de dupla hélice de actina-F é formada por moléculas polimerizadas de actina
G. Presa a cada uma dessas moléculas de actina G, está uma molécula de ADP.
Acredita-se que essas moléculas de ADP sejam os sítios ativos com que interagem os
filamentos de miosina para que haja a contração muscular.
Tropomiosina: são frouxamente presas às cadeias de actina-F. No estado de repouso, as
moléculas de tropomiosina, ficam sobre os sítios ativos das cadeias de actina, impedindo
a atração entre os filamentos de actina e miosina para produzir contração.
Troponina: presa a uma das extremidades de cada molécula de tropomiosina, está uma
molécula de troponina. Ela é um complexo de 3 subunidades protéicos, cada uma com
certa função no controle da contração muscular. A troponina I tem forte afinidade pela
actina; a troponina T pela tropomiosina e a troponina C tem afinidade por íons cálcio.
Acredita-se que esse complexo fixe a tropomiosina à actina.
Interação dos filamentos de miosina e actina e os íons cálcio para produzir a contração:
Um filamento de actina, sem a presença do complexo troponina-tropomiosina, reage com
as cabeças das moléculas de miosina, em presença de ATP. Caso seja adicionado o
complexo troponina-tropomiosina, essa fixação não ocorre. Acredita-se que os sítios
ativos no filamento de actina sejam inibidos, ou recobertos, pelo complexo troponinatropomiosina. Consequentemente, esses sítios não podem se fixar às cabeças dos
filamentos de miosina para provocar a contração.
Na presença de grande quantidade de íons cálcio, o efeito inibidor da troponinatropomiosina sobre o filamento de actina é inibido.
Quando os íons cálcio se combinam com a troponina C, o complexo de troponina passa
por alteração conformacional, puxando a molécula de tropomiosina , “descobrindo” os
sítios ativos da actina, permitindo que ocorra a contração.
Interação entre o filamento “ativado” de actina e miosina:
Assim que o filamento de actina é ativado pelos íons cálcio, as cabeças dos filamentos de
miosina se prendem aos sítios ativos do filamento de actina , e isso, resulta em contração.
A cabeça de miosina fixa-se ao filamento de actina e se desloca, tracionando o filamento.
Após esse movimento, a cabeça se solta do sítio ativo e retorna a sua posição
perpendicular. Nessa posição, ela se fixa a um novo sítio ativo, a cabeça volta a se
inclinar fazendo com que o filamento de actina avance mais um pouco. Quanto maior o
número de pontes (de cabeças de miosina) em contato com o filamento de actina, maior
será a força de contração.
ATP como fonte de energia para contração:
Quando um músculo se contrai, ele realiza trabalho e consome energia. Grande
quantidade de ATP é quebrada em ADP, durante o processo contrátil. Quanto maior for o
trabalho, realizado pelo músculo, maior será a quantidade clivada de ATP.
Antes da contração, as cabeças de miosina fixam ATP. A atividade ATPase da cabeça de
miosina quebra esse ATP em ADP + Pi (fixos à cabeça). Nessa fase, a cabeça se
estende perpendicularmente em direção ao filamento de actina.
Quando o complexo troponina-tropomiosina fixa o cálcio, os sítios ativos do filamento de
actina ficam descobertos, e as cabeças de miosina se ficam a eles.
Essa ligação entre a cabeça de miosina e o sítio ativo do filamento de actina, produz
alteração conformacional na cabeça, fazendo com que ela se curve. Isso é o “movimento
de tensão”, que puxa o filamento de actina. A energia que ativa esse movimento de
actina. A energia que ativa esse movimento, já está armazenada (quebra de ATP em ADP
+ Pi).
Uma vez que a cabeça se curva, isso permite a liberação do ADP + Pi que estavam
presos à cabeça. No sítio de liberação de ADP, fixa-se outra molécula de ATP. Essa
fixação produz a liberação da cabeça da actina.
Após a cabeça Ter se soltado da actina, uma nova molécula de ATP é quebrada para
iniciar um novo ciclo, que leva a um movimento de tensão.
Quando a cabeça de miosina, com sua energia armazenada, se fixa a um novo sítio ativo
do filamento de actina, promove novamente o movimento de tensão.
A unidade motora:
Cada neurônio-motor inerva, com seu axônio, muitas fibras musculares diferentes. Todas
as fibras musculares inervadas por um mesmo axônio formam a chamada unidade
motora. Em músculos pequenos, de reação rápida, as unidades motoras são formadas
por pequeno número de fibras. Os grandes músculos, que não exigem controle preciso,
têm unidades motoras com várias fibras musculares.
As fibras musculares de uma unidade motora não ficam todas agrupadas no interior do
músculo e sim, misturam-se com as fibras de outras unidades motoras. Essa
interdigitação permite que as unidades motoras distintas se contraiam, apoiando uma às
outras, ou seja, simultaneamente.
Tônus do músculo esquelético:
Mesmo quando os músculos estão em repouso, há um certo grau de resistência à
palpação. Isso é chamado de tônus muscular.
O tônus do músculo esquelético resulta de uma baixa freqüência de impulsos nervosos
vindos da medula espinhal.
Fadiga muscular:
A contração forte e prolongada de um músculo leva ao estado de fadiga muscular. A
maior parte da fadiga resulta da incapacidade dos processos contráteis e metabólicos das
fibras musculares de manter a mesma produção de trabalho.
A interrupção do fluxo sangüíneo em um músculo em contração, leva à fadiga muscular
devido à perda do suprimento de nutrientes, em especial de oxigênio.
Rigor mortis:
Algumas horas após a morte, todos os músculos do corpo entram no estado de
contratura. Isto é, o músculo se contrai e permanece rígido, mesmo sem potenciais de
ação. Essa rigidez é causada por perda completa do ATP, necessário para produzir a
separação das cabeças de miosina dos filamentos de actina, durante o processo de
relaxamento. Os músculos permanecem no estado de rigor até que suas proteínas sejam
destruídas por autólise (produzida por enzimas liberadas pelos lisossomos).
PLACA MOTORA
A fibra nervosa ramifica-se, próximo sua extremidade, para formar um complexo de
“terminais” nervosos ramificados que se invaginam na fibra muscular, porém permanecem
por fora da membrana plasmática da fibra. Essa estrutura é chamada de placa motora.
No terminal axônio existem muitas mitocôndrias, que fornecem energia para a síntese do
transmissor excitatório acetilcolina. Esta, excita a fibra muscular. A acetilcolina é
sintetizada no citoplasma do terminal axônio e, absorvida por muitas vesículas sinápticas.
Quando um impulso nervoso atinge a junção neuromuscular, as vesículas de acetilcolina
são liberadas no espaço sináptico.
Quando o potencial de ação invade o terminal axônio, abrem-se canais de cálcio,
permitindo a difusão de grande quantidade de cálcio para o interior do terminal.
Posteriormente, as vesículas sinápticas se fundem com a membrana neural, eliminando a
acetilcolina (no espaço sináptico), por exocitose.
Acetilcolina:
O principal efeito da abertura dos canais acetilcolina-dependentes de voltagem é permitir
a passagem de grande quantidade de íons sódio para dentro da fibra (elevando grande
número de cargas positivas). Isso gera alteração do potencial da membrana da fibra
muscular, chamado de potencial da placa motora. Esse potencial da placa desencadeia
um potencial de ação na membrana muscular, ocasionando a contração do músculo.
A acetilcolina é rapidamente removida do espaço sináptico pela ação da enzima
acetilcolinesterase. E, também, pequena quantidade de acetilcolina difunde-se para fora
do espaço sináptico, não podendo mais atuar sobre a membrana da fibra muscular. O
curto período que a acetilcolina permanece no espaço sináptico, é suficiente para excitar
a fibra muscular.
Acoplamento Excitação-contração
Túbulos transversais – Retículo sarcoplasmático:
Os túbulos T são muito pequenos e transversais às miofibrilas. Eles começam na
membrana celular, passam de um lado da fibra muscular para o lado oposto. No ponto de
origem dos túbulos T (membrana celular) eles se abrem para o exterior. Os túbulos T são
extensões internas da membrana celular. Portanto, quando um potencial de ação se
propaga pela membrana da fibra muscular, ele também se propaga, por meio dos túbulos
T, para o interior da fibra muscular. As correntes do potencial de ação em torno dos
túbulos T, desencadeiam a contração muscular.
O retículo sarcoplasmático (RS) é formado por longos túbulos longitudinais, paralelos às
miofibrilas, chegando em grandes câmaras chamadas de cisternas (que estão acopladas
aos túbulos T). O acoplamento das cisternas com os túbulos T, forma as tríades. Estas,
são formadas por um pequeno túbulo central e uma grande cisterna de cada lado.
Liberação de íons cálcio pelo retículo sarcoplasmático:
Uma das características especiais do RS, é que, dentro de seus túbulos vesiculares, há
íons cálcio em alta concentração e, muitos desses íons são liberados quando há um
potencial de ação no túbulo T adjacente.
O potencial de ação do túbulo T provoca um fluxo de corrente através das cisternas,
acopladas ao túbulo T. Esse sinal, do túbulo para as cisternas, provoca a rápida abertura
de canais de cálcio nas membranas das cisternas e dos túbulos longitudinais do retículo
sarcoplasmático. Esses canais permanecem abertos durante um certo tempo, liberando
os íons cálcio (responsáveis pela contração muscular) no sarcoplasma que banha as
miofibrilas.
Os íons cálcio liberados, difundem-se para as miofibrilas adjacentes, onde se fixam com a
troponina C, desencadeando a contração muscular. Essa contração persistirá enquanto
os íons cálcio permanecem em concentrações elevadas no líquido miofibrilar.
Porém, uma bomba de cálcio, localizada nas paredes do retículo sarcoplasmático, afasta
os íons cálcio das miofibrilas, bombeando-os de volta para dentro dos túbulos
sarcoplasmáticos. Sendo assim, imediatamente após um potencial de ação, a
concentração de íons cálcio nas miofibrilas, é mantida em valor extremamente baixo.
Portanto, em estado de repouso, o complexo troponina-tropomiosina mantém as
miofibrilas em estado muscular de relaxamento. Com a excitação dos sistema túbulos T –
retículo sarcoplasmático, há liberação de íons cálcio suficientes, aumentando sua
concentração no líquido miofibrilar, para produzir a contração muscular.
MÚSCULO LISO
O músculo liso possui fibras bem menores, comparadas às do músculo esquelético.
Muitos dos processos de contração vistos para o músculo esquelético, são aplicáveis para
o músculo liso. O mais importante é que as forças de atração entre os filamentos de
actina e miosina, produzem a contração no músculo liso, como no músculo esquelético.
Mas, a disposição interna das fibras musculares lisas é bem diferente.
CONTRAÇÃO NO MÚSCULO LISO
Base química:
O músculo liso possui filamentos de actina e miosina, porém, não contém o complexo
normal da troponina.
A actina e a miosina derivadas do músculo liso interagem entre si e, o processo contrátil é
ativado por íons cálcio e, a energia utilizada na contração deriva da degradação do ATP
em ADP.
Base física:
O músculo liso não apresenta uma disposição estriada dos filamentos de actina e de
miosina. Estes, estão presos aos chamados corpos densos. Alguns deles estão fixos na
membrana celular. Outros estão dispersos pelo interior da célula, sendo apoiados por
uma rede de proteínas estruturais, que os interligam entre si.
Alguns corpos densos na membrana de células adjacentes, também estão unidos entre si
por pontes protéicas intercelulares. É, talvez, por meio dessas ligações que a força de
contração é transmitida de uma célula para a seguinte.
Contração do músculo liso:
A maioria dos músculos esqueléticos se contraem e relaxam rapidamente. Já, a maior
parte das contrações dos músculos lisos são prolongadas e tônicas.
No músculo liso, a rapidez de fixação entre actina e miosina e, em seguida a liberação da
actina, é muito menor que no músculo esquelético. Porém, a fração de tempo em que os
filamentos de actina e de miosina permanecem fixados (o que, é o fator principal na
determinação da força de contração), é muito maior no músculo liso.
Uma possível razão para essa longa, duração do ciclo, é que as cabeças de miosina
teriam menor atividade ATPásica, de modo que a degradação do ATP (fonte de energia) é
mais lenta.
Acredita-se, que seja necessária apenas uma molécula de ATP, para energizar cada ciclo
de contração no músculo liso.
Essa economia de energia pelo músculo liso, é muito importante para a economia geral
de energia pelo corpo, já que órgãos como intestinos, bexiga urinária, vesícula biliar e
etc., devem manter contrações musculares tônicas de forma quase indefinida.
Apesar dos poucos filamentos de miosina no músculo liso e da longa duração dos ciclos
de contração, a força máxima de contração no músculo liso é, muitas vezes, maior que a
do músculo esquelético. Acredita-se que essa grande força de contração resulte do longo
período de fixação das cabeças de miosina aos filamentos de actina.
Um aumento da concentração dos íons cálcio intracelulares, desencadeia a contração do
músculo liso.
No lugar da troponina, as células musculares lisas contém grandes quantidades de uma
proteína denominada calmodulina. Os íons cálcio se fixam à calmodulina. Essa
combinação ativa a miosinoquinase (enzima). Uma das cadeias leves de cada cabeça de
miosina, é fosforilada. Assim, a cabeça de miosina adquire a capacidade de se fixar ao
filamento de actina, produzindo a contração muscular.
Controle neural e hormonal da contração do músculo liso:
O músculo liso pode ser estimulado a contrair por diversos tipos de sinais: neurais, por
estímulos hormonais, por estiramento do músculo, etc. Isso, porque a membrana do
músculo liso contém muitos tipos de receptores protéicos, capazes de desencadear o
processo contrátil. Outros receptores protéicos inibem a contração do músculo liso.
As fibras nervosas que inervam o músculo liso, em geral se ramificam difusamento sobre
uma camada de fibras musculares. Na maioria dos casos, essas fibras nervosas não
estabelecem contato direto com as fibras musculares lisas, formando junções difusas que
secretam substância neurotransmissora na matriz que reveste o músculo liso. Então, a
substância neurotransmissora se difunde até as células. Onde há várias camadas de
células musculares, as fibras nervosas muitas vezes só estimulam a camada mais externa
e, a excitação das camadas mais internas se dá pela condução do potencial de ação ou
por difusão subseqüente da substância neurotransmissora.
As vesículas das terminações das fibras nervosas, no caso do músculo liso, contêm
acetilcolina e noraepinefrina. Mas, elas nunca são secretadas pelas mesmas fibras
nervosas. Quando a acetilcolina excita uma fibra muscular, em geral a noraepinefrina a
inibe. E, vice e versa.
Os dois neurotransmissores excitam ou inibem o músculo liso, por se ligarem a um
receptor protéico na superfície da membrana da célula muscular. Alguns desses
receptores são excitatórios, outros são inibitórios. Dessa forma, o tipo de receptor
determina se o músculo liso é inibido ou excitado e, por qual neurotransmissor.
Potencial de Ação no músculo liso
Potencial em ponta:
Esses potenciais de ação podem ser produzidos por estimulação elétrica, por ação
hormonal sobre o músculo liso, pela ação de substâncias transmissoras liberadas por
fibras nervosas, pelo estiramento da própria fibra muscular.
Potenciais de ação com platôs:
O início desse potencial de ação é semelhante ao de um potencial em ponta. Porém, a
repolarização da membrana da fibra muscular, é mais demorada.
A importância do platô, é que ele pode explicar os prolongados períodos de contração de
certos tipos de músculo liso.
A membrana da célula muscular lisa tem muitos canais de cálcio dependentes de
voltagem e poucos canais de sódio. Por isso, o sódio tem pequena participação na
geração do potencial de ação dos músculos lisos. Há o fluxo de íons cálcio para o interior
da fibra, é o principal responsável pelo potencial de ação.
Os canais de cálcio se abrem mais lentamente que os canais de sódio, mas permanecem
abertos por mais tempo. Isso explica, em grande parte, os potenciais de ação lentos das
fibras musculares lisas.
A entrada de cálcio para as células musculares, também, sobre o mecanismo contrátil do
músculo liso, para provocar a contração.
Na maioria dos tipos de músculos lisos quase todos os íons cálcio, promotores da
contração entram na célula muscular, vindos do líquido celular, por ocasião do potencial
de ação ou de outros estímulos.
A concentração de íons cálcio no líquido extracelular é relativamente alta e, o potencial de
ação do músculo liso é causado principalmente pelo fluxo de íons cálcio para a célula
muscular. Como as fibras musculares lisas são muito pequenas, esses íons cálcio podem
difundir-se para todas as partes do músculo liso, promovendo a contração.
Cálcio adicional pode entrar na fibra muscular lisa por meio de canais de cálcio hormônio
dependentes; esse cálcio também causa contração.
Normalmente, a abertura desses canais não produz um potencial de ação e, por vezes, só
alterações mínimas do potencial de repouso da membrana, já que potássio (em
quantidade suficiente) passa para o exterior, mantendo um potencial de membrana quase
normal.
Retículo sarcoplasmático:
Algumas células musculares lisas contêm um retículo sarcoplasmático moderadamente
desenvolvido. Em geral, quanto mais extenso for o R.S na fibra muscular lisa, mais
rapidamente ela se contrairá, porque a entrada de cálcio através da membrana celular, é
bem mais lenta que a liberação dos íons cálcio pelo R.S.
Quando a concentração de íons cálcio no líquido extracelular baixa, a contração do
músculo liso quase cessa. Portanto, a força da contração do músculo liso é muito
dependente da concentração de íons cálcio no líquido extracelular.
* Cálcio + calmodulina -----( miosina-quinase- cadeia leve ----( sítio de ligação ativado
----------( deslizamento da actina
A bomba de cálcio:
Para que haja o relaxamento da contração muscular lisa, é necessária a remoção dos
íons cálcio dos líquidos intracelulares, que banham os filamentos de actina e miosina.
Essa remoção é realizada por bombas de cálcio, que retiram os íons cálcio da fibra
muscular lisa, devolvendo-os para os líquido extracelular ou para o interior do retículo
sarcoplasmático.
O CORAÇÃO COMO UMA BOMBA
O coração é formado pelo músculo atrial, pelo músculo ventricular e pelas fibras
musculares excitatórias e condutoras. A contração do músculo atrial e do ventricular é do
tipo prolongada.
O músculo cardíaco é estriado e contém miofibrilas formadas por filamentos de actina e
miosina.
O músculo cardíaco como um sincício:
As fibras musculares cardíacas são formadas por muitas células individuais, ligadas em
série entre si. Entre duas fibras musculares adjacentes há uma membrana chamada de
disco intercalar. Os potenciais de ação passam de ma célula muscular cardíaca para a
seguinte, através dos discos intercalares, com restrição muito pequena, pois os discos
intercalares possuem resistência elétrica baixa e, os íons movem-se com facilidade ao
longo das fibras musculares cardíacas.
Sendo assim, o músculo cardíaco é um sincício, formado por muitas células musculares
cardíacas. Estas células estão interligadas de tal modo que, quando uma delas é
excitada, o potencial de ação se propaga para todas as demais, passando de célula a
célula.
O coração é formado por dois sincícios: o sincício atrial (que forma as paredes de dois
átrios), e o sincício ventricular (formando as paredes dos dois ventrículos). Os átrios
ficam separados dos ventrículos por um tecido fibroso. Os potenciais de ação só podem
ser conduzidos, do sincício atrial para o ventricular, por meio de um sistema especializado
de condução, o feixe atrioventricular (ou feixe A-V), que é um feixe de fibras condutoras.
Essa divisão do coração em dois sincícios funcionais permite que os átrios se contraiam
pouco antes da contração ventricular, o que é importante para a eficácia do bombeamento
cardíaco.
Longo potencial de ação e platô:
No músculo cardíaco, o potencial de ação é causado pela abertura de dois tipos de
canais: os canais rápidos de sódio e, os canais lentos de cálcio (ou cálcio-sódio).
Os canais lentos de cálcio tem abertura mais lenta mas, ficam abertos por mais tempo. E,
durante esse tempo de abertura, grande quantidade de íons cálcio e sódio flui por esses
canais para o interior das fibras musculares cardíacas, provocando um longo período de
despolarização e causando o platô do potencial de ação. Os íons cálcio que entram na
célula durante esse potencial de ação, têm participação importante na excitação do
processo contrátil do músculo.
Após o início do potencial de ação, a permeabilidade da membrana celular do músculo
cardíaco ao potássio, diminui. Essa redução de permeabilidade do potássio diminui o
fluxo de potássio durante o platô do potencial de ação, retardando a volta do potencial a
seu valor de repouso.
Quando os canais lentos de cálcio se fecham, cessa o fluxo de íons cálcio e sódio; a
permeabilidade da membrana ao potássio aumenta. A perda rápida de potássio pela fibra,
faz com que o potencial de membrana retorne a seu valor de repouso, o que finaliza o
potencial de ação.
Período refratário do músculo cardíaco:
O músculo cardíaco fica refratário à reestimulação durante o potencial de ação. O período
refratário do coração é o intervalo de tempo, durante o qual um impulso cardíaco normal
não pode reexcitar uma área já excitada de músculo cardíaco.
O período refratário do músculo atrial é bem mais curto que o dos ventrículos. Portanto, a
freqüência rítmica da contração nos átrios pode ser maior que nos ventrículos.
Quando um potencial de ação se propaga pela membrana do músculo cardíaco, esse
potencial de ação também se propaga para o interior da fibra muscular cardíaca, ao longo
das membranas dos túbulos T.
Os potenciais de ação nos túbulos T, agem sobre as membranas dos túbulos
sarcoplasmáticos, causando a liberação de íons cálcio, para o sarcoplasma, pelo R.S.
Esses íons cálcio se difundem para as miofibrilas, onde provocam as reações químicas
que promovem o deslizamento entre os filamentos de actina e miosina; isso tudo produz a
contração muscular.
A força da contração do músculo cardíaco depende da concentração de íons cálcio no
líquido extracelular. A quantidade de íons cálcio no sistema de túbulos T, depende da
concentração de íons cálcio no líquido extracelular.
Ao final do platô do potencial de ação cardíaco, o fluxo de cálcio, para o interior da fibra
muscular é interrompido e os íons cálcio são bombeados para o retículo sarcoplasmático
e túbulos T. Então, a contração cessa até que haja m novo potencial de ação.
O ciclo cardíaco:
Os eventos cardíacos que ocorrem do início de cada batimento até o começo do seguinte
compõem o chamado ciclo cardíaco. Cada ciclo é desencadeado por um potencial de
ação no nodo sinusal. Este, situa-se na parte superior do átrio direito, perto da abertura da
veia cava superior , o potencial de ação passa pelos dois átrios, pelo feixe AV, até atingir
os ventrículos.
Graças a uma disposição especial do sistema condutor dos átrios até os ventrículos, há
um retardo na passagem do impulso cardíaco dos átrios para os ventrículos.
Isso permite que os átrios se contraiam antes dos ventrículos e, por conseguinte,
bombeiem sangue para os ventrículos, antes da forte contração ventricular. Assim, os
átrios funcionam como bombas para o ventrículos e estes, fornecem a maior parte da
força que vai propelir o sangue pelo sistema vascular.
Sístole e díastole
Todo o ciclo cardíaco consiste em um período de relaxamento, chamado de diástole,
durante o qual o coração se enche de sangue, seguido por um período de contração
chamado de sístole.
Funcionamento dos átrios como bombas:
O sangue flui de forma contínua das grandes veias para os átrios; cerca de 75% do
sangue flui diretamente dos átrios para os ventrículos, mesmo antes que os átrios se
contraiam. Então, a contração atrial faz com que ocorra enchimento adicional dos
ventrículos por 25%. Portanto, os átrios funcionam como bombas, que aumentam a
eficácia do enchimento ventricular por até 25%. Porém, quando os átrios deixam de
funcionar, essa diferença tem pequena probabilidade de ser notada, a não ser que a
pessoa se exercite.
Funcionamento dos ventrículos como bombas:
Durante a sístole ventricular, grande quantidade de sangue se acumula nos átrios, devido
ao fechamento das válvulas A-V. Como conseqüência, quando termina a sístole e as
pressões sistólicas começam a cair, as pressões moderadamente aumentadas, nos
átrios, promovem a abertura das válvulas A-V, permitindo o fluxo rápido de sangue para
os ventrículos.
Durante o último terço da diástole, os átrios se contraem e dão um impulso adicional do
fluxo de sangue para os ventrículos.
Funções da válvulas:
Válvulas atrioventriculares:
As válvulas A-V (tricúspide e mitral) impedem o refluxo de sangue dos ventrículos para os
átrios durante a sístole, enquanto as válvulas semilunares (aórtica e pulmonar) impedem
o refluxo de sangue das artérias aorta e pulmonar para os ventrículos durante a díastole.
Todas essas válvulas se abrem e fecham passivamente, ou seja, se o fluxo de sangue é a
favor elas se abrem, se o fluxo vai contra a direção correta elas se fecham.
Válvulas aórtica e pulmonar:
As altas pressões nas artérias, no final da sístole, fazem com que as válvulas semilunares
se fechem. Devido a seus menores orifícios, a velocidade da ejeção sangüínea pelas
válvulas aórtica e pulmonar é muito maior que pelas válvulas A-V. Também, devido à
rapidez da ejeção e de seu fechamento, as válvulas semilunares estão sujeitas a uma
abrasão mecânica bem mais acentuada que as válvulas A-V.
Pressão aórtica:
Quando o ventrículo esquerdo se contrai, a pressão ventricular aumenta rapidamente, até
que a válvula aórtica se abra.
A entrada de sangue nas artérias faz com que suas paredes sejam estiradas, com
elevação da pressão. Então, ao fim da sístole, a retração elástica dessas artérias mantêm
uma pressão elevada nas mesmas, mesmo durante a diástole.
Após a válvula aórtica se fechar, a pressão na aorta decresce lentamente (durante toda a
diástole), pois há o escoamento do sangue, que ficou retido nas artérias elásticas
distendidas, por meio dos vasos periféricos, para retornar às veias.
REGULAÇÃO DO BOMBEAMENTO CARDÍACO
O mecanismo de Frank-Starling:
A quantidade de sangue bombeada pelo coração, a cada minuto, é determinada pela
intensidade do fluxo sangüíneo para o coração vindo das veias, ou seja, pelo retorno
venoso.
Cada tecido periférico do corpo controla seu próprio fluxo sangüíneo e, o total de todos os
fluxos sangüíneos locais, retorna para o átrio direito por meio das veias. O coração,
bombeia esse sangue, que chega para as artérias sistêmicas, para fluir novamente por
todo o circuito.
Essa capacidade intrínseca do coração de se adaptar a volumes variáveis de sangue que
chegam a ele, é chamado de mecanismo de Frank-Starling. Esse mecanismo significa
que, quanto mais o músculo cardíaco for distendido durante o enchimento, maior vai ser a
força de contração e, consequentemente, maior será a quantidade de sangue bombeada
para a aorta.
Quando quantidade adicional de sangue flui para os ventrículos, o músculo cardíaco é
distendido até comprimento maior. Isso, faz com que o músculo se contraia com mais
força. Portanto, o ventrículo bombeia o sangue adicional para as artérias.
Independentemente da carga da pressão arterial até um limite razoável, o fator que
determina a quantidade de sangue bombeado pelo coração, é ainda, a quantidade de
sangue que chega ao coração.
Controle cardíaco pelos nervos simpáticos e parassimpáticos
A eficácia do bombeameno cardíaco é muito controlada pelos nervos simpáticos e
parassimpáticos, que inervam o coração. A quantidade de sangue bombeada pelo
coração a cada minuto (débito cardíaco), pode ser aumentada pela estimulação
simpática. E, ao contrário, pode ser reduzida pela estimulação parassimpática.
Estimulação simpática:
A estimulação simpática aumenta a força com que o músculo cardíaco se contrai,
aumentando o volume de sangue bombeado e também a pressão de ejeção. Assim, a
estimulação simpática pode aumentar o débito cardíaco por duas a três vezes.
Porém , a inibição do sistema nervoso simpático pode ser usada para diminuir o
bombeamento cardíaco, moderadamente. Quando a atividade do sistema nervoso
simpático é deprimida abaixo do limite normal, isso reduz a frequência cardíaca e a força
da contração ventricular, o que diminui o nível do bombeamento cardíaco.
Estimulação parassimpática (ou vagal):
A estimulação vagal intensa do coração pode interromper os batimentos cardíacos por
alguns segundos e pode também, diminuir a força da contração ventricular. Essa redução
não é maior pelo fato das fibras vagais serem distribuídas em sua maior parte, para os
átrios e, em proporção menor, para os ventrículos, onde ocorre a principal contração
cardíaca.
A grande redução da frequência cardíaca, pode diminuir o bombeamento ventricular,
sobretudo quando o coração está funcionando sob grande carga de trabalho.
Efeito da frequência cardíaca sobre o coração como bomba:
Quanto mais frequente for o batimento cardíaco por minuto, mais sangue ele poderá
bombear, mas há algumas limitações. Por exemplo, quando a frequência cardíaca se
eleva acima de um nível crítco, a força do coração diminui. Além disso, o período da
diástole entre as contrações fica tão diminuído, que o sangue não tem tempo para fluir
adequadamente dos átrios para os ventrículos.
Efeito dos íons potássio:
Excesso de K+ no líquido extracelular faz com que o coração fique extremamente dilatado
e flácido, reduzindo a frequência cardíaca. Grandes quantidades também podem
bloquear a condução do impulso cardíaco dos átrios para os ventrículos pelo feixe A-V.
Esses efeitos se explicam, em parte, pelo fato de a alta concentração de K+, no líquido
extracelular, reduzir o potencial de repouso da membrana das fibras musculares
cardíacas.
Efeito dos íons cálcio:
Excesso de íons Ca+ faz com que o coração entre em contração espástica. Isso é
causado, pois os íons Ca+ excitam o processo contrátil do coração. Inversamente, a falta
de íons Ca+ produz flacidez cardíaca, semelhante ao efeito do excesso do potássio.
Efeito da temperatura:
A temperatura aumentada provoca aumento acentuado da frequência cardíaca. A baixa
da temperatura pode provocar redução da frequência cardíaca.
A força contrátil do coração é aumentada temporariamente, por aumento moderado da
temperatura, mas a elevação prolongada da temperatura exaure os sistemas metabólicos
do coração, causando fraqueza.
EXCITAÇÃO RÍTMICA DO CORAÇÃO
O sistema especializado excitatório e condutor do coração:
O nodo sinusal:
Está situado na parede lateral superior do átrio direito, imediatamente abaixo da veia cava
superior. As fibras desse nodo quase não contêm filamentos contráteis e, conectam-se
diretamente com as fibras atriais, de modo que qualquer potencial de ação originado do
nodo sinusal se propaga de imediato para os átrios.
Muitas fibras cardíacas possuem a capacidade de auto-excitação, processo que pode
provocar descarga e contração automáticas e rítmicas. As fibras do nodo sinusal
possuem essa capacidade de auto-excitação.
Mecanismo da ritmicidade do nodo sinusal:
Nas fibras do nodo sinusal, devido a sua negatividade muito menor, a maioria dos canais
rápidos de sódio ficam bloqueados. Consequentemente, só os canais lentos de cálciosódio podem se abrir e, assim, produzir o potencial de ação. Este, por sua vez, tem
desenvolvimento mais lento que o do músculo ventricular.
Devido à alta concentração de íons sódio no líquido extracelular e, à carga elétrica
negativa no interior das fibras do nodo sinusal em repouso, os íons positivos de sódio
tendem a vazar para o interior das fibras. Como resultado, o fluxo de íons como carga
positivos de sódio, produz um potencial de membrana menos negativo. Desse modo, o
potencial de repouso fica menos negativo entre dois batimentos consecutivos e, quando
atinge um limite, os canais de cálcio-sódio são ativados, causando o fluxo de Ca+ e Na+,
gerando o potencial de ação.
Posteriormente, os canais de cálcio-sódio se fecham e, quase ao mesmo tempo, um
grande número de canais de K+ se abrem. Assim, o fluxo de íons Ca+ e Na+ é
interrompido, enquanto que grande quantidade de íons K+ se difunde para fora da fibra,
finalizando o potencial de ação. Os canais de K+ ficam abertos por mais algum tempo,
transferindo um excesso de cargas positivas de K+ para fora da célula, gerando
temporariamente, excessiva negatividade no interior da fibra (hiperpolarização).
Após o final do ptencial de ação, mais canais de K+ começam a se fechar. Então, os íons
Na+ que entram na fibra, contrabalançam o fluxo, para fora, dos íons K+, fazendo o
potencial de repouso variar em direção da menor negatividade.
Transmissão do impulso cardíaco pelos átrios:
As terminações das fibras do nodo sinusal se fundem com as fibras musculares atriais
circundantes e, os potenciais de ação originados no nodo passam para essas fibras.
Assim, o potencial de ação se propaga por toda a massa muscular atrial, até o nodo A-V.
O impulso cardíaco não passa dos átrios para o ventrículos de forma muito rápida. Essa
demora, é suficiente para que os átrios esvaziem seu conteúdo de sangue nos
ventrículos, antes que comece a contração ventricular.
O nodo A-V situa-se na parte posterior do átrio direito.
Transmissão no sistema de Purkinje
As fibras de Purkinje saem do nodo A-V, passam pelo feixe A-V e chegam aos
ventrículos. São fibras bastante grossas e, que transmitem rapidamente o potencial de
ação. Isso permite a transmissão quase imediata do impulso, cardíaco para todo o
sistema ventricular.
Acredita-se que a rápida transmissão dos potenciais de ação pelas fibras de Purkinje,
decorra da alta permeabilidade das junções dos discos intercalares, situados entre as
sucessivas células cardíacas que formam a fibra de Purkinje. Assim, os íons são
transmitidos facilmente de uma célula para a seguinte, o que aumenta a velocidade de
condução. As fibras de Purkinje contêm poucas miofibrilas, o que significa que elas quase
não se contraem durante a transmissão dos impulsos.
Transmissão do impulso cardíaco no músculo ventricular:
O impulso atinge as extremidades das fibras de Purkinje e, é transmitido pela massa
muscular ventricular, por meio das fibras musculares ventriculares.
O músculo cardíaco enrola-se em torno do coração sob a forma de uma espiral dupla,
portanto, o impulso cardíaco não trafega de modo direto em direção à superfície externa
do coração, mas, ao contrário, segue para essa supefície ao longo da direção desses
espirais.
Controle da excitação e da condução cardíacas
O nodo sinusal como marcapasso cardíaco:
Cada vez que o nodo sinusal entra em atividade, seu impulso é conduzido para o nodo AV e para as fibras de Purkinje, descarregando suas membranas excitáveis. Então, esses
tecidos, como o nodo sinusal, se recuperam do potencial de ação, ficando
hiperpolarizados quase ao mesmo tempo. Mas o nodo sinusal perde sua hiperpolarização
muito mais rápido. Assim, o nodo sinusal produz um novo impulso antes que o nodo A-V
ou as fibras de Purkinje possam atingir seus limiares para sua auto-excitação. O novo
impulso do nodo sinusal mais uma vez descarrega o nodo A-V e as fibras de Purkinje.
Dessa forma, o nodo sinusal controla os batimentos do coração, pelo motivo de ter sua
frequência rítmica de descarga, maior que qualquer outra região deste órgão. Por isso, o
nodo sinusal é o marcapasso normal do coração.
Ocasionalmente, alguma outra parte do coração desenvolve uma descarga rítimica com
frequência maior que a do nodo sinusal. Isso pode ocorrer no nodo A-V ou nas fibras de
Purkinje, quando um deles funciona de foma anômala. Assim, o marcapasso do coração
deixa de ser o nodo sinusal, passando a ser o nodo A-V ou as fibras de Purkinje.
Um marcapasso em qualquer outro ponto, que não o nodo sinusal, é chamado de
marcapasso ectópico. Esse tipo de marcapasso, provoca sequência anormal da contração
das diferentes regiões cardíacas, podendo causar grave enfraquecimento do
bombeamento cardíaco.
O sistema de Purkinje e a contração sincrônica do músculo ventricular:
Pela descrição do sitema de Purkinje, fica claro que o impulso cardíaco atinge quase
todas as regiões dos ventrículos, dentro de um pequeno intervalo de tempo. Isso faz com
que todas as porções do músculo ventricular (nos dois ventrículos) comecem a se contrair
quase ao mesmo tempo. O bombeamento eficaz, pelas duas câmaras ventriculares, exige
essa contração sincronizada.
Efeito da estimulação parassimpática (vagal):
A estimulação dos nervos parassimpáticos para o coração, faz com que o hormônio
acetilcolina seja liberado pelas terminações vagais. Esse hormônio reduz a frequência do
ritmo do nodo sinusal e, diminui a excitabilidade das fibras juncionais A-V (entre a
musculatura atrial e o nodo A-V), o que lentifica a transmissão do impulso cardíaco para
os ventrículos.
A estimulação intensa dos vagos pode interromper a excitação rítmica do nodo sinusal,
ou bloquear a transmissão do impulso cardíaco pela junção A-V. Assim, os impulsos
rítmicos deixam de ser transmitidos para os ventrículos.
A acetilcolina liberada nas terminações nervosas vagais, aumenta a permeabilidade da
membrana das fibras ao K+, o que permite o rápido vazamento de K+ para fora das fibras
condutoras. Isso causa a hiperpolarização das fibras, o que faz com que esse tecido
excitável, fique muito menos excitável.
Efeito da estimulação simpática:
A estimulação simpática aumenta a frequência da descarga do nodo sinusal, a velocidade
de condução e, o nível de excitabilidade em todas as regiões do coração. Ela aumenta,
também, a força de contração de toda a musculatura cardíaca, tanto atrial quanto
ventricular.
A estimulação dos nervos simpáticos libera o hormônio noraepinefrina pelas terminações
nervosas simpáticas. Acredita-se, que esse hormônio, aumente a permeabilidade das
fibras musculares cardíacas ao sódio e ao cálcio.
No nodo sinusal, aumento da permeabilidade ao Na+ provoca potencial de repouso mais
positivo e, maior velocidade de variação desse potencial, em direção ao valor para a autoexcitação; aumentando, portanto, a frequência cardíaca.
No nodo A-V, a permeabilidade aumentada ao sódio, torna mais fácil para o potencial de
ação excitar a fibra condutora, reduzindo o tempo de condução dos átrios para os
ventrículos. O aumento da permeabilidade ao Ca+, é responsável pelo aumento da força
contrátil sob efeito de estimulação simpática, já que os íons Ca+ têm papel importante na
excitação do processo contrátil das miofibrilas.
MICROCIRCULAÇÃO
Na microcirculação, ocorre uma importante função circulatória: o transporte de nutrientes
para os tecidos e a remoção dos excretas celulares.
Estrutura:
Em cada órgão, a microcirculação se organiza de modo a atender às necessidades
específicas desse órgão. Geralmente, cada artéria nutridora, ao entrar no órgão, se
ramifica algumas vezes, antes que se diâmetro diminua e elas passem a ser chamadas
de arteríolas. Em seguida, as arteríolas se ramificam, diminuindo seu diâmetro, e suprindo
sangue para os capilares.
As arteríolas são bastante musculares e, seu diâmetro pode sofrer algumas variações.
Nos pontos onde os capilares verdadeiros emergem das metarteríolas, uma fibra
muscular lisa circunda o capilar. Isso é chamado de esfíncter pré-capilar . Esse esfíncter
pode abrir ou fechar o acesso ao capilar.
As vênulas são maiores que as arteríolas. A pressão nas vênulas é bem mais baixa que
nas arteríolas, de modo que as vênulas podem se contrair consideravelmente, apesar da
pouca musculatura.
A parede capilar é formada por uma única camada de células endoteliais, cercada
externamente por uma membrana basal.
O diâmetro do capilar é suficiente apenas para permitir a passagem (esprimida) dos
glóbulos vermelhos e de outras células sangüíneas.
Fluxo de sangue pelos capilares de forma intermitente, ora sim, ora não, por períodos de
segundos ou minutos. A causa dessa intermitência é o fenômeno chamado vasomoção.
Quando a intensidade do consumo de oxigênio é alta (nos tecidos), os períodos
intermitentes e a sua duração é mais prolongada, permitindo que o sangue carregue
maiores quantidades de oxigênio (e outros nutrientes) para os tecidos.
TROCA DE NUTRIENTES E DE OUTRAS SUBSTÂNCIAS ENTRE O SANGUE E O
LÍQUIDO INTERSTICIAL
Difusão através da membrana capilar:
As substâncias são transferidas entre o plasma e o líquido intersticial por difusão.
No curso do sangue pelo capilar, um grande número de moléculas de água e de
partículas dissolvidas se difundem, através da parede capilar, resultando uma mistura
contínua entre o plasma e o líquido intersticial.
Uma substância lipossolúvel pode difundir-se diretamente, através da membrana capilar.
Entre essas substâncias, estão o O2 e o CO2. Já que essas substâncias se difundem
facilmente pela membrana capilar, sua intensidade de transporte, é bem maior que a
intensidade para a maioria das substâncias não-lipossolúveis.
As substâncias hidrossolúveis (H20, íons Na+ e K+, glicose) só podem difundir-se pelos
“poros” intercelulares presentes na membrana capilar.
Quanto maior for a diferença de concentração de uma certa substância nas duas faces da
membrana capilar, maior será o movimento efetivo da substância em uma direção através
da membrana.
A intensidade da difusão da maioria das substâncias nutricionalmente importantes através
da membrana capilar é tão grande, que bastam pequenas diferenças de concentração
para produzir transporte entre o sangue e o líquido intersticial.
O interstício e o líquido intersticial:
Cerca de 1/6 do corpo consiste em espaços entre as células, que formam o interstício. O
líquido intersticial deriva dos capilares por filtração e difusão. Contém quase que os
mesmos constituintes do plasma, porém, em concentrações menores, já que as proteínas
não passam com facilidade através das paredes dos capilares.
Graças às curtas distâncias entre os capilares e as células teciduais, a difusão permite o
rápido transporte (através do interstício) de moléculas de água, de eletrólitos, nutrientes,
excretas celulares, O2, CO2 e outros.
As proteínas do plasma e do líquido intersticial:
A pressão nos capilares tende a forçar líquido, e suas substâncias em solução, a passar
pelos poros capilares para atingir os espaços intersticiais. De maneira inversa, a pressão
gerada pelas proteínas plasmáticas (pressão oncótica = () tende a provocar o movimento
do líquido dos espaços intersticiais para o sangue. Essa pressão impede a perda de
grande volume de líquido pelo sangue para os espaços intersticiais.
As forças que determinam o movimento do líquido através da membrana capilar são:
Pc – Pressão capilar: tende a forçar líquido para fora, através da membrana capilar;
Pressão do líq. Intersticial: tende a forçar líquido para o interior do capilar (por meio da
membrana capilar) quando for positiva, mas, quando for negativa, atua no movimento
contrário.
Pressão coloidosmótica do plasma (( p) : tende a provocar o movimento do líquido dos
espaços intersticiais para o sangue, através da membrana capilar.
Pressão coloidosmótica intersticial (( li): tende a provocar o movimento de líquido para o
espaço intersticial, através da membrana capilar.
Essas forças são chamadas de “Forças de Starling”.
As proteínas são as únicas substâncias dissolvidas no plasma e no líquido intersticial,
que não se difundem com facilidade através da membrana capilar. E, quando pequenas
quantidades de proteínas se difundem para o líquido intersticial , muitas delas são
removidadas dos espaços intersticiais por meio dos vasos linfáticos.
Essas proteínas são as responsáveis pela pressão coloidosmótica ou oncótica na
membrana capilar.
O EQUILÍBRIO DE STARLING PARA AS TROCAS CAPILARES
Starling destacou que, nas condições normais, há um estado de quase-equilíbrio na
membrana capilar. Nesse equilíbrio, a quantidade de líquido que filtra para fora, em
alguns capilares, é quase igual à quantidade de líquido que volta à circulação.
O SISTEMA LINFÁTICO
O sistema linfático representa uma via acessória pela qual o líquido pode fluir dos
espaços intersticiais para o sangue. Um fato importante, é que os linfáticios podem
transportar proteínas e material em grandes partículas, para fora dos espaços teciduais.
Essa remoção não poderia ser feita diretamente pelos capilares. Essa função dos
linfáticos é essencial, sem ela se morreria dentro de 24 horas.
Capilares linfáticos:
A pequena quantidade de líquido que retorna à circulação por meio dos linfáticos é muito
importante, pois, substância com alto peso molecular, como as proteínas, não podem ser
reabsorvidas de outra maneira. Porém, essas proteínas podem entrar nos capilares
linfáticos quase que sem qualquer impedimento. Isso, graças à estrutura dos capilares
linfáticos. Esses, são formados por células endoteliais, que se fixam no tecido conjuntivo
circundante, por meio de filamentos de ancoragem.
Geralmente, a borda de uma célula endotelial fica sobreposta à da célula adjacente,
permitindo que a borda livre mova-se para dentro, formando uma válvula que se abre no
interior do capilar.
O líquido intersticial pode promover a abertura dessas válvulas, fluindo diretamente para o
interior do capilar linfático. Depois que o líquido entra no capilar, é difícil para ele sair, pois
as válvulas se fecham ao fluxo retrógrado.
Essa válvulas se estendem pelos capilares linfáticos, até o ponto onde eles desembocam
na circulação sangüínea.
Acredita-se que os dois fatores primários que determinam o fluxo de linfa são: a pressão
do líquido intersticial e a atividade da bomba linfática. Ou seja, simplificadamente, a
intensidade do fluxo da linfa é determinada, pelo produto da pressão do líquido intersticial
pela atividade da bomba linfática.
Obs: a linfa deriva do líquido intersticial, que flui para os linfáticos. Consequentemente, a
linfa tem quase a mesma composição do líquido intersticial.
O sistema linfático também atua no controle da concentração protéica nos líquidos
intersticiais, do volume do líquido intersticial e da pressão do líquido intersticial.
Uma vez que a concentração protéica do líquido intersticial tenha atingido certo valor,
causando aumento considerável do volume e da pressão do líquido intersticial, o retorno
da proteína e do líquido, através do sistema linfático, torna-se suficiente para balancear a
intensidade do vazamento de proteína e de líquido pelos capilares sangüíneos.
CONTROLE DO FLUXO SANGÜÍNEO
Cada tecido tem a capacidade de controlar seu próprio fluxo sangüíneo local, de acordo
com suas necessidades metabólicas. E, quando a necessidade de fluxo sangüíneo se
altera, o fluxo segue essa alteração.
Algumas das necessidades específicas dos tecidos em termos de fluxo sangüíneo, são:
Suprimento de O2 aos tecidos;
suprimento de outros nutrientes, como glicose, aminoácidos, ácidos graxos, etc;
remoção de CO2 dos tecidos;
remoção de íons H+ dos tecidos;
manutenção de concentração apropriadas de outros íons nos tecidos;
transporte de vários hormônios e outras substâncias específicas para os diferentes
tecidos.
MECANISMOS DE CONTROLE DO FLUXO SANGÜÍNEO
O controle do fluxo sangüíneo local, pode ser dividido em duas fases: controle agudo e
controle a longo prazo.
Controle agudo: é obtido através de rápidas alterações na constrição local das arteríolas,
metarteríolas e esfíncteres pré-capilares, ocorrendo dentro de segundos a minutos,
proporcionando um meio rápido de manter o fluxo sangüíneo tecidual local apropriado.
Um aumento de até 8 vezes no metabolismo, aumenta agudamente o fluxo sangüíneo em
cerca de 4 vezes. A princípio, o aumento do fluxo é menor que o aumento do
metabolismo. Porém, quando o metabolismo aumenta para remover a maior parte dos
nutrientes do sangue, pode haver um aumento adicional do metabolismo, somente se
houver uma elevação simultânea do fluxo sanguíneo para suprir os nutrientes
necessários.
Teoria vasodilatadora:
Quanto maior o metabolismo ou quanto menor a disponibilidade de O2 (ou de outros
nutrientes) para certo tecido, maior a taxa de formação de uma substância vasodilatadora.
Acredita-se que esta substância vasodilatadora sofra difusão de volta para os esfíncteres
pré-capilares, metarteríolas e arteríolas, causando sua dilatação. Algumas substâncias
vasodilatadoras incluem adenosina, CO2, ácido láctico, compostos de fosfato de
adenosina, histamina, íons K+ e íons H+.
A maioria das teorias vasodilatadoras pressupõe que a substância vasodilatadora seja
liberada pelo tecido, principalmente em resposta à deficiência de O2. Por exemplo, uma
diminuição na disponibilidade de O2 pode induzir a liberação de adenosina e de ácido
láctico pelos tecidos. Estas substâncias podem causar vasodilatação intensa e,
consequentemente, podem ser responsáveis pela regulação local do fluxo sangüíneo.
Acredita-se que a adenosina seria, sem dúvida, o mais importante dos vasodilatadores
locais para o controle do fluxo sangüíneo local. Por exemplo, há liberação de pequenas
quantidades de adenosina das células musculares cardíacas, todavez que o fluxo
sangüíneo coronário torna-se insuficiente e, acredita-se que este processo produza
vasodilatação local no coração, com consequente normalização do fluxo sangüíneo.
Hiperemia reativa:
Quando o suprimento sangüíneo para certo tecido é bloqueado durante algum tempo e,
em seguida, liberado, o fluxo através do tecido geralmente aumenta por 4 a 7 vezes o
normal. Esse aumento do fluxo, dura o mesmo tempo que durou o bloqueio. Este
fenômeno é chamado de hiperemia reativa.
Depois de curtos períodos de oclusão vascular, o fluxo sangüíneo adicional durante a fase
de hiperemia reativa, persiste por tempo suficiente para repor quase exatamente o déficit
tecidual de O2, ocorrendo durante o período de oclusão.
Hiperemia ativa:
Quando qualquer tecido se torna altamente ativo, verifica-se um aumento na velocidade
do fluxo sangüíneo pelo tecido. O aumento do metabolismo local determina um consumo
muito rápido de nutrientes do líquido tecidual pelas células, liberando, ao mesmo tempo,
grandes quantidades de substância vasodilatadora.
Consequentemente, ocorre dilatação dos vasos sangüíneos locais e, por conseguinte,
aumento do fluxo sangüíneo. Assim, o tecido ativo passa a receber os nutrientes
adicionais necessários para manter seu novo nível funcional.
“Auto-regulação” do fluxo sangüíneo:
Em qualquer tecido corporal, a elevação aguda da pressão arterial irá produzir um
aumento imediato no fluxo sangüíneo. Em menos de 1 minuto, o fluxo sangüíneo, na
maioria dos tecidos, retorna praticamente a seu nível normal. Esse retorno é denominado
auto-regulação do fluxo sangüíneo.
Teoria metabólica:
Quando a pressão arterial se torna muito elevada, o excesso de fluxo proporciona
quantidades altas de O2 e de outros nutrientes para os tecidos; esses nutrientes podem
induzir a contração dos vasos sangüíneos, de modo que o fluxo readquire quase o seu
valor normal, apesar da alta da pressão.
Teoria miogênica:
Baseia-se na observação de que a súbita distensão dos pequenos vasos sangüíneos,
provoca contração do músculo liso da parede vascular. Consequentemente, acredita-se
que, quando a pressão arterial elevada distende o vaso, este processo possa causar
constrição vascular e redução do fluxo sangüíneo para níveis quase normais.
Ao contrário, na presença de baixas pressões, o grau de distensão do vaso é menor, de
modo que o músculo liso se relaxa, permitindo um aumento do fluxo.
CONTROLE A LONGO PRAZO: refere-se a alterações lentas do fluxo no decorrer de
vários dias, semanas ou até meses.
Esta regulação a longo prazo proporciona uma regulação mais completa do que a do
mecanismo agudo.
O mecanismo da regulação a longo prazo do fluxo sangüíneo local, representa uma
alteração no grau de vascularização dos tecidos. Ou seja, quando a pressão arterial cai
para 60 mmHg e permanece assim durante muitas semanas, as dimensões estruturais
físicas dos vasos no tecido aumentam e, em certas condições, até mesmo o número de
vasos aumenta. Mas, quando a pressão aumenta e chega num nível muito alto, tanto o
número como as dimensões dos vasos diminui.
Essa capacidade de reconstrução da vasculatura tecidual, para suprir as necessidades
dos tecidos, é muito maior em tecidos jovens do que me tecidos mais velhos e já
estabelecidos.
Angiogênese: esse termo refere-se ao crescimento de novos vasos sangüíneos.
A angiogênese ocorre principalmente em respota à presença de fatores angiogênicos
liberados por tecidos que estão em rápido crescimento ou tecidos que apresentam
metabolismo muito alto. Três desses fatores que foram bem caracterizados são: o fator de
crescimento de células endoteliais (E.C.G.E), o fator de crescimento de fibroblastos
(F.G.F) e a angiogenia.
Provavelmente, é a deficiência tecidual de O2, de outros nutrientes ou de ambos que leva
à formação dos fatores angiogênicos.
Praticamente todos os fatores angiogênicos promovem o crescimento de novos vasos da
mesma maneira. Ou seja, fazem com que os vasos novos brotem a partir de pequenas
vênulas ou , em certos casos, de capilares.
Primeiro, ocorre a dissolução da membrana basal das células endoteliais, no ponto de
brotamento. Depois, ocorre a rápida reprodução de novas células endoteliais, que se
deslocam para fora da parede vascular, formando extensos cordões dirigidos para a
origem do fator angiogênico. As células em cada cordão continuam se dividindo e,
eventualmente, formam um tubo. Esse tubo, entra em contato com outro tubo brotando de
outro vaso, formando uma alça capilar através da qual o sangue começa a fluir. Quando o
fluxo é muito grande, as células musculares lisas invadem a parede, de modo que alguns
dos novos vasos se tornam pequenas arteríolas ou, até, artérias de maior calibre.
CONTROLE DA PRESSÃO ARTERIAL
Sistema Nervoso Autônomo
Sistema Nervoso Simpático:
As fibras nervosas simpáticas vasomotoras passam para a cadeia simpática e, chegam
até a circulação por duas vias; 1. Através de nervos simpáticos específicos, que inervam a
vasculatura das vísceras internas e coração e, 2. Através dos nervos espinhais que
inervam a vasculatura das áreas periféricas.
Todos os vasos são inervados, com exceção dos capilares, dos esfíncteres pré-capilares
e da maioria das metarteríolas.
A inervação das pequenas artérias e arteríolas permite que a estimulação simpática
aumente a resistência e, consequentemente, reduza a taxa de fluxo sangüíneo pelos
tecidos.
A inervação dos grandes vasos particularmente as veias, permite que a estimulação
simpática diminua o volume desses vasos, alterando, assim, o volume do sistema
circulatória periférico. Esse processo pode transferir sangue para o coração, tendo
portanto, importante papel na regulação da função cardiovascular.
Existem, ainda, fibras simpáticas que se dirigem para o coração. A estimulação simpática
aumenta acentuadamente a atividade do coração, aumentando a frequência cardíaca e a
força de bombeamento do coração (também o débito cardíaco).
Sistema Nervoso Parassimpático:
O sistema nervoso parassimpático só desempenha pequeno papel na regulação da
circulação. Seu único efeito circulatório importante consiste no controle da frequência
cardíaca por meio das fibras parassimpáticas levadas até o coração pelos nervos vagos
e, pelo nervo do bulbo diretamente para o coração.
A estimulação parassimpática produz acentuada redução da frequência cardíaca e ligeira
diminuição da contrabilidade do músculo cardíaco.
Sistema vasoconstritor simpático:
Os nervos simpáticos transportam um grande número de fibras vasoconstritoras e apenas
algumas fibras vasodilatadoras.
As fibras vasoconstritoras distribuem-se em praticamente todos os segmentos da
circulação.
Centro vasomotor: Está localizado na substância reticular do bulbo e terço inferior da
ponte. O centro vasomotor transmite impulsos parassimpáticos através dos nervos vagos
para o coração, bem como impulsos simpáticos através da medula e dos nervos
simpáticos periféricos para todos de quase todos os vasos sangüíneos do corpo.
Área vasoconstritora C1: localizada na parte superior do bulbo. Os neurônios desta área
secretam norepinefrina; suas fibras distribue-se por toda a medula espinhal, onde excitam
os neurônios vasoconstritores do sistema nervoso simpático.
Área vasodilatadora A1: localizada na metade inferior do bulbo. As fibras desses
neurônios projetam-se para cima, até a área vaoconstritora C1 e inibem a sua atividade
(de C1), causando vasodilatação.
Área sensorial A2: localizada nas porções póstero-laterais do bulbo e na parte inferior da
ponte. Os neurônios desta área recebem sinais nervosos sensoriais através dos nervos
vago e glossofaríngeo. Os sinais que saem dessa área sensorial (A2), ajudam a controlar
as atividades das áreas vasoconstritora e vasodilatadora, proporcionando m controle
“reflexo” de muitas funções circulatórias. Um exemplo é o reflexo baroceptor, para o
controle da pressão arterial.
Controle da atividade cardíaca pelo centro vasomotor:
As porções laterais do centro vasomotor transmitem impulsos excitatórios até o coração,
por meio das fibras nervosas simpáticas, aumentando a frequência e a contrabilidade
cardíaca; enquanto a porção medial do centro vasomotor, transmite impulsos para o
coração através dos nervos vagos, diminuindo a frequência cardíaca. Ou seja, o centro
vasomotor pode aumentar ou diminuir a atividade cardíaca. Esta aumenta ao mesmo
tempo em que ocorre vasoconstrição por todo o corpo, e diminui ao mesmo tempo em
que ocorre inibição da vasoconstrição.
Sistema Nervoso Central e o controle rápido da P.A:
Uma das funções mais importantes do controle nervoso da circulação, é a sua
capacidade de produzir rápidos aumentos da pressão arterial. Para tanto, todas as
funções vasoconstritoras e cardioaceleradoras do sistema simpático são estimuladas
como uma unidade. Ao mesmo tempo, há uma inibição dos sinais inibidores vagais para o
coração.
Há três alterações principais:
Quase todas as arteríolas do corpo se contraem: isso aumenta a Rpt (resistência
periférica total) acentuadamente, impedindo o escoamento de sangue das artérias e
aumentando a P.A.
As veias e os outros grandes vasos da circulação, contraem-se fortemente: isso desloca o
sangue dos grandes vasos sangüíneos periféricos para o coração, aumentando o volume
nas câmaras cardíacas. Isso faz com que o coração bata com muita mais força,
bombeando grandes quantidades de sangue. Este processo também aumenta a P.A.
O coração é diretamente estimulado pelo sistema nervoso autônomo, aumentando ainda
mais o bombeamento cardíaco. Esse processo é produzido por aumento da frequência
cardíaca, até 3 vezes o normal. Os sinais nervosos simpáticos agem diretamente,
aumentando a força contrátil do músculo cardíaco, aumentando também a capacidade do
coração de bombear maiores volumes de sangue. Sobre forte estimulação simpática, o
coração é capaz de bombear duas a três vezes mais sangue do que em condições
normais. Contribuindo ainda mais para a elevação da P.A.
Sistema de controle baroceptor – reflexos baroceptores:
Este reflexo é desencadeado por receptores de estiramento, denominados baroceptores,
localizados na parede de várias das grandes artérias sistêmicas. Uma elevação da
pressão, distende os baroceptores e faz com que eles transmitam sinais para o S.N. C.
Em seguida, sinais de feed back são enviados de volta à circulação pelo S.N.A , a fim de
reduzir a pressão para níveis normais.
Os baroceptores são abundantes na região do seio carotídeo (artéria carótida interna) e,
na parede do arco aórtico.
Os baroceptores respondem com grande rapidez a alterações da P.A; com efeito, a
frequência de descarga de impulsos aumenta durante a sístole e diminui durante a
diástole.
Além disso, os baroceptores respondem muito mais a uma pressão que está sofrendo
rápida alteração do que a uma pressão estacionária.
Reflexos desencadeados pelos baroceptores:
Os sinais dos baroceptores atingem o feixe solitário do bulbo, surgem sinais secundários,
que inibem o centro vasomotor do bulbo e excitam o centro vagal. Assim, há
vasodilatação das veias e arteríolas por todo o sistema circulatório periférico e, diminuição
da frequência cardíaca e da força de contração do coração. Consequentemente, a
excitação dos baroceptores pela pressão nas artérias produz diminuição reflexa da P.A,
devido à redução Rpt e do débito cardíaco (DC). Ao contrário, a pressão baixa, produz
elevação reflexa da P.A para níveis normais.
A capacidade dos baroceptores de manter a P.A relativamente constante, é importante
quando a pessoa altera sua postura. Ou seja, imediatamente após o indivíduo ficar de pé,
a P.A na cabeça e na parte superior do corpo tende a cair, de modo que uma queda
acentuada dessa pressão, pode causar perda da consciência. A queda da pressão nos
barocptores desencadeia um reflexo imediato, resultando em forte descarga simpática por
todo o corpo, minimizando a redução da pressão na cabeça e na parte superior do corpo.
Como o sistema baroceptor se opõe a elevações ou reduções da P.A, é chamado de
sistema tampão da pressão, enquanto os nervos provenientes dos baroceptores são
chamados nervos tampão.
Por exemplo, em um cão com os baroceptores normais, a P.A permanece durante todo o
dia na faixa de 85 a 115 mmHg (durante a maior parte do dia, a P.A permanece quase
exatamente em 100 mmHg). Em um cão, cujos baroceptores foram denervados, a P.A
encontra-se numa faixa de 50 mmHg (caindo) ou elevando-se até 160 mmHg. Há uma
grande variabilidade da pressão no cão denervado, causada por fatos simples do dia,
como deitar, ficar de pé, comer, etc.
Em síntese, a principal função do sistema baroceptor arterial, é a de reduzir a variação
diária da P.A para cerca a metade a 1/3 da que ocorreria, se o sistema baroceptor não
estivesse presente.
Pouca importância do sistema baroceptor para a regulação a longo prazo da P.A:
O sistema de controle dos baroceptres tem muito pouca importância na regulação a longo
prazo da P.A, pois, os próprios baroceptores reajustam-se, em um a dois dias, a qualquer
nível de pressão a que sejam expostos. Ou seja, se a pressão aumentar de 100mmHg, é
transmitido em grande número de impulsos baroceptores. Em seguida, há diminuição da
frequência de descarga. Nos próximos um a dois dias, a frequência diminui mais
lentamente. Ao final desse período, a frequência retorna praticamente a seu nível normal,
mesmo que a P.A ainda esteja em 100 mmHg.
Quando a P.A cai para níveis muito baixos, os baroceptores não transmitem qualquer
impulso. Porém, no decorrer de mais ou menos um dia, a frequência de descarga dos
baroceptores volta ao nível de controle original.
Regulação da P.A (continuação):
Rim:
Quando há um aumento na Rpt, deve ocorrer um aumento da P.A. Porém, quando os rins
funcionam normalmente, a elevação aguda da P.A não é mantida, ao contrário, ela volta a
seu nível normal dentro de um dia ou mais.
Isso ocorre, porque os rins começam a responder imediatamente à P.A elevada através
da diurese e natriurese de pressão. Dentro de algumas horas ou dias, há a perda de
grandes quantidades de sal e água do organismos, isso prossegue até a P.A retornar ao
nível normal.
Regulação humoral:
Angiotensina: é uma das mais potentes substâncias vasoconstritoras conhecida. A
angiotensina, age simultâneamente sobre todas as arteríolas do corpo, aumentando a
RPT, com consequente elevação da P.A.
ADH (vasopressina): é ainda mais poderosa do que a angiotensina como vasoconstritor.
Em condições normais, ela só é secretada em quantidades muito pequenas. Porém, a
concentração de vasopressina circulante durante a hemorragia grave, pode aumentar o
suficiente para elevar a P.A por até 60 mmHg. Em muitos casos, isso pode fazer com que
a P.A retorne quase a seu valor normal.
Endotelina: é um poderoso vasoconstritor. É encontrada nas células endoteliais da
maioria dos vasos sangüíneos ou de todos eles.
Sistema Renina Angiotensina Aldosterona (SRAA):
A renina é uma pequena enzima liberada pelos rins, quando a P.A cai para níveis muito
baixos. Assim, ela eleva a P.A de várias maneiras, ajudando a corrigir a queda inicial da
pressão.
A renina é sintetizada e armazenada nas células justaglomerulares dos rins. Quando a
P.A cai, a renina é liberada pelas células dos rins e passa para o sangue, para circular por
toda a corrente sangüínea. Porém, uma pequena quantidade permanece nos líquidos
locais do rim.
A renina atua enzimaticamente sobre uma proteína plasmática denominada
angiotensinogênio, liberando a angiotensina I. Esta, possui propriedades vasconstritoras
leves.
Após a formação da angiotensina I, há a formação da angiotensina II. Isso ocorre nos
pequenos vasos dos pulmões.
A angio II é um poderoso vasoconstritor, mas permanece no sangue durante pouco
tempo, devidoà sua rápida inativação pelas angiotensinases.
Durante sua permanência no sangue, a angio II exerce dois efeitos principais, que podem
elevar a P.A. O 1º deles, é a vasoconstrição. A constrição das arteríolas aumenta a Rpt,
ocorrendo elevação da P.A.
O 2º efeito da angio II, é sua atuação sobre os rins, diminuindo a excreção de sal e água.
Este processo aumenta lentamente o volume de líquido extracelular, o que eleva a P.A no
decorrer de várias horas e dias.
Efeito da Angiotensina sobre a retenção renal de sal e água:
A angio exerce vários efeitos intra-renais, resultando em retenção de sal e água pelos
rins. Provavelmente, o mais importante deles seja a constrição dos vasos sangüíneos
renais, o que diminui o fluxo sangüíneo pelos rins.
Consequentemente, uma menor quantidade de líquido é filtrada pelos glomérulos para os
túbulos. Assim, ocorre excreção de menor quantidade de urina. A angio exerce, ainda,
efeito moderado sobre as células tubulares, aumentando a reabsorção tubular de sódio e
água.
Estimulação da secreção de aldosterona pela angiotensina:
A angio também é umdos mais potentes fatores de controle da secreção de aldosterona.
Assim, quando o SRAA é ativado, a taxa de secreção de aldosterona aumenta ao mesmo
tempo. A aldosterona produz aumento pronunciado na reabsorção de sódio pelos túbulos
renais. Esse processo causa retenção de água, aumentando o volume de líquido
extracelular e resultando, secundariamente, um elevação da P.A.
O sistema de renina-angiotensina é o mecanismo automático do feed back, que ajuda a
manter a P.A em seu nível normal ou quase normal, mesmo quando a ingestão de sal
aumenta. Quando a ingestão de sal diminui, verifica-se a ocorrência de efeitos
exatamente opostos.
SISTEMA DIGETIVO
Função:
O tubo digestivo fornece ao organismo, um suprimento contínuo de água, eletrólitos e
nutrientes. Para que isso ocorra, é necessário o movimento do alimento