Atualização em Terapêutica Hormonal
Módulo II
1
Terapêutica com
Hormônios Bioidênticos
Hormônios Bioidênticos disponíveis na Farmácia de
Manipulação.
Estudos & Atualidades
1. Estradiol
O estradiol (E2), também conhecido por 17β-estradiol ou
oestradiol é o segundo hormônio sexual produzido
naturalmente predominante nas mulheres, tendo
impacto crítico sobre a função sexual e reprodutiva.
Quando administrado oralmente é convertido à estrona
(E1), substância que corresponde a 80% dos estrogênios
naturais presentes em mulheres na pré-menopausa. In
vivo o estradiol é menos potente que a estrona, no
entanto, por ser convertido à estrona pelo fígado após
ingestão oral, acaba apresentando eficácia semelhante. É
também encontrado em homens, como produto
metabolicamente inativo da testosterona12.
O estradiol penetra livremente nas células e interage com
receptores citoplasmáticos alvo, tendo acesso ao núcleo da
célula e regulando a transcrição genética, com formação de
RNA mensageiro, que por sua vez interage com os
ribossomos produzindo proteínas específicas que
expressam o efeito do estradiol nestas células alvo. O
estradiol se liga aos receptores estrogênios do tipo ERα e
ERβ, desencadeando seus efeitos sobre a reprodução
feminina e agindo como um fator de crescimento tecidual
nos órgãos reprodutivos, reforçando o crescimento do
miométrio, estimulando o revestimento vaginal,
participando da manutenção de oócitos no ovário,
desempenhando papel fundamental no ciclo menstrual,
entre outros. Além disso, atua sobre o desenvolvimento
sexual, reprodução masculina e exerce efeito sobre os
ossos, fígado, cérebro e vasos sanguíneos14.
2. Estriol
O estriol (E3) é um hormônio encontrado em quantidades mínimas no organismo, tendo sua produção aumentada
durante a gestação. A placenta é responsável por sintetizar este composto a partir de sulfato de
hidroxidehidroepiandrosterona (16-OH-DHEAS), um androgênio produzido pelo fígado e glândulas adrenais do feto. A
placenta humana produz o hormônio pregnenolona a partir do colesterol, e este é convertido na glândula adrenal do
feto em dehidroepiandrosterona (DHEA), um esteroide com 19 carbonos (C19) que é subsequentemente sulfonado e
hidroxilado no fígado do feto a 16-OH-DHEAS. Por fim, a placenta converte o 16-OH-DHEAS a estriol, sendo o principal
sítio de produção deste hormônio15. O estriol é essencial para a gravidez, assim como a progesterona, sendo os
principais esteróides sexuais nesse período da vida da mulher. Além disso, é estrógeno mais benéfico para a vagina,
cérvix e vulva, sendo que nos casos de atrofia ou secura vaginal na menopausa, que predispõe a ocorrência de vaginite
e cistite, é o estrógeno mais eficaz e mais seguro, sendo empregado com sucesso16.
2
Estudos & Atualidades
3. Hidrocortisona
A hidrocortisona é a forma farmacêutica que é convertida a
cortisol no organismo após administração oral, tópica e
intravenosa. Este é um hormônio esteroide glicocorticoide,
produzido pela glândula adrenal, sendo liberado em
resposta ao estresse e baixos níveis de glicocorticoides
sanguíneos.
MECANISMO DE AÇÃO DO CORTISOL12
CORTISOL
Essa liberação é controlada pelo hipotálamo, através da ação
do hormônio adrenocorticotrófico (ACTH), que a qual é
modulada pelo hipotálamo, através da secreção do
hormônio liberador de corticotrofina (CRH)12. O cortisol
exerce seu efeito através de ação sobre receptores
intranucleares que regulam a transcrição gênica,
modificando a atividade de vários genes e das proteínas
produzidas a partir deles. Muitos genes são afetados, entre
eles os das ciclooxigenases e colagenases, que são inibidos.
Dentre seus efeitos estão o aumento da glicose sanguínea
através da gliconeogênese, supressão da resposta imune,
auxílio no metabolismo de lipídeos proteínas e
carboidratos17.
4. Pregnenolona
A pregnenolona é um hormônio esteroide envolvido na síntese
de
progesterona,
mineralocorticóides,
glicocorticoides,
androgênios e estrogênios, sendo por isso considerada um próhormônio. Como outros esteroides, a pregnenolona é sintetizada
a partir do colesterol envolvendo reações de hidroxilação nos
carbonos 20 e 22 através da ação das enzimas do citocromo
P450, localizado na mitocôndria e controlado por hormônios
pituitários12. Assim como a dehidroepiandrosterona e a
progesterona, a pregnenolona pertence ao grupo de
neuroesteroides, os quais são encontrados em altas
concentrações em diversas áreas cerebrais, sendo sintetizados
nestes locais. Os neuroesteroides afetam a função sináptica,
conferem proteção ao cérebro e aumentam a mielinização. A
pregnenolona atua como antagonista de receptor gabaérgico do
tipo a (GABAA) e aumenta a neurogênese no hipocampo18.
5. Progesterona:
A progesterona é um hormônio esteroide envolvido no ciclo menstrual feminino, gravidez e na
embriogênese humana e de outras espécies. Pertence a classe dos progestogênios, sendo o hormônio
deste grupo de maior ocorrência natural. No organismo é produzida a partir da pregnenolona. Em
laboratório pode ser manufaturada a partir da diosgenina, esteroide presente nas plantas da família
Dioscorea19,20.
3
Estudos & Atualidades
Este esteroide exerce sua ação ligando-se ao seu receptor intracelular
específico, embora existam algumas teorias de que a progesterona liga-se
também a receptores na membrana celular 21,22. Além disso, a progesterona
atua como um potente antagonista de receptor mineralocorticoide, com
afinidade superior à aldosterona e a outros corticoides como o cortisol e a
corticosterona. Inúmeros são os efeitos fisiológicos da progesterona, dentre
eles sobre o sistema reprodutivo e nervoso. Esses efeitos se apresentam
amplificados na presença de estrogênio, já que este através de seus
receptores específicos aumenta a expressão dos receptores de
progesterona23.
MECANISMO DE CONTROLE HORMONAL DO
SISTEMA REPRODUTOR FEMININO12
4
Diosgenina
AÇÃO DA PROGESTERONA SOBRE
ENDOMÉTRIO DURANTE O PERÍODO
MENSTRUAL12
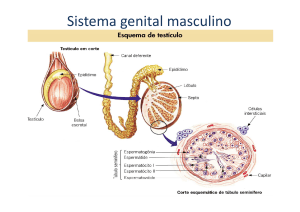
6. Testosterona:
A testosterona é um hormônio esteroide do grupo dos androgênios encontrado em
mamíferos, répteis, pássaros e outros vertebrados. Em mamíferos é
primariamente secretada nos testículos e ovários, apesar de que pequenas
quantidades podem ser secretadas pelas glândulas adrenais.
Nos homens é o principal hormônio sexual, desempenhando papel fundamental na reprodução
masculina, promoção de caracteres secundários sexuais, além de ser um hormônio essencial para a saúde
e bem estar24. É classificado como um hormônio anabólico, o que está diretamente relacionado a sua
capacidade de estimular e promover o crescimento de massa muscular e força, aumento da densidade
óssea e estímulo a sua maturação. Assim como outros esteroides, a testosterona é derivada do colesterol,
o qual é convertido em pregnenolona após algumas reações, e posteriormente à testosterona 25. A
testosterona livre é transportada através do citoplasma das células alvo, onde pode se ligar ao receptor
androgênico ou ser reduzida à 5α-dihidroxitestosterona (DHT) pela enzima citoplasmáticas 5α-redutase. O
DHT se liga a mesmo receptor androgênico, porém com maior afinidade que a testosterona, aumentando
em até cinco vezes a potência da testosterona livre. Após ligação ao receptor alvo, ocorrem alterações
conformacionais que permitem a migração do hormônio pela célula e sua ligação direta às sequências
específicas de nucleotídeos no DNA cromossômico. As áreas de ligação são denominadas elementos de
resposta hormonal (HREs) que influenciam a atividade de transcrição de determinados genes, produzindo
os efeitos androgênicos26,27.
MECANISMO DE CONTROLE HORMONAL DO
SISTEMA REPRODUTOR MASCULINO12
MECANISMO DE AÇÃO DA TESTOSTERONA 12
5
7 e 8. Tiroxina (T4) e Triiodotironina (T3):
São hormônios produzidos pela tireoide, essenciais em vários processos
metabólicos, incluindo crescimento, desenvolvimento e metabolismo celular,
além de ainda inibir a secreção hipofisária de TSH12. A ação dos hormônios da tireoide é mediada por
receptores nucleares, modulando a transcrição gênica e, portanto, a síntese proteica. A triiodotironina ligase a esses receptores com maior afinidade que a tiroxina, sendo assim oito vezes mais potente em suas
ações. A tiroxina, com quatro átomos de iodo na molécula, é inativa, podendo converter-se em
triiodotironina nos tecidos periféricos e sendo responsável por 80% da triiodotironina circulante. Essa
conversão é realizada enzimaticamente, possibilitando seu controle homeostático 28.
Duas situações clínicas mais comuns podem se desenvolver por alterações no metabolismo hormonal da
tireoide, o hipertireoidismo e o hipotireoidismo. O hipertireoidismo ocorre quando excessivas quantidades
de hormônios da tireóide são produzidas e disponíveis na circulação, afetando tecidos periféricos. Os
sintomas mais comuns são perda de peso e apetite, nervosismo, fadiga, taquicardia, bócio, intolerância ao
calor, aumento da sudorese, tremor, palpitação, fraqueza muscular, dispnéia, alterações cutâneas,
colesterol baixo, labilidade emocional e menstruação irregular. O hipotireoidismo, por sua vez, ocorre
quando há deficiência na produção de hormônios tireoidianos, o que causa uma redução generalizada dos
processos metabólicos. Os sintomas incluem ganho de peso, letargia, intolerância ao frio, pele seca, perda
de cabelo, constipação, crescimento retardado, colesterol elevado, bradicardia e hipertensão29.
FORMAÇÃO DOS HORMÔNIOS TIREOIDIANOS (T3 E T4)12
6
Diversos são os hormônios bioidênticos disponíveis para a preparação de formulações
magistrais, entre eles o estradiol, estriol, progesterona e testosterona.
Preparações manipuladas contendo hormônios bioidênticos oferecem vantagens em
relação às preparações hormonais industrializadas, entre elas larga margem de variação nas dosagens,
uso de veículos excipientes especiais como o gel de polaxamer, concentração e composição
individualizadas.
A possibilidade de vias alternativas de administração como cremes, supositórios e tabletes sublinguais,
entre outros, também se mostram como uma vantagem adicional30.
Literatura Consultada
1. Cirigliano
M. Bioidentical hormone therapy: a review of the evidence. J Womens Health (Larchmt). 2007 Jun;16(5):600-31.
2. Francisco L. Is bio-identical hormone therapy fact or fairy tale? Nurse Pract. 2003 Jul;28(7 Pt 1):39-44.
3. Taylor M. Unconventional estrogens: estriol, biest, and triest. Clin Obstet Gynecol. 2001 Dec;44(4):864-79.
4. Simon JA. Understanding the Controversy: Hormone Testing and Bioidentical Hormones. 17th Annual Meeting of The North
American Menopause Society (NAMS). 2006; Oct. Nashville, Tennessee.
5. Hersh AL, Stefanick ML, Stafford RS. National use of postmenopausal hormone therapy: Annual trends and response to recent
evidence. JAMA 2004;291:47.
6. Hing E, Brett KM. Changes in U.S. prescribing patterns of menopausal hormone therapy, 2001–2003. Obstet Gynecol 2006;108:33.
7. Harvard Women´s Health Watch. What are bioindetical hormones? Natural. Bioidentical. Compounded. Confusion about theses
terms is only adding to the confusion over hormone therapy. Harvard Medical School. 2006 Aug;13(12):1-3.
8. Conaway E. Bioidentical hormones: an evidence-based review for primary care providers. J Am Osteopath Assoc. 2011
Mar;111(3):153-64.
9. Moskowitz D. A comprehensive review of the safety and efficacy of bioidentical hormones for the management of menopause and
related health risks. Altern Med Rev. 2006 Sep;11(3):208-23.
10. Iftikhar S, Shuster LT, Johnson RE, Jenkins SM, Wahner-Roedler DL. Use of bioidentical compounded hormones for menopausal
concerns: cross-sectional survey in an academic menopause center. J Womens Health (Larchmt). 2011 Apr;20(4):559-65.
11. Holtorf K. The bioidentical hormone debate: are bioidentical hormones (estradiol, estriol, and progesterone) safer or more
efficacious than commonly used synthetic versions in hormone replacement therapy? Postgrad Med. 2009 Jan;121(1):73-85.
12. Rang HP, Dale MM, Ritter Jm, Moore PK. Pharmacology. 5th Edition. 2003. Churchill-livingstone.
13. Mahesh VB. The dynamic interaction between steroids and gonadotropins in the mammalian ovulatory cycle. Neurosci Biobehav
Rev. 1985 Summer;9(2):245-60.
14. Leyendecker G, Wardlaw S, Nocke W. Experimental studies on the endocrine regulations during the periovulatory phase of the
human menstrual cycle. The effects of exogenous 17-oestradiol and progesterone on the release of pituitary luteinizing and follicle
stimulating hormones. Acta Endocrinol (Copenh). 1972 Sep;71(1):160-78.
15. Longcope C. Estriol production and metabolism in normal women. J Steroid Biochem. 1984 Apr;20(4B):959-62.
16. Melamed M, Castaño E, Notides AC, Sasson S. Molecular and kinetic basis for the mixed agonist/antagonist activity of estriol. Mol
Endocrinol. 1997 Nov;11(12):1868-78.
17. Putman P, Roelofs K. Effects of single cortisol administrations on human affect reviewed: Coping with stress through adaptive
regulation of automatic cognitive processing. Psychoneuroendocrinology. 2011 May;36(4):439-48.
18. Mayo W, Lemaire V, Malaterre J, Rodriguez JJ, Cayre M, Stewart MG, Kharouby M, Rougon G, Le Moal M, Piazza PV, Abrous DN.
Pregnenolone sulfate enhances neurogenesis and PSA-NCAM in young and aged hippocampus. Neurobiol Aging. 2005 Jan;26(1):10314.
19. Applezweig N. Steroids. Chem Week. 1969 May 17;104:57-72.
20. Yang DJ, Lu TJ, Hwang LS. Isolation and identification of steroidal saponins in Taiwanese yam cultivar (Dioscorea pseudoj aponica
Yamamoto). J Agric Food Chem. 2003 Oct 22;51(22):6438-44.
21. Luconi M, Bonaccorsi L, Maggi M, Pecchioli P, Krausz C, Forti G, Baldi E. Identification and characterization of functional
nongenomic progesterone receptors on human sperm membrane. J Clin Endocrinol Metab. 1998 Mar;83(3):877-85.
22. Jang S, Yi LS. Identification of a 71 kDa protein as a putative non-genomic membrane progesterone receptor in boar spermatozoa.
J Endocrinol. 2005 Feb;184(2):417-25.
23. Rupprecht R, Reul JM, van Steensel B, Spengler D, Söder M, Berning B, Holsboer F, Damm K. Pharmacological and functional
characterization of human mineralocorticoid and glucocorticoid receptor ligands.Eur J Pharmacol. 1993 Oct 15;247(2):145-54.
24. Cox RM, John-Alder HB. Testosterone has opposite effects on male growth in lizards (Sceloporus spp.) with opposite patterns of
sexual size dimorphism. J Exp Biol. 2005 Dec;208(Pt 24):4679-87.
25. Mooradian AD, Morley JE, Korenman SG. Biological actions of androgens. Endocr Rev. 1987 Feb;8(1):1-28.
26. McPhaul MJ, Young M. Complexities of androgen action. J Am Acad Dermatol. 2001 Sep;45(3 Suppl):S87-94.
27. Breiner M, Romalo G, Schweikert HU. Inhibition of androgen receptor binding by natural and synthetic steroids in cultured human
genital skin fibroblasts. Klin Wochenschr. 1986 Aug 15;64(16):732-7.
28. Rousset BA. How iodice reaches its site of utilization in the thyroid gland involvement of solute carrier 26A4 (pendrin) and solute
carrier 5A8 (apical iodice transporter). Eur Endoc Dis. 2007. Issue 1.
29. Jansen J, Friesema EC, Milici C, Visser TJ. Thyroid hormone transporters in health and disease. Thyroid. 2005 Aug;15(8):757-68.
30. Weisenbach TM. Bioidentical hormone therapy for menopausal and perimenopausal patients. Adv Nurse Pract. 2004 Aug;12(8):7780.
7