Apoio COTED-CT
Difusão é o transporte de matéria no estado sólido, induzido
por agitação térmica.
Muitas reações e processos industriais importantes no
tratamento de materiais dependem do transporte de massa
de uma espécie sólida, liquida ou gasosa (a nível
microscópico) em outra fase sólida.
Mecanismo pelo qual a matéria é
transportada através da matéria
Os átomos, em gases, líquidos e sólidos,
estão em movimento constante e migram ao
longo do tempo;
Nos metais e ligas metálicas, a difusão dos
átomos é particularmente importante, já que
a maior parte das reações no estado sólido
envolve movimentos atômicos
Processos importantes de difusão
A galvanização consiste na deposição de Zn sobre
aço, sendo que parte do Zn difunde para o interior do
aço
A têmpera que consiste em evitar a difusão do
carbono para fora da austenita
O revenido que consiste em oportunizar saída parcial
do carbono da martensita temperada, visando reduzir
tensões internas
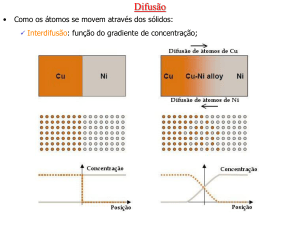
O fenômeno da difusão pode ser demonstrado
mediante o uso de um par de difusão
Barras de dois metais diferentes, com contato íntimo
Par é aquecido por período prolongado e
resfriado até a temperatura ambiente
Metais puros nas extremidades separados por uma
região de liga dos dois metais
Interdifusão ou difusão de impurezas
Existe uma tendência do transporte dos
átomos da região de alta concentração para a
região de baixa concentração
A difusão também ocorre nos metais puros,
porém neste caso todos os átomos que estão
mudando de posição são do mesmo tipo;
Autodifusão
Consiste simplesmente na migração passo a
passo dos átomos de uma posição para outra
na rede cristalina.
Os átomos nos materiais sólidos estão em
constante movimento, mudando
rapidamente de posição.
Representações
esquemáticas das
posições atômicas do
Cu e do Ni no interior
do par de difusão.
Concentrações de
cobre e níquel em
função da posição ao
longo do par.
Representações
esquemáticas das
posições atômicas do
Cu e do Ni no interior
do par de difusão.
Concentrações de
cobre e níquel em
função da posição ao
longo do par.
Um mecanismo envolve a troca de um átomo
de uma posição normal da rede para uma
posição adjacente a vaga ou lacuna na rede
cristalina.
O segundo tipo de difusão envolve átomos
que migram de uma posição intersticial
vizinha que esteja vazia. Esse mecanismo é
encontrado para a interdifusão de impurezas
tais como hidrogênio, carbono, nitrogênio e
oxigênio.
O regime estacionário obedece a
primeira lei de FICK;
A difusão é um processo que depende
do tempo (t);
O objetivo de saber o tempo, é saber a
rapidez que ocorre a difusão – taxa de
transferência;
expressa como fluxo
difusional (j), o qual é definido como
a massa (m) que se difunde em uma
seção transversal de área (A)
unitária do sólido por unidade de
tempo (t).
A
taxa
é
J= m/At > unidade kg/m².s ou átomos/m².s
Nesse regime o fluxo difusional não
varia com o tempo;
Um exemplo clássico é a difusão dos
átomos de um gás através de uma placa
metálica,
na
qual
as
concentrações/pressões de componente
em difusão sobre ambas as superfícies
das placas são mantidas constantes.
Figura 1: Difusão: www.feng.pucrs.br/~schroeder/Ciência%20dos%20Materiais/Difusão.ppt
Quando uma concentração “C” é
representada em função da posição ou da
distância no interior de um sólido (x), a
curva resultante é denominada perfil de
concentração e a inclinação em um ponto
particular sobre essa curva é o gradiente
de concentração.
Gradiente de concentração: dC/dx
Gradiente de concentração: ∆C/ ∆x= (Ca – Cb) /
(Xa- Xb)
Primeira lei de Fick:
Onde D é o coeficiente de difusão expresso m2
/ s. O sinal negativo indica que a direção de
difusão é contrária ao gradiente.
Quando a difusão ocorre, de acordo com a
equação, o gradiente de concentração é a
força motriz.
Difusão em estado não estacionário
A maioria das situações práticas envolvendo difusão, ocorre
em condições de estado não estacionário.
O fluxo de difusão e o gradiente de concentração em um
ponto específico no interior de um sólido, variam ao longo
do tempo.
A figura abaixo mostra o perfil de concentração em 3
momentos diferentes do processo de difusão.
Sob condições de regime não estacionario, usa-se a equação
diferencial parcial, conhecida por segunda lei de Fick:
Se o coeficiente de difusão é independente da
composição e portanto da posição x (o que deve ser
verificado para cada caso específico) ai a equação anterior
fica:
Hipóteses a serem adotadas:
1- Antes do início da difusão os átomos do soluto em difusão
que estejam presentes no material estão uniformemente
distribuídos mantendo uma concentração Co;
2- O valor de x na superfície é zero e aumenta com a
distância para dentro do sólido;
3- O tempo zero é tomado como sendo o instante
imediatamente anterior ao início do processo de difusão.
Essas condições de contorno são representadas pelas
expressões:
As aplicações das condições de contorno acima na
segunda lei de Fick fornece a solução:
Onde Cx fornece a concentração em uma profundidade
x após decorrido um tempo t .
O termo a direita é a função erro de Gauss cujos valores
são dados em tabelas matemáticas. Uma lista parcial
aparece no próximo slide:
A solução para a segunda lei de Fick demonstra a relação que
existe entre a concentração, posição e o tempo, qual seja que
Cx, sendo uma função do parâmetro adimensional
pode ser determinado em qualquer tempo e em qualquer
posição, bastando para tanto que os parâmetros Co, Cs e D
sejam conhecidos.
Suponha que se deseje atingir uma determinada concentração
de soluto C1 em uma liga, o lado esquerdo da equação se
torna então:
Logo o lado direito da equação
também é uma constante
e subsequentemente:
Exemplo 01
Em um processo de cementação em um aço com 0.25 % de carbono a 950ºC
com uma concentração de carbono na superfície externa de 1.2% , qual deve ser o
tempo de cementação para atingir um teor de carbono de 0.8% na posição de 0.5
mm abaixo da superfície? O coeficiente de difusão do carbono no ferro nessa
temperatura é de
Solução: Problema de difusão no estado não estacionário sendo a
composição da superfície mantida constante . As condições de contorno do
problema são as seguintes:
Necessitamos determinar agora o valor de z cuja função erro é
0.4210. Deve-se usar uma interpolação:
Exemplo 02
O coeficiente de difusão do cobre no alumínio a 500ºC e 600ºC são
respectivamente 4,8 X10-14 e de 5.3 X 10-13 m2/s . Determine o tempo
aproximado a 500ºC que produzirá o mesmo resultado de difusão em termos
de concentração de cobre em um ponto específico no alumínio equivalente a
10 h de tratamento térmico a 600ºC
Solução:
Na mesma posição teremos a mesma concentração de cobre logo x é
constante assim:
Uma tecnologia que se aplica a difusão em estado
sólido é a fabricação de circuitos integrados (CI)
semicondutores.
Monocristais de silício são o material básico para a
maioria dos CI. Para que esses dispositivos CI
funcionem satisfatoriamente, concentrações muito
precisas de uma impureza (ou impurezas) devem ser
incorporadas em minúsculas regiões espaciais no
chip de silício, e uma maneira de se fazer isso é por
meio de difusão atômica.
Os dois tratamentos térmicos considerados para a difusão
de impurezas no silício durante a fabricação de circuitos
integrados são a pré-deposição e a redistribuição.
Durante a pré-deposição, os átomos de impureza são
difundidos para o interior do silício, frequentemente a
partir de uma fase gasosa, cuja pressão parcial é mantida
constante.
Na etapa de redistribuição, os átomos de impureza são
transportados mais para o interior do silício, de forma a
gerar uma distribuição de concentrações mais adequada,
porém sem aumentar o teor global de impurezas.
Problema-exemplo 5.6 (Callister, 2012)
Difusão do Boro no Silício
Átomos de boro devem difundir em uma pastilha de
silício usando ambos tratamentos térmicos de prédeposição e de redistribuição; sabe-se que a
concentração de fundo do B nessa pastilha de silício é de
1X1020 átomos/m3.
Problema-exemplo 5.6 (Callister, 2012)
Difusão do Boro no Silício
O tratamento de pré-deposição deve ser conduzido a
900oC durante 30 minutos; a concentração de B na
superfície deve ser mantida em um nível constante de
3X1026 átomos/m3. A difusão de redistribuição será
o
conduzida a 1100 C por um período de 2h. Para o
coeficiente de difusão do B no Si, os valores de Qd e D0
são 3,87 e V/átomo e 1X10-3m2/s, respectivamente.
Lista de símbolos
Símbolo
Significado
A
Área da seção transversal perpendicular à direção da difusão
C
Concentração do componente em difusão
C0
Concentração inicial do componente em difusão antes do início do
processo de difusão
Cs
Concentração superficial do componente em difusão
Cx
Concentração na posição x após um tempo de difusão t
D
Coeficiente de difusão
D0
Constante independente da temperatura
M
Massa do material em difusão
Qd
Energia de ativação para difusão
R
Constante dos gases (8,31 J/mol.K)
t
Tempo decorrido no processo de difusão
x
Coordenada de posição (ou distância) medida a direção da difusão,
normalmente a partir de uma superfície sólida
A magnitude do coeficiente de
difusão é um indicativo da taxa
segundo a qual os átomos se
difundem.
As espécies difusivas, bem como
seu
material
hospedeiro,
influenciam o coeficiente de
difusão.
A temperature tem a influência mais
marcante sobre os coeficientes e
taxas de difusão.
A dependência dos coeficientes de
difusão em relação à temperature
de dá pela equação:
A energia de ativação pode ser
considerada como a energia
necessária
para
produzir
o
movimento difusivo de um mol de
átomos.
Energia de ativação elevada resulta
em um coeficiente de difusão
pequeno.
A
constante pré-exponencial e a
energia de ativação do Fe em
cobalto são dados. Em qual
temperature o coeficiente de
difusão terá o valor de 2.1×10----ˉ¹
m²/s?
D0 = 1,1× 10ˉ⁵m²/s
Qd = 253300 J/mol
RESPOSTA: T = 1518,0 K
Quanto
maior a energia de ativação,
menor é a velocidade do processo e
maior a sensibilidade da velocidade
com a temperatura.
A energia de ativação depende do tipo
de átomo, estrutura e do mecanismo.
Geralmente a energia para uma
difusão por lacuna é maior que a
energia da difusão intersticial.
Os
coeficientes de difusão se
modificam com os caminhos de
difusão disponíveis no material.
Geralmente a difusão ocorre mais
facilmente em regiões estruturais
menos restritivas.
A difusão ocorre mais rapidamente
em materiais policristalinos do que
em monocritais.
A EQUAÇÃO DE ARRHENIUS
A
temperatura tem uma grande influência sobre os
coeficientes e as taxas de difusão (CALLISTER, 2011);
A velocidade da maioria das reações químicas aumenta à
medida que a temperatura também aumenta (CINÉTICA...,
2010);
A
equação de Arrhenius, foi proposta pelo químico sueco
Svante August Arrhenius, onde a qual expressa a
dependência da constante de velocidade (k) com a
temperatura (PERUZZO e CANTO, 2012).
x
Coeficiente
angular
(b) linear
Coeficiente
y(a)
Figura 01- Gráfico de Arrhenius.
GRÁFICO DE ARRHENIUS
D0 conhecido como fator “pré-exponencial”, ele está
relacionado à frequência das colisões, mas também inclui
orientação e outros fatores (RAMOS e MENDES, 2005);
Qd é a energia de ativação. Representa a “barreira” de
energia que deve ser vencida antes que os reagentes se
tornem produtos; e é sempre positivo. Quanto maior o valor
de Qd ,menor a velocidade de uma reação a uma dada
temperatura, e maior será a inclinação da curva (ln k) x (1/T).
Uma energia de ativação alta corresponde a uma velocidade
de reação que é muito sensível á temperatura. O valor de Qd
não muda com a temperatura (RAMOS e MENDES, 2005);
GRÁFICO DE ARRHENIUS
Já
uma pequena energia de ativação indica uma velocidade de
reação que varia apenas ligeiramente com a temperatura (a
curva de Arrhenius tem uma inclinação pequena) (PERUZZO e
CANTO, 2012).
E
uma reação com energia de ativação nula, como para certas
reações de recombinação de radicais em fase gasosa, tem uma
velocidade que é virtualmente independente da temperatura
(PERUZZO e CANTO, 2012).
GRÁFICO DE ARRHENIUS
Qd
Qd
Qd
Figura 02- Gráfico de Arrhenius
– Energia de ativação –
inclinação da reta.
Fonte: CINÉTICA..., 2010.
TABELA DE DADOS DE DIFUSÃO
Fonte: CALLISTER, 2011.
GRÁFICO DO LOGARÍTIMO DO COEFICIENTE DE DIFUSÃO
VERSUS O INVERSO DA TEMPERATURA PARA VÁRIOS METAIS:
Fonte: CALLISTER, 2011
Quando o fluxo de difusão e o gradiente de
concentração em um ponto específico no interior de
um sólido, variam com o tempo.
Segunda lei de Fick.
Se o coeficiente de difusão é independente da
composição e portanto da posição x ai a equação
anterior fica:
FONTE: CALLISTER e RETHWISCH, 2012
Na prática, para um sólido considerado semi-infinito, em que a concentração na
superfície é mantida constante.
Dessa forma as seguintes hipóteses são adotadas:
1- Antes do início da difusão os átomos do soluto em difusão que estejam presentes
no material estão uniformemente distribuídos mantendo uma concentração Co .
2- O valor de x na superfície é zero e aumenta com a distância para dentro do sólido.
3- O tempo zero é tomado como sendo o instante imediatamente anterior ao início
do processo de difusão.
Essas condições de contorno são representadas pelas expressões:
FONTE: CALLISTER e RETHWISCH, 2012.
As aplicações das condições de contorno acima na
segunda lei de Fick fornece a solução:
Onde Cx fornece a concentração em uma
profundidade x após decorrido um tempo t .
O termo a direita é a função erro de Gauss cujos
valores são dados em tabelas matemáticas.
FONTE: CALLISTER e RETHWISCH, 2012.
A função
é a integral normalizada de probabilidade ou função de erro de
Gauss. A função de erro de Gauss é definida como:
Em que
é a variável z. Os valores da função de erro de
Gauss z=erf(y), são tabulados.
FONTE: LMDMWISCH, 2005.
FONTE: CALLISTER e RETHWISCH, 201
Aplicando-se a Equação
é possível avaliar quantitativamente a informação da Figura a
seguir num gráfico padrão único.
FONTE: LMDMWISCH, 2005.
FONTE: LMDMWISCH, 2005.
FONTE: LMDMWISCH, 2005.
FONTE: LMDMWISCH, 2005.
A importância da curva mostrada está na inter-relação
existente entre a distância, o tempo, o coeficiente de difusão e
a concentração, durante a difusão.
FONTE: LMDMWISCH, 2005.
FONTE: LMDMWISCH, 2005.
Para se produzir uma determinada concentração numa certa região de um material,
ou para se conseguir difundir para dentro do material uma certa fração da
quantidade necessária à saturação total, é necessário apenas manter o mesmo valor
de
em que L é uma dimensão que caracteriza o tamanho do objeto.
A Figura apresenta um exemplo de aço cementado. Uma barra de aço com 0,24%p
de carbono inicial foi aquecida a 870°C na presença de carbono em excesso.
FONTE: LMDMWISCH, 2005.
Solução:
Difusão no estado não estacionário
sendo a composição da superfície
mantida constante . As condições de
contorno são:
Determinar o valor de z cuja função erro
é 0.4210. Interpolando:
Então
FONTE: CALLISTER e RETHWISCH, 2012.
REFERÊCIAS
CALLISTER, William, D. Ciência e Engenharia de Materiais – Uma
introdução. 7ª ed. Rio de Janeiro: LTC, 2011.
CINÉTICA Química equação de Arrhenius. Material didático. 2010.
Disponível em:
<http://www.quimica.ufpb.br/monitoria/Disciplinas/Cinetica_quimica/material
/Cinetica_Quimica_Aula_4.pdf>. Acesso em abril de 2014.
PERUZZO, Francisco, M.; CANTO, Eduardo, L. Química na abordagem
do cotidiano. 4ª ed. São Paulo: Moderna, 2012.
RAMOS, Bruno; MENDES, Wendel, T. Parâmetros de Arrhenius: Efeito
da Temperatura na Velocidade de uma Reação. Trabalho acadêmico.
Anápolis, 2005. Disponível
em:<http://www.geocities.ws/ramos.bruno/academic/arrhenius.pdf>.
Acesso em: abril de 2014.
http://www.dem.uem.br/cleber/wpcontent/uploads/2010/03/Capitulo-5.pdf
http://www.foz.unioeste.br/~lamat/downmateriais/materiais
cap8.pdf
LMDM - Laboratório de Material Didático. Ciência dos
materiais – Multimídia. Centro Tecnológico de Minas
Gerais (CETEC). 2005. Disponível em:
<http://www.cienciadosmateriais.org/index.php?acao
=exibir&ca p=19&top=299>. Acesso em 03 de abril de 2014.