Biologia Celular
2006/2007
Ana Catarina Carreira Santos
Membranas Biológicas
Estruturas termodinamicamente estáveis cuja manutenção não requer hidrólise de
ATP que tem uma bicamada fosfolipídica anfipática.
Funções
Separação do conteúdo celular do espaço extracelular (exoplasmático), uma
vez que a parte hidrofóbica do interior da membrana impede a passagem de
água.
Função de invólucro, do núcleo e dos restantes organelos intracelulares.
Organização da topografia interna, separando a célula em dois
compartimentos:
Nuclear
Citoplasmático
Subdivisão do citoplasma em:
Matriz citoplasmática (citosol) – espaço contínuo, compreendido entre a
membrana plasmática e as membranas do núcleo e organelos.
Espaço descontínuo – constituído pelo somatório dos espaços contidos nos
organelos ou vesículas limitadas por membrana.
Definição do limite da célula (única funcionalidade em células procarióticas).
Estrutura Geral (apesar de variarem muito conasoante a sua função
obedecem a linhas gerais)
Bicamada de fosfolípidos de natureza anfipática (impermeáveis à água)
A maioria das funções biológicas são mediadas por proteínas da membrana:
Na membrana exterior da célula (membrana exoplasmática) as proteínas são
receptores moleculares que transmitem informação, formam junções
intercelulares, catalisam reacções químicas e ligam-se a componentes do
citoesqueleto.
Características:
Plasticidade: movimento bidimensional quando há alteração do equilíbrio
Movimentos flip-flop: Colesterol e fosfolípidos (requer ATP e enzimas)
Fluidez: movimento lateral dos fosfolípidos e proteínas ao longo dos dois
folhetos da embrana;
Assimetria: Diferente composição molecular nas duas metaes da membrana.
Abordagem histórica
Franklin: experiências com óleo. Impermeabilidade dos lípidos.
Charles Overton: a capacidade de atravessar membranas dependia da sua
natureza química. As substâncias
apolares passam rapidamente a
membrana.
Semelhanças
entre
membranas e lípidos; há lípidos que se
dissolvem nos lípidos da membrana,
atravessando-a.
Irving Langmuir: Interacção lípidoságua. Descobriu a forma de calcular
áreas de superfícies cobertas por óleo.
Estudou monocamadas de ácidos
Membranas Biológicas
-1-
Biologia Celular
2006/2007
Ana Catarina Carreira Santos
gordos.
Gorter e Grendel: extraíram os lípidos de eritrócitos e concluiu que ocupam o
dobro da área da superfície de onde foram extraídos. Concluíram a existência de
uma bicamada.
Danielli e Davson: As proteínas podiam ser adsorvidas pelo óleo. Propuseram
um modelo em que ambas as camadas estavam cobertas por proteínas.
(Recorreram ao raio-X e MET).
Robertson: Com base na ME propôs o modelo da unidade de membrana, em
que a membrana tem três camadas: duas externas (proteicas) e uma interna
(lipídica).
Singer e Nicholson: Modelo do Mosaico Fluido – bicamada lipídica com
proteínas globulares que flutuam nela.
A porção da porteína em contacto com a membrana é hidrofóbica e tem uma
estrutura tridimensional de alfa-hélice.
Os lípidos da membrana
Fosfolípidos
Extremidade polar ou hidrofílica (cabeça; mais electrodensa) e
extremidade apolar ou hidrofóbica (com duas caudas de ácidos gordos;
mais electrolucente).
Organizam-se espontaneamente em micelas, mesossomas ou bicamadas.
Há quatro tipos de fosfolípidos mais relevantes em termos quantitativos:
Fosfatidilcolina
Fosfaditiletenoamina
neutros
a pH fisiológico
Esfingomiela
Fosfatidilserina
carregada negativamente
O inositol é um fosfolípido que existe em baixas concentrações mas é muito
importante na transmissão de sinais para o interior da célula.
Constituição bioquímica: ácidos gordos, glicerol, grupo fosfato e colina ou
serina.
O arranjo da cauda dos fosfolípidos deriva do grau de saturação dos ácidos
gordos
o Condiciona o movimento de lateralidade e a fluidez
o Altera a temperatura da transição da fase líquida para a fase cristalina
da membrana.
o Ex.: fosfolípidos saturados têm difusão lateral menos rápida e
atingem a transição de fase a temperaturas menos baixas.
Na ME há um perfil trilaminar (“unidade de membrana” de Robertson)
que são duas camadas electrodensas separadas por uma camada
electrolucente.
Há movimentos laterais, de rotação e de flip-flop.
Nota:
Podemos classificar os lípidos em duas categorias:
Saturados – contêm apenas ligações simples, apresentam difusão lateral mais lenta,
atingindo transição de fase (gelificação por diminuição da temperatura) a
temperaturas mais baixas que os insaturados.
Membranas Biológicas
-2-
Biologia Celular
2006/2007
Ana Catarina Carreira Santos
Insaturados – apresentam geometria menos linear na cauda e, por isso mesmo, têm
menos interacções com as caudas dos fosfolípidos adjacentes, logo, atingem a
transição de fase a temperaturas mais altas.
Colesterol
Não existe em procariontes;
2ª molécula lipídica mais abundante depois dos fosfolípidos;
É essencial para que não haja ruptura da bicamada;
Maior facilidade de movimentos de flip-flop (saltar entre os dois
folhetos da membrana) que os fosfolípidos;
Reforçam a impermeabilidade da membrana, diminuem a sua fluidez e
aumentam a temperatura da transição de fases
Glicolípidos
Só existem no folheto exoplasmático da membrana exterior das
células eucarióticas devido ao facto dos resíduos sacarídeos serem
adicionados ás moléculas lipídicas no lúmen do Complexo de golgi
(complexo exoplasmático).
Não têm movimento de flip-flop.
Nas células epiteliais estão na membrana apical (limitados pelas zonas
de oclusão)
Podem actuar como receptores específicos de moléculas exteriores;
Podem ligar-se a componentes da matriz extracelular.
Proteínas de membrana
A massa de uma proteína de membrana de tamanho médio é 40 a 60 vezes superior à
massa de um fosfolípido.
Contribuem para cerca de metade da massa total na maioria das membranas. Boa
parte dela são glicoproteínas.
Estão sujeitas a movimentos laterais mas não a movimentos de flip-flop.
Funções:
Troca metabólica de células solúveis em água entre a célula e o espaço extracelular,
através da formação de canais transmembranares resultantes da associação dinâmica
de proteínas;
Receptores moleculares;
Formação de junções intercelulares;
Catalisadores de reacções químicas;
Ancoragem da membrana a elementos do citoesqueleto.
Existem dois tipos de proteínas membranares:
Proteínas integrais (intrínsecas) – atravessam o plano hidrofóbico da membrana e
são observadas nas faces de criofractura, ou seja, contêm segmentos hidrofóbicos.
Quando atravessam toda a extensão da membrana são chamadas transmembranares.
Para se isolar estas proteínas, é necessário tratar preparações de membrana com
detergente – SDS.
Proteínas periféricas (extrínsecas) – não atravessam o plano hidrofóbico da
membrana e são observadas nas superfícies das membranas, intactas.
Membranas Biológicas
-3-
Biologia Celular
2006/2007
Ana Catarina Carreira Santos
Para se isolar estas proteínas, basta tratar as preparações de membrana com soluções
de salinidade elevada.
A membrana celular pode apresentar domínios (áreas restritas) onde se concentram
proteínas específicas, não detectáveis noutras zonas da membrana.
Nestas células, a membrana é constituída por uma sucessão contínua de mosaicos
fluidos diferentes, cada um com um coeficiente particular de difusão lateral das suas
moléculas. As moléculas, movendo-se lateralmente nessa área, não podem, contudo,
percorrer outras zonas da superfície celular.
Ex: espermatozóide, em que regiões da membrana celular e acrossomal acumulam
proteínas em determinadas áreas da membrana.
Membranas Biológicas
-4-
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
Especializações da membrana celular
Especializações da Membrana
Químicas (proteínas membranares)
Morfologicamente evidentes
Da membrana apical
Da membrana Basal
Da membrana Lateral
Microvilosidades, cílios, Flagelos, estereocílios
Hemidesmossomas, invaginações
Junções impermeáveis, junções comunicantes, interdigitações, desmossomas.
Aumentam a superfície celular:
Microvilosidades
Cílios
Flagelos
Estereocílios
Interdigitações
Promovem a junção intercelular:
Junções impermeáveis
Junções de aderência
Junções comunicantes
Nota:
- As especializações diferem na estrutura das proteínas integradas na membrana.
- Exemplo: Enterócitos (células do epitélio intestinal) - Têm porções da membrana
muito especializadas: a porção que reveste as microvilosidades tem proteínas
transportadoras (permitem a passagem de glicose e aminoácidos…); a membrana da
parte basolateral tem proteínas que deixam passar para fora das células os nutrientes
absorvidos na parte apical.
Estruturas que aumentam a superfície celular
Microvilosidades
Extensões citoplasmáticas digitiformes abundantes em
células epiteliais
Revestidas por membrana plasmática especializada que
contém exteriormente enzimas digestivas e glucídeos que
formam uma rede glicomucoproteica fina ligada à membrana
das microvilosidades – glicocálice.
O interior das microvilosidades tem microfilamentos de
actina paralelos, com a extremidade positiva para cima. O
feixe de microfilamentos é mantido por pontes de proteínas
de baixo peso molecular (fimbrina, fascina e vilina).
Os microfilamentos ligam-se aos fosfolípidos através da
miosina I, que confere contractilidade às microvilosidades.
Especializações da Membrana Celular
-5-
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
O feixe de microfilamentos adere ao topo através de uma placa densa rica em
actinina, ancorando no citoesqueleto, mantendo-se a forma das
microvilosidades.
Células epiteliais: Os microfilamentos ancoram-se na rede terminal
(microfilamentos oriundos do desmossoma circular) através das proteínas
espectrina e miosina II (o que lhes confere mobilidade e contractilidade).
Células sem desmossomas circulares: Os microfilamentos penetram mais
profundamente, nos filamentos intermédios e na rede tridimensional de
microfilamentos do citoesqueleto geral.
Nascimento dos microfilamentos: polimerizações de
monómeros de actina G a partir do pólo positivo,
crescendo para o interior da região cortical
citoplasmática até ancorarem na região terminal. A
subsequente polimerização leva à evaginação da
membrana, formando-se projecções digitiformes.
Nota:
- Células com locomoção têm outras projecções celulares. O seu citoesqueleto tem
microfilamentos.
Embrionariamente todas as células têm mobilidade; no animal adulto quase só os
leucócitos têm_ diapedese.
- Em patologia: A metastização neoplásica maligna depende deste tipo de locomoção,
pois a célula forma feixes contrácteis de microfilamentos associados à α-actinina e
miosina II (fibras de stress). Estes feixes ancoram em placas de actinina
submembranares densas que os ligam a proteínas transmembranares (integrinas).
(Estas são receptoras de moléculas de outras células (epiteliais) e da matriz celular do
tecido conjuntivo.) As fibras de stress estabelecem com estas adesões focais
transitórias, fixando as células. O pólo celular anterior das células forma lamelas
(lamelipodia) após o avanço de expansões tubulares (filipodia) que podem apresentar
expansões mais pequenas (microspikes). Os filipodia têm feixes paralelos de
microfilamentos unidos pela proteína fimbrina.
- Os microfilamentos submembranares estão unidos entre si e às proteínas integrais da
membrana pela espectrina.
- Os lamelipodia são típicos de células epiteliais, dos fibroblastos e de alguns neurónios.
Podem apresentar pregas (ruffles).
- Os leucócitos têm pseudópodes, que são semelhantes aos lameliploidia, mas têm
forma tubular larga e citoesqueleto menos complexo.
Cílios e flagelos
Cílios
Projecções citoplasmáticas móveis
Movimento em chicote
No seu interior têm citoesqueleto embebido por uma matriz proteica e
rodeado por uma diferenciação da membrana.
Facilitam a locomoção, deslocam fluidos (ex.: traqueia) ou células nas
superfícies epiteliais (ex.: trompas de Falópio).
Flagelos
Especializações da Membrana Celular
-6-
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
Semelhantes aos cílios (na estrutura)
São mais longos e em menor número
Movimento sinusoidal
Nota:
Nota
- Nas bactérias os movimentos são diferentes em relação a eucariontes. O flagelo tem
anéis e um eixo aderentes à membrana, fazendo rodar um filamento de flegelina
(proteína).
- O batimento ciliar nos protozoários é diferente do movimento dos epitélios citados
porque a presença de microvilosidades impede o dobrar da base ciliar.
- Quanto à organização dos cílios e flagelos podemos distinguir algumas estruturas:
- Axonema
Organização ultraestrutural do citoesqueleto do cílio ou flagelo
São microtúbulos (filamentos proteicos ocos) e proteínas.
Microtúbulos:
Microtúbulos Dispõem-se num círculo de 9 dupletos que rodeiam 2
microtúbulos centrais simples (padrão 9d + 2s). Os centrais são
independentes um do outro. Nos microtúbulos periféricos, o mais externo
(B) compartilha parte da parede do ais interno (A). Os dupletos são
numerados no sentido horário, a partir daquele que é perpendicular ao eixo
do par central (n.º 1).
Proteínas associadas aos microtúbulos
• Braços de dineína: Projectam-se interna e externamente, ligando o
microtúbulo A ao dupleto seguinte. São constituídos por cadeias
proteicas . Nas cadeias pesadas existe actividade ATPásica_ quando a
ATP se liga, o braço desliga-se do microtúbulo seguinte, voltando a
ligar-se quando há hidrólise do ATP. Assim há um movimento
descendente que é assíncrono (ora numa metade dos microtúbulos, ora
noutra). Dos braços de dineína depende a motilidade ciliar, pois
permitem o deslizamento dos microtúbulos uns sobre os outros.
• Pontes de nexina: Ligam o microtúbulo A de um par ao B do par
seguinte, sendo formadas por proteínas elásticas. Têm a função de
manter intacta a circunferência dos dupletos (pois restrigem os
movimentos dos microtúbulos). Ajudam a converter o movimento de
deslizamento em movimento de dobra.
• Projecções radiais: Projectam-se do microtúbulo A para o par de
microtúbulos centrais. (As suas extremidades centrais são globulares,
tendo o nome de cabeças de projecção radial).
• Bainha interna: Rodeia os microtúbulos centrais. (São 2 braços de
direcção oposta que se projectam a partir de cada microtúbulo central). A
bainha interna em conjunto com as projecções radiais coordena o
deslizamento dos microtúbulos e colaboram na transformação desse
movimento em dobras ciliares.
• Ponte central: Interliga os microtúbulos centrais.
• Filamentos radiais periféricos: Unem os dupletos à membrana ciliar.
• Outras:
♦ Tectinas (A, B e C): Regulam a polimerização dos protofilamentos
Especializações da Membrana Celular
-7-
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
♦ Calmadulina: Proteína livre fixadora de ião cálcio. Quando o cálcio
se liga ela liga-se às cabeças das projecções radiais e à bainha
interna, regulando a motilidade ciliar;
♦ Miosina: Está em torno do pé basal. Tem actividade ATPásica e
provoca a contracção dos microfilamentos com que interage;
♦ Espectrina. Também interage com microfilamentos, particularmente
na sua junção com a membrana. Está em torno dos corpúsculos
basais e da membrana lateral, excepto na região das junções
intercelulares.
♦ Tubulinas livres: Matriz que rodeia o axonema e na membrana
ciliar, conferindo-lhe rigidez. São uma reserva (de tubulinas) útil na
polimerização
de
microtúbulos
do axonema.
♦ Actina
G
livre: Está na
face
externa
dos
microtúbulos
periféricos da
região
proximal
do
axonema.
Aparelho de ancoragem do axonema
Os microtúbulos inserem-se a nível citoplasmático no corpo basal ou
cinetossoma (cilindro oco cuja parede é constituída por tripletos de
microtúbulos (A, B e C). Aos tripletos associam-se outras proteínas que
constituem a matriz do corpo basal e que asseguram a sua fixação ao
citoesqueleto e a sua motilidade. O corpo basal tem actividade enzimática
(fosforilase de nucleósidos purínicos e ATPase Ca++-Mg++) que se
envolvem com a transdução de sinais que regulam a motilidade ciliar.
• Origem dos corpos basais
♦ Metazoários: Na mitose, os centríolos originam complexos
fibrogranulares que levam à formação de cinetossomas que, por sua
vez, interagem com o citoesqueleto e migram para a membrana
apical, ligando-se a ela. Esta ligação induz a síntese do axonema e a
formação do cílio por evaginação da membrana citoplasmática. Os
corpos basais sofrem uma rotação para ficarem orientados na mesma
direcção. Nas células ciliadas maduras os centríolos desaparecem
depois da mitose.
♦ Protozoários: A divisão celular não implica perda de cílios. Os
corpos basais mantêm a posição e originam outros corpos basais e
outros cílios, cujo posicionamento depende da posição do
cinetossoma original. A divisão e ancoragem dos cinetossomas são
antes da divisão. Nos espermatozóides os centríolos, ancorados à
membrana celular, transformam-se em cinetossomas.
Formação dos microtúbulos do axonema
Especializações da Membrana Celular
-8-
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
Os microtúbulos A e B do corpo basal originam os A e B do axonema
Os microtúbulos centrais do axonema têm origem no axossoma ou placa
basal, estrutura densa do eixo ciliar, no colo do cílio. O colo do cílio
(padrão 9d + 0s) não tem braços de dineína e tem filamentos radiais
periféricos. Os seus microtúbulos são menos estáveis e sofrem
facilmente fractura (desciliação) devido a agressões mecânicas,
infecções, agentes tóxicos ou flutuações hormonais.
O corpo basal fixa o axonema ao citoesqueleto e à membrana celular
através de apêndices:
• Fibras de ancoragem: são 9 e unem o cinetossoma à membrana
citoplasmática. Têm actividade ATPásica Ca++. Recebem conexões dos
microfilamentos corticais.
• Pé basal: estrutura cónica de onde emergem radialmente microtúbulos
que se afundam no citoplasma ou paralelamente à superfície celular,
interligando as junções intercelulares apicais. Nele também se inserem
microfilamentos citoplasmáticos ou de microvilosidades.
• Raiz estriada: Estrutura cónica alongada que emerge da base do corpo
basal e se posiciona na direcção oposta à do pé basal. Tem muitas
proteínas (ex.: fosfoproteína, que fixa o ião cálcio e enzima ATPase que
mantém o cílio estirado e fixo ao citoesqueleto). As raízes estriadas
ancoram o corpo basal ao citoesqueleto interagindo com microfilamentos
de microvilosidades (porção superior) e filamentos intermediários do
córtex celular (extremidade proximal).
Em relação ao citoesqueleto
Está
ligado
aos
cílios
intimamente:
• Ajuda a determinar a posição
dos cinetossomas
• Ancora os cílios
• Aumenta a resistência da
célula face ao desgaste
mecânico
• Coordena o batimento ciliar
(entre cílios da mesma célula
e de células contíguas)
• Colabora na regulação do
batimento ciliar face a vários
estímulos
•
•
Nota:
Nota
- A ancoragem do axonema nos
espermatozóides é diferente da dos cílios.
- O axonema, além de proteínas reguladoras
da motilidade, tem proteínas alvo para sinais citoplasáticos, que se geram em resposta a
estímulos que actuam sobre as células ciliadas.
- A motilidade das células ciliadas também é regulada por factores neurohumorais,
humidade, temperatura, osmolaridade, pH e hormonas.
Especializações da Membrana Celular
-9-
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
Patologias relacionados com cílios e/ou flagelos:
flagelos (devido a
variações no axonema que causam imotilidade)
Bronquite crónica e infecções respiratórias: as secreções brônquicas não são
removidas devido à ausência de batimento ciliar
Esterilidade masculina: ausência de braços de dineína nos espermatozóides que
causa imotilidade do flagelo.
Estereocílios
Microvilosidades modificadas na dimensão e forma com um citoesqueleto
constituído por feixes de microfilamentos
Expansões citoplasmáticas de grandes dimensões (semelhante à dos cílios)
Ramificados e/ou anastomosados
Estereocílios dos canais excretores genitais masculinos (epidídimo ou canal
deferente)
São mais longos e mais largos do que as microvilosidades, sendo o seu feixo
de microfilamentos maior do que nas microvilosidades
São ramificados e anastomosados
A proteína que une os microfilamentos é a fimbrina; a vinculina fixa-os
lateralmente à membrana;
Crescimento dos microfilamentos: dá-se no centro polimerizador dos
microfilamentos (+) que adere à face interna da membrana. A adição dos
monómeros de actina G origina actina F.
Devido ao grande comprimento, ramificações e anastomoses os estereocílios
formam uma rede tridimensional porosa acima do ápice celular epitelial
que durante a ejaculação impede a oclusão do lúmen e contribui para que o
sémen progrida para o exterior, ajudando também a remover
espermatozóides degenerados, retendo-os na superfície epitelial.
Estereocílios do ouvido interno
Estão
nas
células
sensoriais externas e
internas do órgão de
Corti (células com pêlos
ou células cabeludas)
que apresentam tufos de
estereocílios
(mais
compridos e mais largos
que os anteriores).
Não são ramificados nem
anastomosados.
Existe estrangulamento
do colo;
Os
microfilamentos
terminam
na porção
basolateral da membrana
celular.
Interdigitações
Reentrâncias de prolongamentos citoplasmáticos de células adjacentes
Mobilidade em função da plasticidade das células, modificando a forma e a
profundidade da penetração.
Aumenta a superfície de contacto das células que as possuem;
Especializações da Membrana Celular
- 10 -
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
Existem geralmente em células de epitélios de revestimento.
Estruturas que promovem a junção intercelular
(Quando a células se agregam e funcionam integradamente)
Os Complexos de junção:
- ocorrem na porção superior da célula
- função: estabelecer maior coesão entre as células, para que não
haja espaços vazios que formem canais, nos quais haja trocas que
só se querem nos locais próprios das glândulas salivares por
exemplo); aumentar as áreas de troca entre a célula e o tecido
conjuntivo
- perto destas há sempre muitas mitocôndrias (ATP para o
transporte activo).
Junções impermeáveis
Junções ocludentes
Porção apical lateral das células epiteliais de
revestimento (ex.: enterócitos, células dos tubos renais
e epitélios dos canais genitais excretores)
Bandas finas que rodeiam completamente as células e
contactam com estruturas idênticas de células
adjacentes
Rede de pregas de partículas
intermembranares
(proteínas
integrais).
(ocludina,
cingulina,
claudina)
O espaço intercelular é nulo e
impermeável
Nota:
Nota
- Nos invertebrados chamam-se junções septadas
(são similares mas são atravessadas por
proteínas transmembranares).
Junções de aderência
Desmossomas circulares ou junções
intermediárias:
Estão
abaixo
das
junções
ocludentes nos tecidos epiteliais;
Rodeiam completamente as células
(espécie de cinto)
As
glicoproteínas
transmembranares que intervêm na
adesão são da família das caderinas
(dependentes do Ca++)
Especializações da Membrana Celular
- 11 -
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
A membrana celular é mais espessa a este nível
Feixes de microfilamentos de actina, introcitoplasmáticos, estão paralelos à
membrana à qual se ligam por proteínas (ex.: vinculina)
As caderinas interpenetram-se nas membranas, ligando-se a células
adjacentes a proteínas da família das cateninas (as cateninas α ligam-se a
filamentos de actina e as β ligam-se às extremidades das acterinas).
Desmossomas focais (ou só desmossomas):
Em
células
epiteliais
vizinhas
Constituído por 2 placas
densas constituídas por
desmoplaquinas I, II e III,
placoglobina e placofilina.
Algumas destas proteínas
associam-se a uma rede de
filamentos intermediários
intracitoplasmáticos
de
queratina.
Na placa desmossómica pode haver ligação de glicoproteínas
transmembranares (caderinas).
Patologia: No pênfigo (doença da pele e mucosas) há disrupção dos
desmossomas das células epiteliais devido a anticorpos contra glicoproteínas
da ligação, originando bolhas.
Hemidesmossomas:
Morfologicamente semelhantes a desmossomas mas química e
funcionalmente diferentes
Ligam a superfície basal das células epiteliais à lâmina basal subjacente
Os filamentos intermédios de queratina terminam na placa densa do
hemidesmossoma (no citoplasma)
Contém polipéptidos: plectina, desmoplaquinas e integrinas (estas últimas
ligam-se às plectinas e placa hemidesmossómica, atravessando a membrana
celular e projectando-se para a lâmina basal).
Junções comunicantes
Junções de hiato (gap junstions ou nexus)
Zonas onde as membranas estão separadas por um
interstício que permite a passagem de marcadores que se
distribuem à volta de estruturas semelhantes a hexágonos
As junções de cada membrana são constituídas pró
moléculas proteicas transmembranares que formam
conexões (cada um com 6 proteínas idênticas entre si conexinas)
Os conexinas de duas células vizinhas formam um canal que as conecta.
Aglomerado de partículas intramembranares associadas com a face
citoplasmática de fractura da membrana celular;
Permitem a comunicação e passagem de pequenas moléculas e iões;
Abrem ou fecham consoante modificações celulares (ex.: concentração de
Ca++ ou pH)
São importantes para: contracção cardíaca, movimentos peristálticos do
intestino, embriogénese, diferenciação das células germinais.
Especializações da Membrana Celular
- 12 -
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
Pontes intercelulares
Na espermatogénese existe uma expansão
clonal em que as células derivadas de uma
espermatogónia se mantêm unidas por
pontes intercelulares (PIC) até á libertação
dos espermatozóides (que resultam de
uma citocinese incompleta – a membrana
das PIC está reforçada por um anel denso
e contráctil);
São parcialmente fechadas por cisternas
do retículo endoplasmático liso (REL)
denominado Complexo de participação
ads pontes intercelulares ou fusoma.
O fusoma:
oclui as PIC durante as divisões
celulares e orienta o fuso acromático;
Permite a passagem de organelos;
É rico em actina-F e α-espectrina.
As PIC permitem:
Sincronizar o ciclo celular (todas as células do memso clone estão na mesma
fase)
Partilhar produtos dos genes.
Invaginações: auentam as áreas de troca entre a célula e o tecido conjuntivo. Há
sempre mitocôndrias por perto (ATP para transporte activo). Existem nos rins e nos
canais estriados das glândulas salivares.
Especializações da Membrana Celular
- 13 -
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
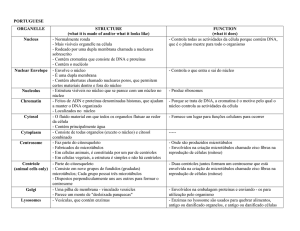
Organização funcional do núcleo celular
É um organelo onde se situa a maior parte do genoma, limitado pelo invólucro nuclear,
uma membrana dupla.
Invólucro nuclear: isola componentes citoplasmaticos de componenets nucleares,
conferindo individualidade ao núcleo. Tem as seguintes funções:
Isolar espacial e temporalmente fenómenos de expressão genética (ex.:
transcrição e tradução)
Criar e manter um ambiente molecular propício a activiodades nucleares (meio
ácido)
Confere impermeabilidade ao núcleo
Está envolvido no transporte núcleo-citoplasmático através dos poros nucleares
Organização espacial da cromatina
Replicação do DNA
O invólucro nuclear sofre trasnformações- aumenta durante a interfase (fase S) para se
adaptar ao voilume crescente de DNA e desorganiza-se na fase M (mitose),
reorganizando-se depois. Compreende três elementos estuturais:
Membranas nucleares:
uma membrana extrena (em continuidade com o retículo endoplasmático e
semelhante a este)
e outra interna (voltada para o nucleoplasma, com proteínas integrais
específicas; associa-se à lâmina nuclear)
delimitam a cisterna nuclear. Estão em continuidade onde existem poros
nucleares.
Lâmina nuclear:
Camada contínua e densa aos electrões apenas interrompidas onde há poros
nucleares.
É umaintreface estrutural e funcional entre a membrana nuclear intrena e a
cromatina
Promove, com a membrana do poror, a ancoragem do poro nuclear ao
invólucro
Em conjunto com a membrana nuclear interna e o poro nuclear promove a
associação da cromatina ao invólucro.
Devido à grande homologia com filamnetos do citoesqueleto (organização
reticular), pode ser considerada uma subclasse destes filamentos.
Poro nuclear:
Permite a passagem de matabolitos diverosos, proteínas e complexos
ribonucleoproteicos (ex.: subunidades ribossomais)
Estrutura:
• 2 anéis co-axiais, um voltado para o citoplasma e outro para o
nucleoplasma, ligados um ao outro e `s membrana do poro (ou terceira
membrana nuclear) por subestruturas que cnferem uma simetria
octogonal.
• Porção central: grânulo central (denso aos electrões)
• Filamnetos quês e projectam do anel citopalsmático para o citoplasma e
do anel nucleoplasmático para um anel intranuclear de menor diâmentro,
formando uma forma de cesto.
Especializações da Membrana Celular
- 14 -
Biologia Celular
Ana Catarina Carreira Santos
Turma 2
Funcionamento:
• A demasiadamente elevada concentração de proteínas a nível nuclear
explica-se de duas formas: trasnpsorte activo mediado por receptores
específicos para sinais presentes em proteínas catriofílicas ou difusão
livre e retenção das proteínas cariofílicas pró ligação a receptores
específicos insolúveis. O transporte activo de proteínas para o núcleo é
efectuado pelo grânulo central em duas etapas:
♦ Associação ao poror nuclear (fibrilas ciroplasmáticas)
♦ Translocação através do poro com gasto de energia.
• Conhecem-se NLS (sinais de localização nuclear) que enviam proteínas
cariofílicas para receptores de NLS (importinas) . A exportação de RNA
depende de sinais de exportação de proteínas associadas (exportinas).
Organização intranuclear da expressão genética
O DNA tem graus de compactação variáveis e há regiões do núcleos ricas em
RNP mas sem (ou com pouco) DNA (estruturas intrecromatínicas).
A cromatina pode ser:
Heterocromatina: na periferia do núcleo njunto ao invólucro nuclear; na
periferia do nucléolo; massas dispersas no citoplasma (raramente)
Eucromatina: ocupa a restante porção do nucleoplasma, em conjunto com
estrutiuras intercromatínicas sem DNA detectável e com elevada
concentração de RNP.
As estruturas intrecromatínicas (ricas em RNP) podem ser:
Agregados de grânulos intrecromatínicos (AGI)
• Domínios de forma irregular interligados numa malha desde a periferia
do núcleo à periferia do nucléolo
• Contêm muitas partículas densas aos electrões (grânulos
intrecromatínicos)
• Associam-se à cromatina formando as fibrilas pericromatínicas (FP)
• Faz concentração em certos domínios nucleares de componentes da
maquinaria de splicing
• É um reservatório de spliceossomas maduros
• Nos AGI e na heterocromatina a actividade trasncricional é escassa. Esta
actividade está a cargo de 3 polimerases_ RNA polimerase I, II e III_ que
dão orgem a pré-mRNA que será processado em mRNA pronto a ser
traduzido no citoplasma.
♦ Adição de um cap de 7-metil-guanosiana à extremidade 5’
♦ Splicing: remoção dos intrões (zonas não codificáveis) e religação
dos exões feita pelo spliceossoma, com a participação de factores de
splicing ribinucleoproteicos (UsnRNP) e proteicos (factores SR que
actuam precocemente no splicing promovendo o reconhecimento dos
locais de splicing e a organização do spliceossoma; têm papel
regulador porque participam no splicing alternativo_ remoção de
diferentes intrõesb no emsmo mRNA, formando-se proteínas
diferenets a partir de um segmneto igual).
♦ Poliadenilação da extremidade 3’.
Especializações da Membrana Celular
- 15 -
Biologia Celular
A actividade trasncricional recruta componentes da maquinaria de
splicing. A RNA polimerase II desempenha um papel importante nesse
aspecto. Certos genes estão próximos de AGI.
Corpos espiralados
• Próximos do nucléolo
• Novelo de fibras entrelaçadas, arredondados, compostos por fibrilas e
grânulos
• Acumulam componentes da maquinaria de processamento de RNA
• Estão envolvidos no ciclo do spliceossoma. Depois do splicing a
desorganização de comkplexos pós-splicing e reformação de snRNP
protnos para um novo ciclo de processamento podem estra relacionados
com este organelo.
•
Ana Catarina Carreira Santos
Turma 2
Especializações da Membrana Celular
- 16 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Transporte transmembranar
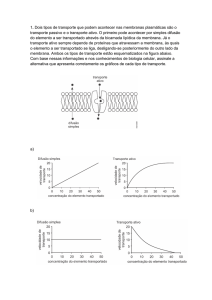
As moléculas lipossolúveis atravessam as membranas biológicas
dissolvendo-se em lípidos (partilha-difusão).
As moléculas insolúveis em lípidos atravessam as membranas ligadas a
moléculas
que
as
envolvem
numa
atmosfera
lipossolúvel
(translocadores/transportadores ou carriers), através de canais proteicos
transmembranares hidrofílicos (canais) ou por intermédio de complexos
moleculares que ligam a sua translocação transmembranar a uma fonte de
energia livre (bombas). É o chamado transporte mediado ou facilitado e é
específico, sensível a temperatura, apresenta saturação, competição,
inibição, activação, inactivação e acoplamento de fluxos (movimento de dois
iões no mesmo sentido ou em sentido contrário através da membrana e
recorrendo ao mesmo translocador). Grande parte dos complexos que
medeiam o transporte são controlados por agentes físicos, químicos
externos (sobre uma proteína transmembranar, a transducina).
A via Lipídica
A passagem de moléculas hidrofóbicas para o interior da camada bilipídica dáse de acordo com o Modelo Partilha-Difusão:
Passagem (partilha) do meio para o núcleo lipídico da membrana
Difusão no interior da membrana
Passagem (partilha) para o meio do lado oposto.
As moléculas que atravessam por difusão a membrana são pequenas moléculas
não polares (oxigénio, azoto), solventes orgânicos (álcool), substâncias
lipossolúveis (esteróides) e pequenas moléculas polares não carregadas (água).
A via lipídica é praticamente impermeável a iões fundamentais (Na+, K+, Cl-,
Ca++, bases conjugadas de aminoácidos e bases orgânicas), pelo que não
assegura as vias metabólicas.
Os iões pequenos atravessam lentamente as membranas (membranas
praticamente impermeáveis a iões e permeáveis a água), não sendo possível
manter as diferenças de concentração dos dois lados da membrana,
assumindo-se que ambos os meios são isotónicos.
Canais, transportadores e bombas
Caracterização de proteínas membranares
O transporte facilitado faz-se através de estruturas especializadas da membrana
(translocadores) que podem ser transportadores ou canais hidrofílicos. Estes
translocadores são proteínas (têm capacidade de difusão lateral na membrana
menor que os lípidos, sendo ainda reduzida nalguns casos devido à ancoragem
a elementos celulares) com capacidade de formar canais membranares e que
estão classificadas de duas formas.
Especializações da Membrana Celular
- 17 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Existem fármacos inibidores de transporte que são marcadores de
translocadores que permitem separar as proteínas em dois grupos:
Intrínsecas: a associação às membranas é forte. São removidas com
detergentes, havendo destruição da membrana. Podem ou não ser
transmembranares.
Extrínsecas: A sua associação à membrana não resiste à aplicação de uma
solução salina.
Podemos classificar proteínas de acordo com a associação proteína-membrana:
Tipo I: Ligadas à membrana por interacções electroestáticas (extrínsecas,
periféricas)
Tipo II: Inseridas na membrana através de polipéptidos hidrofóbicos
(proteínas G)
Tipo III: Cadeia transmembranar lipofílica (hélice α) ligada a cadeias de
aminoácidos polares de ambos os lados da membrana (glicoforina)
Tipo IV: Atravessam a membrana várias vezes, tendo segmentos
hidrofóbicos de ambos os lados da membrana ligados aos segmentos
hidrofóbicos transmembranares (canais)
Tipo V: Ligadas por ligações covalentes susceptíveis a fosfolipases (alguns
receptores).
Caracterização de canais
É feita recorrendo-se ao bloqueio farmacológico (fornece o valor do fluxo do
canal) e ao retalho controlado (permite a medição de correntes nos canais,
mostrando que estes podem estar abertos ou fechados, sendo o seu
comportamento modificado por agentes físicos ou drogas – canais controlados).
A característica comum a muitos dos canais é gerarem correntes iónicas
transmembranares que alteram o potencial de membrana, sendo a
actividade celular regulada pela existência de produtos metabólicos ou
humorais intra ou extracelulares. Excitabilidade é a alteração de uma célula por
meio de agentes (estímulos) fisiológicos.
Canais cujo funcionamento é praticamente não controlado
Canais que abrem e fecham devido à alteração de parte do canal (por acção
do potencial de membrana em células excitáveis, deformação mecânica da
membrana em células ciliares do ouvido interno,…)
Canais que se deformam, abrindo, quando um receptor se combina com o
transmissor T (pode existir uma proteína transmembranar que actua
directamente nas subunidades do canal ou por intermédio de um complexo
molecular_ proteína G_ que actua directamente no canal, fosforilando-o ou
desencadeando uma reacção bioquímica que leva à fosforilação do canal).
Canais cujo desempenho depende de actividades desempenhadas
anteriormente (têm memória).
Outros translocadores
Especializações da Membrana Celular
- 18 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Faz acoplamento entre fluxos de duas ou mais espécies iónicas ou moleculares,
permitindo que a energia armazenada na diferença de concentrações de uma
espécie iónica através de uma membrana seja utilizada para transportar outra
espécie molecular ou iónica contra o gradiente de concentração através de uma
membrana (transporte activo secundário). Exemplo: nas hemácias existe mais
K+ em relação ao meio externo, ao contrário do que se passa com o Na+. Há
saída de K+ e entrada de Na+ (fluxos espontâneos).
Como a concentração celular de iões é constante, têm de existir movimentos
contra o gradiente de concentração de idêntica amplitude (transporte activo)
cujos fluxos estão ligados entre si e à síntese-hidrólise de ATP intracelular. Há
translocação de 3Na+ e 2K+ por cada ATP hidrolisada.
Bombas
Medeiam o transporte activo primário. Quase todas as bombas utilizam ATP,
diferindo o mecanismo hidrólise-síntese de ATP e o transportador iónico.
ATPases-E1-E2: a mesma bomba fosforila-se e passa para dois estádios de
conformação (E1, E2). Insere-se a bomba de cálcio (estimulada por
Ca++/calmodulina), sódio, H+/K+ e bomba aniónica de algumas bactérias.
São iniidas por vanadato.
ATPases-F0-F1: Bombas de protões das mitocôndrias, de cloroplastos, de
membranas baterianas e de vesículas ácidas de células eucarióticas.
Funcionam inversamente às anteriores, usando o gradiente de protões
gerado pelo transporte de electrões para sintetizarem ATP (sintetases-ATP),
não sendo as subunidades fosforiladas. (Teoria quimiosmotica).
Cristalografia e formação de canais transmembranares
Canais de Potássio
O canal são 4 monómeros (cada um com 6 hélices) em volta de um poro
central que atravessa a membrana e cujas entradas estão carregadas
negativamente. A selectividade do canal é determinada por 5 aminoácidos em
cada subunidade, que forram a parte mais externa. Fornecem os grupos –C=O
que estabilizam K+ e determinam o diâmetro do canal (pontes de H e van der
Waals), constituindo uma parte mais estreita que é o filtro de selectividade.
Dentro do filtro podem estar 2K+ separados por 2 moléculas de água. A região
mais larga (cavidade hidrofóbica) comporta várias moléculas de água e um K+
hidratado, mantendo a concentração elevada. A entrada do filtro em contacto
com a parte mais larga existe excesso de cargas (-) que atraem o K+ que está
na cavidade aquosa. A rápida condução deve-se à repulsão electrostática que
existe quando K+ entra. O k+ passa da cavidade larga para o filtro devido à
hidrofobicidade das paredes do canal que não interagem com o ião.
As extremidades das hélices entrecruzam-se, fechando o canal. Quando
estimulado por voltagem, o canal abre-se.
Especializações da Membrana Celular
- 19 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Aquaporinas
Proteína tretramérica em que cada subunidade é como um canal com aberturas
largas para o meio citoplasmático e extracelular, com uma constrição a meio
que possui duas sequências idênticas de 3 aminoácidos que identificam a
aquaporina. Cada subunidade tem 6 hélices α transmembranares (organizadas
em 2 grupos que formam um poro interior) e duas meias hélices com
sequências terminais NPA (projectadas para o interior, muito próximos entre
si). Cada tretâmero AQ1 tem 4 canais específicos para água (o transporte muito
rápido exclui solutos maiores e protões). Dentro do canal podem estar 11
moléculas de água que interagem com os grupos carbonilo que precedem as
NPA.
O primeiro filtro de selectividade é na entrada extracelular, quando o canal
estreita, sendo as moléculas de diâmetro superior a 3ª ou de carga positiva
excluídas. A água ao passar por um resíduo hidrofóbico desvia-se e aproximase de um resíduo carregado positivamente. (A reorientação da molécula é
também um filtro).
O segundo filtro à passagem de protões é a nova reorientação da molécula de
água quando se aproxima do centro do canal onde estão os grupos amido das
meias hélices. Como estas são (+), há reorientação da molécula, formando-se
pontes H entre esta e o NPA.
A condução rápida da água tem características saltatórias porque há duas zonas
hidrofóbicas onde não se estabelecem ligações, aumentando a velocidade. As
moléculas saltam de interacção em interacção, passando por zonas onde a
interacção não é possível.
Integração Funcional a nível celular
As membranas são impermeáveis a substancias hidrosolúveis, tendo
macromoléculas (péptidos ou proteínas) que aceleram o movimento
transmembranar, podendo ser acoplados processos de fornecimento de energia
livre ou de difusão facilitada.
Funcionalmente a integração dá-se em 3 passos:
Captação de energia (radiante, obtida por oxidação, glicólise ou hidrólise de
ATP)
Produção de gradientes através de bombas
Utilização de gradientes para transportar substâncias.
Exemplo: fosforilação oxidativa mitocondrial
O gradiente de Na+ é utilizado para fazer extrusão de protões por antiporte
(nos 2 sentidos) H+/Na+ e para acelerar o transporte para o interior da célula
de oses, bases orgânicas e aminoácidos. O semiporte (1 sentido) de
K+/Na+/2Cl- regula o volume celular e o transporte transcelular. Se a
membrana for impermeável a aniões, o transporte de catiões terá de ser neutro
(troca catião/catião) senão haveria acumulação de cargas e alteração do
potencial da membrana.
Integração funcional a nível de tecidos
Especializações da Membrana Celular
- 20 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Os epitélios são paliçadas de células polarizadas com distribuição assimétrica de
translocadores, situados entre o espaço intercelular (para onde há excreção) e
o exterior (onde há absorção).
Existem junções selantes ou limitantes (impedem passagem de água e solutos),
junções comunicantes ou em ponte e desmossomas (ligam mecanicamente
células contíguas).
A membrana das células epiteliais tem regiões diferentes que diferem, entre
outras coisas, nos translocadores. Estes não têm difusão lateral por estarem
ancorados a elementos do citoesqueleto ou por junções selantes.
Na barreira apical do epitélio existem canais de sódio, enquanto que na barreira
basolateral há bombas de sódio e canais de potássio.
A bomba de sódio potencia uma elevada concentração de potássio e baixa
concentração de sódio intracelular, conferindo propriedades funcionais ao
epitélio. O funcionamento deste mecanismo depende do transporte de sódio e
cloro, que existe na parte ascendente da ansa de Henle dos mamíferos e no
intestino do peixe.
Ver imagens das páginas 93-105 do C.A.
Especializações da Membrana Celular
- 21 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Peroxissomas, glicossomas e hidrogenossomas
Primeiramente apelidados de microcorpos, os peroxissomas têm enzimas
envolvidas na síntese e degradação de peróxido de hidrogénio úteis ao
metabolismo. São semelhantes a glicossomas e hidrogenossomas.
Microperoxissomas são peroxissomas pequenos com cerca de 0,2 micrómetros.
Podem ser confundidos com cortes transversais de túbulos de ligação entre
peroxissomas maiores, que interligam os peroxissomas em multiplicação mais
activa, formando o retículo peroxissomal, antes de se separarem, nos
hepatócitos.
Aspectos morfológicos e enzimáticos
Têm membrana simples (mais fina que a dos lisossomas e idêntica à do RE com
alguma proteínas transportadoras; muito permeável a pequenas moléculas; em
peroxissomas tem muito mais permeabilidade talvez devido a alterações da
membrana causadas pelo processo de isolamento), matriz moderadamente
densa e finamente regular (contém catalase; nucleóides de estrutura cristalina,
que são finos túbulos associados em padrões regulares que contêm uricase, a
oxidase do ácido úrico; placas marginais, que estão junto à membrana,
tornando-a plana neste local e estruturas tubulares complexas alongadas
relacionadas com o RE). Existem em maior número nos hepatócitos, próximo de
gotículas lipídicas, mitocôndrias, cisternas do RE e cloroplastos.
Contém enzimas que se agrupam em: catalase, oxidase, acil transferase,
desidrogenase, amino-transferase, enzimas do ciclo do ácido gliocílico,
enzimas envolvidas na síntese dos plasmalogénios, enzimas intrevenientes
na síntese dos ácidos biliares.
Funções
Respiração: formação de H2O2 e sua decomposição em H2O e O2.
Oxidação em beta dos ácidos gordos: metaboliza ácidos gordos de
cadeia longa (enzima activadora de ácidos gordos, 4 enzimas de oxidação
em beta, isomerase e acetil trasnferase)
Biossíntese dos plasmalogénios: 2 enzimas para introdução da ligação
éster na mesma biossíntese
Biossíntese dos ácidos biliares: conversão metabólica a partir do
colesterol, originando ácidos
Metabolismo do ácido pipecólico: este ácido forma-se durante a
degradação da 1-lisina e é metabolizado neste organelo
Metabolismo do ácido fitânico: uma oxidase converte o ácido em alfaceto ácido
Gluconeogénese: têm transferases específicas na conversão dos ácidos
aminados em glicose (nas células vegetais os peroxissomas- glicossomasintrevem na glucogénse do ácido glicocílico)
Catabolismo das purinas: transformam a alantoina em ácido alantóico ou
ácido glioxílico
Especializações da Membrana Celular
- 22 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Biossíntese do colesterol: a reductase 3-hidroxi-3-metilglutaril CoA é a
enzima chave na mesma biossíntese
Oxidação do etanol: pode ser metabolizado pela catalase (quando em
grandes quantidades)
Funções de regulação: as oxidases podem originar oxail-tiolesteres que
têm efeitos semelhantes à insulina.
Biogénese
A síntese das proteínas da membrana e das proteínas enzimáticas da matriz do
peroxissoma dá-se em ribossomas livres, sendo transportadas para o
citoplasma através da membrana peroxissómica devido à existência de sinais
peptídicos nas proteínas peroxissómicas (PTS 1, PTS2). Os lípidos da membrana
são sintetizados no REL.
Nos hepatócitos de rato, antes da divisão ocorre a formação de uma ansa na
membrana para importar proteínas da matriz. Depois de preenchidas de
proteínas, estas ansas originam dilatações que quando se separam formam um
novo peroxissoma.
Doenças peroxissómicas
Grupo I: ausência quase total de peroxissomas hepáticos; deficiência de
síntese de membrana peroxissomal;
Grupo II: ausência de peroxissomas nalguns hepatócitos; aspecto anormal
dos mesmos;
Grupo III: os hepatócitos podem apresentar peroxissomas normais ou não e
cada entidade clínica tem um défice enzimático.
Glicossomas e hidrogenossomas
Também desempenham algumas funções desempenhadas por peroxissomas.
Os glicossomas têm enzimas catalisadoras da glicólise e os hidrogenossomas
contêm a sintetase do piruvato e a hidrogenase para a degradação do piruvato,
formando-se electrões e hidrogénio molecular.
Consultar páginas 315-324 do C.A.
Especializações da Membrana Celular
- 23 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Matriz extracelular
Conjunto de moléculas nos espaços intercelulares com a capacidade de formar
agregados tridimensionais complexos, ligando-se a receptores celulares
específicos, sendo a sua função diferente de tecido para tecido e de região para
região. A matriz extracelular influencia o comportamento das células.
Conferem resistência
Protegem contra agressores
Está mais desenvolvida em tecidos com funções mecânicas ou de suporte
(tecidos conjuntivos), embora todos os tipos celulares tenham capacidade de
síntese e excreção destes componentes.
Territórios da matriz extracelular
Compartimento intersticial
Tem funções estruturais e é mais abundante nos tecidos conjuntivos:
Tecido conjuntivo denso (tendões, cápsulas fibrosas, adventícias de vasos):
são sistemas fibrosos que dão resistência e elasticidade: sistemas colagénio
e elástico.
Tecido conjuntivo laxo (córion de mucosas, cordão umbilical): Agregados
macromoleculares (proteoglicanos) que mantêm um ambiente hidratado que
permite a difusão de nutrientes e catabolitos, assegurando as propriedades
mecânicas (ex.: cartilagem).
Compartimento pericelular
Envolve-se em processos de modelação do comportamento celular (migração,
adesão, proliferação/apoptose, diferenciação), existindo em todos os tecidos e
influenciado a expressão genética. Inclui matrizes de fibrinectina, proteínas
multifuncionais e proteoglicanos. As células interagem com estes
compartimentos através de receptores de membrana_ integrinas. Exemplos de
matrizes perinucleares:
Laminas basais: placa que une o tecido conjuntivo ao tecido
parenquimatoso (epitélios ou endotélios) ou a células isoladas (musculares e
adiposas).
Glicocálice: Rica em carboidratos, existente à periferia de muitas células,
mais desenvolvida na porção apical de células epiteliais.
Zona pelúcida: rodeia os ovócitos, contribuindo para a fretilização.
Componentes da matriz extracelular
Colagénios
Proteínas extracelulares fibrosas com funções de estrutura. Têm uma tripla
hélice que lhes confere rigidez, estrutura derivada de mecanismos de póstradução e da estrutura primária de cada molécula de colágénio_3 cadeias α. As
cadeias são formadas por 3 resíduos de aminoácidos: glicina-x-y, que se repete
Especializações da Membrana Celular
- 24 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
dando origem a domínios colagénicos, sendo os aminoácidos das posições x e y
a prolina e a hidroxiprolina. A estrutura primária dos colagénios contribui para a
estabilização da tripla hélice, tendo informação para o estabelecimento de
ligações típicas dos colagénios.
Os colagénios são secretados sob a forma de percussores (procolagénios) que
são clicados extracelularmente para dar origem aos colagénios propriamente
ditos (tropocolagénios). As moléculas podem polimerizar espontaneamente em
fibrilas, fibras e consequentemente feixes de colagénio.
Síntese de colagénio:
Síntese de cadeias α
Hidroxilação e glicolisação de alguns aminoácidos
Formação da tripla hélice
Condensação do procolagénio em vacúolos e secreção;
Clivagem extracelular dos polipéptidos_ colagénio
Polimerização, dando origem a fibrilas e estabilização através de ligações
covalentes inter e intramoleculares.
Degradação do colagénio:
Extracelularmente: disrupção facial das fibrilas de colagénio por colagenases
da família das metaloproteinases da matriz (MMP)
Fagocitose dos resíduos.
A polimerização dos colagénios (fibrilogénese) é espontânea no meio fisiológico
mas é controlado por células: a deposição das fibrilas ocorre em
compartimentos pericelulares especializados tubulares, havendo incorporação
das fibrilas em feixes guiada por prolongamentos fibroblásticos. A velocidade,
ordem de clivagem e crescimento em espessura versus longitudinal também
são contolados.
Tipos de colagénios
Tipo I, II, III, V e IX constituem fibras naivas (cilíndricas) que conferem
resistência aos tecidos. O tipo I é o mais abundante.
Tipo VI: Fibras em rosário que formam uma rede flexível que envolve
células, feixes de colagénio, nervos e vasos de modo laxo.
Tipo IX, XII e XIV: Não polimerizam, associando-se à superfície das fibras
nativas (colagénios FACIT)
Tipo IV: a sua polimerização não resultam fibrilas mas uma malha molecular
que interage com as redes da laminina e perlicano, constituintes das lâminas
basais.
Sistema elástico
Fibras distintas dasd de colagénio com contorno e espessura irregulares e sem
periodicidade transversal com dois compartimentos:
Componente amorfo:
Especializações da Membrana Celular
- 25 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
sem nenhuma subestrutura visível;
constituído por elastina, que é uma proteína pouco solúvel de lenta
renovação com muitos resíduos de aminoácidos hidrofóbicos;
está presente na forma insolúvel resultante da polimerização de
moléculas solúveis de tropoelastina, secretadas pelas células, e posterior
estabilização por ligações covalentes promovidas pela lisil-oxidase que
também é responsável pela mesma função em fibrilas de colagénio
Componete microfibrilar:
fibrilas tubulares, microfibrilas, resultantes da repetição de estruturas
globulares unidas por filamentos;
não se encontram sempre associadas ao componente amorfo nem se
organizam sempre em feixes;
nesta organização tem o nome de microfibrilas conjuntivas;
Têm uma constituição mais complexa que o componente amorfo
São constituídas essencialmente por fibrilina (têm pelo menos 5
proteínas).
Proteínas Multifuncionais
População muito heterogénea da matriz extracelular cujas mole´culas têm
domínios que possibilitam muitas interacções e funções.
Interacções:
Entre si
Com outras moléculas
Com receptores celulares.
A interacção com células é mediada por receptores da superfície celular
(integrinas que são proteínas integrais da membrana), que são heterodímeros
com duas subunidades (alfa e beta) muito diversificados devido aos vários tipos
de subunidades alfa e beta e às conbinações que podem existir entre elas. As
integrinas reconhecem determinadas sequências de aminoácidos nos ligandos
extracelulares.
As integrinas, por intermédio dos seus domínios intracelulares interagem com o
citosqueleto (microfilamentos de actina ou, mais raramente, filamentos
intermédios), podendo ser pontes entre a matriz celular e os componentes da
matriz extracelular (transmissão de informação entre os 2 meios). A integrina
pode ainda associar-se a muitas proteínas dos sistemas de sinalização
intracelular, regulando alterações da expressão genética e influenciando a
proliferação e diferenciação das células.
A sequência Arginina-Glicina-Ácido aspártico (RGD) é importante para a adesão.
Funções:
Papel estrutural (interacções com outros componentes da matriz extracelular
como as lâminas basais)
Funções adesivas (a fibronectina e a laminina promovem a intrecação das
células com os substratos)
Moléculas antiadesivas (a tenascina e a trombospondina)
Especializações da Membrana Celular
- 26 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
alterações da expressão genética e in fluenciando a proliferação e
diferenciação das células
Papel muito importante em funções biológicas normais (migração de células
no desenvolvimento embrionário, …) ou patológicas (adesividade de células
tumorais ou de microrganismos, …)
Glicosaminoglicanos e Proteoglicanos
Glicosaminoglicanos são polissacarídeos complexos de elevado peso molecular e
cadeia linear que existem à superfície da célula, essencialmente em lâminas
basais e glicocálice. Podem ocorrer intracelularmente em situações patológicas.
Resultam da repetição de um dissacarídeo formado por um N-acetil-hexosamina
e um ácido urónico, segundo padrões que nos possibilita formar diferentes
grupos:
Sulfatos de condroitina
Sulfatos de dermatano
Sulfatos de heparano
Heparina
Sulfatos de queratano
Ácido hialurónico: único glicosaminoglicano que não está associado a
proteínas por ligações covalentes. Todos os outros associam-se a
componentes proteicos originando proteoglicanos. Ao componente proteico
associam-se oligossacarídeos. Os proteoglicanos diferem nas características
da parte proteica no tipo/número de glicosaminoglicanos e oligossacarídeos.
Os proteoglicanos a part-time podem ou não ter glicosaminoglicanos.
Como têm muitos grupos sulfato e/ou carboxilo os glicosaminoglicanos e o
ácido hialurónico têm muitas cargas negativas_ moléculas polianiónicas_ com
conformação expandida nos tecidos por repulsão electrostática e retenção de
uma grande quantidade de moléculas de água.
Classificação de proteoglicanos
Os proteoglicanos são classificados de acordo com o tipo de glicosaminoglicano,
o que é eficaz se considerarmos a matriz intersticial ou as populações
maioritárias de proteoglicanos na matriz perinuclear. Como os proteoglicanos
de maiores dimensões estão nos compartimentos interfibrilares de tecidos
conjuntivos laxos, têm fundamentalmente sulfatos de condroitina e os
pequenos proteoglicanos associados a fibrilas de colagénio têm um sulfato de
dermatano. Nas matrizes pericelulares existem proteoglicanos de sulfato de
heparano. Como a porção proteica de muitos proteoglicanos está clonada, esta
classificação torna-se inútil.
Cada proteoglicano tem uma desiganção relacionada com o tipo de porção
proteica e função.
Agrecano e versicano: nos territórios interfibrilares da matriz extracelular;
têm porções proteicas de grande peso molecular; formam agregados com
Especializações da Membrana Celular
- 27 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
moléculas de ácido hialurónico (no caso do agrecano a ligação é estabilizada
por uma proteína de ligação).
Decorina, biglicano e fibromodulina: pequenos proteoglicanos
homólogos. A decorina e fibromodulina interagem com as fibrilas nativas de
colagénio influenciando a fibrilogénese; o biglicano interage com factores de
crescimento.
Perlicano: com muitas cadeias de sulfato de heparano. É o mais abundante
nas membranas basais;
Serglicina: Proteoglicano intracelular dos grânulos de secreção das células
hematopoiéticas.
Os proteoglicanos podem estar nas membranas celulares sob a forma de
proteínas integrais ou, depois da inserção de fosfatidil-inositol na bicamada
lipídica, por interacção com receptores da membrana. Neste local podem
mediar as interacções célula-célula ou célula-matriz.
Os proteoglicanos na superfície celular ou na matriz pericelular podem interagir
com factores de crescimento, sequestrando-os e protegendo-os de fenómenos
de degradação, activando-os ou inactivando-os.
Alguns proteoglicanos da membrana são receptores celulares (para ácido
hialurínico, factores de crescimento, …).
Aspectos funcionais da matriz extracelular
A constituição da matriz extracelular está relacionada com a função do tecido.
As células sintetizam, depositam e degradam os componentes da matriz
extracelular, sendo esta também que influencia o comportamento das células.
Existe uma relação biunívoca célula-matriz, o que explica que a função da
matriz vai para além do papel estrutural, sendo também importante para:
adesão, migração e proliferação celulares; modificação da expressão genética,
diferenciação, sendo um vector de transmissão de informação entre as células.
Ver imagens das páginas 75-89 do C.A.
Especializações da Membrana Celular
- 28 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Citoesqueleto
É uma armação fibrilar de suporte de natureza proteica que constitui uma rede
dinâmica e complexa. Foi explicado inicialmente por duas teorias:
Teoria fibrilar: protoplasma formado por fibrilas entrecruzadas numa substância
homogénea
Teoria reticular: os filamentos eram anastomosados numa rede de uma
substância fluida não contráctil.
Bioquímica, morfológica e funcionalmente podemos distinguir três sistemas de
estruturas filamentosas.
Microtúbulos
Rectilíneos ou curvos, aparência rígida.
Inicialmente observados como componentes de 4estruturas celulares complexas
(centríolo, corpúsculos basais, fibras de fuso, axonema de cílios e flagelos)
Constituídos por polimerização de tubulina α e tubulina β (proteínas globulares),
originando 13 protofilamentos alinhados longitudinalmente.
Os microtúbulos e protofilamentos são polarizados. À extremidade + associamse preferencialmente novas subunidades, sendo de crescimento mais rápido que
a extremidade -.
Podem ser de estrutura lábil ou estável
• Lábeis: por polimerização e despolimerização podem formar-se e
desmontar-se ao longo do ciclo celular imprevisivelmente, sendo muito
dinâmicos.
• Estáveis: encontram-se noutras estruturas celulares
Polimerização: Na Interfase as extremidades + apontam para a periferia celular
e as – partem duma região estabilizadora (MTOC – centro organizador de
microtúbulos que é habitualmente o centrossoma). Os microtúbulos crescem a
partir de focos de material denso perto dos centríolos. A tubulina γ coordena os
centros de polimerização. No início da fase M os microtúbulos formam ásteres
que originarão os pólos do fuso. A polimerização depende da concentração de
tubulina, temperatura, iões cálcio e magnésio. Existe um mecanismo de
renovação de subunidades tubulares onde se adicionam dímeros na
extremidade + e separam-se na extremidade -. Há drogas que também
influenciam.
Colchicina: inibe a polimerização da tubulina e provoca a dissociação
dos microtúbulos citoplasmáticos. Não se liga à tubulina
polimerizada.
Vinblastina e vincristina: impedem a polimerização da tubulina pró se
ligarem a ela.
Taxol: estabiliza os microtúbulos por se ligar a polímeros de tubulina
As proteínas associadas aos microtúbulos interferem com a ligação dos
microtúbulos
a
outras
estruturas
celulares
por
polimerização
e
despolimerização. Sãos as MAP e as tau. As proteínas associadas aos
microtúbulos também podem ser motores moleculares (enzimas que associam a
energia libertada pró hidrólise de nucleótidos à produção de movimento
vectorial ao longo da rede de microtúbulos, conferindo movimento a vesículas e
organelos. Destacam-se: dineínas (movimento da extremidade -) e cinesinas
(movimento da extremidade +)
Funções
• Tráfego intracitoplasmático de vesículas e organelos durante a interfase
• Construção do fuso mitótico
• Organização do citoplasma (criação e manutenção de domínios
citoplasmáticos
• Motilidade celular
Especializações da Membrana Celular
- 29 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
•
Transdução sensorial
Microfilamentos (filamentos de actina)
•
•
•
•
•
•
•
•
Estruturas filamentosas paralelas ou de redes de filamentos anastomosados
Formados por polimerização de actina G (globular) originando actina F.
A organização espacial é variável e muito complexa em células não
musculares. Nas regiões submembranares são redes de malhas com
pequenos feixes, as fibras de stress (ex.: fibroblastos). Nas diferenciações
da membrana são muito compactos e de orientação regular.
Os filamentos de actina F também são polarizados, crescendo por adição de
monómeros a uma das extremidades (onde a actina G está ligada a ATP –
pólo de crescimento). Pode haver treadmill (associação de monómeros de
um lado e separação do outro).
Os microfilamentos podem interagir com outras estruturas através de
proteínas de ligação à actina que interferem com a polimerização e
despolimerização. Estas proteínas também podem actuar como motores,
pertencendo à família das miosinas, o que promove a movimentação
intracitoplasmática de organelos e vesículas. A associação com a miosina
tem importância na fagocitose, citocinese e na locomoção celular.
As proteínas associadas podem agir por
Sequestração de actina G, limitando a polimerização (profilina)
Ligação a uma extremidade de actina F, impedindo crescimento ou
dissociação (gelsolina, vilina e actina α)
Associação lateral a segmentos de filamentos, impedindo a sua
fragmentação (tropomiosinas)
Organização espacial: tem forma helicoidal de cadeia simples. Depende das
interacções entre os filamentos formando-se feixes ou redes que, por terem
proteínas de dimensões diferentes, podem ser mais ou menos compactos.
Também se podem ligar a integrinas (através de talina, vinculina e actinina
α) e caderinas clássicas (através de cateninas) em adesões focais ao
substrato e em contactos celulares sem junções. Estas associações tornam
possível a transdução de sinais nas células aderentes.
Filamentos intermédios
Rede perinuclear que se estende até à membrana; pequenos feixes (células
epiteliais: muito compactos)
Proteínas fibrosas (ao contrário das tubulinas e actinas). O domínio central é
responsável pela estrutura dos diferentes filamentos intermédios e os terminais
(muito variáveis) conferem especificidade. São dímeros agregados em
complexos de quatro cadeias. Os tetrâmeros constituem protofilamentos e
quatro destes protofilamentos formam protofibrilas. Estas associam-se aos
grupos de quatro e formam o filamento de 10 nm.
Tipos de proteínas constituintes de filamentos intermédios:
° Citoqueratinas acídicas (tipo I)
° Citoqueratinas básico-neutras (tipo II)
° Vimentina, desmina, proteína acídica fibrilar glial e periferina (tipo III)
° 3 Proteínas dos neurofilamentos, nestina e α–internexina 8tipo IV)
° Lâminas nucleares (tipo V) (envolvidas na estabilidade do núcleo e na
replicação do DNA)
° (nexina e proteínas dos filamentos intermédios do cristalino)
• Os filamentos intermédios são quase insolúveis em certas condições iónicas
e muito estáveis em relação a muitas técnicas morfológicas
Especializações da Membrana Celular
- 30 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
•
•
•
Ao longo do ciclo celular e diferenciação há alterações na distribuição e
alterações pós-traducionais nos filamentos intermédios. Há uma troca
constante de moléculas entre a fracção solúvel e a polimerizada, embora
não haja polaridade.
Os filamentos intermédios mantêm a estabilidade mecânica e organização
multicelular tridimensional. Podem associar-se à superfície celular com
desmossomas (ancoram em caderinas) e hemidesmossomas (ancoram de
modo semelhante, mas a diferentes compostos). Contribuem para a
resistência a tracções e estabilidade da ligação entre o epitélio e o
mesênquima subjacente.
Os filamentos intermédios associam-se a proteínas e complexos
nucleoproteicos, controlando a expressão genética. Podem ligar-se ao núcleo
(vimentina) e às mitocôndrias, sendo importantes na transmissão de sinais
da superfície celular ao núcleo. A plectina pode ligar os filamentos
intermédios ao invólucro nuclear, contribuindo para a organização global do
citoesqueleto.
Especializações da Membrana Celular
- 31 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Especializações da Membrana Celular
- 32 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Nucléolo e transcrição dos rRNA
Estão no nucleoplasma e têm aspecto denso entre a cromatina. São de tamanho,
número e posições variáveis. São basofílicos e tê RNA associado a proteínas. É
responsável pela síntese de rRNA
Morfologia ultraestrutural
Número (1-5 em células somáticas) e de diâmetro variáveis (maiores em ovócitos).
São muito densos e rodeados de cromatina perinuclear.
Componentes:
Componente fibrilar denso: partículas de rRNA e filamentos de RNP
Componente granular: partículas de rRNA (percursores ribossómicos)
Centro fibrilar: zona mais clara e finamente regular onde se localiza o DNA
que contém os genes (que no conjunto formam o NOR) que transcrevem os
rRNA’s. É aqui e na zona circunvizinha do componente fibrilar denso que se
sintetiza rRNA. Podem ligar-se a certos cromossomas porque os nucléolos
estão em contacto com a cromatina perinuclear.
Cromatina intranucleolar: formada por massas densamente compactadas,
fibras com espessura 10-30 mm e aglomerados laxos de filamentos de DNA
(3nm). São organizações cromossómicas nucleossómicas que só se
desorganizam na zona do cromossoma durante a síntese de rRNA .
Os nucléolos podem ser:
Compactos: predomina o componente fibrilar denso (acumulação deste
componente numa fase inicial de transcrição (rDNA-rRNA)
Reticulares: Componente fibrilar denso sob a forma de fita enrolada sobre si
mesma (nucleolonema) rodeada de componente granular
Vacuolares: zona central com componente fibrilar denso com vacúolos ou
interstícios nucleolares. Na posição periférica existe componente granular.
Anelares: esféricos, de grande dimensão. Zona central: volumoso vacúolo
com matriz semelhante ao nucleoplasma perinucleolar. Na periferia:
componentes fibrilar denso e granular.
Citoquímica e Bioquímica
O nucléolo tem DNA (cromatina intranucleolar) em continuidade com DNA
perinuclear, rRNA e proteínas nucleolares, tais como:
Proteínas de revestimento dos rRNA
Partículas proteicas nucleares (small nuclear RNP): snoRNA. São
proteínas associadas a pequenos rRNA nucleolares.
Nucleolinas: importante proteína que se liga ao rRNA transcrito
Fibrilarina: Encontrada principalmente no centro fibrilar e no componente
fibrilar denso, tem um papel importante nas actividades póstrasncricionais da biogénese da maturação de rRNA’s. Associa-se a
snoRNP’s, associação esta que participa no processamento dos préRNA’s. Esta proteína está intimamente associada à transcrição de rRNA's.
Actividade funcional
O nucléolo tem um dinamismo próprio devido á actividade de síntese de rRNA e
exportação das moléculas para o citoplasma. Estas etapas ocorrem nas fases G1, S
e G2 da interfase, observando-se:
Movimento de ciclose dentro do núcleo
Aumentos e diminuição de volume
Especializações da Membrana Celular
- 33 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Aparecimento e desaparecimento cíclicos nas células em divisão: Após a
telofase e no início da interfase (G1) o nucléolo forma-se e desaparece na
profase. Nas células em divisão ele aparece e desaparece ciclicamente,
enquanto que nas células diferenciadas (não sujeitas à divisão cíclica) ele
está sempre presente.
Existem cromossomas específicos (cromossomas nucleolares com DNA nucleolar)
que contêm genes dos rRNA (genes ribossomais). São nucleótidos (Nt) que
transcrevem para os rRNA. Os nucléolos formam-se por aglutinação de rRNA
transcritos. Esta transcrição ocorre em zonas do DNA (molde) por actividade da
RNA polimerase I e de factores de transcrição. Estes complexos ligam-se ao DNA a
montante (antes) ou a jusante (depois) do local de início da transcrição. (Nt +1 é o
nucleótido onde se inicia a transcrição. Os Nt negativos estão a montante).
Os eucariotas têm estimuladores ou activadores (enhancers) longe do Nt + 1 que
influenciam a expressão dos genes, podendo estar em vários locais do rDNA,
actuando para aumentar a actividade do promotor durante a transcrição.
O rDNA, A NOR e a síntese de rRNA
Os cromossomas nucleolares (cromossomas acrocêntricos 13, 14, 15, 21, 22) têm
uma região organizadora nucleolar (NOR) com genes ribossomais. A partir das NOR
formam-se os nucléolos que se acumulam na sua periferia, originado o centro
fibrilar.
Uma das cadeias do rDNA contém Nt repetidas (unidades transcricionais)
intercaladas de sequências Nt não transcricionais. A primeira molécula transcrita
chama-se pré-rRNA (prRNA) e é rRNA 45S. Quando isoladas, as unidades de
transcrição têm a forma de árvore de Natal ou de Miller.
Para ocorrer transcrição é necessário um complexo de iniciação (RNA polimerase I
+ factores de transcrição). A RNA polimerase I liga-se ao promotor de rDNA (a
montante do local de início) interactuando com os factores de iniciação.
Iniciação: as duas cadeias de rDNA são afastadas na zona de iniciação pela
DNA topoisomerase I, que corta uma das cadeias do rDNA que serve de
molde, à medida que a síntese vai ocorrendo.
AS RNA polimerase I necessita de factores de transcrição (TF) que se
associem ao promotor (onde se liga a RNA polimerase para iniciar a
transcrição) e de TBP (TATA – Binding protein) que adere ao promotor. Os
promotores de genes rRNA são reconhecidos por 2 factores de transcrição:
UBF (factor de ligação a montante do Nt+´1) e factor de selectividade (SL1)
com 4 subunidades proteicas (uma delas o TBP). O UBF e o SL1 associam-se
à polimerase I formando o complexo de iniciação.
A este complexo (no Nc+1) ligam-se factores de elongação. Após a
dissociação do complexo de iniciação há a deslocação do complexo
(polimerase I e factores de elongação) ao longo da cadeia de rDNA, que é
copiada no sentido 3’-5’, sendo a molécula de rRNA transcrita no sentido 5’3’. A transcrição ocorre por reconhecimento da complementaridade
nucleotídica entre a cadeia do DNA molde e o RNA neossintetizado. Os
nucleótidos são covalentemente adicionados às extremidades 3’ da cadeia
de rRNA neossintetizada, o que requer energia por hidrólise de ATP.
A elongação da transcrição requer o movimento do “olho” de transcrição da
polimerase I e da topoisomerase.
A etapa da finalização ocorre quando um terminator (factor de terminação)
reconhece uma sequência com 18 bases no fim de cada unidade de
transcrição, libertando-se a RNA polimerase I e o factor de elongação.
O pré-rRNA (prRNA) é libertado, acumulando-se no nucléolo até se iniciar a
clivagem e maturação.
Especializações da Membrana Celular
- 34 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Maturação dos rRNA
A molécula de prRNA é formada por rRNA de 45S que se acumula no nucléolo até á
maturação. Comporta sequências de rRNA de 18S, 5S, 8S e 28s, formando uma
RNP 80S.
A molécula rRNA 45S é processada através da catálise por parte de endonucleases,
perdendo uma pequena sequência nucleotídica na extremidade 5’, originando um
rRNA 41S. As endonucleases clivam o rRNA em rRNA 20S e 32S, que são
processados por clivagem em rRNA 18 S (e 28S + 5.8 S, associadas sob a forma de
RNP 60S que tb inclui um rRNA 5S atravessam os poros e formam a grande
unidade ribossomal). A molécula 18S associada a proteínas (RNP 40S) constituirá a
pequena unidade ribossomal.
Regulação e clivagem de rRNA
Na maturação ocorrem clivagens em sequências Nt específicas do prRNA
catalisadas por rRNA nucleolares de pequenas dimensões (snoRNA) ricos em uridina
(snoRNA U). Estes snoRNA associam-se a proteínas, formando complexos
ribonucleoproteicos, snoRNP.
Nas diferentes etapas de clivagem está envolvida a metilação dos rRNA's. Os
snoRNA podem ainda actuar como chaperones.
Relações núcleo-citoplasmáticas
As moléculas de rRNA de 45S sofrem exportação sob a forma de RNP que migra do
nucleoplasma até ao citoplasma, passando pelos poros nucleares.
Pela utilização da uridina tritiada denota-se a acumulação de RNP na porção
citoplasmática vizinha dos poros nucleares. É nos ovócitos, principalmente aqueles
que precisam de grande quantidade de vitelo (reservas nutritivas), que esta
exportação
é
mais
evidente
Especializações da Membrana Celular
- 35 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Células fagocíticas
Identificaram-se fagócitos profissionais, células com capacidade de ingerir
partículas (nomeadamente infecciosas) que podiam ser micrófagos ou
macrófagos.
Posteriormente identificaram-se fagócitos livres (no sangue e linfa e com
capacidade de migração para locais infectados) e fixos (próprios de um órgão).
Criou-se a noção de sistema reticuloendotelial que inclui macrófagos fixos e células
endoteliais com capacidade de endocitar partículas.
Há outras células com capacidade de internalizar material extracelular por
endocitose e há células não fagocíticas que podem ser estimuladas a fagocitar
bactérias por produtos microbianos. No entanto, só os fagócitos profissionais são
funcionalmente dotados de capacidades fagocíticas importantes.
Ontogenia do sistema fagocítico-mononuclear e da linhagem granulocítica
Em contraposição ao sistema reticuloendotelial, existe o conceito de sistema
fagocitico-mononuclear que contém células maturadas na medula óssea e
libertadas no sangue, migrando para os tecidos.
Existem células progenitoras pluripotenciais que originam linhagens de
leucócitos que se diferenciam em monoblastos. A sua divisão e diferenciação
origina promonócitos e consequentemente monócitos. Os mieloblastos e
promielócitos darão origem aos granulócitos, polimorfonucleares neutrófilos e
eosinófilos.
Os monócitos circulares repõem a população de macrófagos fixos nos tecidos ou,
em inflamações, acumulam-se nos locais onde elas acontecem.
Vários tipos de macrófagos:
Tecido conjuntivo e pele: histiócitos
Fígado: células de kupffer
Medula óssea, Cavidades serosas (pleural e peritoneal), Pulmão (no alvéolo e no
septo conjuntivo), Órgãos linfóides (gânglios linfáticos e baço), sistema nervoso
(algumas células da glia)
Osso: osteoclastos
Sinóvia: células tipo A.
Os neutrófilos têm vida curta, sofrendo apoptose e sendo fagocitados por
macrófagos, versificando-se a união de duas linhagens celulares de diferenciação
divergente a partir da mielopoiese. Esta ingestão fornece aos macrófagos moléculas
com actividade antimicrobiana (cooperação neutrófilo-macrófago). Durante a
inflamação há extravasamento de componentes plasmáticos para os tecidos
(exsudação) e migração de monócitos (monócitos exsudativos ou inflamatórios) e
neutrófilos sanguíneos.
Na medula óssea a produção de monócitos e eosinófilos é controlada quer por
moléculas aqui produzidas, quer por moléculas de outros tipos celulares que
comunicam através de percursores mielóides através de secreção de factores
solúveis no sangue (factores estimuladores de colónias).
Caracterização das células
Macrófagos
Espalhados no suporte onde estão mantidos
Forma variável: fusiforme, estrelada, arredondada
Tal como os monócitos, têm contorno irregular (extensões citopalsmáticas com
formação de vesículas de pinocitose ou fagocitose), núcleo pouco denso
Especializações da Membrana Celular
- 36 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
reniforme ou ovóide, citoplasma abundante e com variados graus de
vacuolização.
Citoplasma: mitocôndrias, RE modesto, complexo de Golgi desenvolvido e
várias vesículas. Lisossomas primários numerosos que, após fusão com
fagossomas, originam lisossomas secundários.
Capacidade de movimentação sobre estruturas fixas: movimento ao acaso ou
dirigido por moléculas (factores quimiocinéticos ou quimitácticos).
Neutrófilos
Um núcleo multilobado (polimorfonucleares) e muito condensado
Citoplasma rico em grânulos que coram com corantes neutros (distinção de
neutrófilos de eosinófilos)
Diferentes grânulos:
• Primários: primeiros a serem formados. Coram com azures (grânulos
azurófilos). São semelhantes aos lisossomas de outras células porque são
ricos em hidrolases ácidas, contendo produtos como a mieloperoxidase (cor
esverdeada que identifica exsudados purulentos, vulgo pus rico em
neutrófilos)
• Secundários ou específicos: conteúdo distinto (lactoferrina)
• Grânulos ricos em gelatinase e outros derivados de vesículas de pinocitose.
A fagocitose
Ligação da partícula à membrana do fagócito (não dependente de energia) com
transmissão (ou não) de um sinal, o que provoca ingestão;
Interacção sequencial da membrana (e receptores) com a superfície da partícula
(processo semelhante a um fecho de correr); pseudópodes emitidos que se
fundem ; a fusão das membranas origina o fagossoma ou vacúolo fagocítico.
Podem fundir-se outros organelos (como os lisossomas).
Pode haver macropinocitose ou fagocitose por enrolamento, que são
processos induzidos por agentes patogénicos, permitindo colonizar as células
fagocíticas.
A ingestão implica:
Acção de microfilamentos: actina que se concentra em torno da membrana,
constituindo os pseudópodes; miosinas; proteínas reguladoras (cinase C e
talina).
Acção de microtúbulos para migração do fagossoma.
Relação com vesículas como os endossomas e lisossomas: amadurecimento da
membrana do fagossoma que adquire e perde moléculas; processo mediado por
GTPases de baixo peso molecular (Rab).
Receptores de superfície
Receptores de fracção Fc das imunoglobulinas (FcR) e receptores do
complemento (CR). As moléculas (imunoglobulinas e complemento) que
facilitam a fagocitose são opsoninas.
Há outras moléculas membranares com mais receptores:
Para factores de coagulação
Para componentes da matriz extracelular
Para proteínas de transporte, factores de crescimento, citocinas, factores
quimiotácticos
Adesinas: moléculas que se ligam a outras moléculas de superfície de outras
células
Antigénio do complexo maior de histocompatibilidade (MHC) da classe I e II
Especializações da Membrana Celular
- 37 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Moléculas de adesão (selectinas, integrinas, moléculas da subfamília das
imunoglobulinas) permitem a migração transendotelial durante processos
inflamatórios.
Receptores de manose, r. tipo Toll (TLR) e receptores de limpeza, que servem
para detecção precoce de infecções.
Produtos lisossomais e de secreção
O macrófago não tem tantos grânulos lisossomais como o eosinófilo e neutrófilo,
mas tem alguns lisossomas com várias enzimas, como a lisozima, que actua sobre
peptidoglicanos de bactérias endocitadas ou é secretada para actuar
extracelularmente. Alguns têm mieloperoxidase que potencia a toxicidade dos
radicais de oxigénio por eles produzidos. Todas estas enzimas estão nos grânulos
primários dos neutrófilos.
O macrófago, ao contrário do eosinófilo, secreta mais produtos:
Hormonas polipetídicas (actividade essencialmente imunorregulatória, como
as citocinas)
Componentes dos sistemas complemento e da coagulação
Enzimas proteolíticas e seus inibidores
Proteínas
da
matriz
extracelular
(fibronectina,
proteoglicanos,
trombospondina)
Proteínas com afinidade para ligandos (transportam cofactores)
Lípidos bioactivos (como as prostaglandinas)
Os neutrófilos e os macrófagos sintetizam moléculas de baixo peso molecular com
importância antimicrobiana e antitumoral:
Produtos reactivos de azoto
Radicais de oxigénio: a sua toxicidade é aumentada pela mieloperoxidase e
por iões metálicos
Interacção macrófago - linfócito T. Activação macrofágica
Após a endocitose de moléculas proteicas há a sua degradação e ligação de
pequenos fragmentos a moléculas codificadas pelo MHC. Estes são reconhecidos
pelos receptores dos linfócitos T como antigénios.
Após contacto com um corpo infeccioso, receptores de compartimentos
intracelulares de macrófagos reconhecem moléculas do microrganismo, ligando-se
a polissacáridos (ex:: manoses que decoram glicoproteínas de membrana),
compostos típico de procariontes (peptidoglicano, lipopolissacarídeo, ,,,). Os
receptores tipo Toll (TLR) informam o macrófago e induzem a resposta inflamatória
pelo recrutamento e activação de células linfóides, apresentando-lhes antigénios.
Existe uma célula de ontogenia diferente, a célula dendrítica, que é mais eficiente a
nível de apresentação de antigénios.
A célula T produz citocinas que alteram a capacidade do macrófago, activando-o
(maior capacidade antimicrobiana, antitumoral e de secreção).
Exemplos de citocinas: interferão gama (activa fagócitos), interleucina-10
(inibe interferão gama e inactiva fagócitos).
Fagócitos e infecção
Na inflamação, há alterações vasculares que permitem a acumulação de leucócitos
nos tecidos lesados (factores quimiotácticos por activação de moléculas endógenas
secretados por células estimuladas – quimiocinas- ou derivados de constituintes
microbianos). Os primeiros a migrar são os neutrófilos e só depois os monócitos
que, in loco, transformar-se-ão em macrófagos exsudativos. Há microrganismos
Especializações da Membrana Celular
- 38 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
que escapam por terem cápsula antifagocítica e há microrganismos que permitem a
sua lenta fagocitose proliferando dentro do macrófago.
A capacidade antimicrobiana pode ser estimulada por citocinas libertadas pelo
linfócito T que reconhece os antigénios da superfície dos macrófagos (activação
macrofágica). Os macrófagos ficam com maior capacidade de secreção, fagocitose e
apresentação de antigénios.
Alguns microrganismos são eliminados por acção de radicais livres, derivados do
oxigénio e/ou óxido nítrico, proteases, defensinas, lactoferrinas ou então o controle
microbiano é exercido por macrófagos em vias de apoptose, talvez por privação de
nutrientes.
Patologias e macrófagos
O macrófago activado tem actividade tumoricida para algumas linhas tumorais, pelo
que se infiltram na massa tumoral, sendo importantes à resistência da
proliferação da célula neoplásica. Têm um papel importante na génese da
placa de ateroma, havendo receptores para lipoproteínas da superfície do
macrófago e citocinas favoráveis à aterogénese.
A linhagem fagocítica-mononuclear origina células neoplásicas (leucemias
monocíticas e mielomonocíticas agudas e linfomas histiocíticos).
O macrófago também é importante em casos de sarcoidose, artrite reumatóide,
hemocromatose e doenças de armazenamento (lipidoses).
Especializações da Membrana Celular
- 39 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Ciclo celular
Tempo compreendido entre a mitose de uma célula e as mitoses das
células filhas. Somente as células indiferenciadas têm capacidade de
proliferação e diferenciação regulada. Existem em todos os tipos de
tecido excepto músculos e neurónios.
Fases do ciclo celular
Interfase: Cromossomas não visíveis; crescimento celular à custa de
síntese de proteínas, ribossomais e retículo granular. É 90% de
duração do ciclo.
G1) Intervalo entre o fim da mitose e o início de uma nova mitose.
Crescimento celular. Existe o ponto R ou restriction point (ponto
de não retorno) onde se decide se a célula entra ou não em
mitose.
S) Síntese de DNA. (6-8 horas no Homem).
G2) Intervalo entre o fim da fase S e o início da fase M. (6 horas
no Homem).
Fase M (uma hora no homem)
A seguir à mitose a célula pode seguir vários caminhos:
Diferenciação e maturação (tornam-se células não proliferarias)
Nova fase de síntese
Fase pós mitótica prolongada (G0) que é uma G1 prolongada
observada em várias células de longos períodos de vida e que
raramente se dividem, a menos que sejam estimuladas
(ex.:hepatócitos). A fase G0 pode ser rpovocada por falta de
nutrientes e de factores de crescimento que inibem síntese
proteica, aumentando a resistência a agressões.
Métodos de estudar o ciclo celular
Métodos autorradiográficos
Pode-se marcar o núcleo com percursores radioactivos de DNA na
fase S, concluindo-se acerca da taxa de proliferação e percentagem
de mitoses marcadas.
Fosfato P32: captado pelo DNA na fase S. Não é específico (pode
ser incorporado por outras substâncias) e emite raios β nocivos.
Adenina C14: são necessárias elevadas quantidades, o que lesa
as células. A detecção de DNA requer extracção de outras
substâncias que captaram o marcador, como o RNA.
Especializações da Membrana Celular
- 40 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Timidina tritiada: incorporada no DNA especificamente, emite
menos radiação e permite boas imagens. A sua incorporação
depende da fosforilação. O trifosfato de timidina é uma forma
activa que, depois da perda de dois ácidos fosfóricos, é
polimerizado no DNA, ficando este radioactivo. Reconhecem-se
células com capacidade de proliferação numa dada população
celular (stem cells).
Os isótopos radioactivos são de uso limitado no Homem porque
emitem radiações que alteram o material genético provocando
aberrações cromossómicas, inibição mitótica, redução de crescimento
e morte celular. Há métodos com substâncias fluorescentes do
DNA mais adequados.
Tempo de geração
O ciclo celular tem tempo variável para cada população. Nas áreas
proliferativas do corpo humano é em média 24 horas.
Com injecção de timidina tritiada, as células em G1, G2 e M não
aparecem marcadas (conclusão: não há síntese de DNA na mitose).
As primeiras moléculas marcadas estavam na fase S no momento da
injecção. O aparecimento das primeiras mitoses marcadas é o tempo
de duração de G2. Assim pode-se calcular o tempo de duração de
todas as fases.
O índice radioactivo é a percentagem de células marcadas depois da
administração do produto radioactivo, antes de qualquer núcleo
marcado tenha tempo para se dividir.
As células embrionárias dividem-se rapidamente, tendo um ciclo
celular síncrono apenas com M e S. Em estados mais avançados da
embriogénese surge o alongamento de G1 e G2.
No esófago, uma quantidade apreciável de células fica em G2,
entrando em mitose depois de uma alimentação normal. Estas células
devem conter mais DNA que as células normais (poliplóides), o que
acontece frequentemente nos hepatócitos e outras células de
roedores e no miocárdio do homem.
Novos métodos de estudo do Ciclo celular
Conhecendo os mecanismos do ciclo é possível combater a
proliferação tumoral. As células de um organismo pluricelular devem
cumprir 4 etapas: crescimento, replicação de DNA, segregação dos
cromossomas homólogos, divisão celular. Os cromossomas devem
duplicar na fase S à custa de enzimas, separarem-se para as células
filhas (segregação na fase M) à custa do citoesqueleto (que também
contribui para a citocinese). Devem codificar proteínas que regulam
o ciclo e proteínas constituintes das futuras células filhas.
Especializações da Membrana Celular
- 41 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Experiências com fusão de células
Com fusão de células de mamíferos concluiu-se que:
As células em fase M têm factores que induzem outras células em
mitose
As células em fase S têm factores que induzem replicação
Após a duplicação do DNA este modifica-se, sendo incapaz de
replicar de novo. Após a fase M as células em G1 adquirem
novamente essa propriedade.
Estas experiências não permitiram detectar que factores são
responsáveis pela regulação do ciclo.
Ciclo celular de células embrionárias
Experiências em oócitos de rã comprovam a existência um factor de
promoção de maturação (MPF) útil em ciclos mitóticos e meióticos.
Os motores do ciclo celular são componentes moleculares que
activam e desactivam reacções químicas do ciclo, tais como o MPF.
Motor do ciclo celular:
MPF activo
(G2 →M)
Ciclina B
(Interfase em células
somáticas; mitose em c.
embrionárias)
Condensação
dos
cromossomas; destruição
do invólucro nuclear;
formação
do
fuso
mitótico.
Ciclina B
MPF inactivo
(final M)
Segregação
cromossomas;
recosntituição
invólucro
citocinese.
dos
do
nuclear;
Com MPF activo, a p34cdc2 fosforila proteínas na fase M:
Lâminas: degradação da membrana nuclear
Filamentos intermédios: reorganização do citoesqueleto (fuso
mitótico)
Proteínas para a condensação mitótica
Proteínas do RE e do Golgi
Factores de transcrição (ficam inactivos)
No final da fase M, entre a anafase e a telofase, as proteínas são
desfosforiladas, revertendo as modificações (desactivação do MPF).
Especializações da Membrana Celular
- 42 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Células embrionárias → provocada pela desactivação de MPF
Nova mitose
e duplicação
do MTOC
Células somáticas
(G1)
Seres unicelulares: START
(divide a interfase: células que não estão em
replicação passam à fase S e depois a G2)
Seres multicelulares: Ponto R
Análise genética do ciclo celular
Estudos com leveduras (mutações induzidas por UV a diferentes
temperaturas – cell division cicle- cdc) levaram à descoberta de
genes que codificam proteínas reguladoras do ciclo.
Identificação do MPF: Complexos CDK-Ciclinas
MPF
P34cdc2: actividade cinásica. Fosforila outras proteíans quando associada à ciclina.
Níveis constantes ao longo do ciclo. Pico em G2/M. Na intrefase está
desfosforilada.
Ciclina B: acumulação em G2. Desaparece no final de M.
CDK’s (proteínas cinases ou cycling dependent kinases). Sempre
presentes. Só varia o estado de associação a ciclinas. (Formam-se
complexos ciclina-cinase) Fosforilam por acção de CAK (cinase activadora
das CDK)
Ciclinas (de cocentração variável ao longo do ciclo)
B: + p34cdc2→MPF
Sintetizada em G1, S e G2. Destruída em M.
G1) Activam as CDK → START
S) + CDK →síntese DNA por fosforilação de proteínas na replicação
Cada ciclina tem uma
região (box) que a
diferencia das outras
e uma região de
degradação
para
fixação de ubiquitina,
que é reconhecida
pelas proteínas, para
degradação
das
ciclinas.
Complexos CDK-Ciclina ao longo do ciclo:
CDK4 – Ciclina D (G1-S)
Indispensáveis para G1/S (SPF). Precisa de pRb (prts retibblastoma)
CDK 2- Ciclina E (s-G2)
CDK 2 – Ciclina A (G2-M)
CDK 1 – Ciclina B (MPF → M) (Mnemónica: 4 Diamantes, 2 Espumantes, 2 Amantes; 1
Beijo)
Especializações da Membrana Celular
- 43 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Factores inibidores de Ciclo celular
Proteínas inibidoras
(CKI –
actuam sobre as CDK). Quando há anomalias graves
conduzem a G0, há proliferação celular excessiva ou
apoptose
P53: regula ao nível da transcrição. Quando há lesão do DNA provoca
paragem em G1 ou apoptose. Induz a p21.
Família P21: Actua sobre CDK-Ciclinas, inibindo a replicação do DNA. Se não
for induzida por p53 pode haver cancro. Importante para a diferenciação, em
conjunto com a p27.
Família p16: Inibidora de CDK4-Ciclina D. (Complexo P16-CDK4-CiclinaDpRB é essencial para G1/S).
MPF inactivo
(porque
p34cdc2
desfosforilada)
p34cdc2
desfosforilada
Ciclina
B (G2)
Fosforilação em resíduos:
•
•
Y15 (treonina
14 + treonina
15) fosforilada
por prts cinase
WEE1
T161 (trionina
161) fosforilada
pelo complexo
CAK
MPF ACTIVO
Desfosforilação no resíduo
y15 pela fosfatase
codificada pelo gene
cdc25
Especializações da Membrana Celular
- 44 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Mitose
Divisão nuclear e citoplasmática em que uma célula origina duas células filhas
geneticamente iguais, mantendo-se inalterável o número de cromossomas.
Existem factores reguladores deste processo.
Profase
Aumento do volume nuclear
Cromatina são longos e finos filamentos (cromossomas dicromatídicos
irregularmente dispersos)
Início da dissipação de nucléolos
Os 2 pares de centríolos na região perinuclear começam a deslocar-se do
citoplasma perinuclear para os pólos opostos da célula
Os cromossomas começam a encurtar (mais visíveis)
Prometafase
Início da dissipação do invólucro nuclear (aparecimento de fragmentos do
invólucro e de cisternas do RE, que estão visíveis até à formação do fuso
acromático)
Encurtamento dos cromossomas e espessamento, estando desorganizados no
nucleoplasma
• Os 2 cromatídeos distinguem-se mais facilmente
• Os cinetocoros são visíveis de cada lado do centrómero e aparecem
microtúbulos ligados a estes e orientados para os pólos do fuso mitótico (ou
acromático)
• Com o desaparecimento do invólucro, cada cromossoma começa a dirigir-se
para o plano equatorial por meio de vários Mt
Centrossomas nos pólos da célula, de onde crescem Mt que se ligam aos
cinetocoros
Metáfase
Cromossomas ligados ao plano equatorial pelos centrómeros: Fase estática da
mitose
Cromatídeos evidentes por afastamento dos seus braços
Cinetocoros e microtúbulos cinetocorianos (MTc) bem visíveis e orientados
desde o pólo do fuso acromático aos cinetocoros
Anafase
Há uma ascensão polar
cromossomas metafásicos.
de
cada
cromossoma
filho
por
segregação
dos
Anafase A
Dissociação da coesão centromérica, cromatídeos (que são agora cromossomas)
puxados por MtC, deslocando-se para os pólos
Anafase B
Cinetocoro ligado aos MtC
Afastamento dos dois pólos do fuso por alongamento da célula devido à
deslocação dos Mt polares
Há maior distância entre centrossomas
Especializações da Membrana Celular
- 45 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Telofase
Reorganização do invólucro nuclear, rodeando os cromossomas que se
descondensam
Nucleocinese: formação de núcleos filhos
Centrossoma na região perinuclear
Despolimerização da maior parte dos Mt
Citoesqueleto das células filhas (filamentos intermédios) alterado
Redistribuição equitativa de organelos (RE e Golgi fragmentam-se e migram
para os pólos por acção de Mt)
Citocinese: citoplasma dividido por clivagem, iniciando-se na anafase B e
terminando antes da célula entrar em interfase.
• Anel de contracção determinado pelo fuso mitótico: filamentos de actina e
miosina II; está a meio da distância entre os 2 centrossomas.
• Os filamentos de actina estão paralelos em relação ao plano de divisão,
associados à membrana citoplasmática do invólucro nuclear
• Quando a membrana está praticamente dividia, desaparece o anel e formase o corpo médio (tem a parte central de Mt polares e material denso)
Reorganização do citoesqueleto
Elementos do fuso acromático ou mitótico
É uma estrutura formada na mitose por Mt e centrossomas cuja formação se inicia
na prometafase, completa-se na metáfase e dissipa-se na anafase B. Tem dois
pólos opostos, cada um ocupado por um centrossoma (2 centríolos a curta distância
em posição ortogonal)
Os pólos estão interligados por microtúbulos, alguns deles ligados aos cinetocoros.
Entre os dois pólos, perpendicularmente à direcção dos Mt, existe o plano ou
placa equatorial ou mitótica.
Centrossoma (e centríolos) e o ciclo centriolar
São 9 tripletos de Mt curtos distribuídos numa superfície cilindróide. Estão na
região polar da célula e em conjunto com proteína da região pericentrossomal
(centrina, centrofilinas, tubulinas, cinesinas, calmodulinas, tequetina,
ATPases, RNA polimerases, …) formam o centrossoma. Os 2 centríolos de cada
centrossoma estão orientados numa posição ortogonal.
Por serem polimerizadores de Mt, os centrossomas também tomam o nome de
centros organizadores de Mt (MTOC).
Microtúbulos e proteínas motoras
Estas proteínas pertencem à família das cinesinas e dineinas e têm vários
domínios para formação de dímeros para ligação aos Mt e um dímero para
associação a outros componentes celulares. Elas ligam os Mt e usam energia da
hidrólise de ATP para mover estruturas celulares em direcção (-) (dineínas) ou (+)
(cinesinas).
No início da fase S forma-se o procentríolo (esboço microtubular) que se organiza
e cresce, passando depois a existir 2 centrossomas (4 centríolos).
Os centros organizadores de microtúbulos
Na célula em G1 ou S há um MTOC associada ao centrossoma. O material
pericentriolar tem tubulina γ, pericentrina, centrina, DMAP60 e CP190. A
tubulina γ está no interior do centríolo e, em conjunto com outras proteínas,
Especializações da Membrana Celular
- 46 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
organiza uma estrutura em forma de anel que serve de base para a polimerização
de Mt a partir de material pericentriolar e está na extremidade (-) dos mesmos.
A capacidade e tipos de Mt variam de acordo com a fase do ciclo, o que sugere que
a composição do MTOC é mudada, para que na interfase hajam Mt escassos e
estáveis e na mitose muitos microtúbulos que são instáveis. Estas alterações
parecem dever-se não à fosforilação de tubulinas mas à fosforilação de MAP
(proteínas associadas aos Mt).
Tipos de microtúbulos e sua associação aos cromossomas
Polares: nucleados a partir de centrossomas, estendem-se em direcção ao pólo
oposto, sobreponde-se na parte central. Responsáveis pelo fuso na parte inicial
e por interacções entre proteínas que estabelecem pontes entre os microtúbulos
dos dois pólos (cinesinas).
Cinetocorianos: ligam os centrossomas aos cinetocoros; organizam a placa
equatorial; segregação de cromatídeos.
Astrais: Nucelados a partir do centrossoma para o córtex celular,
principalmente na direcção oposta à do fuso. Têm função de separar os pólos na
anafase B.
A associação lateral de Mt aos cinetocoros na fase de formação da placa equatorial
permite uma rápida ascensão destes aos pólos _ cromossoams monorientados_
devido às dineínas. Perto do centrossoma, onde há maior densidade de Mt, a
associação lateral transforma-se numa associação onde a extremidade (+) do Mt
está inserida no cinetocoro, permanecendo ligados até ao final de M. Depois os
cromossomas monorienatdos descem para o centro. Os Mt associados ao pólo
oposto crescem e estabelecem uma ligação com o cinetocoro livre. Existe uma força
que repele os cromossomas quando estão perto dos centrossomas (polar wind ou
força de exclusão polar devido à associação das extremidades (+) dos Mt às
cromocinesinas), aproximando os cromossomas dos Mt que crescem do lado
oposto, formando-se cromossomas biorientados.
Dinâmica dos microtúbulos durante metáfase
Existe um treadmilling flux, pois a ligação das extremidades dos Mt e outras
estruturas permite a incorporação de mais tubulinas na extremidade (+). A anafase
inicia-se quando os cromossomas ascendem para os pólos. A presença de um
cromossoma monorientado induz um atraso na anafase até que ele esteja
biorientado. A separação dos cromatídeos na Anafase A deve-se a uma alteração
dos MtC (perda de tubulinas em +, redução de comprimento; ascensão rápida de
cromatídeos). Na anafase B o aumento da distância dos centrossomas deve-se à
ligação de MtP a cinesinas em (+), separando-se as duas metades do fuso. As
dineínas associadas ao córtex celular também se pode ligar a (+) dos MtA. A sua
deslocação para (-) puxa os cromossomas para a membrana celular.
Cromossomas mitóticos
Os dois cromatídeos dos cromossomas mantém-se unidos devido à acção de
coesinas que se associam ao DNA depois da replicação, inicialmente ao longo de
todo o comprimento da molécula de DNA e, mais tarde, quando os cromossomas
estão condensados, são removidas dos braços, mantendo-se no centrómero.
O centrómero e o cinetocoro são duas estruturas inter-relacionadas bem visíveis
em metáfase, no local onde os dois cromatídeos se unem. Cada cromossoma
prometafasico e metafasico tem 2 cinetocoros em posições opostas, cada um ligado
a um cromatídeo na zona do centrómero.
Especializações da Membrana Celular
- 47 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
O cinetocoro tem uma estrutura trilamelar estratificada com base
cinetocoriana (liga à lamela basal do centrómero), lamela apical ou coroa (aderem
os Mt). As proteínas da estrutura trilamelar foram denominadas A, B e C.
Os centrómeros são a zona por onde se ligam os cromatídeos com
heterocromatina dos mesmos e proteínas centroméricas internas na posição
central.
Checkpoint mitótico
Monitorização da ligação entre cromatídeos e Mt do fuso. Há um processo que
impede que a célula entre em anafase sem cromossomas biorientados (alguns deles
podem estar monorientados) por transdução de sinal que detecta a não
biorientação ou a fraca tensão do fuso sobre os cromossomas através da
inibição de uma ubiquitina ligase (APC – anaphase promoting complex). Se
os cromossomas estiverem biorientados esta induz a degradação de coesinas
que mantém os cromatídeos ligados. Há proteínas que fornecem esta informação:
Bub 1, 3 e R1 e Mad 1 e 2.
Mitoses atípicas
Quando as nucleocineses são acompanhadas de não divisões citoplasmáticas,
originando uma célula mononucleada (plasmódio) uma célula multinucleada com
centenas de núcleos. No final das nucleocineses, cada núcleo, com uma porção de
citoplasma, rodeia-se de uma membrana, originando esporoblastos. Cada
esporoblasto diferencia-se em esporo.
(Consultar imagens das páginas 372-395 do C.A.)
Especializações da Membrana Celular
- 48 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Célula neoplásica
Expressão génica e estrutura celular
As formas multicelulares diferenciadas têm possibilidade de aquisição
informação, modificação genica, sobrevivência, morte e passagem
características suas às células germinativas.
de
de
Diferenciação celular e factores de crescimento, capacidade adaptativa e
genes reguladores
A potencialidade de uma célula é dirigida para uma diferenciação por factores
próprios e factores ambientais. Os genes estruturais e reguladores determinam a
diferenciação celular e a expressão/repressão determina o fenótipo.
Factores reguladores de proliferação celular
Na diferenciação do ovo até à expressão morfológica orgânica há factores, químicos
geneticamente determinados, que modulam a proliferação celular e diferenciação
através de sinais intracelulares: factores de crescimento, citocinas, hormonas e
matriz extracelular que interactuam com receptores da membrana.
Os factores de crescimento obrigam a célula a passar de G0 à divisão. Os factores
de competência levam a G1, os factores de progressão levam à fase S. Toda a fase
G1 necessita da acção de factores de crescimento e se houver interrupção há
regressão para G0. Há factores que modulam a acção de factores de crescimento,
como os factores β (transformadores do crescimento – TGF β), o interferão e o
factor necrose tumoral (TNF) que podem antagonizar os efeitos dos factores de
crescimento. Por sua vez os factores de crescimento podem promover a
diferenciação da célula juntamente com o estímulo proliferativo (factores β
transformadores do crescimento). O controle da proliferação relaciona-se com
produtos de genes supressores governados por checkpoints reparadores.
Capacidade adaptativa da célula
A capacidade adaptativa multidireccional da célula expressa-se de várias formas,
algumas delas malignas.
Leucoplasia: Queratinização e disposição arquitecturada de um epitélio
pavimentoso estratificado devido a traumatismos
Metaplasia: Transformação pavimentosa do epitélio cilíndrico brônquico
perante agressão química ambiental
Anaplasia e Neoplasia: Modificação do programa genético da célula.
Tranformação neoplásica:
Na divisão celular e sob determinados factores os cromossomas fragilizam-se em
certos locais, podendo haver rearranjos génicos que alteram o programa genético
da célula. Quanto mais forrem os locais de ruptura, maior será a probabilidade de
neoplasia. Uma insuficiência de ácido fólico despoleta uma baixa na síntese de
timidina e consequentemente de timina, aumentando a fragilidade cromossómica, o
que pode ainda ser agravado com administração de cafeína. Há substâncias ricas
em ácido fólico que impedem esta fragilização.
Formam-se, activam-se e alteram-se sequências em genes de cancro ou
oncogenes, delectam-se ou inibem-se genes supressores da divisão celular, genes
supressores de cancro ou antioncogenes, alteram-se genes responsáveis por
apoptose ou perdem-se ou alteram-se as proteínas para reparação de erros no
DNA.
Especializações da Membrana Celular
- 49 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Proto-oncogenes e oncogenes
Proto-oncogenes codificam produtos para o crescimento, diferenciação, formação
de receptores e reparação de lesões. São percursores de oncogenes. A passagem
de uma célula normal a neoplásica exige numerosos passos (hits) que são
aquisições biológicas que ultrapassam barreiras que zelam a personalidade da
célula. Da iniciação neoplásica na mutação de proto-oncogene a oncogene até uma
massa neoplásica há uma série de eventos que permitem fixar como autónomo o
novo comportamento celular.
Conhecem-se 60 oncogenes.
Genes supressores tumorais
Suprimem a acção de genes que acarretam a divisão celular normal e anormal.
A fosfoproteína nuclear p53, codificada por um destes genes, tem função a nível da
transcrição, no controlo do ciclo celular e no metabolismo.50% dos tumores
humanos devem-se a p53 mutada.
A p16, codificada por um gene inibidor de ciclo celular, é delectada ou mutada em
muitos tumores, não lhe sendo possível associar a ciclina D com ciclinas
dependentes de cinases, impedindo a fosforilação do gene do retinoblastoma
(mantendo-o activo a suprimir a divisão).
O gene da polipose cólica adenomatosa (APC) é similar ao do retinoblastoma,
desenvolvendo neurofibromas que podem evoluir para neurossarcomas. Este gene
codifica proteínas com actividade GTPásica (GAP) que inactivam a função do gene
rãs.
O gene delectado no carcinoma cólico (DCC) relaciona-se com o carcinoma
colo-rectal e com o carcinoma gástrico. Codifica moléculas de adesão que impedem
a divisão.
O gene WT-1 quando delectado é responsável pelo tumor de Willms do rim.
O gene DPC4 (carcinoma do pâncreas) codifica proteínas supressoras idênticas aos
TGL.
O gene tumor supressor PTEN quando perdido ou inactivado é um factor de
progressão de gliomas e de carcionomas na mama e na próstata. Codifica uma
enzima fosfatase que actua sobre uma molécula lipídica ou lípido a membrana,
sendo uma pouco comum fosfatase lipídica. O lípido é o fosfatidilinositol-3,4,5trifosfato ou PIP3, responsável pela via de controlo do crescimento celular,
estimulando-o e bloqueando apoptose. O gene PTEN normal actua inibindo o
crescimento e facilitando a apoptose.
Genes reguladores de apoptose
O gene bcl2 quando alterado impede ou retarda a morte celular pornintervenmção
nos mecanismos oxidativos, acumulando-se as células (ex:linfoma nodular).
O gene p53 e proto-oncogene c-MYC também regulam a apoptose, assim como
as proteínas reguladoras do DNA.
Genes codificadores de proteínas reparadoras de DNA
São responsáveis pela organização genica codificando proteínas que reparam erros
de replicação pela metilação de sequências GATC, anulando o segmento alterado e
reconstituindo um novo segmento.
Há mecanismos de verificação das fases celulares que constituem os factores
de invariabilidade celular. São os checkpoints que impedem a entrada da célula na
fase seguinte.
O gene BRCA1 quando alterado induz susceptibilidades de cancro de mama e de
ovário por funções oxidativas no DNA.
Especializações da Membrana Celular
- 50 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Mecanismos de alteração da função celular
Há factores extracelulares que interagem com receptores da superfície celular,
activando vias intracelulares de informação, orientando o crescimento e
diferenciação e proporcionando funções úteis como a reparação de lesões,
processos adaptativos benignos ou expressão neoplásica.
A transformação neoplásica resulta de um desvio de uma via de sinalização
orientadora de funções dos factores de crescimento. Um certo número de
receptores destes factores com actividade tirosina-cinase são codificados por protooncogenes ou por similares oncogenes víricos (oncogenes sis e oncogenes erb-B de
vírus de eritoblastose aviaria). Os produtos dos onco-genes activos influenciam a
proliferação e diferenciação da célula transformada.
Mecanismos moleculares de carcinogénese:
Mutação de um gene de factor de crescimento (PDGF) levando a célula a uma
constante divisão (proto-oncogene sis, por exemplo)
Mutação de um gene de um receptor de um factor de crescimento (EGFreceptor) obrigando à presença constante desse factor de crescimento (protooncogene erbB por exemplo)
Mutação que exagera a expressão de um gene (proto-oncogene myc por
exemplo) cujos produtos acarretam alterações nucleares e determinam
proliferação indefinida.
Um proto-oncogene pode transformam-se em oncogene por delecção ou mutação
pontual na sequência genica, por amplificação genica, por rearranjos
cromossómicos ou recombinações entre DNA retrovírico e proto-oncogene.
A célula neoplásica
Alterações morfológicas e de comportamento
Morfologia:
Aumento de volume e cromaticidade do núcleo
Inversão da relação núleo-citoplasma
Alteração do número e forma dos organelos
Perda de caractarísticas da célula adulta, diferenciada, substituídas pró aspectos
morfológicos embrionários, definidores de anaplasia ou indiferenciação.
Comportamento:
Comportamento anti-social
• Perde-se a inibição de contacto recusando-se a impossibilidade de se dividir
fora do contacto global da célula
• Capacidade infinita de sobreviver e replicar
• Falta de respeito pelas superfícies de fronteira, invadindo por infiltração de
estruturas vizinhas e disseminação à distância, onde as células dispersas se
fixam, acarretando crescimentos autónomos e metastização neoplásica.
(características de células malignas epiteliais – carcinomas- e das células de
neoplasias malignas parenquimatosas – sarcomas)
Pode ser transplantada, mantendo em cultura todas as características e
originado neoplasias noutros seres quando implantada
Perda de moléculas de adesão (caderinas e integrinas)
Circulação da célula no sangue (devido á actividade plaquetária de bloquear a
célula estranha activa-se a coagulação com formação de fibrina, onde, retida, a
Especializações da Membrana Celular
- 51 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
célula neoplásica adquire integrinas que a fixam à matriz extracelular e
caderinas que determinam adesão intracelular, constituindo-se a metástase).
Alterações da membrana
É aqui que existem receptores que iniciam sinais de transmissão de informação
para o citoplasma e núcleo.
Há invasão e sobrevivência em meios de cultura, perda de adesividade a outras
células, perda de inibição de contacto e de divisão.
Há perda de moléculas de adesão como as caderinas, a β-catenina e a sua via
de ligação a caderinas e controlo da divisão nuclear.
Há modificação de factores, mobilidade destes e perda da sua ligação ao
citoesqueleto , perda de intercomunicabilidade celular e modificações na
capacidade de transporte com facilitação de transporte de aminoácidos e
açúcares, aumento de GMP cíclico, variações enzimáticas, alterações de
glicoproteínas (síntese incompleta de algumas, perda da síntese daquelas que
têm elevado peso molecular como a fibronectina, aumento em ácido siálico,
alterações nos antigénios.
Alterações antigénicas
Antegenicidade distinta dos antigénios normais de histocompatibilidade celular que
determina uma resposa que pode inviabilizar o crescimento neoplásico. Existem
antigénios da célula normal e antigénio diversos (antigénios tumorais e
antigénios associados). Os antigénios específicos dependem do factor de
transformação celular (vírus ou químicos) e os associados são antigénios fetais
como a α-fetoproteína e o antigénio carcino-embrionário e os antigénios solúveis.
Alterações químicas
Não são muito evidentes. Há uma capacidade anaeróbia de produzir lactato. Os
desvios bioquímicos resultam da normal diferenciação da célula normal, sendo
mínimos na célula neoplásica mais diferenciada e mais marcados na célula
indiferenciada com tendência a um perfil semelhante ao da célula fetal ou imatura.
Podem ser fabricados isoenzimas semelhantes aos de células fetais; fosfatase
alcalina de tipo placentário, proteases e glicosidades facilitadoras da sua
disseminação, enzimas e hormonas ectópicas; marcadores enzimáticos, mucinas
neutras, sialomucinas, sulfomucinas.
Alterações cromossómicas
A célula neoplásica inicia, progride e dissemina.
Iniciação e promoção são fases génicas sem evidência de alteração cariotípica. São
a expressão fisiológica da dinâmica adaptativa.
A progressão e disseminação acompanham alterações cromossómicas.
A variabilidade cariotípica de uma neoplasia reside na labilidade genica com
aumento de divisão celular. A neoplasia maligna promove novas expressões e a
variabilidade morfológica na mesma neoplasia é por vezes uma constante.
Há alterações cromossómicas numéricas (perdas ou duplicações em todos os
cromossomas) e estruturais (translocações, delecções_ que podem ser de genes
supressores_ inversões, inserções, amplificações).
Avanços interpretativos das alterações
Células neoplásicas não têm progressão logarítmica, pois esta originaria uma
neoplasia sempre de grande volume e rápida. Existem células stem
Especializações da Membrana Celular
- 52 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
neoplásicas em número reduzido que sobrevivem ás terapias. A maior parte
das células neoplásicas deixa de se dividir ou diferenciam-se, voltando a ser
normais e muitas delas morrem. É de extrema importância a terapia de
sobrevivência ou morte das células stem.
Mutações nos microsatélites (curtas sequências repetitivas nos centrómeros
ou telómeros) alteram a regulação genica e reparação do DNA.
Idade e cancro: As células idosas acumulam proteínas alteradas, diminuindo a
capacidade de reparação de DNA; há um aumento de mutações, não havendo
genes para a reparação do DNA por estarem mutados. A capacidade de divisão
celular relaciona-se com telómeros, quês e encurtam em cada divisão,
protegendo o DNA de agressões, de fusão termino-terminal, de rearranjos e de
pêra cromossómica. Sem estes mecanismos há paragem do cerscimento celular
por instabilidade cromossómica. A activação da telomerase pode induzir um
estado imortal, por estabilização do comprimento dos telómeros.
Quimioterapia antineoplásica: encurta e degrada os telómeros antes da
apoptose, o que sugere que os telómeros são alvos de drogas antineoplásicas.
(No prolongamento de S há aumento da actividade neoplásica, reduzindo-se
depois em G2-M. a sua inibição provoca encurtamento de telómeros, inibição de
crescimento e apoptose).
Terapêutica anti-angiogénica: tentativa de controlo do factor de crescimento
endotelial (VEGF) das células neoplásicas através de inibidores de colagenases
(endostatina, fumagilina) e inibidores específicos dos receptores de VEGF.
Especializações da Membrana Celular
- 53 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
Oncogénese
Iniciação
•
•
•
•
Ocorre alteração do material genético da célula.
Formação de um oncogene.
Poderá ou não vir a originar uma célula oncológica.
Não há expressão fenotípica.
CAUSAS
FACTORES CANCERIGÈNICOS
• Proto-Oncogenes (Codificam proteínas implicadas na regulação do ciclo
celular são indispensáveis para a sobrevivência de uma célula normal:
Factores de crescimento, Receptores factores crescimento, Elementos de
transdução de sinal, Factores de transcrição nuclear
•
Oncogenes
FACTORES DE CRESCIMENTO: Aumento da síntese de factores
de crescimento
ONCOPROTEINAS DE MEMBRANA (RECEPTORES)
Proteína EGFR- proteína receptora do fact. crescimento epitelial
- Receptor sempre activado
- Receptor expresso em número exagerado
ONCOPROTEINAS DE TRANSDUÇÃO DE SINAL
-Proteínas da família Ras (H, K, N-Ras),
proteina G
-Activação permanente desta família
sem estimulo externo.
ONCOPROTEINAS NUCLEARES
Actuam como factores de transcrição estimulando a expressão
de genes de proteínas essenciais para a progressão do ciclo celular.
-Activação permanente independente da transdução de sinal.
GENES SUPRESSORES TUMORAIS
Proteínas que impedem a continuação do ciclo celular após serem detectadas
irregularidades no genoma
das células permitem a reparação do DNA ou a destruição da célula por
apoptose.
FACTORES INTRINSECOS
• Genéticos
FACTORES EXTRINSECOS
• Químicos: Amianto, Alcatrão, Benzeno, Aflatoxinas
• Biológicos: Vírus hepatite , Vírus HPV, Vírus EBV, Parasitas
• Físicos: RX, UV
Promoção
•
Células já apresentam alterações fenotipicas. Existe alteração morfológica
Especializações da Membrana Celular
- 54 -
Resumo teórico de BioCel
Ana Catarina Santos; 2oo6/2oo7
•
•
Alteração fenotípica celular Progride ou não dependendo de vários factores.
CÉLULA
NEOPLASICANucleo/citoplasma; nucleos forma e volume
irregular;
ribossomas; pouco reticulo, mitocondrias, lisossomas.
Citoesqueleto organizado para benificiar a migração celular; Poucas
especializações de membrana; proteinas membrana transporte glicose.
Progressão
•
Multiplicação das célulasfenotipicamente alteradas Com acomulação de
mutações.
Invasão: com metástases vasculares
P53 – the gatekeeper
Tem muita importância no controlo do ciclo celular transição
G1-S. Promove a paragem do ciclo celular para reparações do DNA
Ou para activação da apoptose.
A p53 interage com diversas proteínas para executar a sua função ATM p73 Bax
Bcl2. Mas a mais importante é a p21 por inibição Das CDKs (proteinas ciclino
dependentes) fase G1 e fase S.
Rb1
Relaciona-se com os retinoblastomas daí a sua denominação. Inibe proteínas
pertencentes à família E2F que activam a expressão de genes de proteínas
necessárias para a fase S como a ciclina E e a Timidilato sintetase. Se a Rb1 não se
expressar vai haver um descontrolo na transcrição destas proteínas com activação
descontrolada da mitogenese.
Apoptose
Morte celular programada. Sem inflamação, sem necrose. Evento normal num
adulto, morrem por apoptose. 50 biliões de células dia.
Necessário para
complementar a actividade e o equilíbrio proliferativo normal.
FASE DE EXECUÇÃO
CASPASES - Cisteinas (C) + aspartato (asp) + enzimas(ases)
(clivagem)
São proteases (10 tipos que destroem elementos fundamentais da
célula como citoesqueleto, membrana nuclear e DNA. Provocam “morte limpa”
FASE DE CONTROLE
Bcl-2 Encontram-se na membrana externa da mitocôndria evitam libertação para o
citosol de citocromo c que activa as caspases
Proteinas Transmembranares
Bcl-2 -antiapoptotica
Bax – pro-apoptotica.
(activação se não é possível Corrigir o defeito DNA)
Proteínas anti-apoptoticas- IAP (Exp. Survivina-fetal)
Fazem parte do mecanismo mesmo em células normais.
Especializações da Membrana Celular
- 55 -