Universidade Camilo Castelo Branco
Instituto de Engenharia Biomédica
PÂMELA MARIA MOREIRA FONSECA
EFEITO BACTERICIDA DA OZONIZAÇÃO, SONICAÇÃO E
OZONIZAÇÃO/SONICAÇÃO EM Streptococcus mutans
BACTERICIDE EFFECT OF OZONATION, SONICATION AND
OZONATION/SONICATION IN Streptococcus mutans
São José dos Campos, SP
2012
ii
PÂMELA MARIA MOREIRA FONSECA
EFEITO BACTERICIDA DA OZONIZAÇÃO, SONICAÇÃO E
OZONIZAÇÃO/SONICAÇÃO EM Streptococcus mutans
Orientador: Prof. Dr. Carlos José de Lima
Co-Orientadores: Prof. Dr. Luciano dos Santos Feitosa
Profa. Dra. Adriana Barrinha Fernandes
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Bioengenharia
da Universidade Camilo Castelo Branco, como complementação dos créditos necessários
para obtenção do título de Mestre em Bioengenharia
São José dos Campos, SP
2012
iii
FICHA CATALOGRÁFICA
iv
v
DEDICATÓRIA
Dedico este árduo trabalho à minha pequena “Vitória Helena Fonseca Moreira” que
desde as suas primeiras horas de vida ensinou-me que é preciso coragem para
vencer a vida, e que Deus é Misericordioso perante as dificuldades encontradas.
vi
AGRADECIMENTOS
A Deus que neste percurso, a Tua mão grandiosa permanecia sobre minha vida,
encorajando-me a prosseguir. Àquele que, em Seu infinito amor, me concedeu
coragem para lutar e perseverança para vencer.
Aos meus pais José e Lucília que me deram a vida e ensinaram-me a viver com
dignidade além de iluminarem os meus caminhos, principalmente os obscuros, com
afeto e dedicação para que os trilhasse sem medo e cheios de esperanças. Amo
muito vocês!
Ao meu orientador, Prof. Dr. Carlos José de Lima, pelos ensinamentos, dedicação
e paciência durante estes anos de estudo. Agradeço também pela amizade,
profissionalismo.
Ao Prof. Dr. Luciano dos Santos Feitosa pela imensa contribuição nos
experimentos, cedendo laboratório de Biologia Molecular para a realização destes.
À Prof.ª Dr.ª: Adriana Fernandes Moretti Barrinha pelo carinho e estímulo para o
término desta pesquisa. Obrigada pelos ensinamentos com as placas de pétri e
meios de cultura, além da Escala de Mac Farland.
Ao Prof. Dr. José Lucas Martins e Prof. Dr. José Cássio de Almeida Magalhães
pelo apoio e carinho neste trabalho, e também pela imensa contribuição nas coletas
do material da cárie, e pela autorização do uso da Clínica de Odontologia.
À Petúnia de Àvila Moreira Fonseca pela paciência em me auxiliar neste estudo,
ensinando-me que paciência é uma virtude na vida, sendo uma ferramenta essencial
no crescimento profissional.
Ao Plínio Augusto Moreira Fonseca, pelos momentos de coragem e luta, fazendome a acreditar sempre na vitória.
vii
À Poliana Maria Moreira Fonseca pelos meus maiores presentes: Marcos
Vinícius, Pérola e Vitória Helena! Obrigada pelos momentos de alegria e
felicidades!
Ao Dr. Paulo Luiz de Sá Júnior pelo incentivo, apoio e carinho.
À Cláudia Dos Santos de Oliveira pela amizade desde a minha chegada em São
Paulo, pelos momentos de distração na caminhada a São José dos Campos, além
do companheirismo e incentivo a nunca desistir.
À Profa. Msc. Ana Maria Costa Carneiro pela oportunidade.
Agradeço também a todos os meus colegas da UNICASTELO, amigos e familiares
que contribuíram direto e indiretamente neste sonho e que mesmo distante torceram
pelo sucesso desta etapa!
OBRIGADA!
viii
"Aceitar-se como um ser humano
cheio de limites e fraquezas é acima de
tudo, sinal de equilíbrio,
paz consigo mesmo e felicidade ."
Pe. Fábio de Melo
ix
EFEITO BACTERICIDA DA OZONIZAÇÃO, SONICAÇÃO E
OZONIZAÇÃO/SONICAÇÃO EM Streptococcus mutans
RESUMO
O gás ozônio diluído em água tradicionalmente tem evidenciado resultados
significativos em termos de eliminação de micro-organismos patogênicos; condições
de temperatura da água e grau de pureza deste meio líquido tem mostrado
importante influência na dosagem do O3 para o desempenho biocida. O efeito
piezelétrico
atuante
no
sistema
limpador
ultrassônico,
também
evidencia
característica germicida interessante. Instrumentos odontológicos utilizados durante
o procedimento clínico apresentam significativo meio de contaminação cruzada, o
Streptococcus mutans é o responsável pela formação de cárie no dente, e
normalmente durante o tratamento dentário, este germe frequentemente fica
depositado na superfície do instrumento odontológico utilizado. Técnicas de
utilização de água ozonizada e do limpador ultrassônico foram utilizadas para a
higienização da cureta de raspagem odontológica. Streptococcus mutans foi
cultivado em meio de cultura microbiológico especifico, em que as curetas
odontológicas foram contaminadas, por método único. Este material foi submetido
nas técnicas de higienização de água ozonizada, e sistema limpador ultrassônico
sob condição individual e simultânea. Análise quantitativa microbiológica foi
realizada, e os resultados evidenciaram significativa diminuição dos microorganismos em cada técnica separada, ocorreu maior redução microbiológica
quando se utilizou as duas técnicas de O3 e ultrassom em situação simultânea, este
processo de higienização de instrumentais odontológicos, sugere viabilidade na
praticidade de higienização destes materiais.
Palavras-Chave: Ultrassom, ozônio, higienização clínica.
x
BACTERICIDE EFFECT OF OZONATION, SONICATION AND
OZONATION / SONICATION IN Streptococcus mutans
ABSTRACT
The ozone gas diluted in water has traditionally been shown to produce significant
results in terms of the elimination of pathogenic microorganisms. The temperature
conditions of the water as well as its purity have an important influence on the
dosage of O3 for sterilization purposes. The piezoelectric effect acting in the
ultrasonic cleaner system also presents interesting germicide characteristics. Dental
instruments used during the clinical procedures constitute important cross
contamination media. Streptococcus mutans is the etiologic agent of dental caries
and, normally, during dental treatment, it contaminates dental instruments.To analyze
the grade of disinfection of a surgical dental instrument using a process suitable for a
common clinical environment, using commercially available instruments.Using
ozonated water and an ultrasonic cleaner were employed for the hygienization of a
dental curette. Streptococcus mutans was grown in a selective medium and used to
contaminate the dental curettes through a single method. The curette was then
submitted to hygienization by ozonated water, by ultrasound, or both combined. The
quantitative microbial analysis was performed. Show that either method, used alone,
produced a significant microbial reduction, but the efficacy of both methods combined
was greater. This method of hygienization of dental instrumentation proved to both
viable and cheap.
Keywords: Ultrasound, ozone, clinical hygienization.
xi
LISTA DE ABREVIATURAS E SIGLAS
AIHA
MAS
AMSB
Atm
Au
BHI
CEP
DIFCO
DNA
EGM
H
HIV
IL-1
NaCl
nº
O2
O3
OH
OMS
OSHA
pH
PPM
RNA
S. mutans
SF 0,9%
TNF α
UFC
US
µg/mL
- Associação Americana de Higiene Industrial
- Ágar Mitis Salivarius
- Ágar Mitis Salivarius acrescido de Bacitracina
- Atmosfera
- Ouro
- Brain Heart Infusion
- Comitê de Ética em Pesquisa
- Difco Laboratories
- Ácido Desoxirribonúcleico
- Estreptococos do Grupo Mutans
- Hidrogênio
- Vírus da Imunodeficiência Humana
- Interleucina-1
- Cloreto de Sódio
- Número
- Oxigênio
- Ozônio
- Hidroxila
- Organização Mundial de Saúde
- Administração de Saúde e Segurança Ocupacional
- Potencial de hidrogênio
- Partículas por milhão, Equivalente a mg/L
- Ácido Ribonúcleico
- Streptococcus mutans
- Soro Fisiológico a 0,9%
- Fator de Necrose Tumoral Alfa
- Unidades Formadoras de Colônias
- Ultrassom
- Micrograma por mililitro
xii
LISTA DE FIGURAS
Figura 1: Placa bacteriana em dentes inferiores na região anterior e posterior ................... 20
Figura 2: Cálculo dental visto ao longo da linha da gengiva ................................................ 20
Figura 3: Macro e micromorfologia de colônias de Streptococcus mutans .......................... 26
Figura 4: Fluxo para os processos de limpeza e desinfecção de artigos contaminados ...... 28
Figura 5: Representação da formação do ozônio por descarga elétrica .............................. 35
Figura 6: Estrutura molecular do ozônio.............................................................................. 35
Figura 7: Representação do reator para a geração de ozônio pelo método de descarga
elétrica. ................................................................................................................................ 36
Figura 8: Mecanismo de ação do ozônio nos microrganismos: 1) Bactéria; 2) Parede celular
em contato com ozônio; 3) Oxidação da parede celular da bactéria; 4), 5) e 6) Ruptura e
destruição da bactéria.......................................................................................................... 39
Figura 9: Regiões de freqüência do som............................................................................. 40
Figura 10: Cavitação acústica ............................................................................................. 41
Figura 11: Ondas ultras-sônicas e processo de cavitação .................................................. 42
Figura 12: Cureta dentística. ............................................................................................... 45
Figura 13: Meio de cultura BHI no frasco de vidro identificado como positivo, com
crescimento bacteriano, turvação do meio e negativo, sem contaminação bacteriana......... 45
Figura 14: Frasco de vidro contendo SF0,9% com colônias e tubo numerado (1) da escala
Mac Farland. ........................................................................................................................ 46
Figura 15: Bico de Bunsen aceso e instrumentais com os seus respectivosbéquers, durante
a contaminação dos instrumentos........................................................................................ 46
Figura 16: Representação esquemática do tratamento realizado na cureta contaminada com
Streptococcus mutans, com aparelho de ultrassom. ............................................................ 47
Figura 17: A- Béquers e placas de Petri contendo o meio AMSB, e curetas embaladas em
papel crepado. B- Béquers e curetas contaminadas com as respectivas placas de Petri. ... 48
Figura 18: Aparelho gerador de ozônio: a) Fotografia do aparelho; b) Água sendo ozonizada
com pedra porosa em uma proveta 1000 mL. ...................................................................... 49
Figura 19: Colônias de S.mutans, gram positivas, microscopia com focal colorida. ............ 51
Figura 20: Placa contendo meio de cultura ágar sangue e contendocolônias de S.mutans
alfa e beta hemolíticos. ........................................................................................................ 51
xiii
Figura 21: Tratamento da bactéria S. Mutans com ozonização, concentração: 5 PPM,
temperatura da água: 18ºC .................................................................................................. 54
Figura 22: Relação em porcentagem da redução bacteriana após a ozonização
(concentração 5 PPM), nos tempos de 0,5, 1, 2, 3, 4, 5, 6 e 8 minutos ............................... 55
Figura 23: Relação em porcentagem da redução bacteriana após a ozonização/sonicação,
nos tempos de 0,5, 1, 2, 3 e 4 minutos ................................................................................ 56
Figura 24: Tratamento da bactéria S. Mutans com o híbrido ultrassom/ozonização (5 PPM
O3). Dose: concentração x tempo x energia. ........................................................................ 57
Figura 25: Placa de Petri contendo o meio de cultura Mitis Salivarius sacarosado e
bacitracina a 2%, e UFC de S. mutans. ............................................................................... 57
Figura 26: Fotografia digital do S. mutans utilizando microscópio confocal. Lâmina com o
biofilme formada a partir de meio de cultura específico para este micro-organismo. A- S.
mutans, microscopia confocal colorida; B- S.mutans, microscopia confocal preto e branco. 58
Figura 27: Meio de cultura Agar Sangue contendo colônias de S. mutans, com zonas
distintas de hemólise ao redor das colônias......................................................................... 58
Figura 28: Tratamento das colônias com ultrassom, mantendo uma distância de 4 cm entre
o fundo do béquer e a cuba do aparelho de sonicação, e IC50 = 20 minutos ........................ 59
Figura 29: Tratamento das colônias com ultrassom, mantendo uma distância de 0,5 cm
entre o fundo do béquer e a cuba do aparelho de sonicação, e IC50 = 7 minutos ................. 59
Figura 30: Tratamento das colônias com ozônio, concentração 5 PPM, temperatura da
água: 18ºC e IC50 = 18 segundos ......................................................................................... 60
Figura 31: Tratamento das colônias com o híbrido ultrassom + ozônio, e IC50 = 0,3 minuto
(18 segundos) ...................................................................................................................... 60
xiv
LISTA DE TABELAS
Tabela 1: Principais desinfetantes químicos e esterilizantes utilizados em artigos
odontológicos....................................................................................................................... 31
Tabela 2: Relação da temperatura e da solubilidade do ozônio em água. ........................... 37
Tabela 3: Número de Crescimento de S. mutans em UFC/mL após Sonicação, com
Distância de 0,5 cm entre o Cristal e o Béquer. ................................................................... 53
Tabela 4: Número de crescimento de S. mutans em UFC após exposição à água ozonizada
(5 PPM O3) em diferentes tempos ....................................................................................... 54
Tabela 5: Número de Crescimento de S. mutans em UFC após Exposição à Água
Ozonizada (5 PPM O3) e Ultrassom Simultaneamente, em diferentes Tempos ................... 56
xv
SUMÁRIO
1. INTRODUÇÃO................................................................................................................. 17
1.1. Objetivos......................................................................................................... 18
2. REVISÃO BIBLIOGRÁFICA............................................................................................. 19
2.1. Microbiota bucal e biofilme.............................................................................. 19
2.2. Relação entre doenças periodontais e cardiopatias ........................................ 22
2.3. Cárie ............................................................................................................... 23
2.4 Streptococcus mutans ..................................................................................... 25
2.5. Fluxo e processamento de instrumentos odontológicos .................................. 26
2.5.1. Limpeza ............................................................................................ 29
2.5.2. Enxague ............................................................................................ 29
2.5.3. Inspeção visual ................................................................................. 30
2.5.4. Secagem ........................................................................................... 30
2.5.5. Desinfecção ...................................................................................... 30
2.5.6. Esterilização ...................................................................................... 32
2.5.6.1. Processo físico ............................................................................... 32
2.5.6.2. Armazenamento dos instrumentos esterilizados............................. 33
2.5.6.3. Monitoramento da esterilização ...................................................... 34
2.6. Ozônio ............................................................................................................ 34
2.7. Ultrassom ....................................................................................................... 40
3. MATERIAIS E MÉTODOS ............................................................................................... 43
3.1. Sujeitos da pesquisa ....................................................................................... 43
3.2. Meios de cultura ............................................................................................. 43
3.3. Obtenção da amostra ..................................................................................... 44
3.4. Preparo das cuspensões dos micro-organismos............................................. 45
3.5. Contaminação dos instrumentais .................................................................... 46
3.6. Tratamento com ultrassom ............................................................................. 47
xvi
3.6.1. Semeadura .................................................................................................. 48
3.7. Ozonização da água ....................................................................................... 49
3.8. Tratamento com água ozonizada .................................................................... 50
3.9. Tratamento com água ozonizada + ultrassom ................................................ 50
3.10. Provas de identificação ................................................................................. 50
3.10.1. Prova da catalase............................................................................ 50
3.10.2. Coloração de Gram ......................................................................... 50
3.10.3. Prova hemólise ............................................................................... 51
3.11. Análise e apresentação dos dados ............................................................... 51
3.12. Considerações éticas.................................................................................... 51
4. RESULTADOS ................................................................................................................ 53
4.1. Avaliação do tempo de sonicação necessário para reduzir população/ colonias
da bactéria S. mutans .......................................................................................................... 53
4.2. Avaliação do tempo de água ozonizada necessário para reduzir as UFC do S.
mutans ................................................................................................................................. 54
4.3. Avaliação do tempo de ozonização e sonicação simultâneos necessários para
reduzir as UFCs do S. mutans ............................................................................................. 55
4.4. Identificação da bactéria S.mutans ................................................................. 57
5. DISCUSSÃO.................................................................................................................... 61
6. CONCLUSÃO .................................................................................................................. 68
REFERÊNCIAS BIBLIOGRÁFICAS ..................................................................................... 70
ANEXO A. TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO ............................... 78
ANEXO B. PROTOCOLO DE AUTORIZAÇAO DA PESQUISA EMITIDA PELO .P DA
UNICASTELO ...................................................................................................................... 79
17
1. INTRODUÇÃO
Muitos estudos têm demonstrado que o Streptococcus mutans está associado com a
cárie em seres humanos e que há uma correlação entre o número desta bactéria
presente na saliva, a manifestação clínica da doença e o risco ao desenvolvimento
da doença (BRATTHAL; HOSZEK; ZHAO,1996).
Em geral, a aquisição de micro-organismos pelo corpo humano ocorre por
contato direto entre hospedeiro e outro, ou através de objetos inanimados, como
chupetas e brinquedos (LI; CAUFIELD, 1995).
Um dos aspectos de extrema importância na biossegurança diz respeito à
esterilização do instrumental clínico. Jabur e Scabell (2002), afirmam que a
descontaminação de instrumentos impregnados com material ou fluido orgânico
proveniente do paciente é uma fase essencial no controle das infecções passíveis
de serem adquiridas na clínica odontológica.
O Ministério da Saúde determinou que equipamentos, instrumentos e
utensílios contaminados deveriam ser submetidos a alguns processos, como:
limpeza e desinfecção (BRASIL, 2000).
Os processos acima citados estão relacionados à biossegurança, um conjunto
de condutas e medidas técnicas, administrativas e educacionais que devem ser
empregadas por profissionais da área de saúde ou afins.
A evolução das pesquisas voltadas a aplicação do ozônio sob a forma
medicinal tem aumentado de forma significativa. O gás ozônio apresenta
características microbiocidas interessantes, por ser mais seguro e contundente do
que os desinfetantes convencionais agir sobre um grande número de microorganismos, incluindo patógenos resistentes. Além de ser reconhecido como seguro
por não gerar resíduos tóxicos. Quimicamente, o ozônio é arranjo molecular
triatômico e instável do oxigênio, que pode ser gerado pela excitação do oxigênio
molecular a oxigênio atômico, através de um ambiente eletricamente energizado que
permite a recombinação de átomos. É um potente agente oxidante (RICE, 2006).
O ultrassom é uma forma de energia que consiste de ondas mecânicas,
produzidas com freqüência além da sensibilidade normal do ouvido humano. Os
sons normalmente audíveis pelo homem possuem freqüências entre 8 a 20 kHz.
18
O ultrassom é usado na indústria para limpeza de materiais, solda de
plásticos, processos químicos, preparação de emulsão e suspensão, degaseificação
de solventes e avaliação não-destrutiva em materiais.
Os efeitos químicos e mecânicos de ultrassom são causados por bolhas de
cavitação que são gerados durante a pressão no período de ondas sonoras, que
provocam a morte bacteriana.
O propósito deste trabalho foi identificar o poder microbiocida com o
ultrassom e ozônio, e os dois simultâneos, em curetas contaminadas com
Streptococcus mutans aumentando o efeito antimicrobiano, e como consequência,
diminuindo o tempo de desinfecção do instrumental, redução dos resíduos tóxicos,
diminuição nos custos, inclusive energia elétrica, além de facilidades para a
desinfecção destes, para os colaboradores que utilizam este instrumental.
1.1. Objetivos
1. Verificar
o
desempenho
das
técnicas
de
ozonização,
sonicação
e
ozonização/sonicação simultaneamente, como potencial bactericida na
desinfecção
e
controle
microbiológico
em
instrumentais
clínicos
odontológicos.
2. Caracterizar a bactéria Streptococcus mutans no instrumental clínico
específico (cureta), após coleta de material do dente com lesão cariosa.
19
2. REVISÃO BIBLIOGRÁFICA
2.1. Microbiota bucal e biofilme
De acordo com os autores Simões, Araújo e Araújo (2008), a microbiota bucal
refere-se às diversas colônias de micro-organismos que colonizam a cavidade oral
desde o nascimento, sendo representada particularmente pelos Streptococcus
sobrinus; Streptococcus mutans; Streptococcus cricetus; Staphylococcus aureus;
Staphyloccus epidermides; Lactobacillos sp; Candida albicans; Candida tropicalis;
Prevotella
intermedia;
Prevotella
melaninogenica;
Porphyromonas
gingivalis;
Actinobacillus actinomycetemcomitans; Capnocytophaga gingivalis e Fusobacterium
nucleatum.
Normalmente a microbiota residente não causa doenças, porém um
desequilíbrio no estado de saúde geral, má higiene bucal, alimentação rica em
sacarose e outros dissacarídeos, levam ao crescimento excessivo destes microorganismos residentes, que por sua vez geram muitos metabólitos nocivos (ácidos:
aceticolático, succínico, fórmico, enzimas proteolíticas, endotoxinas) às celulase ao
próprio dente, causando à cavidade oral doenças infecciosas como: cáries,
periodontites, abscessos orofaríngeos, halitose, entre outras doenças.
A microbiota bucal tem relação direta com o meio ambiente onde o indivíduo
se encontra, e seu estabelecimento é dependente das exigências nutricionais e
físico-químicas dos micro-organismos (LUCAS; BEIGHTON; ROBERTS, 2000;
KONONEN et al., 2001).
Atualmente discutem-se várias estratégias para o controle da microbiota
bucal, visando à prevenção da cárie dental, dentre elas salienta-se a importância de
uma higiene correta, o uso de agentes antimicrobianos como a clorexidina e o flúor,
e principalmente, a prevenção da transmissão dos micro-organismos cariogênicos,
por meio de orientação e educação do núcleo familiar (NEWBRUN, 2002).
A gengivite, bem como a periodontite e a cárie são doenças infecciosas
causadas por bactérias que colonizam a superfície dos dentes, formando a placa
dental. Por este motivo a placa bacteriana é o fator etiológico primordial para o
desencadeamento do processo inflamatório e das cáries (JORGE, 1998;
KOLENBRANDER, 2000).
20
A placa bacteriana (Figura 1) é uma massa densa, não calcificada, constituída
por micro-organismos envolvidos numa matriz rica em polissacarídeos extracelulares
bacterianos e glicoproteínas salivares, firmemente aderida aos dentes, e outras
superfícies da cavidade bucal.
Figura 1: Placa bacteriana em dentes inferiores na região anterior e posterior.
Fonte: Navarro, Grázia e Michel (2007)
O tártaro é o resultado da mineralização da placa bacteriana ou biofilme
maduro. Após aproximadamente 21 dias, caso o biofilme bacteriano não seja
removido, há o estabelecimento de uma comunidade estável de bactérias. O cálculo
então forma-se a partir da mineralização da placa (Figura 2), com a participação da
saliva que contém íons de cálcio, e do dente, de onde a placa retira cálcio e fosfato
pela queda do pH.
Figura 2: Cálculo dental visto ao longo da linha da gengiva.
Fonte: Rosing e Loesche (2011)
Segundo Leite et al. (2001), o termo biofilme é usado para denominar
comunidades de micro-organismos aderidas sobre uma superfície dentária e sob a
ação contínua de um fluxo salivar. É a etapa inicial no desenvolvimento da cárie,
assim como de infecções periodontais. A formação do biofilme ocorre através de um
processo ordenado e dinâmico onde há a necessidade da fixação e proliferação de
21
bactérias sobre as superfícies dos dentes. A aderência bacteriana ao dente
representa
um
dos
primeiros
mecanismos
envolvidos
na
iniciação
do
desenvolvimento do biofilme dental (CARVALHO et al., 2006).
Os biofilmes podem ser formados por uma única ou por diferentes espécies
de micro-organismos. No seu processo de formação, uma comunidade microbiana
de multiespécies, com um patógeno predominante, interage com o hospedeiro,
dividindo espaço e recursos disponíveis com outros organismos oportunistas (LEITE
et al., 2001).
O biofilme dental é composto por um grupo heterogêneo de micro-organismos
e tende a se estabilizar com o passar do tempo. Essa homeostase bacteriana resulta
em um processo dinâmico nas interações microbianas (MARSH, 1989) e a atividade
metabólica causa flutuações de pH até mesmo em condições de repouso. Tais
flutuações de pH causam alterações no fluído do biofilme ou placa dental, resultando
em um distúrbio no equilíbrio na interface dente e placa, levando a intermitente
perda e ganho de minerais na superfície dental (MANJI et al., 1991).
Feres et al. (2004) demonstram a relação entre o biofilme e os múltiplos
determinantes biológicos que influenciam na possibilidade de desenvolvimento da
lesão,entre estes, encontra-se a composição do próprio biofilme, composição e
capacidade de tampão da saliva, velocidade da secreção salivar, composição e
frequência da dieta. Além dos fatores determinantes, existem outros que variam de
população para população, nos quais incluem os fatores sócio-econômicos,
educacionais e comportamentais.
A remoção mecânica do biofilme é um fator importante na prevenção da cárie
e doença periodontal. O biofilme dental é essencial na patogênese da cárie dental e
constitui o maior fator etiológico na gengivite crônica (MICHELIN et al., 2005).
A fluoretação tem eficácia de até 60% na redução das cáries, o mecanismo
pelo qual o flúor confere maior resistência ao esmalte dentário ocorre na superfície
dessa estrutura, ao longo de toda a vida, através de sucessivos episódios de
desmineralização e remineralização superficial, desencadeados pela queda de pH
decorrentes da produção de ácidos a partir de carboidratos. A presença contínua, ao
longo de toda a vida do indivíduo, de pequenas quantidades de flúor no meio bucal
é, portanto, indispensável para que o efeito preventivo se manifeste, com a formação
de fluoreto de cálcio na etapa de remineralização.
22
2.2. Relação entre doenças periodontais e cardiopatias
As doenças cardiovasculares constituem a principal causa de morte em populações
do mundo ocidental, apesar da tendência de declínio de sua incidência e da
mortalidade relatada em diversos países, incluindo o Brasil.
No Brasil, aproximadamente 260 mil indivíduos morrem por doenças
cardiovasculares por ano, e grande parcela dessa mortalidade é devida a eventos
coronarianos agudos (SOUZA; CARVALHO; MARTINS, 2010). Os fatores de risco
para aterosclerose e, conseqüentemente, para a doença arterial coronariana são
classificados em modificáveis e não modificáveis Entre os principais fatores de risco
modificáveis, salienta-se a hiperlipidemia, hipertensão arterial sistêmica, tabagismo e
diabetes melitus. Idade, sexo e história familiar estão entre os principais fatores de
risco não-modificáveis associados à cardiopatia isquêmica (STEELE et al., 2004).
Endotoxinas liberadas pelos micro-organismos bucais e pelos tecidos em
resposta à inflamação podem induzir a agregação plaquetária, causar danos nas
células endoteliais, proliferação do músculo liso e formação de ateromas, que
obstruem progressivamente o diâmetro dos vasos. As doenças periodontais
passaram a ser associadas a cardiopatias pelos seguintes motivos:
Já foi encontrado material genético de bactérias periodontais (como
Porphyromonas gingivalis e Prevotella intermedia) em placas de ateroma.
Acredita-se que na presença de infecção crônica na cavidade bucal, haja
liberação de produtos bacterianos na corrente circulatória, como é o caso das
endotoxinas, que estimulam o sistema imune a liberar uma série de citocinas
inflamatórias que poderão favorecer a formação de ateromas (ALMEIDA et
al., 2006).
Em indivíduos com doença periodontal são encontrados níveis aumentados
de proteínas da fase aguda, como fibrinogênio e proteína C reativa (PCR),
que estão associadas a um aumento do risco para as doenças
cardiovasculares.
Pode haver predisposição genética comum às duas patologias, pois alguns
pacientes apresentam uma resposta inflamatória aumentada na presença de
infecções.
A periodontite já apresentou relação com a hiperlipidemia através da liberação
de citocinas inflamatórias, como IL-1 e TNF-α.
23
Outra situação que pode provocar patologias cardíacas é através da
penetração na corrente circulatória de micro-organismos presentes na
cavidade bucal, o que pode provocar infecção em regiões distantes, como as
válvulas cardíacas, ocasionando a endocardite bacteriana (MICHELIN et al.,
2005).
Taylor et al. (2007) realizaram um estudo de intervenção em pacientes com
avançada periodontite que necessitavam extração completa das peças dentárias.
Doze semanas após a completa extração dentária observaram significativa redução
da proteína-C-reativa, inibidor do ativador do plasminogênio, contagem de plaquetas
e glóbulos brancos. Esse estudo demonstrou que a eliminação da periodontite
avançada, pela completa extração dentária reduz marcadores de risco inflamatórios
e trombóticos, suportando a hipótese de que o tratamento de doenças periodontais
pode reduzir o risco cardiovascular.
2.3. Cárie
A cárie dentária é uma doença multifatorial crônica, que progride lentamente na
maioria das pessoas. É considerada a doença mais comum entre as crianças,
representando um aspecto crítico das condições gerais de saúde além de influenciar
na qualidade de vida dos pacientes por causar dor e sofrimento (SOUZA FILHO;
CARVALHO; MARTINS, 2010). É definida como um processo de dissolução do
esmalte ou de dentina, causada pela ação bacteriana na superfície do dente,
mediado por um fluxo físico-químico de íons dissolvidos em água (FERES et al.,
2004).
A cárie é um grande problema de saúde pública devido aos altos custos do
tratamento e medidas preventivas para evitá-la (FEJERSHOV; KIDD, 2005). Ocorre
na presença de micro-organismos na superfície dental, contudo, a simples presença
destes, não é suficiente para o desenvolvimento da doença.
A flora bacteriana associada a lesões de cárie é muito complexa e altamente
diversificada entre diferentes lesões (BECKER et al., 2002; MARSH; NYVAD, 2003).
A frequente presença de carboidratos fermentáveis e a microbiota residente na
cavidade bucal são fatores importantes para o seu desenvolvimento devido à
fermentação dos carboidratos e produção de ácidos pelas bactérias do biofilme
presente sobre a estrutura dentária. A cárie possui uma etiologia multifatorial, ou
24
seja, é causada pela associação de três fatores primários causais: o hospedeiro, a
microbiota e a dieta juntamente com o fator secundário, o tempo (NEWBRUN, 2002).
A multiplicidade de variáveis que condiciona a existência ou não desta
doença, influi também no ritmo e velocidade de sua evolução. O desenvolvimento
econômico, as políticas públicas, o nível educacional da população, assim como
padrões de cultura e de tradição popular, entre outras, interferem na formação de
hábitos alimentares e nas condutas de higiene pessoal e coletiva, que podem
proporcionar a ocorrência de outras doenças (FADEL, 2009).
Nos países desenvolvidos tem ocorrido declínio na prevalência e severidade
da cárie, devido principalmente ao aumento da exposição ao flúor, modificações no
padrão e na quantidade do consumo de açúcar, maior acesso aos serviços
odontológicos e ampliação da educação em saúde bucal. Em contrapartida, em
países subdesenvolvidos observa-se o inverso, uma vez que a condição sócioeconômica da população tem influência direta na prevalência da doença, havendo
além disso, necessidade de medidas sociais, e não apenas de mudanças dos
hábitos individuais (RIBEIRO; OLIVEIRA; ROSENBLATT, 2005). O flúor e o açúcar
são duas variáveis importantes que podem alterar positivo ou negativamente a
prevalência da cárie.
A cárie dentária é uma doença mediada por desmineralização dos dentes. Se
não for tratada, leva à cavitação, dor, desconforto e eventual perda de dentes
(DUAILIBE; GONCALVES; AHID, 2007).
A prevenção é a maneira mais econômica e eficaz de se evitar o aparecimento e
desenvolvimento dessas doenças. Dentro das várias atividades preventivas, a educação e a
motivação do indivíduo são medidas tomadas com o objetivo de mudar hábitos e
comportamentos, no sentido de promover a saúde e melhorar a higiene bucal do paciente.
A fluoretação das águas de abastecimento público é considerada o método de
prevenção de cáries mais efetivo em termos de abrangência coletiva. Além disso,
trata-se de uma medida simples, econômica, segura e eficaz. Graças a essa
medida, associada ao uso de dentifrícios fluoretados e aos programas preventivos
implantados nos municípios, o país experimenta uma redução da prevalência de
cárie (BARBEAU; NADEAU, 1997).
25
2.4 Streptococcus mutans
Apesar da grande diversidade de espécies de micro-organismos que colonizam a
cavidade bucal, os Streptococcus mutans, destacam-se como o agente etiológico da
cárie em humanos e animais, não sendo, porém, os únicos micro-organismos
envolvidos no processo cariogênico (LUCAS; BEIGHTON; ROBERTS, 2000). Foram
descritos pela primeira vez em 1924, quando Clarke isolou micro-organismos de
lesões de cárie de dentes humanos e os denominou de Streptococcus mutans
devido à morfologia mais ovalada das colônias, aparentando ser uma forma mutante
de estreptococos. A partir de 1956, esses micro-organismos foram "redescobertos" e
demonstraram ser capazes de causar cárie dental em roedores.
São cocos gram positivos, anaeróbios facultativos, catalase negativa,
microaerófilos, acidogênicos, e capazes de formar polissacarídeos extracelulares. A
maioria das cepas é alfa-hemolítico, mas ocasionalmente cepas beta-hemolíticas
são encontradas.
A caracterização preliminar dos estreptococos pode ser realizada através da
determinação da hemólise (KONEMAN et al., 2001). Ao contrário de muitos outros
estreptococos orais que fermentam apenas pequena quantidade de carboidratos, o
grupo do S. mutans fermenta diversos açúcares. Em particular, sua capacidade de
fermentar o manitol e o sorbitol, permite diferenciá-los dos demais estreptococos
orais (SIMÕES; ARAÚJO; ARAÚJO, 2008).
A situação taxonômica dos estreptococos cariogênicos está bem definida no
“Estreptococos do Grupo Mutans” (EGM). Existem sete espécies que estão incluídas
no EGM: S. mutans, S. sobrinus, S. cricetus, S. rattus, S. ferus, S. macacae, S.
downei. Das espécies citadas, o S. mutans e S. sobrinus apresentam potencial
cariogênico em humanos. As outras espécies são encontradas em animais e, se
estão presentes em humanos, não parecem ser altamente cariogênicas (EMILSON,
1983).
O primeiro habitat de S. mutans é a superfície dentária, podendo ser
encontrado também nas fezes (MECA et al., 2009). É cariogênico em modelos
experimentais de ratos, hamsters e macacos, estando associado com a cárie dental
em humanos (SÁNCHEZ; SÁENZ, 2001).
O meio de cultura mais frequente utilizado para o isolamento primário de
S.mutans é o ágar mitis salivarius (AMS) com adição de sacarose e bacitracina
26
(GOLD; JORDAN; HOUTE, 1973), formam colônias pequenas, com bordas
irregulares, fortemente aderidas ao meio. Com adição de sacarose ao ágar, muitas
linhagens de S. mutans produzem colônias cerca de 1 mm de diâmetro, Figura 3.
A
B
Figura 3: Macro e Micromorfologia de Colônias de Streptococcus mutans. Legenda: Micromorfologia
(A) característica de S. mutans, coloração de gram. Características macro (B) das colônias em ágar
mitis salivarius, com adição de sacarose e bacitracina.
Fonte: Vasconcelos et al. (2006)
Meca et al. (2009) evidenciou altas concentrações do EGM em áreas de cárie
incipiente de esmalte, quando comparadas com áreas adjacentes saudáveis.
Estudos microbiológicos demonstram que o S. mutans é um dos fatores
necessários para o início e a progressão da lesão cariosa em crianças, logo após a
erupção dos primeiros dentes decíduos. S. mutans é amplamente distribuído, não
apenas em populações de moderada ou alta incidência de cárie, como também em
populações que não apresentam ou têm baixo índice da doença, mostrando que a
simples colonização por estes micro-organismos não implica no desenvolvimento de
cárie (DUAILIBE; GONCALVES; AHID, 2007).
Durante seu processo evolutivo, S. mutans desenvolveu fatores que
determinam sua cariogenicidade ou virulência, como o sistema enzimático para o
metabolismo da sacarose, substância mais cariogênica consumida pelos seres
humanos.
2.5. Fluxo e processamento de instrumentos odontológicos
A prática da odontologia abrange inúmeros procedimentos, e durante esta prática,
agentes infecciosos podem ser transmitidos aos pacientes e profissionais por
27
diferentes vias: contato direto com lesões infecciosas, sangue e saliva contaminada;
contato indireto, mediante transferência de micro-organismos presentes em objetos
contaminados; respingos de sangue, saliva e/ou secreções nasofaríngeas,
diretamente em feridas de pele e mucosa; e principalmente, pela transferência de
micro-organismos por aerossóis (BRASIL, 2000).
Apesar de grande parte das infecções relacionadas à assistência a saúde
serem causadas por micro-organismos da microbiota do próprio indivíduo, as
infecções de origens exógenas merecem à atenção dos profissionais de saúde. O
descumprimento de boas práticas de prevenção e controle de infecção são os
principais responsáveis pelas iatrogenias infecciosas (GRAZIANO; GRAZIANO,
2000).
Os riscos biológicos estão representados pelos micro-organismos e podem
afetar pacientes e/ou profissionais de saúde. Porém, muitas vezes nem mesmo o
paciente está ciente desta condição ou às vezes é um portador crônico, ou ainda
está em período de incubação da doença. Sendo assim todo material proveniente de
serviço de saúde que entrou em contato com sangue ou invadiu tecidos subepiteliais
é considerado de risco biológico, portanto, infectante (BLOCK, 2001).
Muitos dos instrumentos utilizados na prática diária dos dentistas são de aço
inoxidável,
estando
constantemente
expostos
à
contaminação
durante
os
procedimentos clínicos.
O processamento de artigos compreende a limpeza e a desinfecção e/ou
esterilização, esses processos devem seguir o fluxo descrito na Figura 4 abaixo, de
modo a evitar o cruzamento de artigos não processados (sujos) com artigos
desinfetados ou esterilizados (limpos).
28
Instrumento Contaminado
↓
Exposição agente de limpeza
↓
Enxague
↓
Secagem
↓
Inspeção visual
↓
Preparo e embalagem
↓
Desinfecção/Esterilização
↓
Armazenamento
Figura 4: Fluxo para os processos de limpeza e desinfecção de artigos contaminados.
O cuidado com instrumentais odontológicos é relatado por Brasil (2000) que
preconiza a esterilização, como melhor conduta para o controle de infecção de
instrumentais metálicos, embora seja necessária a realização de um correto
processamento do instrumental contaminado antes da esterilização, visando
redução de sujidades e resíduos orgânicos, e subsequente diminuição do risco de
infecção ocupacional.
29
2.5.1. Limpeza
A limpeza é a remoção mecânica de sujidades, com o objetivo de reduzir a carga
microbiana, a matéria orgânica e os contaminantes de natureza inorgânica, de modo
a garantir o processo de desinfecção e esterilização e a manutenção da vida útil do
artigo. Estudos têm demonstrado que a limpeza reduz aproximadamente 105 UFC
do conteúdo microbiano presente nos artigos e superfícies (RUTULA, 1996).
A limpeza deve ser realizada imediatamente após o uso do instrumento.
Pode-se fazer a imersão em solução aquosa de detergente com pH neutro ou
enzimático, usando uma cuba plástica, mantendo os instrumentos totalmente
imersos para assegurar a limpeza adequada.
O preparo da solução e o tempo de permanência do material imerso devem
seguir as orientações recomendadas pelo fabricante.
A limpeza pode ser manual, por meio de ação física aplicada sobre a
superfície do instrumento, usando:
a) Escova de cerdas macias e cabo longo;
b) Escova de aço para brocas;
c) Escova para limpeza de lúmen;
d) Pia com cuba profunda específica para este fim e preferentemente com
torneira com jato direcionável;
e) Detergente e água corrente.
Ou pode ser limpeza mecânica, quando o procedimento é automatizado para
a remoção de sujidade por meio de lavadoras com jatos de água ou lavadoras com
ultrassom de baixa frequência, que operam em diferentes condições de temperatura
e tempo. Esse tipo de limpeza diminui a exposição dos profissionais aos riscos
ocupacionais de origem biológica, especialmente, aos vírus da hepatite e HIV
(BRASIL, 2000).
2.5.2. Enxague
Deve ser realizado em água potável e corrente, garantindo a total retirada das
sujidades e do produto utilizado na limpeza. A qualidade da água tem relação com a
durabilidade do instrumental, sendo recomendado que o último enxague seja feito
30
com água livre de metais pesados. Os artigos que contêm lúmen devem ser
enxaguados com bicos de água sob pressão (BRASIL, 1999).
2.5.3. Inspeção visual
Serve para verificar a eficácia do processo de limpeza e as condições de integridade
do instrumento. Se necessário, deve-se proceder novamente à limpeza ou à
substituição deste (FERREIRA et al., 2001).
2.5.4. Secagem
Deve ser criteriosa para evitar que a umidade interfira nos processos e para diminuir
a possibilidade de corrosão dos artigos. Pode ser realizada com a utilização de pano
limpo e seco, exclusivo para esta finalidade, secadora de ar quente/frio, estufa
regulada para este fim e/ou ar comprimido medicinal (GANDINI et al., 1997).
2.5.5. Desinfecção
A desinfecção é definida como um processo físico ou químico que elimina a maioria
dos micro-organismos patogênicos de objetos inanimados e superfícies, com
exceção de esporos bacterianos.
Block (2001), classifica a desinfecção como sendo de baixo, médio e alto
nível. Existem diversos produtos para desinfecção que devem possuir registro junto
ao Ministério da Saúde e necessitam ser avaliados com relação ao custo benefício,
a eficácia e ao artigo a ser processado, vide Tabela 1 a seguir.
31
Tabela 1: Principais desinfetantes químicos e esterilizantes utilizados em artigos odontológicos.
Desinfetante
Características
Indicações
Desvantagens
Álcool 70% (etíllico
Ação rápida, fácil
Desinfecção de nível
Inflamável, resseca
e isopropílico
aplicação, viável
médio de artigos e
plástico e opacifica
para artigos
superfícies
artigos acrílicos
metálicos
Cloros e Composto
Em forma líquida ou
Desinfecção de nível
É corrosivo para
Cloratos
sólida; ação rápida e
médio de artigos e
artigos e superfícies
baixo custo
superfícies e
metálicas; irrita
descontaminação de
mucosas; odor forte
superfícies
Glutaraldeído
Não danifica
Esterilização e
Irritante para
instrumentais,
desinfecção de alto
mucosas e pele
plásticos; atividade
nível
(olhos, nariz,
germicida em
garganta, etc.)
presença de matéria
Plasma de Peróxido
É realizada através
Esterilização de
Alto custo do
de Hidrogênio
de equipamento
artigos sensíveis ao
equipamento
automatizado e
calor e a umidade
computadorizado
Ácido Peracético
Não forma resíduos
Formulações
Instável após a
tóxicos
associadas a
diluição
peróxido de
hidrogênio
Óxido de Etileno
Processo de
Esterilização de
Tóxico para pele e
esterilização
artigos
mucosas
combinado ao calor
termossensíveis
úmido da autoclave
Fonte: Brasil (1999)
A realização de desinfecção química dos instrumentos metálicos é
notadamente eficiente como medida de segurança no contágio de doenças
infecciosas na área da saúde.
A efetividade dos procedimentos de desinfecção de instrumentais, visando
diminuição de agentes contaminantes oriundos principalmente de saliva e sangue,
está relacionada com uma adequada seleção do agente químico. Para tanto, o
produto químico escolhido deve realizar, efetivamente, a função de desinfecção,
32
sem alterar a superfície do material, não apresentando inclusive toxidade para o
manipulador.
2.5.6. Esterilização
A esterilização consiste na eliminação ou destruição, completa de todos os tipos de
micro-organismos, estando eles na forma vegetativa ou esporulada (CENTERS FOR
DISEASE CONTROL, 1993). Para garantir a esterilização, é fundamental que os
passos já citados do processamento de instrumentos sejam seguidos corretamente
(BRASIL. MINISTÉRIO DA SAÚDE, 2000).A esterilização pode ocorrer pelos
seguintes métodos:
Métodos Físicos: Calor úmido e seco;
Filtração;
Radiação: Ionizante e Não – Ionizante;
Métodos químicos: Compostos fenólicos, alcoóis, óxido de etileno,
halogênios, peróxido de hidrogênio, etc.
Na odontologia, os processos de esterilização indicados são:
a) Físicos: utilizando-se o vapor saturado sob pressão (autoclave);
b) Químicos: utilizando-se soluções de glutaraldeído a 2% e de ácido
peracético a 0,2%.
A esterilização química deve ser utilizada em instrumentais que não
apresentam resistência com relação à variação de temperatura, ou seja, apenas
quando não houver outro método que a substitua (BRASIL, 1994).
2.5.6.1. Processo físico
Realizado em autoclave, onde os micro-organismos são destruídos pela ação
combinada da temperatura e pressão, que promove a desnaturação das proteínas
da estrutura genética celular.
Os padrões de tempo, temperatura e pressão para esterilização pelo vapor
variam de acordo com o aparelho e encontram-se dentro de: 121° C a 127° C (1 atm
de pressão) por 15 a 30 minutos e 132°C a 134°C (2 atm de pressão) por quatro a
sete minutos de esterilização.
33
Atualmente, a esterilização em estufas (calor seco) é recomendada por
instituições nacionais e internacionais apenas para óleos e pós na área médica e
para alguns tipos de brocas e alicates ortodônticos na odontologia (CENTERS FOR
DISEASE CONTROL, 2003). Estas indicações se justificam pelo fato do processo
exigir longo período de tempo e altas temperaturas, podendo ocorrer falhas no
processo de esterilização. Os equipamentos utilizados atualmente nos serviços
odontológicos não são automatizados, não permitem registros confiáveis dos
parâmetros físicos do processo, são susceptíveis a interrupção do processo e o
monitoramento biológico é complexo.
Lima et al. (1990), analisando seis estufas nacionais, verificaram que as
temperaturas indicadas pelo termômetro das mesmas não eram reais, sendo sempre
superiores a demonstrada no interior da estufa. Além disso, relataram que o tempo
de aquecimento da estufa até atingir a temperatura máxima, variava em torno de 30
a 40 minutos.
A esterilização pode não ser um processo eficiente, principalmente por
envolver erro operacional. Dos processos comuns (óxido de etileno, glutaraldeído,
formaldeído, ácido peracético e plasma de peróxido de hidrogênio), mais da metade
exige emprego de funcionários preparados e treinados, acarretando alto custo de
operação e risco de falha humana.
A autoclave convencional, à base de vapor d'água, utiliza a alta temperatura e
pressão como formas de esterilização. Além de consumir muita energia elétrica
apresenta riscos, pois sua alta pressão de operação pode acarretar explosões
(LINGER et al., 2001).
2.5.6.2. Armazenamento dos instrumentos esterilizados
O instrumental deve ser armazenado em local exclusivo, separado dos demais, em
armários fechados, protegido de poeira, umidade e insetos, e deve haver uma
distância mínima de 20 cm do chão, 50 cm do teto e 5 cm da parede, respeitando-se
o
prazo
de
validade
da
esterilização
(SOCIEDADE
ENFERMEIROS DE CENTRO CIRÚRGICO, 2001).
BRASILEIRA
DE
34
2.5.6.3. Monitoramento da esterilização
O processo de esterilização deve ser comprovado por meio de monitoramento físico,
químico e biológico. O monitoramento biológico deve ser registrado, juntamente com
a data da esterilização, lote, validade e equipamento utilizado (FERREIRA et al.,
2001).
2.6. Ozônio
Durante os últimos anos, o ozônio tem sido apresentado como um agente
antibacteriano alternativo. Tem sido reconhecido como um forte e eficaz atuador
biocida (SHARMA; HUDSON, 2008). A maioria dos artigos publicados considerando
o uso de ozônio em odontologia tem sido em relação a seus efeitos antimicrobianos
(BAYSAN; LYNCH, WHILEY, 2000; NAGAYOSHI et al., 2004; POLYDOROU; PELZ;
HAHN, 2006) e cárie (BAYSAN; BEIGHTON, 2007; BAYSON; LYNCH, 2006).
O tratamento com ozônio poderia reduzir drasticamente o número total de
micro-organismos e reverter à maior parte de lesões da raiz cariada. Polydorou et al.
(2011), mostrou que o tratamento com ozônio resultou em redução significativa da
quantidade de S. mutans em cavidades de cárie em relação ao grupo controle.
O efeito antimicrobiano do ozônio pode ocorrer através de um mecanismo que
envolve a ruptura das membranas dos micro-organismos (BOCCI et al., 1998;
YAMAYOSHI; TATSUMI, 1993)
É provável que o ozônio interfira no metabolismo celular da bactéria, através
da inibição e bloqueio do funcionamento enzimático. Uma quantidade suficiente de
ozônio pode romper a membrana celular, e isto leva à destruição da bactéria.
Lezcano et al. (1999), afirma que não só a concentração na aplicação de ozônio,
mas também a dose utilizada, desempenham um papel importante em seu efeito
antibacteriano.
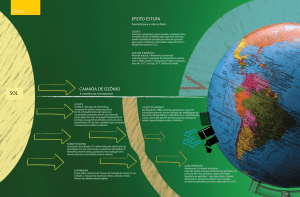
Este gás é encontrado de forma natural nas camadas superiores da
atmosfera, que fica aproximadamente entre 25 e 35 km de altura, com importante
papel de absorver a radiação ultravioleta dos raios solares, extremamente
prejudiciais ao homem (GARDUÑO GARDUÑO et al., 1995). O ozônio pode ser
produzido por geradores específicos, sendo que o método de produção é realizado
através da associação de um átomo de oxigênio com uma molécula de oxigênio
35
(O2), expressa por O + O2, o ozônio (O3), Figura 5. Esta molécula instável pode ser
gerada pela passagem de uma descarga elétrica através do oxigênio puro (BRADY;
HUMISTON, 1996; KIRCHHOFF, 2002).
Figura 5: Representação da formação do ozônio por descarga elétrica.
Fonte: Kim, Yousef e Chism (1999)
O ozônio é um gás produzido naturalmente na atmosfera terrestre, reativo e
capaz de oxidar metais como ferro, chumbo e arsênio, após várias pesquisas
concluíram-se que o ozônio tem um papel ainda mais importante, utilizando-o como
um eficaz desinfetante durante epidemias infecciosas (INSTITUTO NACIONAL DE
PESQUISAS ESPACIAIS, 2006). Suamolécula contém três átomos de oxigênio
(Figura 6).
Figura 6: Estrutura molecular do ozônio.
Fonte: Rakovsky, Anachkov e Zaikov (2009)
Atribui-se a descoberta do ozônio, ao químico Christian Friedrich Schonbein
que em meados do século XIX, observou que após descargas elétricas na atmosfera
havia um odor, “notado também quando a água era decomposta por uma corrente
36
voltaica”. Schonbein acreditou que esse odor poderia ser atribuído à existência de
um gás atmosférico de odor peculiar (SHELDON; BROWN, 1996).
Cardoso (2006), dentre os processos utilizados para a geração de ozônio,
relata:
[...] o método de descarga dielétrica por efeito corona, vêm
sendo
atualmente
utilizado
em
praticamente
todos
os
ozonizadores disponíveis industrialmente (Figura 7). Através
deste método, o ozônio é gerado pela passagem de oxigênio
puro entre dois eletrodos, a uma elevada diferença de potencial
elétrico, causando dissociação de oxigênio, sendo a formação
do ozônio consequência da recombinação de espécies radicais
de oxigênio com moléculas de oxigênio presentes no sistema.
A concentração do ozônio vai depender da composição do gás
empregado na produção (O2 ou ar), frequência, fluxo de
distribuição do sistema e voltagem aplicada nos eletrodos.
Figura 7: Representação do reator para a geração de ozônio pelo método de descarga elétrica.
Fonte: Cardoso (2006)
A taxa de solubilização do ozônio em meio líquido, depende do tamanho das
bolhas do gás que borbulham na água, pois quanto menores as bolhas formadas,
maior a superfície de contato, favorecendo desta forma a probabilidade de
transferência do gás para a água. O tamanho mais adequado deve variar entre 1 e
3mm de diâmetro.
A estabilidade do ozônio em água aumenta com a acidificação e redução de
temperatura, demonstrado na Tabela 2.
37
Tabela 2: Relação da temperatura e da solubilidade do ozônio em água.
Temperatura (ºC)
Solubilidade (litros ozônio/litros água)
0
0,640
15
0,456
27
0,270
40
0,112
60
0,000
Fonte: Rice, 2006
O ozônio é cerca de 50% mais denso que o oxigênio, apresenta-se como um
gás incolor, tem massa molecular igual a 48, liquefaz-se a -112°C, possui ponto de
congelamento de -251,4°C, e sua decomposição ocorre rapidamente, pode
apresentar característica de reação explosiva em temperaturas acima de 100°C
(BAYSAN; WHILEY; LYNCH, 2000).
Velano et al.
(2001); Haas; Kaymak (2003), relatavam que a ação
antimicrobiana do ozônio depende da relação de sobrevivência do micro-organismo
com o tempo de exposição a este gás, intimamente associado à concentração inicial
de micro-organismos e a concentração do ozônio, e também da velocidade de
dissipação destes expostos a água ozonizada.
Os primeiros usos do ozônio, como agente sanitizante na indústria alimentícia,
são registrados na literatura desde o início do século 20, sendo utilizado na
preservação de alimentos e ingredientes no continente europeu (KIM; YOUSEF;
CHISM, 1999). Comercialmente, foi utilizado pela primeira vez em 1907, em Nice
(França), no tratamento de água potável do município e, em 1910, em Saint
Petesburg (Rússia) (NASCIMENTO; LIMA; VALLE, 2005).
O ozônio tem sido utilizado como uma alternativa de baixo custo, confiável,
prático e com poucos efeitos colaterais no tratamento de várias doenças em
humanos e animais, desde que obedeça a dosagem correta para o objetivo
específico, ressalta-se também a sua aplicação na descontaminação bacteriana,
fúngica e viral de fluidos, objetos, alimentos e ambientes.
38
Na Odontologia, o ozônio pode ser empregado em processos de esterilização
de instrumentais e purificação do sistema de irrigação do equipo, servindo como
uma ótima estratégia no controle e prevenção de infecções cruzadas no ambiente
odontológico e no tratamento de diversas doenças orais, obtendo resultados
superiores em comparação às terapias convencionais (SALVADOR et al., 2006).
De acordo com Greene et al. (1993), o ozônio é efetivo na destruição de
bactérias e vírus, em pH variando de 5,6 a 9,8. Segundo o mesmo autor, quando
comparada à cloração, a ozonização possui custo baixo, não requer calor e não
deixam resíduos como os clorados.
O ozônio ataca primeiro a membrana bacteriana pelos glicolipídeos ou
aminoácidos como o triptofano e atua também nos grupos sulfidrilas de certas
enzimas. A morte bacteriana é rápida e é frequentemente atribuída a mudanças na
permeabilidade celular seguida pela lise celular, o que basicamente diferencia o
ozônio de outros agentes desinfetantes é seu mecanismo de destruição dos microorganismos (BOCCI, 2000).
O cloro, especificamente, atua por difusão através da parede celular, agindo
sobre os elementos vitais localizados no interior da célula, como enzimas, proteínas,
DNA e RNA. O ozônio, por apresentar uma capacidade de oxidação superior, age
diretamente na parede da célula, causando sua ruptura e morte em menor tempo de
contato, inviabilizando a recuperação dos micro-organismos após o ataque (Figura
8). Com isso, dependendo do tipo de micro-organismo, o ozônio pode agir até 3.125
vezes mais rápido do que o cloro na inativação celular.
A diminuição do crescimento de organismos na água ozonizada se deve
também ao aumento do oxigênio nela dissolvido e disponível. Sua alta capacidade
de remoção de compostos orgânicos através da parcial oxidação é um atributo
importante na atuação bactericida (GUIRQUIS; PROBER; SLOUGH, 1978).
39
Figura 8: Mecanismo de ação do ozônio nos microrganismos: 1) Bactéria; 2) Parede celular em
contato com ozônio; 3) Oxidação da parede celular da bactéria; 4), 5) e 6) Ruptura e destruição
da bactéria.
Fonte: Snatural & Naturaltec (2013)
De acordo com Korol et al. (1995), a destruição microbiana se reduz quando
tanto as formas vegetativas quanto os esporos estão acompanhados de substâncias
orgânicas que atuariam como protetoras, não só para limitar a penetração do
desinfetante, mas também no caso do ozônio, porque os radicais livres formados por
este elemento reagem com as substâncias mencionadas antes de alcançar os
micro-organismos.
Embora estudos demonstrem que o consumo de alimentos tratados com
ozônio não causa qualquer efeito tóxico à saúde humana e de animais, é importante
que haja o monitoramento e proteção das pessoas que trabalham na manipulação
dessa substância na indústria e em outras atividades. Por ser volátil, o gás ozônio
pode afetar o sistema respiratório e causar sintomas de toxidade, como cefaléia,
tontura, sensação de queimação na região dos olhos, irritação da garganta e tosse.
Em baixas concentrações, o ozônio não provoca sinais de toxicidade, mas em altas
concentrações pode ser fatal aos humanos (BOOT, 1991).
O processo de esterilização por ozônio consiste em encaminhar oxigênio
concentrado para geradores de ozônio sob condições controladas. O ozônio gerado
passa por reatores, sendo em seguida encaminhado para uma câmara de
esterilização. Após o preenchimento da câmara até determinada pressão, o ozônio é
retirado e destruído. Após determinado número de ciclos, o material colocado na
câmara de esterilização estará esterilizado (KIM; YOUSEF; CHISM, 1999).
40
2.7. Ultrassom
Nos últimos anos vem aumentando a utilização do ultrassom em reações orgânicas.
Isto ocorre devido às vantagens que essa ferramenta proporciona como a redução
do tempo de reação, do consumo de energia, na quantidade de solventes e aumento
do rendimento das reações.
O ultrassom tem uma frequência característica num intervalo acima de 20
kHz, sendo que a sensibilidade do ouvido está na faixa de 10 Hz a 18 KHz (Figura
9). O que torna o ultrassom uma ferramenta tão poderosa é o fenômeno físico da
cavitação, baseado no processo de criar, aumentar e implodir cavidades de vapor e
gases.
Figura 9: Regiões de freqüência do som.
Fonte: Cravotto; Cintas (2006)
O limite superior da frequência de ultrassons é de 5 MHz para gases e 500
MHz para líquidos e sólidos. A sua aplicação é dividida em duas áreas: alta
frequência e baixa intensidade (2-10 MHz), aplicada em diagnóstico médico e
análise química, e baixa frequência e alta intensidade (20-100 kHz), normalmente
usada para limpeza, soldadura e sonoquímica (NASCIMENTO; LIMA; VALLE, 2005).
Os equipamentos de ultrassom são fabricados pelo acoplamento de um ou
mais cristais piezelétricos na parte inferior de um reservatório metálico para líquido,
preferencialmente construído em aço inoxidável.
Conforme Williams (1990) é vasta as aplicações de ondas de ultrassom, que
vão desde homogeneização de substâncias, rompimento de células, extração de
produtos fitoquímicos, esterilização de equipamentos, localização de mineral,
emulsificação, até degradação de massa molar e fonoforese (ação do ultrassom
para facilitar a penetração de agentes farmacologicamente ativos através da pele).
41
Experiências realizadas por Scherba, Weigel e Brien (1991), mostraram a
eficiência da ação germicida da energia ultrassônica, a uma freqüência de 26000 Hz
aplicada em suspensões aquosas de bactérias.
Os efeitos químicos e mecânicos de ultrassom são causada por bolhas de
cavitação que são gerados durante a pressão e descompressão durante a
propagação das ondas sonoras.
Segundo Guirro (1999), a cavitação gerada pelo US pode induzir fenômenos
elétricos, químicos e cisalhamento mecânico. Isto acontece quando neste último as
cavidades se colapsam ou quando as bolhas de gás crescem, até ficarem
suficientemente grandes para vibrar em ressonância com as ondas sonoras e
romperem-se.
A
cavitação
produz
intensas
ondas
de
choque,
aumentos
instantâneos de temperatura e pressão, e efeitos químicos no meio, que são
gerados pelo colapso das cavidades ou microbolhas.
A cavitação é a formação de cavidades ou bolhas no meio líquido contendo
quantidades variáveis de gás, vapor ou ambos, conforme mostra a Figura 10
(BELLO, 2003).
Outro fenômeno citado por Korn, Pereira e Borges (2005), é que no colapso
das bolhas há liberação de energia que pode romper as ligações moleculares
provocando a produção de radicais livres H e OH altamente reativos e, como
conseqüência, causar mudanças químicas.
Figura 10: Cavitação acústica.
Fonte: Korn, Pereira e Borges (2005)
Os equipamentos de limpeza ultrassônica convertem ondas sonoras de ultra e
alta frequência em vibrações mecânicas que se propagam na água criando bolhas
microscópicas, representados na Figura 11 (AMMI, 2010).
42
Figura 11: Ondas ultras-sônicas e processo de cavitação.
Fonte: Martines, Davolos e Jafelicci Júnior (2000)
A temperatura no interior e na zona de cavitação poderá ser superior a
5000ºC e a 2000ºC respectivamente (SUSLICK; GRINSTAFF, 1990; SUSLICK,
1990).
43
3. MATERIAIS E MÉTODOS
3.1. Sujeitos da pesquisa
A amostra deste estudo foi constituída por 20 voluntários com idade entre 18 e 35
anos, de ambos os sexos. Os indivíduos em tratamento odontológico foram
selecionados por um professor, diretor de uma Clínica Odontológica, e responsável
pela disciplina de dentística no curso de odontologia em uma instituição de ensino
na cidade de São Paulo.
Foram incluídos neste estudo, clientes que possuíam cárie no dente molar
inferior, por serem os dentes mais frequentemente atingidos pela cárie.
Foram excluídos clientes em uso de antibioticoterapia e que usavam aparelho
ortodôntico, e ainda aqueles que não possuíam cárie neste dente específico, e
também os que possuíam cárie, porém não concordaram em participar da pesquisa.
Todos os indivíduos da pesquisa assinaram o Termo de Consentimento Livre
e Esclarecido (Anexo A), seguindo determinação do Comitê de Ética e Pesquisa
(Anexo B).
3.2. Meios de cultura
Os micro-organismos foram isolados nos meios de culturas demonstrados na
relação abaixo:
Caldo BHI (Infusão de Cérebro e Coração) (Newprov):
BHI pó
Água Destilada
37 g
1000 mL
Pesado e hidratado o meio conforme instruções do fabricante; distribuído 3,0
mL em tubos com tampa de rosca; esterilizado em autoclave; retirado os tubos da
autoclave e deixado esfriar em temperatura ambiente (BRASIL, 2004).
Ágar Mitis Salivarius Sacarosado com Bacitracina (AMSB) (DIFCO):
Ágar Mitis Salivarius
45 g
Sacarose
15 g
Água Destilada
500 mL
Bacitracina (sol. Estoque 50.000 µg/mL)
0,30 mL
44
Foi preparado de acordo com o descrito por Gold, Jordan e Houter (1973). A
formulação
comercialmente
disponível:
Bacto
Agar
Mitis
Salivarius
(Difco
Laboratories) foi suplementada com 15 % de sacarose (Microbiologie Merk) e 0,2
unidades de Bacitracina (Calbiochem Novabiochem Corporation) por mL de solução.
As placas Petri foram seladas e estocadas sob refrigeração por no máximo seis dias
até sua utilização (OPLUSTIL et al., 2010).
Ágar Sangue:
Peptona bacteriológica
10 g/L
Extrato nutritivo
10 g/L
Cloreto de sódio
Ágar
Sangue de carneiro desfibrinado
5 g/L
15 g/L
5 mL
Pesado e hidratado o meio conforme instruções do fabricante; esterilizado em
autoclave; esfriado a base a aproximadamente 50ºC; adicionado 5 mL de sangue
desfibrinado de carneiro para cada 100 mL de base; homogeneizado delicadamente
para não formar bolhas; distribuído em placas de Petri de 90 mm de diâmetro
(BRASIL, 2004).
3.3. Obtenção da amostra
As amostras foram colhidas pelo dentista e professor, devidamente paramentado,
roupa e sapato branco, guarda-pó, gorro, máscara, e luva estéril.
As coletas foram realizadas no período da manhã, no dente com cárie, com o
instrumento estéril, uma cureta dentística, cabo sextavado, no 5, autoclavada em
vapor saturado sob pressão a 127ºC, em embalagem grau cirúrgico, com validade
de sete dias conforme protocolo de esterilização, representada na Figura 12.
A amostra do material da cárie foi colhida por raspagem de cima para baixo,
sem ocasionar vai e vem e fricção.
Após a colheita, o instrumental, agora contaminado, foi encaminhado ao
laboratório de Biologia Molecular em recipiente estéril e fechado em condições
assépticas. Este trajeto (clínica de odontologia ao laboratório) não ultrapassou 5
minutos.
45
Figura 12: Cureta Dentística.
As amostras do instrumental foram raspadas por um swab estéril umedecido
e este foi imerso no caldo BHI em tubo de ensaio, o qual foi acondicionado em
estufa a 37ºC, por 48 h, Figura 13.
Após a turvação do meio BHI, semeou-se a solução em placa de Petri,
contendo AMSB, e acondicionados em estufa a 37ºC, por 24 e 48 h.
Figura 13: Meio de Cultura BHI no frasco de vidro identificado como positivo, com crescimento
bacteriano, turvação do meio e negativo, sem contaminação bacteriana.
3.4. Preparo das cuspensões dos micro-organismos
Após crescimento dos micro-organismos na placa de Petri contendo o meio AMSB,
foram preparadas suspensões das colônias do meio, em tubos com 2 mL de solução
fisiológica esterilizada (NaCl 0,9%), baseando-se na escala nefelométrica de Mac
Farland (18 milhões de bactérias por mL de meio), que consiste em uma série de 11
tubos numerados de 0,5 a 10, com diferentes quantidades de cloreto de bário e
ácido sulfúrico para se obter diferentes concentrações de sulfato de bário, que
46
correspondem a diferentes contagens bacteriana (LENNETTE et al., 1985). A
referência de equivalência para a contaminação das curetas foi o tubo número 1,
que equivale a 3 x 108 de bactérias por mL de meio, mostrado na figura 14.
Figura 14: Frasco de vidro contendo SF0,9% com colônias e tubo numerado (1) da escala
MacFarland.
Fonte: Lennette et al. (1985)
3.5. Contaminação dos instrumentais
Preparado
a
suspensão
de
micro-organismos,
referenciado
pela
escala
nefelométrica de Mac Farland, realizou-se a contaminação dos instrumentos
odontológicos, na suspensão por 30 s, e aguardou-se 30 minutos em ambiente
asséptico, com o bico de Bunsen aceso, para a formação do biofilme no
instrumental, Figura 15.
Figura 15: Bico de Bunsen aceso e instrumentais com os seus respectivosbéquers,
durante a contaminação dos instrumentos.
47
3.6. Tratamento com ultrassom
O aparelho de ultrassom utilizado foi o da marca COLE-PARMER, do modelo 8891E
DTH com frequência de 40KHz, com capacidade total de 2 L de água, e potência
acústica a partir dos dois cristais piezelétricos de 100 W.
O instrumental contaminado foi imerso em béquer de vidro de 200 mL de
capacidade total. No béquer, em condições assépticas foram adicionados 150 mL de
água esterilizada, usou-se uma tela em aço de 10 cm x 10 cm de tamanho, com
orifício central de 2 mm para a introdução da cureta, com a finalidade de suporte do
instrumental.
O instrumental foi imerso no béquer, mantendo uma distância de 0,5 cm
entre a base do béquer e a extremidade da cureta.
O béquer esterilizado por sua vez, através de um suporte, confeccionado para
este fim, conforme Figura 16, foi introduzido na cuba do aparelho de ultrassom,
posicionando em duas distâncias, uma de 0,5 e outra de 4 cm entre a base do
Becker e o fundo do reservatório do equipamento de ultrassom, respectivamente.
Para evitar o acúmulo de calor com o respectivo aumento de temperatura do
equipamento de ultrassom, foi adotado um sistema hidrodinâmico com entrada e
saída de água.
Figura 16: Representação esquemática do tratamento realizado na cureta contaminada com
Streptococcus mutans, com aparelho de ultrassom.
Fonte: Esquematizado por Prof. Dr. Carlos José de Lima
48
O teste de desinfecção usado pelo ultrassom foi realizado nos seguintes
tempos: 0, 1, 5, 10, 15, 20, 25 e 30 minutos. As dosagens do ultrassom foram
definidas pela potência acústica (W) versus o tempo de atuação do aparelho (s), o
que resulta as dosagens acústicas de 6 kJ, 30 kJ, 60 kJ, 90 kJ, 120 kJ, 150 kJ, e
180 kJ respectivamente.
3.6.1. Semeadura
Após a sonicação, o material remanescente foi removido com auxílio de um swab
estéril, umedecido e em seguida semeado no meio de cultura AMSB em placa de
Petri.
As placas foram identificadas (Figura 17) com o tempo de exposição ao US e
a data do respectivo teste, e acondicionados em estufa para posterior leitura
microbiológica de 24 e 48 horas.
A
B
Figura 17: A. Béquers e placas de Petri contendo o meio AMSB, e curetas embaladas em papel
crepado. B. Béquers e curetas contaminadas com as respectivas placas de Petri.
O grupo controle positivo foi definido pela raspagem do material de uma
cureta contaminada, sem passar por tratamento, e o grupo controle negativo,
realizou-se o swab de uma cureta estéril, em seguida, semeou-se no meio AMSB e
acondicionados a estufa a 37ºC para posterior leitura.
49
3.7. Ozonização da água
Foi utilizado um gerador de ozônio (Aparelho: Z-OZONE, Modelo: ZOT-5G110V,
método de ozonização: Efeito corona por Descarga Elétrica, potência: 80 W),
apresentado na Figura 18.
A ozonização da água foi realizada a partir do gerador de ozônio, bem como
também através de um cilindro de oxigênio com acoplamento de válvulas de controle
de pressão e fluxo de gás O2 na entrada.
Água destilada e deionizada com volume de um litro foi ozonizada em
recipiente coluna de vidro, com a adição de pedra porosa e tubo de silicone
acoplado ao gerador de ozônio. A monitoração da medida de concentração do O3 no
líquido foi realizada, pelo medidor colorimétrico marca CHEMets, modelo R-7402,
estabeleceu-se a concentração de 5 PPM com temperatura de 18oC.
A
B
Figura 18: Aparelho gerador de ozônio: a) Fotografia do aparelho; b) Água sendo ozonizada com
pedra porosa em uma proveta 1000 mL.
Para assegurar a limpeza do sistema, foi ozonizado o volume de um litro de
água deionizada contida no reservatório, por 20 minutos. Após este tempo, a água
foi desprezada, e igual volume de novo líquido foi recolocado na proveta para
produção da água a ser utilizada no experimento.
50
3.8. Tratamento com água ozonizada
Os instrumentais contaminados foram imersos em béquer de 200 mL, contendo 100
mL de água ozonizada, concentração: 5 PPM, temperatura de 18ºC, e tempos de 0,
0,5, 1, 2, 3, 4 e 5 minutos, resultando nas dosagens de: 0, 2,5, 5, 10, 15, 20, 25,
respectivamente. Após os testes com água ozonizada, realizou-se as coletas
microbiológicas utilizando o swab nas curetas submetidas a ozonização, e
semeadas em meio AMSB, em placas de Petri, acondicionadas em estufa a 37ºC,
realizou-se a leitura de UFC por 24 e 48 h. Os testes foram feitos em triplicata.
3.9. Tratamento com água ozonizada + ultrassom
Os instrumentos contaminados foram imersos em becker de 200 mL, contendo 100
mL de água ozonizada, concentração 5 PPM, com temperatura de 18ºC, e
simultaneamente sonicados no aparelho de ultrassom, como já descritos
anteriormente na Figura 16, nos seguintes tempos: 0; 0,5; 1; 2; 3; 4; 5; 6; 7; 9; 10;
15; 30 minutos.
3.10. Provas de identificação
3.10.1. Prova da catalase
A prova da catalase foi realizada colocando-se água oxigenada 3% sobre colônias
características crescidas no AMSB, observando-se a formação de bolhas de gás
(prova positiva). O resultado negativo da prova revela a presença de bactérias do
gênero Streptococcus (KUBICA, 1966).
3.10.2. Coloração de Gram
A técnica de coloração de gram, conforme Koneman et al. (2008), aliada à
observação de lâminas a fresco foram utilizadas para diferenciar os grupos de
bactérias. A imagem coletada na Figura 19 foi adquirida através de um microscópio
óptico confocal laser, marca Olympus, modelo FV1000.
51
Figura 19: Colônias de S.mutans, gram positivas, microscopia confocal colorida.
3.10.3. Prova hemólise
As bactérias S. mutans são hemolíticos em ágar sangue (Figura 20) (BURNETT et
al., 1978).
Figura 20: Placa contendo meio de cultura ágar sangue e contendocolônias de S.mutans alfa e beta
hemolíticos.
3.11. Análise e apresentação dos dados
Os resultados obtidos foram anotados, tabulados e submetidos à análise estatística
para determinar o seu nível de significância. Foi realizada análise estatística, com
média e desvio padrão, através dos resultados encontrados no meio de cultura,
comparando-se com o grupo controle (CAMPOS; CAMPOS, 2002).
3.12. Considerações éticas
A coleta de dados só foi realizada respeitando os preceitos éticos em pesquisa que
envolve seres humanos, após a aprovação pelo Comitê de Ética em Pesquisa (CEP)
52
da Universidade Camilo Castelo Branco, sob o CAAE: 401042, e número de
processo: 3362-3582/11.
53
4. RESULTADOS
4.1. Avaliação do tempo de sonicação necessário para reduzir população/
colonias da bactéria S. mutans
Realizou-se os testes com o ultrassom, em curetas contaminadas, com duas
distâncias, entre o fundo do béquer e o cristal do aparelho de ultrassom, de 0,5 e 4
cm, respectivamente, e em seguida realizou-se a semeadura do material em placa
de Petri contendo meio de cultura mitis salivarius sacarosado e bacitracina, após 24
e 48 horas, em estufa a 37ºC, realizou-se contagem das UFC contidas nas placas.
Foram observados os efeitos bactericidas de sonicação nos tempos de 1, 5,
10, 15, 20, 25 e 30 minutos, sobre a cureta contaminada com S. mutans. Os valores
de crescimento dos micro-organismos em UFC/mL estão expressos através da
Tabela 3. O tempo zero foi definido como controle positivo.
Tabela 3: Número de crescimento de S. mutans em UFC/mL após sonicação, com distância de 0,5
cm entre o cristal e o béquer.
Número
de
testes
Nº de UFC em placas nos tempos determinados em minutos
0
1
5
10
15
20
25
30
1
533
527
304
211
28
83
3
0
2
518
500
298
206
28
40
4
0
3
637
569
333
117
39
43
6
0
4
700
400
432
153
50
39
6
0
5
560
498
498
99
93
28
22
0
Observa-se que durante os experimento com o ultrassom, frequência de
40kHz, potência acústica de 100 W, e dose de 6 kJ, 30 kJ, 60 kJ, 90 kJ, 120 kJ,
150 kJ, 180 kJ, respectivamente, ocorreu um declínio acentuado nas UFC de S.
mutans exposta á sonicação, com distância de 0,5 cm entre o cristal e o béquer, a
partir de 10 minutos, houve queda de 85% das colônias; após 15 minutos a redução
foi de 96%, e 99,5% após 25 minutos de sonicação, com relação a população inicial
de colônias. Observou-se também que no tempo de 30 minutos, ocorreu a
aniquilação total do microorganismo considerado.
54
4.2. Avaliação do tempo de água ozonizada necessário para reduzir as UFC do
S. mutans
Identificou os efeitos de redução das UFCs do S. mutans no instrumental
odontológico (cureta), através da água ozonizada nos tempos de 0,5, 1, 2, 3, 4, 5, 6,
8 e 10 minutos, com temperatura inicial da água de 18ºC, o tempo zero, foi definido
como controle positivo. Os valores de crescimento dos micro-organismos em UFC
contidos na placa de Petri contendo o meio específico estão expressos através da
Tabela 4 e Figura 21.
Tabela 4: Número de crescimento de S. mutans em UFC após exposição à água ozonizada (5 PPM
O3) em diferentes tempos.
Número
de
testes
No de UFCs nos tempos determinados em minutos
0
0,5
1
2
3
4
5
6
8
10
1
533
104
194
72
41
12
23
12
0
0
2
518
108
70
70
56
33
14
8
0
0
3
637
79
7
80
9
39
10
6
0
0
Figura 21: Tratamento da Bactéria S.Mutans com ozonização, concentração: 5 PPM, temperatura da
água: 18ºC.
Com relação à população inicial de colônias após 0,5 minuto de ozonização,
houve redução de 87,5% e aumentando a exposição à água ozonizada para 3, 4, 6 e
55
8, há redução de 93,5%, 98,1%, 99,0% e 99,9%, respectivamente, representado na
Figura 22. Também neste caso ocorreu total morte bacteriana a partir do tempo de 8
minutos.
Figura 22: Relação em porcentagem da redução bacteriana após a ozonização (concentração 5
PPM), nos tempos de 0,5, 1, 2, 3, 4, 5, 6 e 8 minutos.
4.3. Avaliação do tempo de ozonização e sonicação simultâneos necessários
para reduzir as UFCs do S. mutans
Realizou-se os testes com água ozonizada (5 PPM O3) e sonicação (frequência: 40
kHz) simultaneamente, com temperatura de 18ºC, nos tempos de 0,5, 1, 2, 3, 4, 5, 7,
8, 9 e 10 minutos. Identificou-se que durante os testes em que foi realizado o
experimento, ocorreu diminuição de 77,8%, 91%, 95%, 97% e 99% da UFC de S.
mutans pelos tempos de 0,5, 1, 2, 3, 4 minutos, respectivamente, representados na
Figura 23.
A Tabela 5 representa o número de testes realizados e as UFC, relacionados
ao tempo e sonicação/ozonização simultaneamente.
56
Tabela 5: Número de crescimento de S. mutans em UFC após exposição à água ozonizada (5 PPM
O3) e ultrassom simultaneamente, em diferentes tempos.
No de UFCs em placas nos tempos determinados em minutos
No de
testes
0
0,5
1
2
3
4
5
7
8
9
1
533
148
44
29
28
0
0
0
0
0
2
518
124
31
45
30
3
0
0
0
0
3
637
158
50
16
32
6
0
0
0
0
4
700
138
178
28
78
0
0
0
0
0
5
560
498
64
43
34
0
0
0
0
0
Figura 23: Relação em porcentagem da redução bacteriana após a ozonização/sonicação, nos
tempos de 0,5, 1, 2, 3 e 4 minutos.
A Figura 24 representa o tratamento simultâneo nas curetas com o ultrassom
e ozônio, bem como os tempos de tratamento.
57
Figura 24: Tratamento da bactéria S.Mutans com o híbrido ultrassom/ozonização (5 PPM O3). Dose:
concentração x tempo x energia.
4.4. Identificação da bactéria S.mutans
A caracterização preliminar dos estreptococos pode ser realizada através da
determinação da hemólise e da produção de catalase, uma vez que essas bactérias
são catalase-negativas.
Realizou-se as provas de identificação bacteriana em colônias aderidas ao
meio de cultura AMSB, para a identificação da bactéria S.mutans. Neste meio de
cultura identificam-se colônias ovóides, aderidas ao meio, conforme Figura 25.
Figura 25: Placa de pétri contendo o meio de cultura Mitis Salivarius sacarosado e bacitracina a 2%,
e UFC de S. mutans.
Realizou-se a técnica de coloração de gram, em lâminas á fresco, resultando
em bactérias gram positivas, conforme a Figura 26.
58
A
B
Figura 26: Fotografia digital do S. mutans utilizando microscópio confocal. Lâmina com o biofilme
formada a partir de meio de cultura específico para este micro-organismo: A- S. mutans, microscopia
confocal colorida; B- S. mutans, microscopia confocal preto e branco.
Realizou-se a prova da hemólise em meio de cultura ágar sangue, os S.
mutans se enquadram no grupo dos α hemolíticos, ou seja, quando em contato com
um meio ágar-sangue, desenvolvem em 48 horas uma zona interna de
descoramento esverdeado (1 a 2 mm) existindo por volta dessa zona, uma zona
externa de hemólise completa, conforme a Figura 27.
Figura 27: Meio de Cultura Agar Sangue contendo colônias de S. mutans, com zonas distintas de
hemólise ao redor das colônias.
Através dos testes realizados fica evidenciada a presença de S. mutans na
amostra colhida do dente molar inferior com cárie.
59
4.5. Determinação da IC50
Realizou-se a determinação da half maximal inhibitory concentration (IC50), é uma
medida da eficácia de um composto em função biológica ou bioquímica de inibição.
Esta medida quantitativa indica a quantidade da concentração do ozônio e ultrassom
foram necessárias em relação ao tempo para inibir a metade da sobrevida de S.
mutans. É a concentração inibitória de metade com relação ao máximo (50%) (IC) de
uma substância (50% IC, ou IC50). É comumente utilizada como uma medida
de antagonista de drogas potência na investigação farmacológica.
A seguir serão apresentadas as Figuras 28, 29, 30 e 31 com as respectivas
IC50.
Figura 28: Tratamento das colônias com ultrassom, mantendo uma distância de 4 cm entre o fundo
do béquer e a cuba do aparelho de sonicação, e IC50 = 20 minutos.
Figura 29: Tratamento das colônias com ultrassom, mantendo uma distância de 0,5 cm entre o fundo
do béquer e a cuba do Aparelho de sonicação, e IC50 = 07 minutos.
60
Figura 30: Tratamento das colônias com ozônio, concentração 5 PPM, temperatura da água: 18ºC e
IC50 = 18 segundos.
Figura 31: Tratamento das colônias com o híbrido ultrassom + ozônio, e IC50 = 0,3 minutos (18
segundos).
61
5. DISCUSSÃO
Nesta pesquisa pretendeu-se identificar o desempenho da ozonização, sonicação e
ozonização/sonicação simultaneamente, como potencial da desinfecção e controle
microbiológico em instrumentais clínicos odontológicos, além de caracterizar a
bactéria Streptococcus mutans no instrumental clínico específico (cureta), após
coleta de material do dente com lesão cariosa. O experimento foi quantitativo,
propondo a utilização do híbrido ultrassom/ozônio para verificar o aumento da
eficácia de desinfecção da bactéria S. Mutans.
A desinfecção de instrumentais é importante para a redução de patógenos,
pois as doenças ocasionadas por infecção cruzada são um grande problema de
saúde e continuam sendo um desafio para a equipe responsável pela sua prevenção
e controle.
Este estudo objetivou proporcionar métodos de desinfecção que reduzem e
elimine a bactéria S. mutans, com custos reduzidos, tempos curtos, e facilidades de
acesso aos profissionais que manipulam instrumentais contaminados, seguida de
medidas de intervenção e providências necessárias para garantir um material que
atenda um padrão de qualidade.
A partir do isolamento em AMSB, as colônias características de S. mutans,
com macromorfologia de aspecto puntiformes, pequenas, médias e grandes foram
selecionadas. Duas a três colônias com morfologia característica de S. mutans foram
repicadas em meios próprios para a realização da coloração pelo método gram para
análise de sua micromorfologia, e prova da catalase e hemólise.
É uma espécie de bactérias gram-positivas com morfologia de coco,
pertencente ao gênero Streptococcus. Agrupam-se em colônias pares (meio sólido)
ou agrupadas (caldo). Suas dimensões variam de 0,6 a 1 µm, pela técnica gram, as
características da sua parede celular e membrana simples determina coloração roxa
(gram-positiva). São imóveis (com poucas exceções), e são bactérias anaeróbias
facultativas.
Possuem alto poder cariogênico, devido sua capacidade acidogênica e
acidúrica. A detecção ou não de Estreptococos do Grupo Mutans (EGM) não é
determinante da atividade cariogênica, porém facilita a identificação de clientes
suscetíveis ao desequilíbrio do processo de desmineralização dental, contribuindo
assim para o planejamento e execução de programas preventivos, reduzindo a cárie.
62
A coleta realizada no trigésimo segundo dente molar, com cárie, nesta
pesquisa, confirmou-se, através do meio seletivo, coloração de gram e catalase, a
presença de S.mutans, no raspado dentário. Pacientes livres de cárie apresentavam
na sua maioria baixa contagem de S. mutans, na pesquisa de Ferreira (2009), o que
corrobora esta pesquisa.
O´Sullivan; Thibodeau (1996) estudaram a correlação entre lesões de cárie e
número de S. mutans presentes no biofilme e na saliva. O número de S. mutans,
presentes no biofilme, era comumente estimado, a partir de amostras colhidas na
saliva, sendo a contagem de micro-organismos presentes na saliva considerada um
indicador da totalidade da carga microbiológica dentária.
Spolidorio (1997), em sua pesquisa demonstrou que os S. mutans esteve
presente em 100% da população investigada independente da classe sócioeconômica estudada; já nos dados apresentado por Campos; Campos (2002), que
pesquisou a contagem e prevalência de (EGM) em 40 crianças (faixa etária de até
12 anos de idade), encontrou 23 (57,5%) colonizadas por S. mutans, sendo que seis
(15%) apresentavam também S. sobrinus (com menos de 105 UFC/mL), dezesseis
crianças apresentam níveis de S. mutans menores que 105 UFC/mL.
Na avaliação do crescimento das colônias, quando a cureta foi submetida ao
ultrassom, variou-se a distância entre o fundo do Becker e a cuba do ultrassom em
0,5 cm e 4 cm, identificou-se uma maior redução do número de colônias na distância
de 0,5 em relação a distância maior, também avaliou-se o tempo de exposição da
cureta ao ultrassom. Portanto, a atividade bactericida apresentou maior eficácia com
menor distância da extremidade da cureta em relação a fonte geradora da onda
acústica, ou seja, o cristal piezelétrico.
Nos experimentos realizados com a distância maior entre a base do vidro
bequer e o cristal piezelétrico (4 cm), a diminuição das UFC nas placas de cultura
não foi significativa nos tempos de 1, 5 e 10 minutos, já nos tempos de 15 e 20
minutos houve redução maior em relação ao controle positivo e não ocorreu inibição
total do crescimento bacteriano. De fato, este fenômeno pode ser explicado devido a
uma maior densidade de potência acústica do ultrassom quando o instrumento a ser
higienizado fica mais próximo em relação ao fundo da cuba do aparelho limpador
ultrassônico, o contrário ocorre quando o bequer fica distante da cuba, a densidade
de potência acústica será menor, diminuindo assim a atuação biocida, e
consequentemente a potência vibracional e o efeito de cavitação no meio.
63
Segundo Suslick (1990), o efeito do ultrassom na área biológica, pode ocorrer
devido ao poder da alta potência acústica, que pode deslocar distorcer e/ou
reorientar partículas intercelulares ou mesmo células com relação a suas
configurações normais. Tais efeitos estão associados a grandes tensões
hidrodinâmicas suficientes para causar danos às células e macrocélulas suspensas.
Além disso, o ultrassom desenvolve o processo biofísico da cavitação que vem
sendo considerado como um dos principais mecanismos que acarretam a atividade
germicida em meio líquido.
A diminuição de colônias de S. mutans nos ensaios realizados nesta
pesquisa, pelo ultrassom evidenciam a capacidade do aparelho, através de um
efeito físico-mecânico em eliminar micro-organismos.
No ponto do colapso e implosão das bolhas, há formação de ondas de
choque, ou seja, na fase vapor no interior da microbolha, há a expectativa de
variações de temperatura e pressão muito elevadas da ordem de aproximadamente
5000°C e pressão de 500 atmosferas.
Segundo Gonze et al. (1998), a destruição ou inativação de micro-organismos
por aplicação de ondas ultrassônicas pode ser utilizado com eficácia na desinfecção
de águas. Ainda estes pesquisadores, concluíram que aumentando o poder do US
aumenta a destruição das células bacterianas e que as ondas do ultrassom de alta
frequência são mais eficazes do que as de baixa frequência com relação ao
processo de desinfecção de água.
Na referência de Bougrier et al. (2006), quando aplicaram o US de 20 KHz o
em condições controladas de laboratório houve diminuição da viabilidade celular de
Saccharomyces cerevisae. A eficiência do US aumenta com o tempo de exposição
aos efeitos das ondas acústicas e da cavitação sobre as células. Segundo este
mesmo autor, o US pode ser utilizado como um método de controle da viabilidade de
micro-organismos em resíduos aquosos e sanitização de águas contaminadas.
Suslick (1990) realizou um estudo com aplicação de US na preparação e
preservação de produtos cosméticos emulsionáveis, constatando por meio de seus
resultados que o US é um excelente agente biocida. O tratamento do cosmético
contaminado com o fungo Aspergillus flavus com ondas ultrassônicas identificou-se
eficiente levando-se em consideração a diminuição do número de micro-organismos
presentes após exposição. Foram estudadas amostras de cosméticos contaminadas
com o fungo e expostas no gerador de US nos tempos de 12, 16 e 20 minutos,
64
mostrando que a diminuição é maior em função do aumento do tempo de atuação
das ondas acústicas, o que corrobora estes ensaios, havendo uma redução maior no
número de colônias, quando a exposição das curetas contaminadas é maior a
sonicação. Vale ressaltar que na verdade a partir de um valor específico de potência
acústica gerada no cristal piezelétrico, os tempos de atuação do ultra-som resultam
tecnicamente em doses referentes à energia em unidades de Joules [J], de fato, as
maiores dosagens evidenciando maior eficácia bactericida, apresentou valores 150 e
180KJ.
O ozônio (O3) é um gás reativo, que forma radical oxidante em função dos
parâmetros do meio em que ele habita, esta partícula iônica atua na membrana
celular do micro-organismo, podendo causar neste ser a lise celular, desta maneira,
apresenta propriedades antimicrobianas (GARDUÑO GARDUÑO et al., 1995;
VELANO et al., 2001).
A especificação da faixa dosagem do O3 em água para o estudo de
desinfecção levando-se em consideração o Streptococcus mutans, foi estabelecida a
partir de uma concentração com um valor de 5 PPM ou 5 mg/L, Song et al.(2007), de
fato, para doses maiores, ou seja, tempo maior de atuação do ozônio, ocorreu maior
inativação microbiológica.
Nesta pesquisa houve redução de 100% das colônias de S. mutans em oito
minutos de ozonização, na concentração de 5 PPM, o que se aproxima de Baysan;
Whiley e Lynch (2000) encontraram uma redução significativa em S. mutans e S.
sobrinus (BOCCI et al,. 1998; YAMAYOSHI; TATSUMI, 1993).
Segundo Torres et al. (1996), quanto maior for o tempo de atuação da
solução ozonizada maior será o seu efeito oxidativo, consequentemente seu
resultado microbiocida.
O processo de higienização e conseqüente descontaminação a base de
ozônio tem como princípio utilizar as propriedades deste gás. O O3 é o mais potente
germicida em relação ao cloro, e nesta condição torna-se eficaz contra vírus,
bactérias, protozoários e fungos, sem a geração de resíduos químicos sintéticos.
Levando em consideração o protocolo de segurança, o processo de geração e
aplicação do ozônio em concentrações e dosagens adequadas na área clínica,
apresenta elevado fator de segurança, garantindo sua operação dentro do próprio
hospital, reduzindo custos e tempo. Um processo totalmente automatizado, que
65
elimina o erro humano, reduz o risco de operação a praticamente zero e pode ser
100% eficaz.
Baysa; Lynch (2006) encontraram em seu estudo, que o tratamento com
ozônio reduziu drasticamente o número total de micro-organismos e reverteu a
maioria das lesões de raiz de cárie.
Aplicação de ozônio na dentina infectada com S. mutans alcançou
consistentemente reduções significativas no número de micro-organismos viáveis
nos grupos teste, nos ensaios de Polydorou, Pelz e Hahn (2006).
Joahnson; Claesson; Dijken (2009), em sua pesquisa para verificar a eficácia
do ozônio, em sua metodologia, borbulhou o gás direto a solução contaminada com
micro-organismo sem o difusor, comprometendo a eficiência da transferência do gás
para o meio líquido, a concentração foi estabelecida a partir do gerador sem
considerar a atuação do tempo. Já neste trabalho proposto, ozonizou-se a água,
com difusor para diminuir o tamanho das bolhas, até atingir um valor de
concentração específico em PPM (5) posteriormente, imergiu as curetas
contaminadas para a higienização.
Johansson; Claesson; Dijken (2009), confirmaram a sensibilidade dos S.
mutans a exposição ao ozônio, concentração de 5 PPM por 60 segundos de
exposição, destruíram quase 100% desta bactéria, já nos ensaios desta pesquisa, a
redução total deste micro-organismo ocorreu após sete minutos de exposição, tal
fato pode ser explicado pela quantidade de bactérias presentes no biofilme do
instrumental usado, uma vez que no protocolo de preparo já citado anteriormente na
metodologia deste trabalho, há uma quantidade numérica do Streptococcus mutans
muito maior.
Para avaliar a utilidade do ozônio como um agente desinfectante e sua
eficácia antimicrobiana é preciso definir as concentrações e as diferentes formas de
contato, bem como o tempo de exposição.
Quando realizamos o tratamento das curetas com ozônio e ultrassom
simultaneamente, observou-se uma redução nos tempos de exposição, quando
comparados ao ozônio e ultrassom isolados, com a dose híbrida com o tempo de 0,5
minuto de exposição, onde houve redução de 77,3% das colônias, quando
comparados ao número de colônias do grupo controle. Observamos também que o
tempo necessário para a redução/inativação do S. mutans foi reduzido.
66
Na realização do híbrido (ultrassom e ozônio) a redução de todas as colônias
(99,9%) ocorreram após 5 minutos de ozonização, que pode ser explicado pelo
aumento de radicais livres O e OH, que a sonicação ocasiona na água ozonizada, e
pelo efeito mecânico e físico do ultrassom nas moléculas, além do efeito bactericida
do próprio ozônio, se tornando mais efetivo que os tratamentos isolados.
Este estudo mostrou que a temperatura da água, a dose de ozônio,
densidade de energia acústica teve um efeito positivo na redução de colônias de S.
mutans, e o híbrido (US+O3) aumentou morte bacteriana, evidenciado pela redução
das UFC´s nas placas de petri, além disso, a sonicação poderia melhorar e
aumentar a decomposição do O3 para gerar mais OH para reagir com o substrato.
Por outro lado, as microbolhas do O3 podem atuar como núcleos fonte de cavitação
produzindo ainda mais efeito de lise celular, o que aumentou a eficiência do
tratamento hídrico (APHA, 2005).
Yan et al. (2012), estudou em suas pesquisas o grau de desintegração de
resíduo químico utilizando o hibrido (US + O3), o ultrassom foi uma sonda
diretamente imersa na água (frequência: 20 kHz, potência: 250 W), e esta estava 1,5
cm abaixo do nível do líquido, diferente deste estudo, no qual a cuba se localizava
na porção inferior do aparelho do ultrassom, e houve redução das colônias a partir
de 0,5 minutos devido ao efeito sinérgico resultante da combinação entre sonicação
e ozonização.
A densidade de potência potencializa os efeitos mecânicos do ultrassom e
com a mistura (US + O3) há aumento do cisalhamento de bolhas do gás, isto
aumentaria a taxa de transferência ozônio na água.
Gary et al. (1975), prepararam vírus e bactérias presentes em meios de
cultura específicos e trataram com água ozonizada e ultrassom simultaneamente,
bem como também de forma isolada de cada técnica, neste artigo não ficou
tecnicamente evidenciado a metodologia de atuação tanto do ultrassom quanto da
aplicação do O3.
A aplicação simultânea do ozônio e do aparelho limpador ultrassônico
demonstrou maior eficácia quando comparado a cada técnica isolada, tanto o evento
das ondas acústicas quanto o do gás ozônio, não acarreta a geração de resíduos
sintéticos intrínsecos, pois, o efeito mecânico, o radical livre e a molécula de
oxigênio são conseqüentes destes próprios eventos.
67
Este trabalho procurou evidenciar a aplicabilidade de desinfecção de
instrumentos cirúrgicos em geral, de fato, em comparação com os tradicionais
métodos de esterilização citando como exemplo a autoclave e a estufa, estes além
de apresentar longo tempo de utilização, custo de manutenção significativo,
considerável consumo energético elétrico, entre outros, este trabalho procurou
evidenciar a provável viabilidade de utilização de um equipamento comercial
limpador ultra-sônico, em conjunção com um gerador de gás ozônio para a
desinfecção destes materiais, pois estes apresentam baixo consumo de energia
elétrica, custo de compra mais viável e também significativa eficácia em termos de
eliminação bacteriana.
68
6. CONCLUSÃO
A partir dos resultados e discussão realizados nesta pesquisa, concluímos que o S.
mutans esteve presente em todas as amostras dos dentes com cárie, sendo uma
bactéria altamente cariogênica.
A desinfecção de instrumentais odontológicos é um importante fator para a
redução do já citado patógeno, contribuindo para a redução de infecções
oportunistas.
O processo de desinfecção com ultrassom mostrou através dos ensaios, ser
um importante fator para a redução microbiológica, reduzindo todas as colônias de
S.mutans a partir de 30 minutos.
Neste estudo evidenciou a importância da distância entre o material a ser
higienizado e o fundo da cuba do aparelho de ultrassom que é onde se localiza o
cristal piezelétrico gerador de ondas acústicas, de fato, identificamos que se a
distância for menor (0,5 cm neste estudo) a eficiência da sonicação será maior,
tendo uma redução de 85% em 10 minutos de sonicação e 100% em 30 minutos,
enquanto para uma distância maior (4 cm) a redução das UFC em 10 minutos foi de
62,1%, e não houve redução total em 30 minutos de sonicação.
O ozônio reduziu totalmente as UFC aos 8 min quando as curetas foram
expostas a água ozonizada, mostrando ser também um eficiente bactericida, pois
após 0,5 minutos, já houve redução de 87,5% das colônias na placa de petri
contendo o meio de cultura seletivo.
No presente estudo, foram especificadas doses individuais do sistema
ultrassônico e do gás ozônio, bem como também da atuação simultânea destas
duas técnicas a fim de verificar o comparativo efetivo.
O ultrassom em condição simultânea com ozônio apresentou uma técnica
mais eficaz para reduzir o número de colônias da bactéria em estudo, visto que os
ensaios apresentaram redução total do número de colônias, aos 5 min, e sendo mais
eficaz do que ozônio e ultrassom sozinhos. E quando as curetas foram submetidas
simultaneamente ao tratamento híbrido, observamos que o tempo necessário para a
eliminação/inativação do S. mutans foi reduzido. De fato, observou-se que o evento
simultâneo do gás ozônio na água e do limpador ultrassônico, mostrou uma redução
mais significativa do número de UFC em tempo menor.
69
Os sistemas tradicionais atuais de esterilização de instrumentais cirúrgicos,
como por exemplo, a autoclave e a estufa, se notabilizam por serem eficazes na
eliminação
total
microbiana,
entretanto
estes
equipamentos
apresentam
características com considerável consumo de energia elétrica e significativo custo de
manutenção.
Futuramente, a partir de mais estudos, pretendemos padronizar a
metodologia de utilização deste sistema híbrido (ultrassom e ozônio) com a
finalidade de realizar a higienização de instrumentais em geral. Além disso, este
sistema apresentaria a vantagem de muito menor consumo energético elétrico, pois
um equipamento comercial de ultrassom somado a um gerador de O3 apresenta
potência elétrica de aproximadamente 350 W.
70
REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA, R.F.; PINHO, M.M., LIMA,C.; et al. Associação entre doença periodontal e
patologias sistêmicas. Rev. Port. Clin. Geral 22: 379-90, 2006.
AMMI: Association for the Advancement of Medical. Designing Testing and
Labeling Reusable Medical Devises for Reprocessing in Healt Care Facilities: a
Guide for Device Manufactures Arlington: AMMI, 2010. (AAMI TIR12:2010).
APHA. AWWA. WPCF. Standard Methods for the Examination of Water and
Wastewater Washington: American Public Health Association, 2005.
BARBEAU, J.; NADEAU, C. Dental unit waterline microbiology: a cautionary tale. J.
Can. Dent. Assoc. 63: 7-12, 1997.
BAYSAN, A.; BEIGHTON, D. Assessment of the ozone-mediated killing of bacteria in
infected dentine associated with noncavitated occlusal carious lesions. Caries Res.
41: 337- 341 26, 2007.
BAYSAN, A.; LYNCH, E. The use of ozone in dentistry and medicine. Ozone and
root caries. Prim. Dent. Care13: 37-41, 2006.
BAYSAN, A.; WHILEY, R.A.; LYNCH, E. Antimicrobial effect of a novel ozone
generating device on micro-organisms associated with primary root carious lesions in
vitro. Caries Res. 34(6): 498-501, 2000.
BECKER, M.R.; PASTER, B.J.; LEYS, E.J. et al. Molecular analysis of bacterial
species associated with childhood caries. J. Clin. Microbiol. 40: 1001-1009, 2002.
BELLO, C. Estudo da eficiência das ondas de ultra-som em relação ao
hipoclorito de sódio e à filtração adsorção na eliminação de microrganismos
em estação de tratamento de água. 2003. 116 p. Tese (Mestrado Ciências
Biológicas - Microbiologia Aplicada) - UNESP, Rio Claro, 2003.
BLOCK, S. S. Disinfection, Sterilization, and Preservation. Philadelphia: Lea
Febiger, 2001, 1049 p.
BOCCI, V. Ossigeno-Ozonoterapia. Comprensione del Meccanismi di Azione e
Possibilitá Terapeutiche. Milão: CEA-Casa Editrice Ambrosiana, 2000. 324 p.
BOCCI, V.; LUZZI, E.; CORRADESCHI, F. et al. Studies on the biological effects of
ozone: 3. An attempt to define conditions for optimal induction of cytokines.
Lymphokine Cytokine Res.12: 121-126, 1998.
BOOT, T.R. Ozone as a disinfectant in process plant. Food Control 2: 44 -49, 1991.
71
BOUGRIER, C.; ALBASI, C. J. P.; DELGENES, H. et al. Effect of ultrasonic, thermal
and ozone pre-treatments on waste activated sludge solubilisation and
anaerobicbiodegradability. Chem. Eng. Process. 45: 711-718, 2006.
BRADY, J.E.; HUMISTON, G.E. Química Geral. Rio de Janeiro: LTC, 1996, 332 p
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Curso
Básico de Controle de Infecção Hospitalar: Caderno C, Método de Proteção
Anti-Infecciosa. Brasília: ANVISA, 2000.
BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Descrição
dos Meios de Cultura Empregados nos Exames Microbiológicos. Brasília:
ANVISA, 2004.
BRASIL. Ministério da Saúde. Coordenação de Controle de Infecção Hospitalar.
Processamento de Artigos e Superfícies em Estabelecimentos de Saúde.
Brasília: Ministério da Saúde, 1994.
BRASIL. Ministério da Saúde. Coordenação de Controle de Infecção Hospitalar.
Processamento de Artigos e Superfícies em Estabelecimentos de Saúde.
Brasília: Ministério da Saúde, 1999.
BRASIL. Ministério da Saúde. Coordenação de Controle de Infecção Hospitalar.
Secretaria de Políticas de Saúde. Coordenação Nacional de DST e AIDS. Controle
de Infecções e a Prática Odontológica em Tempos de AIDS: Manual de
Condutas. Brasília: Ministério da Saúde, 2000.
BRATTHAL, D.; HOSZEK, A.; ZHAO, X. Evaluation of a simplified method for specific
determination of mutans streptococci levels. Swed. Dent. J. 20(6): 215-220, 1996.
BURNETT, G.W. SCHERP,A.; SCHUSTER,F. et al. Microbiologia Oral e Doenças
Infecciosas. 4. Ed. Rio de Janeiro: Guanabara Koogan, 1978. 425 p
CAMPOS, J.A.D.B.; CAMPOS, A.G. Cárie e Streptococcus mutans em ratos
alimentados com sacarose e maltose. Rev. Paul. Odontol. 24: 34-36, 2002.
CARDOSO, M.G. Estudo da eficiência da água ozonizada como solução
irrigadora na eliminação de Candida albicans, Enterococcus faecalis e
endotoxinas do canal radicular. 2006.133 p. Tese (Doutorado em Odontologia) UNESP, São José dos Campos, São Paulo.
CARVALHO, M. G.; JOSINETE, S. A.; CUNHA, A. B., et al. Pimarane Diterpenes
and a Sesquiterpene from Salzmmania nitida. An. Acad. Bras. Ciênc. 78: 17-21,
2006.
CENTERS FOR DISEASE CONTROL. National Nosocomial Infection Study
Report. Atlanta: CDC, 1993.
CENTERS FOR DISEASE CONTROL. Recommended Infection-Control Practices for
Dentistry. Morb. Mortal. Wkly Rep. 41(RR-8): 1-12, 2003.
72
CRAVOTTO, G.; CINTAS, P. Power ultrasound in organic synthesis: moving
cavitational chemistry from academia to innovative and large-scale applications.
Chem. Soc. Rev.35: 180-196, 2006.
DUAILIBE, S. A. C.; GONCALVES, A. G.; AHID, F. J. M. Effect of a propolis extract
on Streptococcus mutans counts in vivo. J. Appl. Oral Sci. 15: 24-27, 2007
EMILSON, C.G. Prevalence of Streptococcus mutans with different colonial
morphologies in human plaque and saliva. Scand. J. Dent. Res. 9: 26-32, 1983.
FADEL, C. Cárie Dental Precoce: Qual o Verdadeiro Impacto da Dieta em sua
Etiologia? Cienc. Biol. Saúde 9: 12-15, 2009.
FEJERSHOV, O; KIDD, E. Cariologia clínica e a dentística operatória. In:
FEJERSHOV, O; KIDD, E. Cárie Dentária: a Doença e seu Tratamento Clínico.
2. Ed. São Paulo: Santos, 2005, p 101-110
FERES, M.; CORTELLILL, S. C.; FIGUEIREDO, A. N. et al. Microbiological basis for
periodontal therapy. J. Appl. Oral Sci. 12: 32-37, 2004.
FERREIRA, D.L.A. Contagem de streptococcus mutans, streptococcus
sobrinus e lactobacillus spp e avaliação da atividade antagonista da
microbiota em portadores de síndrome de down. 2009.112p. Tese (Mestrado em
Ciências e Saúde) - Universidade Federal do Piauí, Teresina, Piauí.
FERREIRA, E. L.; OURW, E. A.; SILVA, A.R. et al. Avaliação do efeito dos
processos de esterilização e desinfecção em brocas de aço carbono e aço carbide
associadas ou não ao uso de lubrificantes. Rev. ABO Nac. 8: 375-81, 2001.
GANDINI, J. L. G.; MELOTI, A. F.; SANTOS, P. A. et al. Controle da infecção
cruzada em Ortodontia:Processamento, esterilização e controle de corrosão. Rev.
Dent. Press Ortodon. Ortop. Maxilar 2: 80-85, 1997.
GARDUÑO GARDUÑO, M. P.; GONZALEZ QUIJANO, J. I.; VAZQUEZ DE LARA, L.
G. et al. Efectos del agua ozonificada en la placa dentobacteriana. Rev. ADM 52(6):
305-308. 1995.
GARY, R.; BURLESON, T. M.; MURRAY. et al. Inactivation of Viruses and Bacteria
by Ozone, With and Without Sonication. Appl. Microbiol. 29: 340-344, 1975.
GOLD, O.C.; JORDAN, H.V.; HOUTE, J. A seletive medium for Streptococcus
mutans. Arch. Oral. Biol. 18:1357-1364, 1973.
GONZE, E.; GONTHIER, Y; BOLD, P. et al. Standing waves in a high frequency
sonoreactor: Visualization and effects. J. Chem. Eng. Sci. 53: 523-532, 1998.
GRAZIANO, K.U.; GRAZIANO, R.W. Limpeza, desinfecção e esterilização de artigos
odontológicos e cuidados com o ambiente. In: Controle de Infecção na Prática
Odontológica. Controle de infecção na prática odontológica. São Paulo:
APECIH, 2000, p 11-24
73
GREENE, A.K.; FEW B. K.; SERAFINI J. C. et al. A comparison of ozonation and
chlorination for the disinfection of stainless stell surfaces. J. Dairy Sci. 76: 36173620, 1993.
GUIRQUIS, W. A.; PROBER, R.; SLOUGH, J. W. Effects of ozone pretreatment and
bacterial growth on activated carbon treatment. In: MCGUIRE, M. J.; SUFFET, I.
Hactivated Carbon Adsorption of Organics from the Aqueous Phase. Ann Arbor:
Ann Arbor Science, 1980. p. 371-84
GUIRRO, E.C.O. Bioefeitos induzidos por ultra-som em Staphylococus aureus
e Escherichia coli estudo in vitro.1999. 91p. Tese (Doutorado- Ciências Biológicas
Microbiologia Aplicada) - UNESP, Rio Claro, São Paulo.
HAAS, C.N.; KAYMAK, B. Effect of initial microbial density on inactivation of Giardia
muris by ozone. Water Res. 37: 2980-2988, 2003.
INSTITUTO NACIONAL DE PESQUISAS ESPACIAIS (INPE). Índices teórico da
radiação UV-B, para as cidades Brasileiras. São José dos Campos: INPE, 2006.
JABUR, M.S.; SCABELL, P.L. Manual de Biossegurança da Faculdade de
Odontologia. Rio de Janeiro: Faculdade de Odontologia; Centro Biomédico,
Universidade do Rio de Janeiro, 2002. 62 p. Disponível em:
http://www.odontologia.uerj.br/fouerj/download/Manuais/bioseguranca.pdf. Acesso 7
jan 2013.
JOHANSSON, E.; CLAESSON, R.B.; DIJKEN, J.W.V. Antibacterial effect of ozone
on cariogenic bacterial species. J. Dent. 37(6): 449-453, 2009.
JORGE, A. O. C. Microbiologia Bucal. São Paulo: Santos, 1998, 121p
KIM, J.G.; YOUSEF, A.E.; CHISM, G.W. Use of ozone to inactivate microorganisms
on lettuce. J. Food Saf. 19: 17–34, 1999.
KIRCHHOFF, V. W. J. H. Atmosfera Terrestre, Camada de Ozônio e Raios
Ultravioleta. São José dos Campos: INPE; Laboratório de Ozônio, 2002.
KOLENBRANDER, P. E. Oral microbial communites: biofilms, interactions and
genectic systems. An. Rev. Microbiol. 54: 413 - 437, 2000.
KONEMAN, E.W.; ALLEN, S.; JANDA,D. et al. Diagnóstico Microbiológico: Texto
e Atlas Colorido. Rio de Janeiro: Guanabara Koogan, 2001. p 589-660
KONONEN, E.; KANERVO, A.; TAKALA, A.et al. Establishment of oral anaerobes
during the first year of life. J. Dent. Res. 78: 1634-9, 1999.
KORN, M.; PEREIRA, M.G.; BORGES, S.S.; Algumas Aplicações Analíticas dos
Ultra-sons. Bol. Soc. Port. Quím. 96: 23-26, 2005.
74
KOROL, S.; FORTUNATO, M. S.; PAZ, M. et al. Desinfección da agua: acción
comparativa del ozono y cloro sobre un amplio espectro bacteriano. Rev. Argent.
Microbiol. 27: 175-183, 1995.
KUBICA. G.P. Differential identification of micobacteria: I. Tests on catalase activity.
Am. Rev. Respir. Dis. 95: 400-405, 1996.
LEITE, B.; PASCHOLATI, S. F.; KITAJIMA, E. W. et al. Mecanismos de adesão de
bactérias e fungos às plantas hospedeiras. Revisão Anual de Patololia de Plantas
9: 1- 41, 2001.
LENNETTE, E.H.; BALOWS, A.; HAULER, W.J. et al. Manual of Clinical
Microbiology. American Society for Microbiology. Washington (D.C.): American
Society for Microbiology, 1985, 654p.
LEZCANO, I.; PÉREZ, R.; SÁNCHEZ, E. et al. Ozone inactivation of Pseudomonas
aeruginosa, Escherichia coli, Shigella sonneus and Salmonella typhimurium in water.
Ozone Sci. Eng. 21: 293-300, 1999.
LI, Y.; CAUFIELD, P.W. The fidelity of initial acquisition of mutans streptococci by
infants from their mothers. J. Dent. Res. 74: 681 - 685, 1995.
LIMA, S.N.M.; Salvador, S.L.S.; SOUZA, M.C.M. et al. Uso do calor seco na
esterilização (forno de Pasteur). Rev. Paul. Odontol. 12(1): 28-36, 1990.
LINGER, J. B. DERYCKERE, D.; BRANDA, K.K. et al. Evaluation of a hydrogen
peroxide disinfectant for dental unit waterlines. J. Am. Dent. Assoc. 132(9): 12871291, 2001.
LUCAS, V.S.; BEIGHTON, D.; ROBERTS, G.J. Composition of the oral streptococcal flora in healthy children. J. Dent. 28: 45-50, 2000.
MANJI, F.; CHEN, G.; WEI, Z. et al. The epidemiological features of dental caries in
Africam and Chinese populations: iimplications for risk assesment. In: JOHNSON, N.
W. Risk Markers for Oral Diseases: Volume 1, Dental Caries: Markers of High
and Low Risk Groups and Individuals. Cambridge: Cambridge University Press,
1991, p 62-69
MARSH, P. D. Host defences and microbial homeostasis: role of microbial
interactions. J. Dental Res. 68: 1567-1575, 1989.
MARSH, P. D.; NYVAD, B. The oral microflora and biofilms on teeth. In:
FEJERSKOV, O.; KIDD, E. A. M. (ed.). Dental Caries: the Disease and its Clinical
Management. 2. Ed. Oxford, UK: Blackwell Munksgaard, 2003. pp. 163-187.
MARTINES, M. A. U.; DAVOLOS, M. R.; JAFELICCI JÚNIOR, M. O efeito do ultrasom em reações químicas. Quím. Nova 23(2): 251-256, 2000.
75
MECA, L. B.; SOUZA, F. R. N. D.; TANIMOTO, H. M. et al. Influence of preventive
dental treatment on mutans streptococci counts in patients undergoing head and
neck radiotherapy. J. Appl. Oral Sci. 17(Suppl): 5-12, 2009.
MICHELIN, B. D.; MULLER, Z.; STELZL, E. et al. Evaluation of the Abbott Real
assay for quantitative detection of hepatitis C virus RNA. J. Clin. Virol. 38: 96-100,
2005.
NAGAYOSHI, M.; KITAMURA, C.; FUKUIZUMI, T. et al. Antimicrobial effect of
ozonated water on bacteria invading dentinal tubules. J. Endod. 30: 778-781, 2004.
NASCIMENTO, L.C.; LIMA, L.C.O.; VALLE, R.H.P. Uso de derivados clorados,
ozônio e ultra-som na sanificação de água e alimentos. Hig. Aliment. 19: 48-57,
2005.
NAVARRO, R.S., GRÁZIA, V.E.; MICHEL, N.Y. Estudo clínico do comportamento de
escolares mediante escovação supervisionada e motivação no controle de placa
bacteriana. Rev. Odontol. USP 10: 153-157, 2007.
NEWBRUN, E. Preventing dental caries: breaking the chain of transmission. J. Am.
Dent. Assoc. 123: 55-59, 2002.
O´SULLIVAN, D., THIBODEAU, E. Caries experience and mutans streptococci as
indicators of caries incidence. Pediatr. Dent. 18: 371-374, 1996.
OPLUSTIL, C. P. ZOCOLI, C. M.; TOBOUTI, N. R. et al. Procedimentos Básicos
em Microbiologia Clínica. 3. Ed. São Paulo: Sarvier (Almed), 2010, 544 p
POLYDOROU, O.; AHAMAD, H.; WITTMER, A, P. et al. The antibacterial effect of
gas ozone after 2 months of in vitro evaluation. Clin. Oral Invest. 6: 23-26, 2011.
POLYDOROU, O.; PELZ, K.; HAHN, P. Antibacterial effect of an ozone device and
its comparison with two dentin-bonding systems. Eur. J. Oral Sci. 114: 349-353,
2006.
RAKOVSKY, S.; ANACHKOV, M.; ZAIKOV, G. Fields of Ozone Application. In:
ZAIKOV, G.E. Success in Chemistry and Biochemistry: Mind's Flight in Time
and Space Vol. 4. Hauppauge: Nova Science Publishers, 2009. p 1-36
RIBEIRO, A. G.; OLIVEIRA, A. F.; ROSENBLATT, A. Cárie precoce na infância:
prevalência e fatores de risco em pré-escolares, aos 48 meses, na cidade de João
Pessoa, Paraíba, Brasil. Cad. Saúde Pública 21: 1695-1700, 2005.
RICE, R.G. Application of ozone in water and wastewater treatment. In:
CHELSEA,M.I.; LEWIS,I. Analytical Aspects of Ozone: Treatment of Water and
Wastewater. Chelsea: Lewis Publishers, 2006, p 7-26
RÖSING, C. K.; LOESCHE, W. Halitosis: an overview of epidemiology, etiology and
clinical management. Braz. Oral Res. 25 (5): 466-471, 2011.
76
RUTULA, W. A. Disinfection and sterilization of patient-care items. Infect. Control
Hosp. Epidemiol. 17: 377-384, 1996.
SALVADOR, A.; ABAD, I.; ARNAL, L.; et al. Effect of ozone on postharvest quality of
persimmon. J. Food Sci. 71: 443-446, 2006.
SÁNCHEZ, P.L.; SÁENZ M.L. Cuantificación del grupo mutans em saliva y placa em
el médio MSB. Bol. Med. Hosp. Infant. Mex. 58(10): 694-702, 2001.
SCHERBA, G.; WEIGEL, R.M.; BRIEN, Jr.W.D. Quantitative assessment of the
germicidal efficacy of ultrasonic energy. Appl. Environ. Microbiol. 57: 2079 - 2084,
1991.
SHARMA, M.; HUDSON, J. B. Ozone gas is an effective and practical antibacterial
agent. Am. J. Infect. Control. 36: 559-563, 2008.
SHELDON, B.W.; BROWN, A.L. Efficacy of ozone as a disinfectant for poultry
carcasses and chill water. J. Food Sci. 51: 305-309, 1996.
SIMÕES, C.C.; ARAÚJO, D.B.; ARAÚJO, R.P.C. Estudo in vitro e ex vivo da ação de
diferentes concentrações de extratos de própolis frente aos microrganismos
presentes na saliva de humanos. Rev. Bras. Farmacogn. 18: 84-89, 2008.
SNATURAL & NATURALTEC. Ozônio Desinfectante. Disponível em:
http://www.snatural.com.br/Tratamento-Agua-Ozonio.html. Acesso em: 20 jun. 2013.
SOCIEDADE BRASILEIRA DE ENFERMEIROS DE CENTRO CIRÚRGICO
(SOBECC). Recuperação Anestésica e Central de Material e Esterilização. São
Paulo: SOBECC, 2001.
SONG, S.; XIA, M.; HE, Z.; et al. Degradation of p-nitrotoluene in aqueous solution
by ozonation combined with sonolysis. J. Hazard Mater. 144(1-2): 532-537, 2007.
SOUZA FILHO, M. D.; CARVALHO, D. F.; MARTINS, M.C.C.; Consumption of sugarrich foods and dental caries in preschool children. Arq. Odontol. 46: 215-222, 2010.
SPOLIDORIO, D. M. P. Biotipos de Streptococcus grupo mutans e avaliação de
parâmetros clínicos e microbiológicos entre escolares de diferentes classes
socioeconômicas. 1997.121p. Tese (Mestrado em Odontologia) - Universidade
Estadual de Campinas, Campinas.
STEELE, J.G.; SANDERS, A.E.; SLADE, G.D. et al. How do age and tooth loss affect
oral health impacts and quality of life? A study comparing two national samples.
Community Dent. Oral Epidemiol. 32: 107-114, 2004.
SUSLICK, K.S.; GRINSTAFF, M.W. Protein microencapsulation of nonaqueous
liquids. J. Am. Chem. Soc. 112: 7807-7809.1990.
SUSLICK, K.S.The chemical effects of ultrasound. Science 247: 1439, 1990.
77
TAYLOR, R.R.L.; NURKIN, N., CRUZ, I. et al. Associação entre doença periodontal e
síndrome coronariana aguda. Arq. Bras. Cardiol. 88(2): 185-190, 2007.
TORRES, E.A.F.S.; RIMOLI, C.D. R.; OLIVO, R. et al. Estudo das propriedades
desinfetantes do ozônio em alimentos. Revista Higiene Alimentar 10(42): 18-22,
1996.
VASCONCELOS, L.C.S.; SAMPAIO, F.C.; SAMPAIO, M.C.C. et al. Minimum
inhibitory concentration of adherence of Punica granatum Linn (pomegranate) gel
against S. mutans, S. mitis and C. albicans. Braz. Dent. J. 17: 223-227, 2006.
VELANO, H.E.; NASCIMENTO, L. C.; BARROS, L. M. et al. Avaliação in vitro da
atividade antibacteriana da água ozonizada frente à Escherichia coli. Rev. Bras.
Clín. Ter. 28(6): 226-231, 2002.
WILLIAMS, A. R. Phonophoresis: an in vivo evaluation using three topical
anaesthesic preparations. Ultrasonics 28(3): 137-141, 1990.
YAMAYOSHI, T.; TATSUMI, N.Microbicidal effects of ozone solution on methicillinresistant Staphylococcus aureus. Drugs Exp. Clin. Res. 19: 59-64, 1993.
YAN, W.; ZHANG, H.; CHEN, L. et al. Ozonation combined with ultrasound for the
degradation of tetracycline in a rectangular air-lift reactor. Sep. Purif. Technol. 84(9):
138-146, 2012.
78
ANEXO A. TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
Solicito através deste termo a sua colaboração para participar desta pesquisa, cujo
título é: “OZONIZAÇÃO E SONICAÇÃO NA DESINFECÇÃO DE INSTRUMENTAIS
ODONTOLÓGICOS”, aprovada no Comitê de Ética da Universidade Camilo Castelo
Branco sob o CAAE: 401042, e número de processo: 3362-3582/11,sendo que a sua
contribuição ao pesquisador será a obtenção do título de mestre em Bioengenharia
pela Universidade Camilo Castelo Branco. Você foi convidado a participar deste
estudo por estar em tratamento odontológico na Clínica de Odontologia desta
Universidade e estar entre a faixa etária de 18 a 45 anos.
Este estudo objetiva-se identificar os efeitos do ozônio na desinfecção e controle
microbiológico em instrumentais clínicos odontológicos, e analisar o potencial de
desinfecção do ultra-som comparado-o com a ozonização.
Será coletado com auxílio de um instrumental, (a cureta) esterilizado da microbota
de sua boca, especificamente nos dentes que apresentarem cáries, avaliados pelo
aluno do sétimo e oitavo semestre do curso de odontologia selecionado pelo
professor da disciplina específica de seu tratamento, especificamente, o aluno que
estiver em seu acompanhamento.
Lembro que você poderá desistir da pesquisa quando quiser. Em caso de afirmação
na participação deste estudo, você terá total liberdade para recusar-se em participar
ou retirar o seu consentimento em qualquer fase do trabalho. Esclareço que serão
respeitados os preceitos éticos, garantindo sigilo total e anonimato quanto aos dados
confidenciais envolvidos nesta pesquisa. Esclareço também que não haverá nenhum
pagamento para sua participação na pesquisa.
O participante poderá entrar em contato com a pesquisadora Pámela Maria Moreira
Fonseca RG: 11.513.321 ou CPF: 055.855.656-64, nos telefones: 6688-5045/ 38957650 com o orientador desta pesquisa: Prof.Dr. Carlos José de Lima, CPF:
052.365.168-62, telefone: (12) 3905 4401. Desde já antecipo o agradecimento e a
atenção que me foi dada.
São Paulo, ___ de ___________de _______________________________
2011.
_
_____________________________
Assinatura da pesquisadora
Assinatura do (a) participante
79
ANEXO B. PROTOCOLO DE AUTORIZAÇAO DA PESQUISA
EMITIDA PELO .P DA UNICASTELO