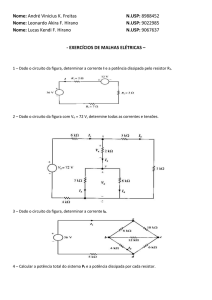
CARACTERÍSTICAS DE UMA PILHA
A expressão corrente “pilha eléctrica” designa um
gerador electroquímico não recarregável.
GERADOR ELECTROQUÍMICO:
Um gerador electroquímico é um dispositivo capaz de
transformar energia química em energia eléctrica, podendo
comportar um ou vários elementos. Quando ele é não
recarregável é designado pelo termo “PILHA” ou “PILHA
PRIMÁRIA”, quando é recarregável designa-se por “
ACUMULADOR”
ou
“BATERIA”
ou
“PILHA
SECUNDÁRIA”.
INTERESSE NO USO DAS PILHAS:
O grande interesse das pilhas é o de fornecer energia
eléctrica em locais isolados da rede ( ex: aparelhos portáteis)
com disponibilidade imediata (sem tempos de espera), com
um controle perfeito de potência através do circuito exterior
( nos limites de potência máxima), com possibilidade de
paragem e de arranque sempre que se queira, e geralmente
sem peças móveis e sem necessitar de qualquer tipo de
assistência técnica.
1
PILHA DE VOLTA
A primeira pilha foi descrita em 1800 por Alessandro
VOLTA. Ela era constituída por um empilhamento de discos
de cobre e zinco em alternância, entre os discos foi colocado
um cartão embebido numa solução salina. O termo pilha
surgiu do facto de se efectuar um empilhamento de discos.
INCONVENIENTE: Nos processos redox que ocorrem nesta
pilha participam o CO2 e o O2 do ar.
2
PILHA DE DANIELL
3
PILHA DE LECLANCHÉ
(Pilha Seca)
A pilha de Leclanché ( par Zn/MnO2) é um exemplo
de uma das pilhas mais usuais do mercado.
Cátodo: Mistura de óxido de
manganês, eléctrodo de carbono
(colector)
Ânodo: Zinco
Electrólito: pasta de
MnO2,C,NH4Cl,ZnCl2,H2O
Após migração os iões Zn2+ são complexados no cátodo pelas
moléculas de NH3.
4
Princípio de funcionamento
Compartimento Anódico:
Zn + 2NH4+ -----
[Zn (NH3)2]2+ + 2H+ + 2e
(1)
n=2 ; Eº1 = -1,1 V/ENH
Compartimento Catódico:
MnO2 + NH4+ + 1e- ----
Mn OOH + NH3
(2)
m= 1 ; Eº2 = +0,5Volts/ ENH
Na pilha de Leclanché o separador pode ser um papel
impregnado numa solução aquosa saturada de cloreto de
amónio (NH4Cl), geleificada para impedir fugas do
electrólito para o exterior da pilha, por isso se designa esta
pilha por pilha seca.
A tensão em circuito aberto ou força electromotriz, f.e.m.,
nas condições padrão, é obtida calculado a diferença entre os
potenciais de redução padrão do cátodo (Eº2) e do ânodo
(Eº1).
Eº2 = +0,50V ; Eº1 = -1,1V
f.e.m = 0,5 – (-1,1)
f.e.m = + 1,6V
5
A f.e.m. está relacionada com as grandezas
termodinâmicas da reacção global como a
energia livre de Gibbs (∆G):
f.e.m. = - ∆G (3)
n.F
Zn + 2NH4+ + 2 MnO2 -----
[Zn (NH3)2]2+ + 2 Mn OOH
∆G = - 309 kJ ; f.e.m. = 1,6V
A energia livre de Gibbs, ∆G, representa a energia
máxima que o sistema pode fornecer ao exterior, na
prática esta energia diminui devido às perdas por
efeito de joule (queda óhmica) no seio do electrólito e
a nível dos eléctrodos, para além das perdas devido à
polarização dos eléctrodos.
6
O eléctrodo negativo adquire um potencial um pouco
superior ao potencial de equilíbrio do par redox 1
(sobretensão positiva) o que facilita a ocorrência da reacção
(1), o eléctrodo positivo adquire um potencial inferior ao do
par redox 2 (sobretensão negativa) o que facilita a reacção
(2). As sobretensões dos eléctrodos criam um campo
eléctrico que provoca a migração dos iões no electrólito e,
por conseguinte, a passagem de corrente na pilha. Os aniões
(ex: Cl-) dirigem-se em direcção ao eléctrodo cuja
sobretensão é positiva ou seja o ânodo. Os catiões (ex: NH4+;
[Zn (NH3)2]2+) dirigem-se para o eléctrodo cuja sobretensão
é negativa ou seja o cátodo.
Durante o funcionamento da pilha podem ocorrer
modificações dos meios anódicos e catódicos. Na pilha
de Leclanché, a nível do ânodo criam-se mais iões H+,
do que iões que migram de NH4+, há acumulação de
ácido clorídrico que pode provocar a corrosão do
ânodo de zinco que neste caso constitui a “caixa” da
pilha. No compartimento catódico o meio torna-se
básico.
O gradiente de pH assim criado diminui a f.e.m., que
volta a subir progressivamente quando a pilha fica
um período em repouso porque permite a difusão dos
iões H+ e de NH3 entre os compartimentos catódico e
anódico.
7
PRINCIPAL INCONVENIENTE DAS PILHAS
DE LECLANCHÉ
A f.e.m. é variável durante a descarga devido a dificuldades
de difusão dos iões Zn2+, forma-se uma camada isolante de
NH3 junto do cátodo.
Obtém –se uma curva do potencial em função do tempo do
tipo
E
(V)
A inclinação da curva
depende da intensidade
de corrente debitada
t (h)
8
PERFORMANCES DE UMA PILHA
Uma PILHA para além da sua geometria e do
seu peso, é também caracterizada pela sua
capacidade,
tensão,
curva
de
descarga, potência, o seu comportamento
em relação à temperatura de trabalho, para
além da facilidade de armazenamento e
finalmente o seu preço.
9
CAPACIDADE:
A capacidade é medida em Ampère-hora (Ah);
Regra geral é usado um excesso de uma das
massas activas;
Na pilha de Leclanché é o MnO2 que limita a
capacidade da pilha
CAPACIDADE NOMINAL
Corresponde à capacidade da pilha que é possível
obter nas condições normais de utilização.
Para uma pilha de Leclanché R20 a capacidade
nominal é de ~ 4Ah ( 40 mA durante 100h).
CAPACIDADE ESPECÍFICA
E CAPACIDADE VOLÚMICA
Pode-se caracterizar uma massa activa pela sua
capacidade específica ou volúmica.
Exemplo:
Capacidade específica do Zn = 820 Ah/kg
10
TENSÃO E CURVAS CARACTERÍSTICAS
Em funcionamento, a f.e.m. de uma pilha, depende da
corrente e da “história” anterior da pilha (ex: 1.0V a 1.2V
para uma pilha de Leclanché).
As pilhas também são caracterizadas pelas suas curvas de
polarização,
E = f(I)
E: Tensão ;
I: intensidade da corrente
e pelas suas curvas de descarga,
E= f(capacidade de descarga)
11
POTÊNCIA
A potência de uma pilha é medida em watts, é o
produto da tensão dos extremos, E, pela intensidade
de corrente, I, tem-se,
P = E.I
A potência é fraca quando a corrente é fraca (I~0) e
quando a corrente é forte (E~0).
Na vizinhança de ½ da tensão nominal, ela passa por
um máximo, nesse momento metade da energia é
transformada em calor dentro da pilha. Por
conseguinte, não é aconselhável fazer funcionar uma
pilha em contínuo a mais de ¼ da sua potência
máxima. Este valor pode ser obtido sem perigo
quando a pilha funciona de forma intermitente ou
por impulsos.
12
ENERGIA
A energia (W) fornecida por uma pilha é dada pelo integral,
em relação ao tempo, da potência (E.I) fornecida ao exterior,
W= ∫ E.I . dt
a energia é máxima para fracas potências ( E elevado) o
que corresponde a uma descarga completa.
A energia máxima prática é obtida para um regime de
funcionamento normal ( 200h para uma pilha de Leclanché, 20h
para uma pilha alcalina Zn/MnO2, ...). Utiliza-se muitas vezes a
energia específica (Wh/kg) e a energia volúmica
(Wh/dm3) (1Watt-hora = 3 600 Joules) para caracterizar os
tipos de pilhas. Elas variam de ~50 Wh/kg
para as pilhas
Leclanché, a mais de 500 Wh/kg para as pilhas Li/SO Cl2, e de
100 Wh/dm3 a 1200 Wh/dm3. Para as pequenas pilhas (pilhas
botão) é a energia volúmica que conta ( 230 Wh/dm3 para
Zn/MnO2 alcalina a 950 Wh/dm3 para Zn-ar).
13
Comportamento da pilha em função da temperatura
Uma elevação da temperatura aumenta a condutibilidade
do electrólito e a velocidade de difusão dos reagentes e
produtos. Em consequência a potência máxima cresce
fortemente com a temperatura (e inversamente diminui
fortemente a frio).
O funcionamento de uma pilha pode ser bloqueado
abaixo de uma temperatura limite (limite inferior) devido
à precipitação de sais do electrólito (ex: -20ºC para a
pilha de Leclanché).
O comportamento de uma pilha pode tornar-se perigoso
quando utilizada a uma temperatura superior à sua
temperatura máxima de funcionamento.
14
CONSERVAÇÃO E AUTODESCARGA
Uma pilha é um sistema que não se encontra em
equilíbrio termodinâmico, mas deve responder aos pedidos.
È por isso natural que exista uma certa autodescarga , cuja
importância depende muito dos separadores. Em geral um
separador eficaz é também resistente.
A corrosão do ânodo é uma das causas mais frequentes de
auto descarga. O ânodo deve ser passivo nos períodos de repouso e
activo nos períodos de funcionamento. O zinco e o lítio são dois
metais que possuem esta propriedade.
O zinco pode ser passivado pelo mercúrio (amalgama) e continuar
electroquimicamente activo, esta passivação não é porém absoluta.
A capacidade de uma pilha, com ânodo de zinco, depende do tempo
e da temperatura de armazenamento. De salientar que a
autodescarga é mais rápida a quente.
15
PREÇO
As pilhas eléctricas não representam o meio mais
económico de produzir electricidade. O seu custo depende
essencialmente da tecnologia de montagem e um pouco dos
materiais, mas pode ser considerado baixo face ao serviços
prestados tendo em conta o preço do aparelho que é
alimentado.
16
PILHAS ALCALINAS
Pilha Zn-MnO2 “Alcalina”
Trata-se de uma pilha de potência, adaptada ao serviço contínuo para
aparelhos electrónicos e portáteis com motor (ex: aparelhos fotográficos,
gravadores...). O electrólito é o hidróxido de potássio aquoso (KOH) a
30%, saturado em zincato de potássio. Trata-se de um electrólito bastante
condutor, conduz a corrente eléctrica a temperaturas extremamente baixas
até - 40º C. O MnO2 usado é de boa qualidade. Em meio alcalino a
transformação Mn IV em Mn III é bastante rápida e parcialmente
reversível. Afim de aumentar a potência, o zinco pulverizado é disperso no
electrólito geleificado e colocado no centro com um colector de corrente em
latão. O MnO2 é colocado contra a caixa da pilha de aço. A tensão em
circuito aberto varia de 1.55V a 1.0V de acordo com o estado da carga.
As pilhas alcalinas existem em vários formatos comerciais, desde as pilhas
“botão” até ao formato R 20, as mais correntes são as R 6. Uma pilhas R 20
pode fornecer 0.5A durante 20h para uma tensão acima de 0.9V. A alimentação
de motores de aparelhos fotográficos é muitas vezes assegurada por um
conjunto de vários geradores elementares colocados em série de modo a obterse uma tensão elevada (9 V).
Pode ser perigoso de colocar em curto-circuito pilhas alcalinas novas. O
aquecimento resultante pode provocar a abertura brutal da pilha com
projecção de potassa (KOH) caustica quente.
17
PILHA Zn-MnO2 ALCALINA
No eléctrodo positivo, a redução de MnO2 gera iões HO-:
MnO2 + H2O + 1e
MnOOH + HO-
no eléctrodo negativo, iões HO- são consumidos:
Zn + 2HO-
ZnO + H2O + 2e
18
A corrosão do zinco puro finamente dividido seria muito
rápida se não fosse a presença do mercúrio. A presença
deste metal pesado causa problemas ecológicos. De acordo
com as directivas do Conselho Europeu estão interditas as
pilhas alcalinas com mais de 0,025% em peso de mercúrio.
Em geral a quantidade de zinco é limitante, quando a pilha
está completamente descarregada, o zinco desapareceu
completamente e por conseguinte a corrosão cessa, o mesmo
não acontece com as pilhas de Leclanché.
A autodescarga é em princípio fraca da ordem dos 5% por
ano à temperatura de 20ºC, a sua limitação exige um
controlo estrito da pureza dos materiais e da limpeza dos
materiais de produção.
19
Em circuito aberto a tensão de uma pilha alcalina nova
é da ordem dos 1,58V. Quando a pilha trabalha em
circuito fechado a tensão decai gradualmente em
função da intensidade da descarga.
20
VANTAGENS DA PILHA ALCALINA Zn-MnO2
COMPARADA COM A PILHA TIPO LECLANCHÉ
Descarga menos acentuada que a pilha de Leclanché;
Resistência interna mais baixa do que a pilha de
Leclanché;
Melhor performances a baixas temperaturas;
Densidade energética mais elevada (230Wh/dm3 );
Melhor serviço de manutenção;
As pilhas alcalinas embora sejam duas vezes mais caras que
as pilhas salinas tornam-se mais económicas em aplicações
que exijam potência ou quando se trabalha a baixas
temperaturas.
21
ACUMULADORES, BATERIAS,
PILHAS SECUNDÁRIAS
Uma característica importante dos acumuladores
ou pilhas secundárias é que são recarregáveis.
Durante a descarga há transformação de energia
química em energia eléctrica. Durante a carga
fornece-se energia eléctrica de modo a forçar a
ocorrência de reacções electroquímicas de forma a
restabelecer
as
massas
activas
que
foram
transformadas durante a descarga.
A primeira bateria a ser comercializada foi a
bateria de chumbo de Planté a partir de 1859,
usada inicialmente como bateria de carros.
22
BATERIA DE CHUMBO
EM MEIO ÁCIDO
1- BATERIA DE CHUMBO - PRODUÇÃO
As placas que constituem a bateria são constituídas por
grelhas de chumbo com aberturas de cerca de 0,5x1,0cm. O
chumbo é muitas vezes amalgamado com antimónio de
forma a aumentar a dureza do chumbo. A pasta de óxido de
chumbo (II) é feita com água e é espalhada pelas grelhas de
chumbo. Quando este material fica seco forma-se uma pasta
porosa de PbO na grelha de chumbo, tal é ilustrado no
esquema abaixo.
23
As placas assim constituídas são imersas numa solução 6M
de ácido sulfúrico. Ás extremidades das placas é imposta
uma
tensão
de
forma
a
ocorrerem
as
reacções
electroquímicas:
PbO + 2H+ + 2e
PbO + 2H2O
Pb + H2O
PbO2 + 2H+ + 2e
Passamos então a ter dois eléctrodos modificados que podem
funcionar como eléctrodos de uma bateria de chumbo. A
voltagem de um par destes eléctrodos é de cerca de 2V, as
baterias dos carros são em geral de 12V, isto significa ligar
em série seis pares de eléctrodos modificados.
24
25
26
2- DESCARGA DE UMA BATERIA DE CHUMBO
Quando a bateria é usada como fonte de corrente as
reacções que ocorrem são as seguintes;
PbO2 + 4H+ + 2e + SO4 2Pb + SO42-
PbSO4 + 2H2O
PbSO4 + 2e
e a reacção global é :
PbO2 + Pb + 2SO42- + 4H+
2PbSO4 + 2H2O
se combinarmos os iões H+ e os iões SO42- tem-se;
PbO2 + Pb + 2H2SO4
2PbSO4 + 2H2O
Durante a descarga, os iões Pb2+ que se formam precipitam
com os iões sulfato. O sulfato de chumbo fica agarrado às
grelhas de chumbo polarizando os eléctrodos aumentando
assim as resistências internas com o tempo de descarga. À
medida que o sulfato de chumbo se acumula por vezes acaba
por cair para o fundo da bateria, isto traduz-se numa perda
de massa por parte da bateria.
27
3- RECARGA DE UMA BATERIA DE CHUMBO
Quando a bateria de chumbo deixa de funcionar significa
que pelo menos uma das massas activas se esgotou, ou então,
que os eléctrodos estão de tal forma polarizados que deixa de
existir uma d.d.p. entre eles pois as suas superfícies passam a
ter a mesma composição química.
Neste caso aplicamos uma d.d.p. nos extremos da bateria,
invertemos o processo (célula electrolítica), forçamos as
reacções inversas a ocorrerem por passagem de corrente
eléctrica de forma a regenerarmos as massas activas.
Atenção uma recarga rápida pode provocar a electrólise
do ácido com formação do gás hidrogénio o que ocasiona
perigo de explosão.
28
4- VOLTAGEM
A voltagem em circuito aberto de uma bateria de chumbo
comercial é de 2,15V por cada célula. A voltagem depende
da composição química da bateria.
5- CAPACIDADE
A capacidade da bateria é variável depende da quantidade
de massa activa que contém. As células individuais podem
ter gama de valores desde 1Ah a alguns milhares de amperehoras.
A capacidade da célula está essencialmente ligada ao
número de electrões produzidos.
Podemos aumentar a capacidade da bateria conectando em
série várias células.
29
30