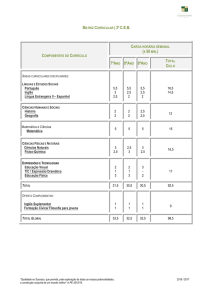
Cinética de Reação
Introdução
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
1
Cinética das Reações: Introdução
• Físico-Química
– Termodinâmica: composição final do sistema
– Cinética:
• variações no tempo; velocidade em função do tempo
• Produção em velocidade otimizada
Rendimento da reação química
Tempo para atingir o rendimento
Termodinâmica: relação
entre produtos e reagentes:
K
(Constante de Equilíbrio)
Cinética:
mecanismo envolvido:
k
(Constante de Velocidade)
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
2
Cinética das Reações: Introdução
• Objetivos da Cinética
– quantificar a velocidade da reação (teórica e/ou empiricamente)
• Depende das variáveis de processo (ver adiante quais são).
• Depende de resultados experimentais: o conhecimento da curva de
produção em função do tempo permite previsões.
– mecanismo da reação (conhecimento das etapas reais da reação ou
quais os estados do sistema durante a reação)
• Depende de pesquisa científica. Nem sempre é possível chegar ao
mecanismo real.
• O conhecimento do mecanismo permite alterações no processo e sua
otimização.
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
3
• Processos em Metalurgia e Materiais:
– são Reações Químicas (e Eletroquímicas – PMT2423)
– a condição ótima é obtida estudando-se as
variáveis de processo que são:
• Tipo de processo (p.ex. pirometalurgia ou hidrometalurgia)
• Tipo(s) de equipamento(s) (p.ex. Siemens-Martin, EOF - Energy
Optimizing Furnace)
• Forma do reagente e do produto (p.ex. sólido ou líquido;
tamanho de partículas (finas ou grossas))
• T; P; concentração dos reagentes (taxa de fornecimento de
reagente, se houver)
• catalisadores
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
4
– estas variáveis agem sobre:
• VELOCIDADE DA REAÇÃO
– CATALISADOR: altera a velocidade sem alterar o
equilíbrio (altera o mecanismo: altera k sem alterar K)
– TEMPERATURA : difusão (transporte de massa); pode
alterar o mecanismo (altera k e K)
– CONCENTRAÇÃO DE REAGENTES : altera a
probabilidade de colisão entre reagentes em reações
homogêneas; altera atividade (altera r sem alterar k e K)
– INTERFACES: sistemas heterogêneos
• EQUILÍBRIO DA REAÇÃO
– TEMPERATURA : altera as concentrações do equilíbrio
(pois altera K !)
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
5
Tipos de Reações
• HOMOGÊNEAS
– uma única fase: sólida, líquida ou gasosa
(implica uniformidade de T, P e composição)
– variáveis: creagentes , T
• HETEROGÊNEAS
– mais de uma fase: INTERFACE
– variáveis: creagentes , T, parâmetros de
Transferência de Calor e Transporte de Massa
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
6
Exemplos: Homogêneas
• Fase gasosa:
CO + ½ O2 = CO2
CO + H2O = CO2 + H2
• Fase líquida:
• líquidos usando H+ como catalisador.
• Fase sólida:
– decomposição espinodal: precipitação de fase
´ em ligas Fe-Cr.
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
7
Exemplos: Heterogêneas
• Sólido/Gás:
• Óxidos de Me + CO; Coque + O2
• Sólido/Líquido:
• Sem transferência de carga elétrica: dissolução química
• Com transferência de carga elétrica (PMT2423): corrosão,
eletrodeposição, electroforming
• Líquido/Líquido:
• Metal/Escória
• Líquido/Gás:
• Refino e purificação de Metais e Ligas
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
8
Exemplos: Heterogêneas
• Sólido/Gás:
– Queima do coque:
C + O2 = CO ou CO2
– Ustulação de PbS, ZnS, Cu2S, NiS:
PbS + 3/2 O2 = PbO + SO2
– Cementação (gasosa) de aço:
2CO = CFe,s + CO2
– Nitretação (gasosa) de aço:
N2(g) = 2NFe,s
– Gás com catalisador sólido:
formação de H2O a partir de H2 e O2 usando superfície de Pt.
– Reação de Adsorção
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
9
Processos de Nitrocarbonetação de aços: Gás; Líquido e Plasma
Instalações do processo
Tenifer-Tenox
(Brasimet/Bodycote)
para Nitrocarbonetação
em banho de sais.
Referência:
ZANETIC, S.T. Tese de
Doutorado, fev/2006.
Reações no processo Tenifer-Tenox:
4NaCN + 2O2 4NaCNO
8NaCNO 2Na2CO3 + 4NaCN + CO2 + CFe + 4NFe
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
11
Ataque: água régia
1200
(NBS-S)
Microdureza (HV)
1000
800
600
400
200
0
20
40
60
80
Profundidade da camada (m)
100
Micrografias e Perfil de Dureza
da camada obtida por Nitrocarbonetação
Tenifer-Tenox (Brasimet) de aço 304.
Ref.: ZANETIC, S.T. Tese, fev/2006.
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
12
Análise de difração de raios X:
; ´;CrN;Fe3O4
UNS-S-30400;NBS-S
CrN (602)
5000
CrN (004)
Fe4 N (222)
CrN (222)
Fe4 N (222)
1000
CrN (113)
Fe3 N (030)
Fe4 N (220)
CrN (220)
Fe3 N(030)
Fe4 N (002)
2000
Fe4 N (111)
3000
Fe3 0 4 (113)
CrN (111)
Intensidade (cps)
4000
0
40
50
60
70
80
90
100
110
120
2 Theta (graus)
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
13
Exemplos: Heterogêneas – cont.
• Líquido/Líquido:
– Reações Metal / Escória com difusão
– Reações Metal / Escória com transferência de elétrons (PMT2423)
• Líquido/Gás:
– Descarburação do Gusa
– Nitretação de aço ou outros metais: N2(g) = 2NFe,l
– Remoção de hidrogênio do aço líquido usando argônio:
HFe,l = H2,dissolvido em Ar
• Sólido/Sólido
– Redução de óxidos de metais com mais de um reagente
sólido: FeO + C = Fe + CO
– Precipitação de fases sólidas: = + Fe3C em aços
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
14
Aciaria: exemplo de
reação Líquido / Líquido:
Mel / Escl
Conversor de aço (primeiros projetos). (Ref.: CHAPTER XI: THE
GENESIS OF THE BESSEMER PROCESS.
http://www.history.rochester.edu/ehp-book/shb/
em 01/8/08.
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
15
Forno Siemens-Martin
Ref.: COLPAERT, H. Metalografia dos Produtos Siderúrgicos Comuns. p.10-12; 3a. edição – 4a. reimpressão: 1992.
• forno horizontal longo com diversas aberturas
laterais para a carga; as impurezas são
removidas pelas reações com óxidos de Fe na
escória.
• o aquecimento é obtido pela queima de um
combustível gasoso ou óleo que é insuflado
com ar aquecido por uma das extremidades do
forno; os produtos da combustão saem pela
extremidade oposta;
• os gases com temperatura elevada passam por
um empilhamento de tijolos (recuperador)
onde cedem calor, dirigindo-se em seguida à
chaminé; o sentido dos gases é invertido e o
aquecimento é feito no recuperador (no caso
de forno a óleo, apenas o ar é pré-aquecido
nos recuperadores);
• a produção diária dos fornos SM varia de 60 a
350 t;
• a duração de uma corrida - desde o
carregamento até o vazamento – de cerca de
100 t é da ordem de 12 h.
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
16
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
17
Exemplos: Heterogêneas – cont.
• Líquido/Líquido:
– Reações Metal / Escória com difusão
– Reações Metal / Escória com transferência de elétrons (PMT2423)
• Líquido/Gás:
– Descarburação do Gusa
– Nitretação de aço ou outros metais: N2(g) = 2NFe,l
– Remoção de hidrogênio do aço líquido usando argônio:
HFe,l = H2,dissolvido em Argônio
• Sólido/Sólido
– Redução de óxidos de metais com mais de um reagente
sólido: FeO + C = Fe + CO
– Precipitação de fases sólidas: = + Fe3C em aços
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
18
Aciaria: exemplo de reação Líquido / Líquido:
Mel / Escl / Gás (Processo Linz-Donawitz ou LD ou Conversor a Oxigênio)
Linz, cidade da
Áustria; Donawitz,
região próxima de
Linz. (Siderúrgica:
Voest-Alpine)
Conversor de aço
(primeiros projetos).
(Ref.: CHAPTER XI:
THE GENESIS OF THE
BESSEMER PROCESS.
http://www.history.roche
ster.edu/ehp-book/shb/
em 01/8/08.
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
19
Conversor Bessemer
Ref.: COLPAERT, H. Metalografia dos produtos siderúrgicos comuns. p.10-12. 3a. edição – 4a. reimpressão: 1992.
• forno basculante em cujo fundo se
encontram orifícios através dos quais
passa ar sob pressão, que borbulha
através da carga líquida;
• as corridas são de 10 a 30 t (há de
60t – ex: Siderúrgica Aliperti anos
80-90);
• o ar insuflado é frio e o calor do
banho é mantido pelas reações
exotérmicas do oxigênio do ar com
silício, manganês e carbono;
• a soprada é da ordem de 15min
(Siderúrgica Aliperti: 60t / 20 min,
mas o forno era do tipo EOF);
• no conversor não se eliminam P e S.
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
20
Exemplos: Heterogêneas – cont.
• Líquido/Líquido:
– Reações Metal / Escória com difusão
– Reações Metal / Escória com transferência de elétrons (PMT2423)
• Líquido/Gás:
– Descarburação do Gusa
– Nitretação de aço ou outros metais: N2(g) = 2NFe,l
– Remoção de hidrogênio do aço líquido usando argônio:
HFe,l = H2,dissolvido em Argônio
• Sólido/Sólido
– Redução de óxidos de metais com mais de um
reagente sólido: FeO + C = Fe + CO
– Precipitação de fases sólidas: = + Fe3C em aços
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
21
•
Bibliografia:
– LEVENSPIEL, O. Chemical Reaction Engineering. New York, John
Wiley & Sons, 1972 (Copyright: 1972, 1962). Ou: LEVENSPIEL, Octave.
Chemical Reaction Engineering. Third Edition, United States of America,
John Wiley & Sons, c1999. [541.124^L576c3]
•
Leitura Complementar:
– LEVENSPIEL, Octave. Chemical Reaction Engineering. Third Edition,
United States of America, John Wiley & Sons, c1999. [541.124^L576c3]
• Chapter 1 – Overview of Chemical Reaction Engineering
– DARKEN, L. S. Kinetics of metallurgical reactions with particular
referencee to the Open Hearth. In: ELLIOT, J. F. editor The Physical
Chemistry of Steelmaking, proceedings of the Conference The Physical
Chemistry of Iron and Steelmaking, 28 may – 3 june, 1956. New York,
MIT, Massachussetts Institute of Technology, c1958. [669.18^C76c]
– SMITH, J. M. Chemical Engineering Kinetics. International Student
Edition. Second Edition, Tokyo, McGraw-Hill Kogakusha, LTD, 1970.
[541.124 Sm61c2]
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
22
Velocidade de Reação
Definição
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
23
Velocidade de Reação: Definição
A, B, C,… são
componentes de
uma reação:
rB
dn B número de mols de B formados
dt
tempo
• Medir a velocidade
em relação a B é:
– medir a relação
entre o número de
mols de B
transformados por
unidade de tempo
– velocidade sempre
é um número
positivo
dn B
dt
quando B é produto :
rB
quando B é reagente :
rB
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
dn B
dt
24
Modos de Expressar a Velocidade: efeito do tamanho do sistema
NORMALIZAÇÃO DA VELOCIDADE
Cuidado com características do processo:
•Um béquer de 2 L produz 20 mol.min-1 de produto por reação homogênea.
•Um béquer de 3 L produz 30 mol.min-1
•Se a reação é a mesma, a velocidade também é a mesma.
O que mudou foi o tamanho do sistema.
•Levando-se em conta o tamanho do sistema, a velocidade é a mesma:
10 mol.min-1.L-1
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
25
Relação entre as velocidades tomando-se os diferentes
componentes da reação:
aA bB cC
dn A
dn B dn C
a
b
c
dn C
dn A
dn B
V.dt.a
V.dt.b V.dt.c
rA rB rC
a
b c
a
a
rA rB rC
b
c
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
26
Modos de Expressar a Velocidade: efeito do tamanho do sistema
Conforme o problema cinético, a velocidade pode ser expressa como:
1. por unidade de volume do fluido reagente
rB
1 dn B (número de mols de B formados)
V dt
( volume do fluido )( tempo)
2. por unidade de massa do sólido em sistemas fluido/sólido
rBw
1 dn B (número de mols de B formados )
w dt
(massa do sólido)( tempo)
3. por unidade de área da superfície interfacial (de dois líquidos ou de sistemas fluido/sólido)
rBS
1 dn B ( número de mols de B formados )
S dt
(área )( temp o)
4. por unidade de volume do sólido em sistemas fluido/sólido
V
rB Sol
1 dn B (número de mols de B formados)
VSol dt
( volume do sólido)( tempo)
5. por unidade de volume do reator (se diferente do volume do fluido)
V
rB reator
dn B (número de mols de B formados )
Vreator dt
( volume do reator)( tempo)
1
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
27
Modos de Expressar a Velocidade: efeito do tamanho do sistema
Conforme o problema cinético, a velocidade pode ser expressa como:
1. por unidade de volume do fluido reagente
rB
1 dn B (número de mols de B formados )
V dt
( volume do fluido )( tempo)
2. por unidade de massa do sólido em sistemas fluido/sólido
rBw
1 dn B (número de mols de B formados)
w dt
(massa do sólido)(tempo)
3. por unidade de área da superfície interfacial (de dois líquidos ou de sistemas fluido/sólido)
rBS
1 dn B (número de mols de B formados)
S dt
(área )(tempo)
4. por unidade de volume do sólido em sistemas fluido/sólido
V
rB Sol
1 dn B (número de mols de B formados)
VSol dt
( volume do sólido)( tempo)
5. por unidade de volume do reator (se diferente do volume do fluido)
V
rB reator
dn B (número de mols de B formados )
Vreator dt
( volume do reator)(tempo)
1
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
28
Observação:
• rB é função do estado do sistema
• A forma dessa relação funcional permanece a mesma
independente do modo pelo qual a velocidade foi definida.
• Apenas as constantes de proporcionalidade e suas
dimensões é que se alteram quando se passa de uma
definição para outra.
• As definições de velocidade de reação estão relacionadas
por:
V.rB W.r S.r V .r
w
B
S
B
Vsol
sol B
V
Vreator
reator B
.r
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
dn B
dt
29
Procedimento para Análise Cinética:
resultado empírico:
ajuste estatístico
fornece a equação
cinética empírica
1 dn B dc B
rB
.....
V dt
dt
comparar
modelo cinético:
fornece a
equação cinética
teórica
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
30
• Bibliografia:
– LEVENSPIEL, Octave. Chemical Reaction
Engineering. New York, John Wiley & Sons, 1972
(Copyright: 1972, 1962).
Ou: LEVENSPIEL, Octave. Chemical Reaction
Engineering. Third Edition, United States of America,
John Wiley & Sons, c1999. [541.124^L576c3]
– SMITH, J. M. Chemical Engineering Kinetics.
International Student Edition. Second Edition, Tokyo,
McGraw-Hill Kogakusha, LTD, 1970. [541.124
Sm61c2]
PMT2306 - Físico-Química para Metalurgia e Materiais II - Neusa Alonso-Falleiros
31