EXERCÍCIOS DE FÍSICA – Professor João Rodrigo Escalari Quintiliano
CALORIMETRIA
1. (Ita 2007) A água de um rio encontra-se a uma
velocidade inicial V constante, quando despenca de
uma altura de 80 m, convertendo toda a sua energia
mecânica em calor. Este calor é integralmente
absorvido pela água, resultando em um aumento de
1 K de sua temperatura. Considerando 1 cal ¸ 4 J,
aceleração da gravidade g = 10 m/s£ e calor
específico da água c = 1,0 calg-¢°C-¢, calcula-se que
a velocidade inicial da água V é de
a) 10Ë2 m/s. b) 20 m/s.
c) 50 m/s.
d) 10 Ë32 m/s.
e) 80 m/s.
2. (Ufu 2005) Considere as informações a seguir:
20 g de um gás ideal contido em um recipiente de 15
litros é resfriado, diminuindo sua temperatura de 30
°C para 10 °C.
Pede-se:
a) se o volume do recipiente for mantido fixo e a
pressão exercida pelo gás nas paredes do recipiente
diminuir 3000 N/m£ com o resfriamento, qual sua
pressão quando a temperatura era de 30 °C?
b) se o gás, ao atingir 10 °C, sofre uma transição de
fase, condensando-se, calcule a quantidade de calor
liberada pelo gás ao ter sua temperatura reduzida de
30 °C para 10 °C, tornando-se líquido.
Dados: calor específico do gás = 0,2 cal/g.°C
calor latente de vaporização = 10,0 cal/g
3. (Unifesp 2005) Uma esfera de aço de massa m =
0,20 kg a 200°C é colocada sobre um bloco de gelo
a 0°C, e ambos são encerrados em um recipiente
termicamente isolado.
Depois de algum tempo, verifica-se que parte do
gelo se fundiu e o sistema atinge o equilíbrio
térmico.
Dados:
coeficiente de dilatação linear do aço: ‘ = 11 × 10­§
°C-¢;
calor específico do aço: c = 450 J/(kg°C);
calor latente de fusão do gelo: L = 3,3 × 10¦ J/kg.
a) Qual a redução percentual do volume da esfera
em relação ao seu volume inicial?
b) Supondo que todo calor perdido pela esfera tenha
sido absorvido pelo gelo, qual a massa de água
obtida?
4. (Fgv 2007)
Nossa personagem soube por uma amiga que uma
nova dieta sugeria que beber meio litro de água
fresca (22°C) poderia provocar a queima imediata de
100 calorias. De acordo com nossos conhecimentos
de calorimetria, se a perda de calorias fosse devida
unicamente ao aquecimento da água pelo corpo,
haveria muito mais energia para se "queimar".
Levando-se em conta que a água que tomamos,
após o equilíbrio térmico com nosso corpo, atinge a
temperatura de 37°C se beber meio litro de água,
após a queima imediata das 100 calorias, ainda
deveria ocorrer a "queima" adicional, em cal, de
Dados:
- calor específico da água: 1,0 cal/(g°C)
- densidade da água: 1,0 g/mL
a) 5 700.
b) 5 900.
c) 6 300.
d) 6 800.
e) 7 400.
5. (Pucsp 2007) O gráfico (figura 1) representa um
trecho, fora de escala, da curva de aquecimento de
200 g de uma substância, aquecida por uma fonte
de fluxo constante e igual a 232 cal/min.
Sabendo que a substância em questão é uma das
apresentadas na tabela (figura 2), o intervalo de
tempo Ðt é, em minutos, um valor
a) acima de 130.
c) entre 70 e 100.
e) menor do que 20.
b) entre 100 e 130.
d) entre 20 e 70.
6. (Ufmg 2007) Numa aula de Física, o Professor
Carlos Heitor apresenta a seus alunos esta
experiência: dois blocos - um de alumínio e outro de
ferro -, de mesma massa e, inicialmente, à
temperatura
ambiente,
recebem
a
mesma
quantidade de calor, em determinado processo de
aquecimento.
O calor específico do alumínio e o do ferro são,
respectivamente, 0,90 J/(g°C) e 0,46 J/(g°C).
Questionados quanto ao que ocorreria em seguida,
dois dos alunos, Alexandre e Lorena, fazem, cada
um deles, um comentário:
- Alexandre: "Ao final desse processo de
aquecimento, os blocos estarão à mesma
temperatura."
- Lorena: "Após esse processo de aquecimento, ao
se colocarem os dois blocos em contato, fluirá calor
do bloco de ferro para o bloco de alumínio."
Considerando-se essas informações, é CORRETO
afirmar que
a) apenas o comentário de Alexandre está certo.
b) apenas o comentário de Lorena está certo.
c) ambos os comentários estão certos.
d) nenhum dos dois comentários está certo.
7. (Ufsc 2006) O gráfico a seguir representa a
quantidade de calor absorvida por dois objetos A e B
ao serem aquecidos, em função de suas
temperaturas.
Observe o gráfico e assinale a(s) proposição(ões)
CORRETA(S).
(01) A capacidade térmica do objeto A é maior que a
do objeto B.
(02) A partir do gráfico é possível determinar as
capacidades térmicas dos objetos A e B.
(04) Pode-se afirmar que o calor específico do
objeto A é maior que o do objeto B.
(08) A variação de temperatura do objeto B, por
caloria absorvida, é maior que a variação de
temperatura do objeto A, por caloria absorvida.
(16) Se a massa do objeto A for de 200 g, seu calor
específico será 0,2 cal/g°C.
8. (Ufrj 2006) Em um calorímetro ideal, há 98g de
água à temperatura de 0°C. Dois cubinhos metálicos
são introduzidos no calorímetro. Um deles tem
massa 8,0g, calor específico 0,25cal/g°C e está à
temperatura de 400°C. O outro tem 10g de massa,
calor específico 0,20cal/g°C e está à temperatura de
100°C.
Posteriormente, esse último cubinho é retirado do
calorímetro e verifica-se, nesse instante, que sua
temperatura é 50°C.
Calcule a temperatura final de equilíbrio da água e
do cubinho que permanece no calorímetro.
9. (Fgv 2006) Os trajes de neopreme, um tecido
emborrachado e isolante térmico, são utilizados por
mergulhadores para que certa quantidade de água
seja mantida próxima ao corpo, aprisionada nos
espaços vazios no momento em que o mergulhador
entra na água. Essa porção de água em contato
com o corpo é por ele aquecida, mantendo assim
uma temperatura constante e agradável ao
mergulhador. Suponha que, ao entrar na água, um
traje retenha 2,5 L de água inicialmente a 21°C. A
energia envolvida no processo de aquecimento
dessa água até 35°C é Dados: densidade da água =
1 kg/L calor específico da água = 1 cal/(g.°C)
a) 25,5 kcal.
d) 50,5 kcal.
b) 35,0 kcal.
e) 70,0 kcal.
c) 40,0 kcal.
10. (Ufrrj 2006) Um estudante de Física
Experimental fornece calor a um certo corpo,
inicialmente à temperatura de 10°C. Ele constrói o
gráfico indicado a seguir, onde, no eixo vertical,
registra as quantidades de calor cedidas ao corpo,
enquanto, no eixo horizontal, vai registrando a
temperatura do corpo.
Consideremos agora um outro corpo, com o dobro
da massa do primeiro, feito da mesma substância e
também inicialmente a 10°C. Com base no gráfico,
podemos dizer que, fornecendo uma quantidade de
calor igual a 120 calorias a esse outro corpo, sua
temperatura final será de
a) 18°C.
b) 20°C.
c) 40°C.
d) 30°C.
e) 25°C.
11. (Ufg 2006) O cérebro de um homem típico,
saudável e em repouso, consome uma potência de
aproximadamente 16W. Supondo que a energia
gasta pelo cérebro em 1 min fosse completamente
usada para aquecer 10 ml de água, a variação de
temperatura seria de, aproximadamente,
Densidade da água:
1,0.10¤ kg/m¤
Calor específico da água:
4,2.10¤ J/kg.°C
a) 0,5 °C
d) 23 °C
b) 2 °C
e) 48 °C
c) 11 °C
12. (Ufpr 2006) Numa garrafa térmica há 100 g de
leite à temperatura de 90°C. Nessa garrafa são
adicionados 20 g de café solúvel à temperatura de
20°C. O calor específico do café vale 0,5 cal/(g°C) e
o do leite vale 0,6 cal/(g°C). A temperatura final do
café com leite é de:
a) 80°C.
b) 42°C.
c) 50°C.
d) 60°C.
e) 67°C.
TEXTO PARA AS PRÓXIMAS 3 QUESTÕES.
(Puccamp 2005) Se o convidarem para saborear um
belo cozido português, certamente a última coisa
que experimentará entre as iguarias do prato será a
batata, pois ao ser colocada na boca sempre
parecerá mais quente. ... Mas será que ela está
sempre mais quente, uma vez que todos os
componentes do prato foram cozidos juntos e
saíram ao mesmo tempo da panela? Sabemos que,
ao entrarem em contato, objetos com temperaturas
diferentes tendem a trocar calor até ficarem com a
mesma temperatura. Parece estranho, não? Uma
coisa é certa: ao comer o cozido a chance de você
queimar a boca com a batata é muito maior do que
com o pedaço de carne. Comprove isso no próximo
cozido que tiver oportunidade de comer.
(Aníbal Figueiredo. "Física - um outro lado calor e temperatura." São Paulo. FTD, 1997)
13. A característica da batata a que se refere o
texto, de permanecer quente por mais tempo do que
os demais pertences do cozido, deve-se ao fato de
que, em relação aos demais, a batata tem
a) maior densidade.
b) maior calor específico.
c) menor pressão interna.
d) menor condutividade térmica.
e) menor índice de permeabilidade.
14. Uma batata de 100 g sai direto da geladeira
(temperatura interna 6 °C) para dentro da panela
com 238 g de água (calor específico 1,0 cal/g. °C) a
50 °C. Depois de algum tempo, quando o equilíbrio
térmico é atingido, a temperatura da batata é 40 °C.
Desprezando a troca de calor com o ambiente,
pode-se afirmar corretamente que o calor específico
da batata é, em cal/g. °C, igual a
a) 0,54
b) 0,65
c) 0,70
d) 0,80
e) 0,85
15. Uma sala tem 6 m de largura, 10 m de
comprimento e 4 m de altura. Deseja-se refrigerar o
ar dentro da sala. Considere o calor específico do ar
como sendo 30 J/ (mol K) e use R= 8 J/ (mol K).
a) Considerando o ar dentro da sala como um gás
ideal à pressão ambiente (P = 10¦ N/m£), quantos
moles de gás existem dentro da sala a 27 °C?
b) Qual é a quantidade de calor que o refrigerador
deve retirar da massa de ar do item (a) para resfriá-
Ia até 17 °C?
16. (Ufpe 2005) Com o objetivo de melhorar de uma
contusão, um atleta envolve sua coxa com uma
bolsa com 500 g de água gelada a 0 °C. Depois de
transcorridos 30 min, a temperatura da bolsa de
água atinge 18 °C. Supondo que todo o calor
absorvido pela água veio da coxa do atleta, calcule a
perda média de calor por unidade de tempo, em
cal/s.
a) 1
b) 2
c) 3
d) 4
e) 5
17. (Fuvest 2000) Uma experiência é realizada para
estimar o calor específico de um bloco de material
desconhecido, de massa m½=5,4kg. Em recipiente
de isopor, uma quantidade de água é aquecida por
uma resistência elétrica R=40², ligada a uma fonte
de 120V, conforme a figura. Nessas condições, e
com os devidos cuidados experimentais é medida a
variação da temperatura T da água, em função do
tempo t, obtendo-se a reta A do gráfico. A seguir,
repete-se a experiência desde o início, desta vez
colocando o bloco imerso dentro d'água, obtendo-se
a reta B do gráfico.
Dado: c = 4 J/g°C, para a água
18. (Unicamp 2000) Um escritório tem dimensões
iguais a 5m×5m×3m e possui paredes bem isoladas.
Inicialmente a temperatura no interior do escritório é
de 25°C. Chegam então as 4 pessoas que nele
trabalham, e cada uma liga seu microcomputador.
Tanto uma pessoa como um microcomputador
dissipam em média 100W cada na forma de calor. O
aparelho de ar condicionado instalado tem a
capacidade de diminuir em 5°C a temperatura do
escritório em meia hora, com as pessoas presentes
e os micros ligados. A eficiência do aparelho é de
50%. Considere o calor específico do ar igual a
1000J/kg°C e sua densidade igual a 1,2kg/m¤.
a) Determine a potência elétrica consumida pelo
aparelho de ar condicionado.
b) O aparelho de ar condicionado é acionado
automaticamente quando a temperatura do
ambiente atinge 27°C, abaixando-a para 25°C.
Quanto tempo depois da chegada das pessoas no
escritório o aparelho é acionado?
19. (Unesp 2007) Considere seus conhecimentos
sobre mudanças de fase e analise as afirmações I, II
e III, referentes à substância água, um recurso
natural de alto valor.
I. Durante a transição de sólido para líquido, a
temperatura não muda, embora uma quantidade de
calor tenha sido fornecida à água.
II. O calor latente de condensação da água tem um
valor diferente do calor latente de vaporização.
III. Em determinadas condições, a água pode
coexistir na fase sólida, líquida e gasosa.
a) Estime a massa M, em kg, da água colocada no
recipiente.
b) Estime o calor específico c½ do bloco, explicitando
claramente as unidades utilizadas.
Pode-se afirmar que
a) apenas a afirmação I é correta.
b) apenas as afirmações I e II são corretas.
c) apenas as afirmações I e III são corretas.
d) apenas as afirmações II e III são corretas.
e) as afirmações I, II e III são corretas.
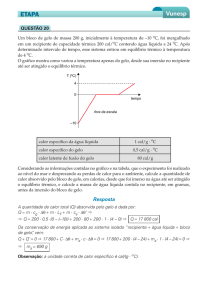
20. (Ufg 2007) Um lago tem uma camada superficial
de gelo com espessura de 4,0 cm a uma
temperatura de -16 °C. Determine em quanto tempo
o lago irá descongelar sabendo que a potência
média por unidade de área da radiação solar
incidente sobre a superfície da Terra é 320 W/m£.
Dados:
Calor específico do gelo = 0,50 cal/g °C
Calor latente de fusão do gelo = 80 cal/g
Densidade do gelo = 1,0 g/cm¤
1,0 cal ¸ 4,0 J
21. (Ufjf 2006) Um bloco de chumbo de 6,68 kg é
retirado de um forno a 300°C e colocado sobre um
grande bloco de gelo a 0°C. Supondo que não haja
perda de calor para o meio externo, qual é a
quantidade de gelo que deve ser fundida?
Dados: calor específico do gelo a 0°C = 2100
J/(kg.K)
calor latente de fusão do gelo = 334 x 10¤ J/kg calor
específico do chumbo = 230 J/(kg.K)
calor latente de fusão do chumbo = 24,5 x 10¤ J/kg
temperatura de fusão do chumbo = 327°C
22. (Ufpel 2006) Com base em seus conhecimentos
sobre Termodinâmica, assinale a alternativa correta.
a) Duas substâncias A e B, de massas iguais,
recebem a mesma quantidade de calor, portanto
sofrem a mesma variação de temperatura.
b) Em um mesmo banho-maria, aquecem-se duas
barras metálicas quaisquer simultaneamente. A
dilatação térmica maior ocorrerá na barra mais
longa.
c) O coeficiente de dilatação aparente de um líquido
é sempre maior que o coeficiente de dilatação real
do líquido.
d) Se a relação entre os coeficientes de dilatação
linear de dois metais é igual a 2, a relação entre os
respectivos coeficientes de dilatação cúbica se
mantém.
e) Nas substâncias que diminuem de volume
quando passam do estado líquido para o estado
sólido, um aumento de pressão faz baixar o ponto
de fusão.
23. (Fatec 2006) O gráfico a seguir é a curva de
aquecimento de 10g de uma substância, à pressão
de 1 atm.
Analise as seguintes afirmações :
I. a substância em questão é a água.
II. o ponto de ebulição desta substância é 80°C.
III. o calor latente de fusão desta substância é
20cal/g .
Das afirmações apresentadas,
a) todas estão corretas.
b) todas estão erradas.
c) somente I e II estão corretas.
d) somente II e III estão corretas.
e) somente I está correta
24. (Uerj 2006) Algumas máquinas do navio operam
utilizando vapor d'água a temperatura de 300°C.
Esse vapor é produzido por uma caldeira alimentada
com óleo combustível, que recebe água a
temperatura de 25°C. O gráfico a seguir mostra o
comportamento do calor específico c do vapor
d'água em função da temperatura š.
a) Considerando as condições descritas, calcule a
quantidade de calor necessária para transformar 1,0
× 10¦ g de água a 25°C em vapor a 300°C.
b) Admita que:
- a queima de 1 grama do óleo utilizado libera
10.000 cal;
- a caldeira, em 1 hora, queima 4.320 g de óleo e
seu rendimento é de 70%.
Determine a potência útil dessa caldeira.
25. (Ita 2006) Um bloco de gelo com 725 g de
massa é colocado num calorímetro contendo 2,50 kg
de água a uma temperatura de 5,0°C, verificando-se
um aumento de 64 g na massa desse bloco, uma
vez alcançado o equilíbrio térmico. Considere o calor
específico da água (c = 1,0 cal/g°C) o dobro do calor
específico do gelo, e o calor latente de fusão do gelo
de 80 cal/g. Desconsiderando a capacidade térmica
do calorímetro e a troca de calor com o exterior,
assinale a temperatura inicial do gelo.
a) -191,4°C
b) -48,6°C
c) -34,5°C
d) -24,3°C
e) -14,1°C
26. (Pucpr 2005) Quando o gelo se derrete, verificase, experimentalmente, que ele deve receber, por
grama, 80 calorias, mantendo-se a temperatura
constante em 0°C.
A quantidade de calor, em caloria, para derreter 100
g de gelo é de:
a) 800 cal
b) 1000 cal
c) 100 cal
d) 80 cal
e) 8000 cal
27. (Uel 2005) Nas condições usualmente
encontradas no ambiente em que vivemos, a
matéria assume três estados: sólido, líquido e
gasoso. A água, por exemplo, pode ser encontrada
em qualquer desses estados de acordo com a
pressão e temperatura do ambiente. Nosso domínio
sobre o ambiente decorre, entre outras coisas, do
fato de que sabemos controlar as mudanças entre
esses estados. De maneira geral, fusão é a
transformação que leva uma substância do estado
sólido para o estado líquido. Vaporização é a
transformação que leva uma substância do estado
líquido para o estado gasoso. Sublimação é a
transformação que leva uma substância diretamente
do estado sólido para o estado gasoso. O diagrama
de fases reune em um diagrama de pressão x
temperatura, as curvas de fusão, de vaporização e
de sublimação de uma dada substância, conforme a
figura a seguir. Com base no diagrama e nos
conhecimentos sobre o tema, é correto afirmar:
a) Na região I, a substância está no estado gasoso.
Na região II, a substância está no estado líquido. Na
região III, a substância está no estado sólido. No
ponto 1, a substância está em um estado de
coexistência de estados sólido e gasoso. No ponto
2, a substância está em um estado de coexistência
de estados líquido e gasoso. No ponto 3, a
substância está em um estado de coexistência de
estados líquido e sólido.
b) Na região I, a substância está no estado líquido.
Na região II, a substância está no estado gasoso. Na
região III a substância está no estado sólido. No
ponto 1 a substância está num estado de
coexistência de estados sólido e líquido. No ponto 2
a substância está num estado de coexistência de
estados líquido e gasoso. No ponto 3 a substância
está num estado de coexistência de estados sólido e
gasoso.
c) Na região I a substância está no estado gasoso.
Na região II a substância está no estado sólido. Na
região III, a substância está no estado líquido. No
ponto 1, a substância está em um estado de
coexistência de estados líquido e gasoso. No ponto
2, a substância está em um estado de coexistência
de estados sólido e gasoso. No ponto 3, a
substância está em um estado de coexistência de
estados líquido e sólido.
d) Na região I, a substância está no estado sólido.
Na região II, a substância está no estado líquido. Na
região III, a substância está no estado gasoso. No
ponto 1, a substância está em um estado de
coexistência de estados sólido e gasoso. No ponto
2, a substância está em um estado de coexistência
de estados sólido e líquido. No ponto 3, a substância
está em um estado de coexistência de estados
líquido e gasoso.
e) Na região I, a substância está no estado líquido.
Na região II, a substância está no estado sólido. Na
região III, a substância está no estado gasoso. No
ponto 1, a substância está em um estado de
coexistência de estados líquido e gasoso. No ponto
2, a substância está em um estado de coexistência
de estados sólido e líquido. No ponto 3, a substância
está em um estado de coexistência de estados
sólido e gasoso.
28. (Unesp 2004) Um recipiente de capacidade
térmica desprezível e isolado termicamente contém
25 kg de água à temperatura de 30°C.
a) Determine a massa de água a 65°C que se deve
despejar no recipiente para se obter uma mistura em
equilíbrio térmico à temperatura de 40°C.
b) Se, em vez de 40°C, quiséssemos uma
temperatura final de 20°C, qual seria a massa de
gelo a 0°C que deveríamos juntar aos 25 kg de água
a 30°C?
Considere o calor específico da água igual a 4,0
J/g.°C e o calor latente de fusão do gelo igual a 320
J/g.
29. (Unesp 2004) A figura mostra os gráficos das
temperaturas em função do tempo de aquecimento,
em dois experimentos separados, de dois sólidos, A
e B, de massas iguais, que se liquefazem durante o
processo. A taxa com que o calor é transferido no
aquecimento é constante e igual nos dois casos.
Se TÛ e T½ forem as temperaturas de fusão e LÛ e
L½ os calores latentes de fusão de A e B,
respectivamente, então
a) TÛ > T½ e LÛ > L½.
b) TÛ > T½ e LÛ = L½.
c) TÛ > T½ e LÛ < L½.
d) TÛ < T½ e LÛ > L½.
e) TÛ < T½ e LÛ = L½.
30. (Fuvest 2004)
Um recipiente de isopor, que é um bom isolante
térmico, tem em seu interior água e gelo em
equilíbrio térmico. Num dia quente, a passagem de
calor por suas paredes pode ser estimada, medindose a massa de gelo Q presente no interior do isopor,
ao longo de algumas horas, como representado no
gráfico. Esses dados permitem estimar a
transferência de calor pelo isopor, como sendo,
aproximadamente, de
Calor latente de fusão do gelo ¸ 320 kJ/kg
a) 0,5 kJ/h
b) 5 kJ/h
c) 120 kJ/h
d) 160 kJ/h
e) 320 kJ/h
31. (Unifesp 2003) Sobrefusão é o fenômeno em
que um líquido permanece nesse estado a uma
temperatura inferior à de solidificação, para a
correspondente pressão. Esse fenômeno pode
ocorrer quando um líquido cede calor lentamente,
sem que sofra agitação. Agitado, parte do líquido
solidifica, liberando calor para o restante, até que o
equilíbrio térmico seja atingido à temperatura de
solidificação para a respectiva pressão. Considere
uma massa de 100 g de água em sobrefusão a
temperatura de -10°C e pressão de 1 atm, o calor
específico da água de 1 cal/g°C e o calor latente de
solidificação da água de -80 cal/g. A massa de água
que sofrerá solidificação se o líquido for agitado será
a) 8,7 g.
b) 10,0 g.
c) 12,5 g.
d) 50,0 g.
e) 60,3 g.
GABARITO
1. [E]
2. a) 4,54 × 10¥N/m£
b) 280 cal
3. a) redução de 0,66%
4. [E]
5. [A]
6. [B]
b) m ¸ 0,055kg
7. 01 + 02 + 08 + 16 = 27
8. T = 9°C
9. [B]
10. [E] 11. [D] 12. [A] 13. [B]
14. [C]
15. a) 1 × 10¥ mols
b) 3 × 10§ J
16. [E]
17. a) M = 4,32 kg
b) c½ = 0,8 J/g.°C
18. a) 2100 W b) 3,75 min
19. [C]
20. 12 h 12 min
21. m = 1,38 kg
22. [E]
23. [D]
24. a) Q = 7,4 × 10¨ cal
b) P = 8,4 × 10¤ cal/s
25. [B]
26. [E]
27. [A]
28. a) 10 kg
b) 2,5 kg
29. [C]
30. [D]
31. [C]