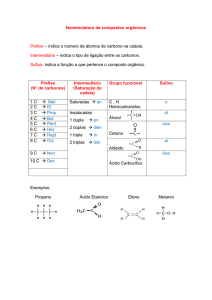
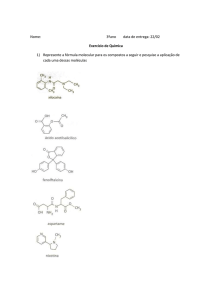
LISTA DE QUÍMICA 2º ANO TURMAS
PROFESSORES: BRUNO
Aluno:_________________________________________________nº:____Turma:______
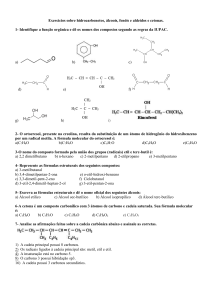
QUESTÃO 1-O índice de octanos ou octanagem, é o número utilizado para expressar a qualidade de uma
gasolina. Dizer, por exemplo, que uma gasolina apresenta octanagem 65 significa que, ao utilizá–la, o
rendimento do motor é o mesmo que se fosse utilizada uma mistura contendo 65% do isooctano. O nome
oficial do isooctano é 2,2,4–trimetil–pentano.
Com relação ao tema, julgue os itens a seguir.
1.(C) (E) -A fórmula estrutural plana do isooctano é mostrada no quadro abaixo.
2.(C) (E) -A gasolina é obtida por meio da destilação simples do petróleo.
3.(C) (E) -O ponto de ebulição do heptano é maior que o do octano.
4.(C) (E) -Uma das vantagens de se utilizar o álcool em substituição à gasolina está no fato de ele ser uma
fonte renovável de energia.
5.(C) (E) -A gasolina pode ser classificada como um combustível fóssil.
QUESTÃO 2-(UnB).O álcool de uso doméstico, utilizado em limpeza de modo geral, é uma mistura contendo
etanol e água, comumente comercializado em frascos de polietileno. Examinando o rótulo de um frasco de
álcool, lê-se os seguintes informações:
Álcool refinado, de baixo teor de acidez e de aldeídos.
Com o auxílio dessas informações, julgue os itens que se seguem.
1.(C)(E).A referida acidez pode ser ocasionado pelo presença do ácido propanóico, resultante do redução
catalítica do etanol.
2.(C)(E).Um dos aldeídos presentes pode ser o acetaldeído (etanol), proveniente da oxidação do etanol.
3.(C)(E).No Brasil, devido ao monopólio, a PETROBRÁS é a principal empresa produtora de etanol, obtido a
partir do petróleo.
4.(C)(E).O polietileno é derivado da polimerização do etanol.
QUESTÃO 03- (UnB).Existem boas possibilidades de reativação do produção de veículos movidos a álcool
(CH3CH2OH), devido a uma maior eficiência no produção desse combustível, que é obtido a partir da destilação
do garapa (caldo de cana-de-açúcar) fermentado. Em relação ao texto, julgue os itens.
1.(C)(E).Na destilação da garapa,há rompimento de ligações inter-moleculares.
2.(C)(E).O método eficiente de produção de álcool citado no texto é um processo químico.
3.(C)(E).A substância cuja fórmula foi apresentado no texto é denominada metanol.
4.(C)(E).A água se mistura à gasolina da mesma forma que se mistura ao álcool.
QUESTÃO 04- (UnB). O álcool etílico é o mais utilizado de todos os álcoois e, muito provavelmente, foi
uma das primeiras substâncias orgânicas obtidas pelo homem a partir de processo de fermentação. Seu ponto
de fusão é – 115ºC e o de ebulição 78,5ºC. Auxiliado por essas informações e com a estrutura abaixo do
álcool etílico, julgue os itens a seguir.
1.(C)(E) -O álcool etílico, quando ingerido, pode ocasionar cegueira nas pessoas.
2.(C)(E) -O nome oficial do álcool etílico é etanol.
3.(C)(E) -O álcool etílico é um gás a temperatura ambiente.
4.(C)(E) -Em países onde o inverno é rigoroso, o álcool etílico é misturado a água do radiador a fim de evitar
que ela congele.
5.(C)(E) -Bebidas destiladas, como conhaque, apresentam baixo teor alcoólico, e por isso não ocasionam
grandes danos à saúde.
QUESTÃO 05-Testosterona, com sua promessa de rejuvenescimento e virilidade, vira moda entre os
quarentões. Testosterona é uma palavra que evoca imagens bem definidas: músculos, virilidade e
masculinidade, o hormônio masculino por excelência. Calcula-se que um em cada seis homens com mais de
60 anos sofre com a queda nos níveis de testosterona. “Isso é muito mais comum do que se imaginava” diz o
endocrinologista Geraldo de Medeiros da USP. Para esses senhores os médicos são unânimes, testosterona
neles. O hormônio ajuda a desenvolver a massa muscular e aumentar o apetite sexual. São duas preocupações
do homem moderno. Mas o perigo está em quem os consome sem precisar. Os riscos a médio prazo são
maiores do que os benefícios. Doses extras desse hormônio podem causar problemas no fígado e aumentam a
probabilidade de câncer na próstata. Entre outros possíveis efeitos estão o aumento das mamas e a diminuição
dos testículos. Mulheres podem ter engrossamento irreversível da voz, calvície precoce e até infertilidade.
Veja, 26/04/2010
Fórmula da testosterona:
Assinale a alternativa verdadeira, considerando a fórmula apresentada.
a) Sua cadeia é acíclica, homogênea e saturada.
b) Apresenta função éter e álcool em sua estrutura.
c) Sua cadeia é aromática com ramificações.
d) Sua estrutura apresenta uma cadeia cíclica insaturada e ramificada.
e) Sua fórmula mínima é C20H19O2.
QUESTÃO 06-O álcool alílico rincoferol é o feromônio de agregação da praga “broca do olho do coqueiro”
(Rhycnhophorus palmarum) vetor da doença “anel vermelho”, letal para a planta, sendo responsável por
enormes prejuízos neste tipo de cultura. A nomenclatura segundo a IUPAC do rincoferol representado abaixo
é:
a) 6,6-dimetil-2-hexen-4-ol.
b) 2-metil-5-hepten-4-ol.
c) 6-metil-2-hepten-4-ol.
d) 2,6-dimetil-5-hexen-4-ol.
e) 6-metil-3-hepten-4-ol.
QUESTÃO 07-O composto orgânico, de fórmula plana abaixo, possui:
a) 5 carbonos primários, 3 carbonos secundários, 1 carbono terciário e 2 carbonos quaternários.
b) 3 carbonos primários, 3 carbonos secundários, 1 carbono terciário e 1 carbono quaternário.
c) 5 carbonos primários, 1 carbono secundário, 1 carbono terciário e 1 carbono quaternário.
d) 4 carbonos primários, 1 carbono secundário, 2 carbonos terciários e 1 carbono quaternário.
e) N.D.A
QUESTÃO 08- Suponha que o trabalho realizado por um motor de combustão interna a gasolina, em um
ciclo, seja igual a 0,5 Kcal e que a gasolina seja constituída pelo hidrocarboneto C9H20, que possui calor de
combustão de 1.500 Kcal/mol. Considere, ainda, que a densidade da gasolina seja de 0,8 g/mL e que o
rendimento desse motor seja de 30%. Sabendo que M(C9H20) = 128 g/mol, calcule o número de ciclos que o
motor pode realizar com 480 mL de gasolina. Divida o valor calculado por 100 e despreze a parte fracionária
de seu resultado, caso exista.
QUESTÃO 09-(VALOR: 1,0 ponto)- O entendimento sobre estruturas é fundamental para se fazer um
estudo aprofundado da matéria. Sobre esse assunto, forneça as estruturas de Lewis e descreva a geometria das
espécies SO2, SO3 e SO4-2. Para a resolução da questão, considerar a carga do íon localizada no seu átomo
central.Dados: O (Z) = 8 e S (Z) = 16
QUESTÃO 10- Considere três substâncias CH4, NH3 e H2O e três temperaturas de ebulição: 373 K, 112 K e
240 K. Levando-se em conta a estrutura e a polaridade das moléculas dessas substâncias, pede-se:
A)Correlacionar as temperaturas de ebulição às substâncias.
B)Justificar a correlação que você estabeleceu.
QUESTÃO 11-De o nome oficial dos seguintes alcoóis segundo a nomenclatura oficial da Iupac.
A)_____________________________________________________
B)_____________________________________________________
C)_____________________________________________________
D)_____________________________________________________
E)_____________________________________________________
QUESTÃO 12-O Diazepan analgésico (usado como sedativo) diminui a dependência, depressão e anemia.
Este composto pode ser representado por:
A respeito do composto, julgue os itens.
1.(C)(E).Fórmula molecular C16H5N2OCl.
2.(C)(E).Dois átomos de carbono terciários.
3.(C)(E).Apresenta 2 átomos de carbono saturados e 14 insaturados.
4.(C)(E).Possui o radical metil preso ao nitrogênio ligado ao anel benzênico.
5.(C)(E).É uma cadeia polinuclear que possui os núcleos aromáticos condensados.
QUESTÃO 13-Um alcano de cadeia alifática normal apresenta em sua estrutura 14 átomos de hidrogênio por
molécula. O número de átomos de carbono existentes em uma molécula do alcano é igual a:
a) 14
b) 10
c) 8
d) 7
e) 6
QUESTÃO 14 - Os mais antigos filósofos gregos já afirmavam que tudo provém da água. A ciência tem, por
sua vez, demonstrado que a vida se originou na água e que ela constitui a matéria predominante em todos os
corpos vivos. A respeito das propriedades químicas, físicas e estruturais da água, julgue os itens seguintes.
1.(C)(E)Moléculas de água ligam-se entre si, através de forças intermoleculares do tipo pontes de hidrogênio.
2.(C)(E)A água apresenta uma geometria piramidal em sua molécula, devido à presença de dois pares de
elétrons livres no átomo central da molécula.
3.(C)(E)Numa molécula de água, o número de elétrons compartilhados através de ligações covalentes do tipo
sigma é igual a quatro.
4.(C)(E)A água se caracteriza por sua extraordinária capacidade de dissolver outras substâncias. Essa
capacidade de dissolver outras substâncias faz da água um ácido de Arrhenius.
5.(C)(E)A água apresenta, em sua estrutura, ligações de caráter polar, mas devido à repulsão de seus pares
eletrônicos (pares de elétrons), a resultante dos vetores momento dipolo torna-se nula, fazendo com que a
molécula tenha caráter apolar. Dados: (H = 1 e O = 16).
QUESTÃO 15- O indigo blue, corante azul presente nos jeans, pode ser fabricado a partir do benzeno, por
meio de várias reações químicas que o transformam, sucessivamente, nas substâncias A, B, C e, finalmente, no
indigo blue.
Julgue os itens.
1.(C)(E) A fórmula molecular da substância A é C6H7N.
2.(C)(E) Na molécula de B existem 8 átomos de carbono.
3.(C)(E) As fórmulas moleculares de B e C são iguais.
4.(C)(E) Na molécula de indigo blue existem 10 átomos de hidrogênio.
5.(C)(E) Uma molécula orgânica com 3 átomos de carbono é formada apenas por carbono e hidrogênio e seus
átomos de carbono estão distribuídos ao longo de uma linha reta, logo sua fórmula molecular é C3H4.
QUESTÃO 16-(VALOR: 0,5 ponto)- Em relação à estrutura, é CORRETO afirmar que possui:
a)
b)
c)
d)
E)
Apenas 3 carbonos primários.
Apenas 4 carbonos primários.
Apenas 3 carbonos secundários.
3 carbonos terciários e 4 primários.
3 carbonos secundários e nenhum quaternário
QUESTÃO 17- (ITA – SP) Colocando grãos de nitrato de potássio em um frasco com água, nota-se que com
o passar do tempo o sólido desaparece dentro da água. Qual das equações é a mais adequada para representar
a transformação que ocorreu dentro do frasco?
a)
KNO3s KNO3 l
b)
KNO3s H2Ol KOHaq HNO3aq
c)
KNO3s K+aq NO3aq
d)
KNO3s Kl NO3aq
e)
KNO3s H2Ol KNO2aq H2O2aq
QUESTÃO 18-
História da Química Orgânica
As substâncias encontradas na natureza eram divididas na antiguidade, em três grandes reinos: o vegetal, o
animal,mineral. Tanto o reino vegetal como o reino animal são constituídos por seres vivos ou
orgânicos.apesar de serem conhecidas várias substâncias extraídas de produtos naturais, a Química como
ciência, teve início no fim da Idade Média com o nome de "alquimia".Os alquimistas, como eram chamados
os primeiros pesquisadores tinham por objetivos:- transformar qualquer metal em ouro - princípio chamado
de "pedra filosofal" e- o "elixir da vida", para prolongar a vida.O médico Paracelso (Suiço) que também
atuava no campo da alquimia, afirmou, que "o homem é um composto químico, cujas doenças são
decorrrentes das alterações desta estrutura, sendo necessários medicamentos para combater as enfermidades."
Foi o início do uso de medicamentos para curar as enfermidades da época (séculos XVI e XVII). Somente no
século XVIII foram extraídas várias substâncias a partir de produtos naturais, além daquelas anteriormente
conhecidas (vinho, fermentação da uva e os produtos obtidos pela destilação de várias outras
substâncias).Neste mesmo século - no ano de 1777-, a química foi dividida em duas partes de acordo com
Torben Olof Bergmann:a Química Orgânica que estudava os compostos obtidos diretamente dos seres vivos
e- a Química Inorgânica que estudava os compostos de origem mineral. Entretanto, o desenvolvimento da
Química Orgânica era prejudicado pela crença de que, somente a partir dos organismo vivos - animais e
vegetais - era possível extrair substâncias orgânicas. “Tratava-se de uma teoria, conhecida pelo nome de
“Teoria da Força Vital”, formulada por Jöns Jacob Berzelius, que afirmava: a força vital é inerente da célula
viva e o homem não poderá criá-la em laboratório.” Em 1828, após várias tentativas, um dos discipulos de
Berzelius, mais precisamente Friedrich Wöhler, conseguiu por acaso obter uma substância encontrada na
urina e no sangue, conhecida pelo nome de uréia. Estando no laboratório, Wöhler aqueceu o composto
mineral e obteve composto orgânico, derrubando assim, a Teoria da Força Vital. Após o êxito desta
experiência vários cientistas voltaram ao laboratório para obter outras substâncias orgânicas e verificaram que
o elemento fundamental era o carbono. Em 1858 Friedrich A. Kekulé definiu a Química Orgânica como
sendo a parte da química dos compostos do carbono.Atualmente são conhecidos milhões de compostos
orgânicos e diarimente, devido às pesquisas para a obtenção de novas substâncias, o número de compostos
orgânicos aumenta consideravelmente.
De classificação das cadeias carbônicas existentes em cada uma das estruturas a seguir e escreva suas
fórmulas moleculares dos compostos abaixo :
CLASSIFICAÇÃO:_____________________________________
_____________________________________________________
FÓRMULA MOLECULAR:
CLASSIFICAÇÃO:_____________________________________
_____________________________________________________
FÓRMULA MOLECULAR:
CLASSIFICAÇÃO:_____________________________________
_____________________________________________________
FÓRMULA MOLECULAR:
CLASSIFICAÇÃO:_____________________________________
_____________________________________________________
FÓRMULA MOLECULAR:
QUESTÃO 19- Dê o nome dos óxidos abaixo e classifique-os segundo os critérios: básico, ácido, anfótero,
neutro.
a) SrO:
Nome:
Classificação:
b) Al2O3:
Nome:
Classificação:
c) CO2:
Nome:
Classificação:
d) Cl2O6:
Nome:
Classificação: