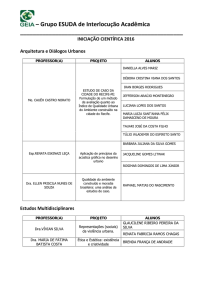
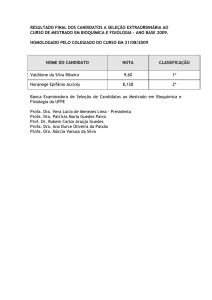
Prof. Dra. Lisandra Ferreira de Lima
PROPRIEDADES
FÍSICAS
PARTE II
VISCOSIDADE; TENSÃO SUPERFICIAL E PRESSÃO DE VAPOR
SUBSTÂNCIA PURA
Prof. Dra. Lisandra Ferreira de Lima
Densidade - revisão
Prof. Dra. Lisandra Ferreira de Lima
Tensão superficial
forças de adesão
Tensão superficial
As moléculas volumosas (no
líquido) são igualmente atraídas
pelas suas vizinhas.
forças de coesão
Prof. Dra. Lisandra Ferreira de Lima
LIQUIDOS – TENSÃO SUPERFICIAL
Prof. Dra. Lisandra Ferreira de Lima
Tensão superficial
Pode ser definida como a quantidade de trabalho
necessário para aumentar a superfície
do fluido
considerado. A tensão superficial surge das interações
intermoleculares que retém as moléculas de um líquido.
Fluidos com alta tensão superficial tem como
consequência a dificuldade em formar gotas pequenas
e quando conseguem não são estáveis. Dificilmente
molha as superfícies, o que pode provocar implicações
sensoriais e tecnológicas nestas substâncias.
A tensão superficial pode ser medida por
equipamentos especiais como o dipositivo de Dupré ou
pela formação de gotas.
Prof. Dra. Lisandra Ferreira de Lima
Tensão Superficial
As moléculas da superfície são atraídas apenas para dentro
no sentido das moléculas volumosas.
– Conseqüentemente, as moléculas da superfície estão
mais densamente empacotadas do que as moléculas
volumosas.
A tensão superficial é a energia necessária para aumentar a
área superficial de um líquido.
Prof. Dra. Lisandra Ferreira de Lima
TENSÃO SUPERFICIAL
Prof. Dra. Lisandra Ferreira de Lima
TENSÃO SUPERFICIAL DA ÁGUA
EM RELAÇÃO A TEMPERATURA
Prof. Dra. Lisandra Ferreira de Lima
Tensão superficial
Prof. Dra. Lisandra Ferreira de Lima
Prof. Dra. Lisandra Ferreira de Lima
Tensão superficial
forças adesão >
forças coesão
forças coesão >
forças adesão
As forças de coesão
ligam as moléculas
entre si.
As forças de adesão
ligam as moléculas
a uma superfície.
Menisco da água comparando com o
menisco do mercúrio
Prof. Dra. Lisandra Ferreira de Lima
Tensão Superficial
Prof. Dra. Lisandra Ferreira de Lima
MOLHABILIDADE DA
PAREDE
Prof. Dra. Lisandra Ferreira de Lima
Tensão superficial
Menisco é a forma da superfície do líquido.
– Quando as forças de adesão entre o líquido e a
superfície (vidro) são mais fortes do que as forças de
coesão do líquido, a superfície do líquido é atraída
para a superfície do recipiente. Portanto, o menisco
tem formato de U (ex.: água em um copo).
– Quando as forças de coesão são maiores do que as
forças de adesão, o menisco é curvo para baixo (ex.:
Hg).
Ação capilar: Quando um tubo de vidro estreito é colocado
em água, o menisco puxa a água para o topo do tubo.
Prof. Dra. Lisandra Ferreira de Lima
TENSOATIVOS: É O COMPONENTE NA FORMULAÇÃO DO
DETERGENTE RESPONSÁVEL PELA MISTURA (ÁGUA+ ÓLEO) E
TAMBÉM PELA ESPUMA GERADA
Podemos formular um detergente de alta, média ou baixa espumação
somente alterando o tensoativo na formulação. Remoção de sujidades
Prof. Dra. Lisandra Ferreira de Lima
Prof. Dra. Lisandra Ferreira de Lima
AÇÃO DE DETERGENTES
A bolha de sabão é formada porque a camada superficial
de um líquido (normalmente água) apresenta tensão
superficial que faz com que esta camada se comporte
como uma membrana elástica. Entretanto, uma bolha só
de água pura não é estável e há a necessidade de adição
de um surfactant (surface active agent), o sabão, para
estabilizá-la. O sabão, na verdade, diminui a tensão
superficial da água em cerca de 60%. O sabão não
fortalece as bolhas, ele as estabiliza. A parede da bolha é
um filme comum a fina camada de água entre duas
camadas de moléculas de sabão. As moléculas de sabão
têm uma extremidade hidrofílica (gosta de água) e uma
cauda hidrofóbica (uma cadeia de hidrocarbonetos que
tende a evitar a água). As caudas hidrofóbicas procuram a
superfície, tentando evitar a água, e se projetam para fora
da camada de moléculas de água. Isto separa as
moléculas de água umas das outras. O aumento da
distância entre as moléculas de água diminui a tensão
superficial.
Por Ferreira
outro lado,
as caudas projetadas para fora
Prof.
Dra. Lisandra
de Lima
protegem a camada de água da evaporação, dando maior
Viscosidade - líquidos
Viscosidade é a resistência de um líquido em fluir.
Um líquido flui através do deslizamento das moléculas
sobre outras.
Quanto mais fortes são as forças intermoleculares, maior
é a viscosidade.
Prof. Dra. Lisandra Ferreira de Lima
Viscosidade de Líquidos
Resistência ao escoamento –
escoamento – fluidez
o oposto da Resistência ao
A viscosidade chamada de viscosidade absoluta apresenta unidades no SI
de (Ns/m2), mas comumente se utiliza também poise (P), em homenagem
a Poiseville e representa a viscosidade de um fluido que escorre a 1cm/s
(ou 1m/s) sujeito a uma tensão de dy/cm2 (0,1N/m2).
η (eta): Quantidade de matéria que escoa numa certa distância num
dado tempo:
Ns
1P Prof.0Dra.
,1 Lisandra
100 cP
2 Ferreira de Lima
m
Viscosidade de Líquidos
Algumas vezes é de grande utilidade usarmos a viscosidade cinemática (ν):
cm 2
1S 1
s
Cuja unidade no SI é m2/s, usando-se também stokes (S) ou centistokes (cS).
Tabela de viscosidade de fluidos Newtonianos em diferentes temperaturas e
concentrações
Substância
Água
Azeite de oliva
Sol. 60% Sacarose
Temperatura (oC)
μ (cP)
10
1,30
20,2
1,00
90
0,32
10
138
70
12,4
10
114
90
4,2
Prof. Dra. Lisandra Ferreira de Lima
Viscosidade de Líquidos
Prof. Dra. Lisandra Ferreira de Lima
Medidores de viscosidade
Prof. Dra. Lisandra Ferreira de Lima
Medidas de viscosidade (mP)
Prof. Dra. Lisandra Ferreira de Lima
Viscosidade x Massa molar
Prof. Dra. Lisandra Ferreira de Lima
Viscosidade de Alimentos
Prof. Dra. Lisandra Ferreira de Lima
Viscosidade de Alimentos
Prof. Dra. Lisandra Ferreira de Lima
Viscosidade de Alimentos
Prof. Dra. Lisandra Ferreira de Lima
Viscosidade de gases
Prof. Dra. Lisandra Ferreira de Lima
Tabela de
viscosidade
(B.6.8)
Prof. Dra. Lisandra Ferreira de Lima
Prof. Dra. Lisandra Ferreira de Lima
Pressão de vapor
Prof. Dra. Lisandra Ferreira de Lima
Pressão de vapor
Pressão de vapor: pressão parcial, exercida pelo
vapor na superfície do líquidos. Estando as duas
fases em equilíbrio chama-se pressão de vapor de
saturação. Quanto maior a temperatura, maior a
pressão de vapor.
Ebulição: formação de bolhas de vapor no interior
do liquido.
Cavitação: fenômeno que pode ocorrer em
escoamento de líquidos quando submetidos a
pressões menores que a pressão de vapor do
liquido, havendo formação de bolhas.
Prof. Dra. Lisandra Ferreira de Lima
Prof. Dra. Lisandra Ferreira de Lima
Distribuição de Energia
Prof. Dra. Lisandra Ferreira de Lima
Pressão de vapor
Prof. Dra. Lisandra Ferreira de Lima
Pressão de vapor
A pressão exercida pelo vapor em equilíbrio
com o seu líquido é chamada de pressão de
vapor de equilíbrio do líquido ou apenas
pressão de vapor.
Prof. Dra. Lisandra Ferreira de Lima
Pressão de vapor
Prof. Dra. Lisandra Ferreira de Lima
Pressão de vapor
Prof. Dra. Lisandra Ferreira de Lima
LIQUIDOS
PRESSÃO DE VAPOR
Prof. Dra. Lisandra Ferreira de Lima
RELAÇÃO DA PRESSÃO DE
VAPOR COM A TEMPERATURA
Prof. Dra. Lisandra Ferreira de Lima
Calculo da Pressão de
vapor
Clausius Clapeyron:
Clausius Antoine:
v
H
ln Pv
B
RT
B
ln P A
T C
Carta de Cox:
Prof. Dra. Lisandra Ferreira de Lima
v
TABELA ANTOINE
Prof. Dra. Lisandra Ferreira de Lima
WAGNER
Prof. Dra. Lisandra Ferreira de Lima
APLICAÇÕES
P 2 atm
Teb (agua) 120ºC
Tempo de cocção mais rápido
Melhor transferencia de calor
Prof. Dra. Lisandra Ferreira de Lima
EBULIÇÃO
O ponto (TEMPERATURA) de ebulição
de um líquido é a temperatura na qual a
pressão de vapor do líquido é igual à
pressão externa ou pressão
atmosférica.
Prof. Dra. Lisandra Ferreira de Lima
DIAGRAMA DE FASES
Prof. Dra. Lisandra Ferreira de Lima