QUÍMICA - FRENTE II – FICHA 3 – TABELA PERIÓDICA
História da Tabela Periódica
Dimitri Ivanovitch Mendeleyev em 1869 ordenou cerca de 60 elementos químicos que eram conhecidos em
sua época. Ele ordenou em linhas horizontais segundo a ordem crescente de massa atômica e na vertical
os elementos com propriedades química semelhantes, elucidando a atual Tabela Periódica.
Classificação da Tabela Periódica Moderna
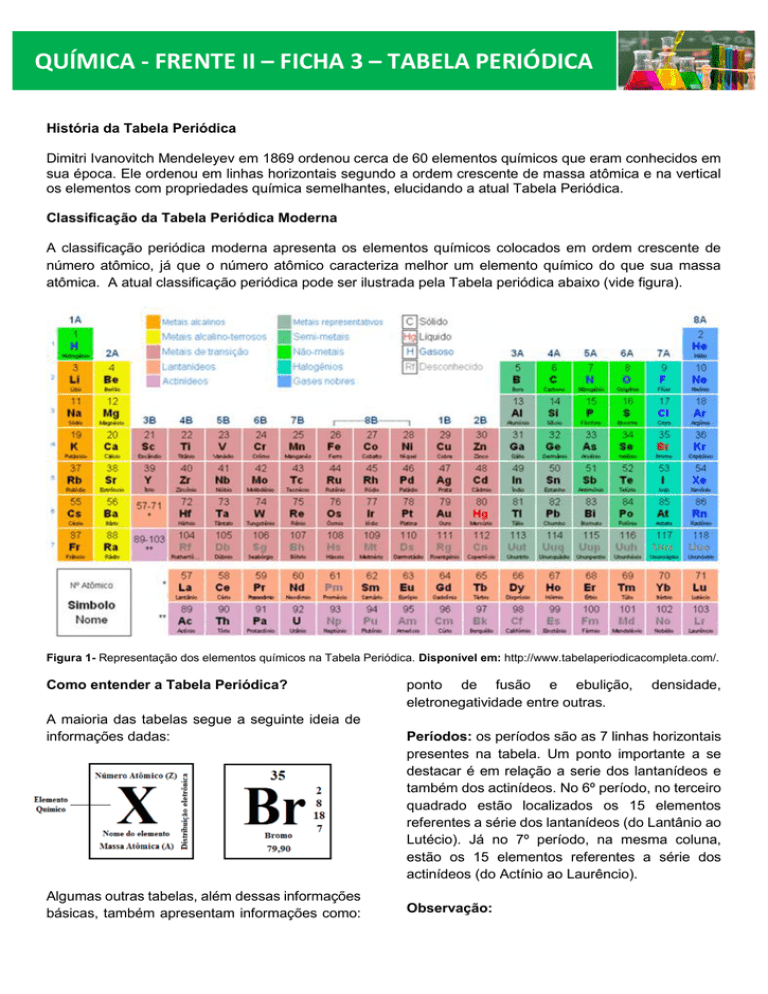
A classificação periódica moderna apresenta os elementos químicos colocados em ordem crescente de
número atômico, já que o número atômico caracteriza melhor um elemento químico do que sua massa
atômica. A atual classificação periódica pode ser ilustrada pela Tabela periódica abaixo (vide figura).
Figura 1- Representação dos elementos químicos na Tabela Periódica. Disponível em: http://www.tabelaperiodicacompleta.com/.
Como entender a Tabela Periódica?
A maioria das tabelas segue a seguinte ideia de
informações dadas:
Algumas outras tabelas, além dessas informações
básicas, também apresentam informações como:
ponto de fusão e ebulição,
eletronegatividade entre outras.
densidade,
Períodos: os períodos são as 7 linhas horizontais
presentes na tabela. Um ponto importante a se
destacar é em relação a serie dos lantanídeos e
também dos actinídeos. No 6º período, no terceiro
quadrado estão localizados os 15 elementos
referentes a série dos lantanídeos (do Lantânio ao
Lutécio). Já no 7º período, na mesma coluna,
estão os 15 elementos referentes a série dos
actinídeos (do Actínio ao Laurêncio).
Observação:
QUÍMICA - FRENTE II – FICHA 3 – TABELA PERIÓDICA
Elementos Transurânicos: são elementos
situados após o Urânio (U-92) e não existem na
natureza, sendo preparados artificialmente. Além
deles, são artificiais também o Tecnécio (Tc-43), o
Promécio (Pm-61) e o Astato (As-85).
Colunas, grupos ou famílias: se referem às 18
colunas presentes na Tabela Periódica. A
identificação das colunas é dada por uma
numeração corrida de 1, 2, 3, 4 e assim por diante
até o 18, segundo a IUPAC (Internacional Union of
Pure and Applied Chemistry – União Internacional
de Química Pura e Aplicada). Algumas famílias
têm nomes especiais:
Metais Alcalinos (1 ou 1A): Li, Na, K, Rb, Cs
e Fr.
Metais Alcalino-terrosos (2 ou 2A): Be, Mg,
Ca, Sr, Ba e Ra.
Calcogênios (16 ou 6A): O, S, Se, Te e Po.
Halogênios (17 ou 7A): F, Cl, Br, I e At.
Gases nobres (18 ou 8A): He, Ne, Ar, Kr, Xe
e Rn.
Observação:
O Hidrogênio (H), apesar de estar localizado na
coluna 1 ou 1A, ele não pertence aos metais
alcalinos. Ele tem características próprias e
diferentes de todos os outros elementos, logo não
se encaixa em nenhuma família em especifico. Ele
apenas aparece na família 1 por convenção.
Além do já discutido, podemos classificar os
elementos da tabela em classe: Metais, nãometais (ametais), semi-metais e gases nobres.
Figura 2 – Classificação dos elementos na tabela periódica
de acordo com as suas propriedades.
• Metais: incluem todos os elementos da tabela na
faixa rosa (vide figura acima), inclusive os metais
alcalinos e os alcalinos terrosos. Os metais têm
características próprias como, condutibilidade,
maleabilidade, elasticidade e brilho. Alguns
apresentam dureza, outros são bem moles que
podem ser cortados com papel.
• Ametais: incluem os elementos em verde (vide
figura), são eles: Carbono (C), Nitrogênio (N),
Oxigênio (O), Flúor (F), Fósforo (P), Enxofre (S),
Cloro (Cl), Selênio (Se), Bromo (Br), Iodo (I) e
Astato (At). Diferentemente dos metais, não são
bons condutores de eletricidade, mas sim
isolantes ou semi-condutores.
• Semi-metais: são os elementos em amarelo
(vide figura), o Boro (B), o Silício (Si), o Germânio
(Ge), o Arsênio (As), o Antimônio (Sb), o Telúrio
(Te) e o Polônio (Po). Eles apresentam
semelhanças das propriedades físicas com os
metais e químicas com os ametais, daí a
designação como semi-metal, ou seja, a transição
entre as características de ambos os grupos.
• Gases Nobres: Em condições normais de
temperatura e pressão (CNTP), são todos gases
inodoros, incolores, monoatômicos de baixa
reatividade química. Os seis gases nobres que
ocorrem naturalmente são o hélio (He), neônio
(Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e
radônio (Rn).
Configurações eletrônicas dos elementos ao
longo da classificação periódica
• Os 7 períodos da Tabela correspondem às 7
camadas ou níveis eletrônicos dos átomos. Ex: O
Ferro (Fe-26) está na 4ª linha, logo possui 4
camadas eletrônicas.
• Nas colunas 1 (1A), 2 (2A), 13 (3A), 14 (4A), 15
(5A), 16 (6A), 17 (7A) e 18 (8A), o número de
elétrons na última camada eletrônica é igual ao
próprio número da coluna. Ex: O nitrogênio está na
família 15 ou 5ª, portanto sua camada eletrônica
tem 5 elétrons (s² p³).
QUÍMICA - FRENTE II – FICHA 3 – TABELA PERIÓDICA
Figura 3 - Configurações eletrônicas dos elementos ao longo da classificação periódica.
Exercícios Resolvidos
1 – (Uneb – BA) Um átomo apresenta
normalmente 2 elétrons na primeira camada, 8
elétrons na segunda camada, 18 elétrons na
terceira camada e 7 na quarta camada. A família e
o período em que se encontra esse elemento são,
respectivamente:
a) Família dos halogênios, sétimo período;
b) Família do carbono, quarto período;
c) Família dos halogênios, quarto período;
d) Família dos calcogênios, quarto período;
e) Família dos calcogênios, sétimo período.
2p6
3s²
Logo a última camada pode ser representada por: 4s24p5
2 – (FGV-SP) Um elemento químico A apresenta
propriedades químicas semelhantes às do
oxigênio. A pode ter configuração eletrônica:
a) 1s² 2s² 2p6;
Resolução
Sabendo que o elemento A possui propriedades químicas
semelhantes, podemos dizer que estão na mesma família,
tendo, portanto, o mesmo número de elétrons na camada de
valência. Então, como o oxigênio se encontra na família dos
calcogênios ou 16 A, ele apresenta 6 elétrons na última
camada, tendo a seguinte configuração eletrônica:
1s² 2s² 2p6 3s² 3p4
Exercícios Complementares
Resolução
Fazendo a distribuição eletrônica, temos: 1s² 2s²
3p64s23d104p5
b) 1s² 2s² 2p6 3s²;
c) 1s² 2s² 2p6 3s² 3p¹;
d) 1s² 2s² 2p6 3s² 3p³;
e) 1s² 2s² 2p6 3s² 3p4.
1 - (UFAC) O número atômico do elemento que se
encontra no período III, família 3A,é:
a) 10;
b) 12;
c) 23;
d) 13;
e) 31.
2 - (Mack-2006) Átomos do elemento químico
potássio, que possuem 20 nêutrons, estão no
QUÍMICA - FRENTE II – FICHA 3 – TABELA PERIÓDICA
quarto período da tabela periódica, na família dos
metais alcalinos. Em relação a seus íons, é correto
afirmar que:
6 – (FUVEST) Na tabela periódica, os elementos
químicos estão ordenados:
a) têm Z = 18.
b) têm 20 elétrons e A = 40.
c) têm 18 elétrons e A = 39.
d) são cátions bivalentes.
e) têm A = 38.
3 – (UFRS) Considere os seguintes conjuntos de
elementos químicos:
I – H, Hg, F, He
II – Na, Ca, S, He
III – K, S, C, Ar
IV – Rb, Be, I, Kr
O conjunto que apresenta metal alcalino, metal
alcalino-terroso, calcogênio e gás nobre
respectivamente é:
a) I
b) II
c) III
d) IV
e) Todos os elementos representativos pertencem
aos grupos B da tabela periódica.
e) V
4 – (UFSM) Entre os pares de elementos
químicos, o par que reúne elementos com
propriedades químicas mais semelhantes é:
a) Na e K;
b) Cl e Ar;
c) Ca e Cu;
d) F e Ba;
e) H e I.
5 – (UFC – CE) Com relação à classificação
periódica moderna dos elementos, assinale a
afirmação verdadeira:
a) Na Tabela Periódica, os elementos químicos
estão colocados em ordem decrescente de
massas atômicas;
b) Em uma família, os elementos apresentam
propriedades químicas bem distintas;
c) Em uma família, os elementos apresentam
geralmente o mesmo número de elétrons na última
camada;
d) Em um período, os elementos apresentam
propriedades químicas semelhantes;
a) Segundo seus volumes atômicos crescentes e
pontos de fusão decrescentes;
b) Rigorosamente segundo suas massas atômicas
crescentes e, salvo algumas exceções, também
segundo seus raios atômicos crescentes;
c) De maneira tal que os ocupantes de uma
mesma família têm o mesmo número de níveis de
energia;
d) De tal modo que todos os elementos de
transição se localizam no mesmo período;
e) De maneira tal que o volume atômico, ponto de
fusão e energia de ionização variam
periodicamente.
7 – Um elemento X apresenta a configuração 5s2
5p3 na camada de valência. Indique o grupo e a
família desse elemento na tabela periódica:
a) 5º período e família dos calcogênios.
b) 15º período e família dos halogênios.
c) 3º período e família do nitrogênio.
d) 5º período e família do nitrogênio.
e) 5º período e família dos gases nobres.
8 – (Uniceub - DF) O aço tem como um dos
componentes que lhe dá resistência e
ductibilidade o elemento vanádio; sobre o vanádio
podemos afirmar que seu subnível mais
energético e seu período são, respectivamente:
(Dado: 23V.)
a) 4s2 e 4º período.
b) 3d3 e 4º período.
c) 4s2 e 5º período.
d) 3d3 e 5º período.
e) 4p3 e 4º período.
Gabarito
1 - D; 2 - C; 3 - B; 4 - A; 5 - C; 6 - E; 7 - D; 8 - B.












