AVALIAÇÃO DO EFEITO DA METFORMINA NO CRESCIMENTO
TUMORAL E NAS ALTERAÇÕES METABÓLICAS HEPÁTICAS
INDUZIDAS PELO TUMOR WALKER-256
Winny Beatriz de Souza (PIBIC/UEL- Fundação Araucária), Flaviane de Fátima
Silva, Helenir Medri de Souza (Orientadora), e-mail: [email protected].
Universidade Estadual de Londrina/ Departamento
Fisiológicas/ Centro de Ciências Biológicas, Londrina, PR.
de
Ciências
Área e sub-área do conhecimento: Ciências Biológicas/Fisiologia
Palavras-chave: Câncer, perfusão de fígado, alterações metabólicas.
Resumo
Portadores de câncer apresentam uma síndrome complexa (caquexia),
caracterizada por acentuado catabolismo de proteínas e lipídeos, que resulta
em perda de tecido muscular e adiposo e de peso corpóreo. A resistência
insulínica parece colaborar para esse estado hipercatabólico e
desenvolvimento da caquexia. Assim, é possível que terapias que melhorem a
sensibilidade à insulina (INS) possam amenizar a perda de massa corporal e
outras alterações metabólicas associadas à caquexia do câncer. Este estudo
investigou os efeitos da metformina (MET), um fármaco sensibilizador da INS,
isolada ou associada à INS, sobre o crescimento tumoral e alterações
metabólicas hepáticas induzidas pelo tumor Walker-256. A MET (300 ou 500
mg.kg-1, oral) e MET+INS (NPH, 1,0 UI.kg-1, sc) foram administradas uma vez
ao dia, por 12 dias, iniciando o tratamento no dia da inoculação das células
tumorais. A MET e MET+INS não alterou o crescimento tumoral, a inibição da
glicólise e neoglicogênese e nem afetou glicogenólise. Concluiu-se que o
tratamento com MET e MET+INS não teve efeito sobre as anormalidades
hepáticas induzidas pelo tumor-Walker-256.
Introdução e objetivo
A caquexia do câncer tem como característica a perda progressiva do peso
corpóreo, com predomínio do catabolismo e redução do anabolismo, havendo
alterações no metabolismo de carboidratos, proteínas e lipídios, com intensa
perda de massa muscular e adiposa (1). Um achado comum que pode
contribuir para a caquexia do câncer é a resistência periférica à INS, visto que
a INS tem importantes efeitos anabólicos e anti-catabólicos. Portanto, é
possível que o uso de agentes sensibilizadores da INS, como a MET
(Glifage®), possa ter efeitos benéficos na resistência à INS e em algumas
alterações metabólicas associadas ao câncer. A MET é um antidiabético com
capacidade de aumentar a ligação INS-receptor e a atividade tirosino-quinase
do receptor de INS no músculo e fígado, aumentando a captação de glicose
pelos tecidos. O objetivo deste estudo foi investigar os efeitos da MET e
MET+INS sobre o crescimento tumoral e alterações metabólicas hepáticas
induzidas pelo tumor Walker-256.
Materiais e métodos
Os procedimentos com os animais foram aprovados pelo Comitê de Ética em
Experimentação Animal da Universidade Estadual de Londrina. Foram usados
ratos machos Wistar (220-230 g) saudáveis (RS) e portadores de tumor
Walker-256 (RPT), tratados com MET ou MET+INS, ou não-tratados. Para a
implantação do tumor foram inoculadas 8x10 7 células Walker-256 (sc) no
flanco direito dos ratos. Os RS foram inoculados com PBS. Os RPT foram
tratados com MET (300 ou 500 mg.kg-1, oral) e MET+INS (NPH, 1,0 UI.kg-1,
sc), a partir do dia da inoculação das células tumorais. Ratos controles (RPT
ou RS) receberam veículo no lugar de MET ou INS. Os experimentos foram
realizados 12 dias após os tratamentos. No 12º dia, os ratos foram submetidos
à perfusão de fígado com o tampão Krebs/Henseleit-bicarbonato. Para a
perfusão, ratos anestesiados com tiopental (50 mg/Kg) foram laparatomizados
para canulação da veia porta (para a entrada do líquido de perfusão) e da veia
cava inferior para a coleta do líquido de perfusão efluente do fígado, o qual foi
usado para avaliação da glicólise a partir da glicose exógena, da
neoglicogênese a partir da alanina e da produção de glicose e glicogenólise
basal. A glicólise foi calculada como: ½ produção de piruvato + lactato e a
glicogenólise como: produção de glicose + ½ produção de piruvato + lactato
liberados no perfusado. Os protocolos de perfusão do fígado estão ilustrados
nas figuras. Após a perfusão o tumor foi dissecado e pesado para avaliação do
crescimento tumoral. As concentrações de glicose (2), lactato (3) e piruvato (4)
no perfusado foram mensuradas por métodos enzimáticos. Os resultados
foram analisados por Anova One-Way seguido de Tukey utilizando os
programas Statistics 6 ou GraphPad Prism 5.0. Os dados foram expressos
como média ± EPM e ao nível de significância de 5% (p<0,05).
Resultados e discussão
Os tratamentos com MET (300 ou 500 mg.kg-1), isoladas ou associada com
INS, não alteraram o crescimento do tumor (Fig 1). Os RPT apresentaram
menor produção de lactato (Fig 2A), piruvato (Fig 2B) e glicólise (Fig 2C) a
partir da glicose exógena, em relação aos RS. Estes resultados são
consistentes com a menor atividade da glicoquinase já observada nestes
animais e indicam menor captação de glicose pelo fígado dos RPT. Os
tratamentos com MET (500 mg.kg-1), isolado ou associado com a INS, não
tiveram efeitos sobre esses parâmetros (Fig 2D). Os RPT apresentaram
redução da produção de glicose (Fig 3A) e glicogenólise (Fig 3B) em
comparação aos RS, possivelmente devido ao menor conteúdo de glicogênio
no fígado. O tratamento com MET (500 mg.kg-1) não alterou estes parâmetros,
mas o tratamento com MET+INS aumentou a produção de glicose e
glicogenólise dos RPT, em relação aos RS (Figs 3C, 3D), possivelmente
porque a INS aumentou o conteúdo de glicogênio e a MET, por ativação da
proteína quinase dependente de AMP (AMPK), estimulou a glicogenólise. Em
comparação aos RS, os RPT apresentaram inibição da neoglicogênese a partir
da alanina, como visto pela menor produção hepática de glicose (Fig 4A),
lactato (Fig 4B) e piruvato (Figs 4C). O tratamento com MET (500 mg.kg -1) ou
MET+INS não alterou a produção de glicose, mas aumentou a produção de
lactato e piruvato no fígado dos RPT (Fig 4D), efeito que pode ser resultante
da ação estimulatória da MET no catabolismo da glicose (glicólise) proveniente
da neoglicogênese.
Conclusão
Tratamento com MET, isolado ou associado à INS, não reduziu o crescimento
tumoral, não alterou a inibição da glicólise e neoglicogênese e nem teve efeito
sobre a glicogenólise hepática.
Agradecimentos
Fundação Araucária e Universidade Estadual de Londrina.
Referências
1. TISDALE, M.J. Are tumoral factors responsible for host tissue
wasting in cancer cachexia? Future Oncology, v. 6, n. 4, p. 503-513,
2010.
2. GUTMANN, I.; WAHLEFELD, W. L-(+)-lactate. Determination with
lactate dehydrogenase and NAD. In: Bergmeyer, H.U. Methods of
enzymatic analysis. Academic press, p. 1464-1472, 1974.
3. CZOK, R.; LAMPRECHT, W. Pyruvate, phosphoenolpyruvate and Dglycerate-2-phosphate. In: Bergmeyer, H.U. Methods of Enzymatic
Analysis. Academic Press, p. 1446-1448, 1974.
4. Bergmeyer HU, Bernt E. Determination of glucose with glucose-oxidase
and peroxidase. Met Enz Anal 1974;2:1205-15.
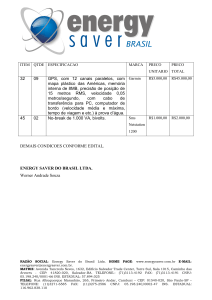
Figura 1. Massa tumoral (n=8 a 23); Figura 2.Produção de lactato (A), piruvato (B), glicólise
(C) e áreas sob as curvas (AUCs) (D) (n=5 a 6); Figura 3. Produção de glicose (A),
glicogenólise basal (B) e valores médios de produção de glicose (C) e glicogenólise (D) (n=5 a
6); Figura 4. Produção de glicose (A), lactato (B) e piruvato (C) a partir da alanina e AUCs (D)
(n=3 a 7); Em fígados de ratos portadores de tumor Walker-256 tratados com metformina 300
(Tumor + Met 300) e/ou 500 (Tumor + Met 500 mg.kg-1) ou com metformina + insulina (Tumor +
Met + INS) ou veículos, durante 12 dias. Resultados analisados por ANOVA One-Way seguido
de Tukey. *p<0,05; **p<0,01 e ***p<0,001 versus Saudável. #p<0,05 e ###p<0,001 versus
Tumor.