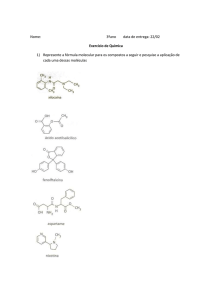
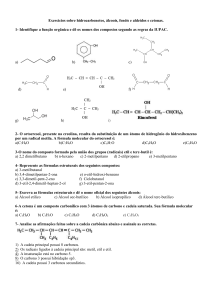
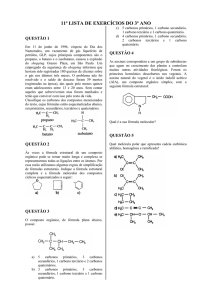
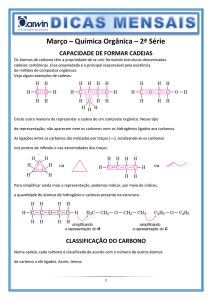
GABARITO
Química E – Extensivo – V. 1
Exercícios
01)B
a)Errada. Cada ligação dupla possui dois elétrons
pi. Como existem 11 ligações duplas, segue que o
número de elétrons pi é 22.
b)Certa. Ligações conjugadas são as ligações duplas
entre átomos de carbono que se alternam com simples.
c)Errada. Possui 18 átomos de carbono sp3 (que só
fazem ligações simples).
d)Errada. Não possui carbono quiral (assimétrico).
Carbono quiral é o carbono que só faz ligações
simples, possuindo 4 ligantes diferentes.
e)Errada. A estrutura apresentada é apolar e, portanto,
não é solúvel em água.
07)Alternativas corretas: II, III, IV e VI.
I. Errada. Em um anel aromático, todos os carbonos
fazem ligação dupla (hibridação sp2).
II. Certa. Os orbitais p puro são formados na ligação
pi. Os seis átomos do anel participam de ligação
pi, totalizando os seis orbitais que não são híbridos
(p – p ou "p puro").
III. Certa. Os hidrogênios têm orbital s e os carbonos
de dupla ligação têm hibridação sp2. A ligação
entre hidrogênio e carbono é simples (sigma) do
tipo s – sp2.
IV. Certa. São três ligações duplas (pi).
V. Errada. São 12 ligações sigma, sendo 6 dentro do
anel e mais 6 entre carbonos e hidrogênios.
VI. Certa. Todos os carbonos do anel fazem dupla
ligação.
VII. Errada. Todos os carbonos do anel são insaturados
(ligação dupla).
02)D
Ligações pi: uma na ligação dupla e duas na ligação
tripla = 3
Carbono de hibridação sp2 é o carbono que faz ligações duplas, ou seja, é o caso de todos os carbonos
da estrutura apresentada.
03)C
08)C
A ligação pi é a ligação conhecida como dupla. Essa
ligação ocorre entre átomos que possuem pelo menos
um orbital p incompleto. Ocorre em eixos paralelos com
interpenetração de orbitais.
04)D
A ligação pi é a ligação conhecida como dupla. Essa
ligação ocorre entre átomos que possuem pelo menos
um orbital p incompleto. Ocorre em eixos paralelos com
interpenetração de orbitais.
Para a determinação da fórmula molecular ou estrutural a partir da representação espacial, recomenda-se
observar as quantidades de hidrogênios ligados às
estruturas dos carbonos. O número de vértices nos
pontos de ligação de cada estrutura mostra as ligações
entre os carbonos.
09)D
Na representação espacial o carbono é colocado no
centro do tetraedro e as valências ficam nos vértices.
05)C
I. Certa. As ligações sigma são as ligações simples.
II. Certa. Na ligação dupla, uma é sigma e uma é pi,
totalizando três sigma e uma pi.
III.Errada. Na ligação tripla, uma é sigma e duas são
pi, totalizando duas sigma e duas pi.
IV.Certa. Sendo uma entre os carbonos 3 e 4 e outras
duas entre os carbonos 1 e 2.
06)E
Ligações sigma: uma na ligação dupla, uma na ligação
tripla e as ligações simples. Não esquecer as ligações
entre carbono e hidrogênio.
10)Respostas:
a)Fórmula estrutural plana condensada (mostra a
estrutura da molécula de forma resumida, omitindo
as ligações dos hidrogênios).
b)Fórmula molecular (ainda mais resumida, mostra
uma unidade de cada elemento com seu índice de
atomicidade).
c)Fórmula estrutural plana (mostra a estrutura da
molécula).
d)Fórmula espacial (mostra de forma mais completa
a estrutura da molécula no espaço).
Química E
1
GABARITO
11)18
16)C
01.Errada. A ligação dupla entre carbonos caracteriza a cadeia insaturada.
02.Certa. O átomo diferente é o heteroátomo que
caracteriza a cadeia heterogênea.
04.Errada. A cadeia normal não apresenta ramificações.
08.Errada. Cadeias aromáticas com mais de um
núcleo podem ser condensadas (núcleos juntos)
ou isoladas (núcleos separados).
16.Certa. Se há apenas um núcleo, a palavra
condensada não é apropriada pois representa
a união de dois ou mais núcleos.
32.Errada. A classificação correta é aberta, heterogênea, ramificada e insaturada, pois há ligação
dupla entre carbonos.
A cadeia é acíclica (aberta), com duas ramificações, duas
insaturações (duplas ligações) e homogênea (sem heteroátomo entre carbonos).
17)D
A cadeia é alifática (aberta), com duas ramificações, uma
insaturação (dupla ligação) e heterogênea (com o heteroátomo nitrogênio entre carbonos).
18)B
A cadeia é acíclica (aberta), saturada (sem duplas ligações entre carbonos) e heterogênea (com o heteroátomo
nitrogênio entre carbonos).
12)B
19)C
É sempre importante orientar o aluno iniciante na
disciplina sobre a cadeia homogênea. No exemplo,
os oxigênios estão fora da cadeia e por isso não
são heteroátomos. Para a cadeia ser heterogênea,
o heteroátomo deve estar entre dois carbonos, da
mesma forma que a ligação dupla, para tornar a
cadeia insaturada.
13)62
20)A
1
2
3
4
5
CH3
CH
C
CH2
CH3
6
01.Errada. O carbono terciário (3) faz ligação dupla. Para ser assimétrico, o carbono deve fazer
somente ligações simples e ter quatro ligantes
diferentes.
02.Certa. Os carbonos 1, 5 e 6.
04.Certa. Os carbonos 2 e 3.
08.Certa. Os carbonos 2 e 4.
16.Certa. Todo carbono é tetravalente (faz 4 ligações).
32.Certa. Os carbonos 1, 4, 5 e 6.
64.Errada. O composto é orgânico.
Na cadeia heterogênea, o heteroátomo (átomo diferente de carbono) deve estar entre dois carbonos.
15)Respostas:
a)Aberta (alifática ou acíclica), normal, heterogênea,
saturada.
b)Aberta (alifática ou acíclica), ramificada, homogênea, saturada.
A cadeia é aberta, normal (sem ramificações), insaturada
com duas insaturações (duplas ligações) e homogênea
(sem heteroátomo entre carbonos).
22)C
A cadeia é acíclica (aberta), saturada (sem duplas ligações
entre carbonos) e com uma ramificação.
23)26
14)34
2
A cadeia é alifática (aberta), homogênea (sem heteroátomo
entre carbonos), insaturada (com uma ligação dupla entre
carbonos) e com uma ramificação.
21)E
CH3
A cadeia é heterogênea (com o heteroátomo nitrogênio
entre carbonos), saturada (sem dupla ligação entre carbonos) e com quatro ramificações. Para cadeias cíclicas,
considera-se o ciclo como a cadeia principal e os substituintes de carbono como ramificação.
Cadeia carbônica normal é a cadeia não ramificada. Nesse tipo de cadeia, existirão apenas carbonos primários e
secundários.
24)99
Na cadeia carbônica saturada, existem apenas ligações
simples entre os átomos de carbono. Uma ou mais ligações duplas ou triplas entre carbonos caracteriza a cadeia
insaturada. É importante diferenciar cadeia saturada de
carbono saturado. No item 01, por exemplo, existe um
carbono insaturado (faz dupla ligação), todavia a cadeia
é saturada pois entre os carbonos só existe ligação simples.
Química E
GABARITO
31)E
25)Resposta: III
I. Errada. A cadeia é alifática, normal, saturada e
homogênea.
II. Errada. A cadeia é alifática, normal, saturada e
heterogênea.
III.Certa.
IV.Errada. A cadeia é alifática, normal, insaturada e
homogênea.
I. Errada. Existem apenas 2 anéis aromáticos.
II. Certa. Cada vértice das formas geométricas corresponde a um carbono.
III.Certa. Para saber os hidrogênios, deve-se completar as ligações do carbono totalizando quatro
ligações.
26)D
A cadeia é acíclica (aberta), ramificada (com duas
ramificações), insaturada (com uma dupla ligação) e
homogênea (sem heteroátomo entre carbonos).
32)94
01.Errada. A cadeia é fechada (cíclica).
02.Certa. Dentro do ciclo existe um oxigênio (heteroátomo).
04.Certa. Alicíclica é a cadeia fechada que não é aromática (costuma confundir com acíclica, que quer
dizer aberta).
08.Certa. Não contém ligações duplas entre os carbonos.
16.Certa. Está entre carbonos.
32.Errada. A cadeia contém um carbono secundário
e dois carbonos primários (ligam-se a apenas um
carbono).
64.Certa.
27)C
Carbono primário: ligado a somente mais um carbono.
CH3
CH3
C
CH2
CH3
CH3
28)A
Recomenda-se ao aluno mais inexperiente que redesenhe a estrutura com sua fórmula estrutural completa.
33)C
Hidrocarboneto: composto orgânico formado por apenas carbonos e hidrogênios.
Insaturado: com duplas ligações entre átomos de
carbono.
Aromático: com anel aromático (núcleo benzênico – 6
carbonos com 3 duplas ligações alternadas).
Núcleos condensados: os núcleos têm contato direto
entre si.
29)C
a)Certa. Um ciclo com duas ramificações.
b)Certa. As duas ligações duplas.
c)Errada. A cadeia possui carbonos primários, secundários e terciários, mas não possui carbono
quaternário (ligado a outros 4 carbonos).
d)Certa.
e)Certa. Carbonos ligados a outros 3 carbonos.
Ressonância, ou mesomeria, é o fenômeno que ocorre
quando um composto pode ser representado por duas
ou mais fórmulas estruturais, apresentando a mesma
posição para os núcleos dos átomos, mas diferindo
pela posição dos elétrons que fazem parte da ligação.
Esse fenômeno ocorre nas ligações pi pois não têm
localizações rígidas (são deslocalizadas), podendo
ocorrer em qualquer parte da molécula. O fenômeno
de ressonância comumente observado em anéis aromáticos dá origem às formas canônicas.
34)22
01.Errada. Existem 4 carbonos terciários (marcados
abaixo).
30)A
A ligação pi corresponde a ligação dupla e a cadeia
aromática é a que contém o anel aromático (seis carbonos em ciclo com 3 duplas ligações alternadas entre
eles).
02.Certa. Em cada vértice há um hidrogênio, exceto
nos carbonos terciários.
04.Certa.
Química E
3
GABARITO
08.Errada. Os núcleos estão condensados (em
contato direto).
16.Certa.
32.Errada. A cadeia é insaturada com duplas ligações entre os átomos de carbono.
64.Errada. A fórmula molecular é C14H10.
39)B
35)56
01.Errada. A cadeia é mista (uma parte aberta e uma
parte fechada ou cíclica).
02.Errada. A cadeia é mista (uma parte aberta e uma
parte fechada, ou cíclica).
04.Errada. A cadeia é mista (uma parte aberta e uma
parte fechada, ou cíclica).
08.Certa.
16.Certa. Na parte aberta, existe dupla ligação
(insaturada).
32.Certa. Na parte fechada (cíclica), não existe heteroátomo.
64.Errada. Tem apenas 5 carbonos secundários
(ligados a outros dois carbonos).
a)Errada. Alicíclica é a cadeia fechada que não é aromática.
b)Certa.
c)Errada. Alifática quer dizer aberta.
d)Errada. A cadeia tem heteroátomo.
e)Errada. A cadeia contém duplas ligações entre átomos
de carbono.
40)B
a)Errada. Alicíclica é a cadeia fechada que não é aromática.
b)Certa.
c)Errada. Alifática quer dizer aberta.
d)Errada. A cadeia tem heteroátomo.
e)Errada. A cadeia contém duplas ligações entre átomos
de carbono.
36)D
a)Errada. A cadeia é insaturada.
b)Errada. A cadeia é heterogênea e contém carbonos
primários (os que estão ligados ao oxigênio).
c)Errada. A cadeia contém carbonos primários (os
que estão ligados ao cloro).
d)Certa.
e)Errada. A cadeia é heterogênea e contém carbonos
primários (os que estão ligados ao nitrogênio).
41)C
a)Errada. A cadeia carbônica é saturada (somente
ligações simples entre os carbonos).
b)Errada. O cloro não está entre dois carbonos e por
isso não é heteroátomo.
c)Certa. Os 3 carbonos da cadeia são secundários
(ligam-se a outros 2 carbonos).
d)Errada. A cadeia é heterogênea, pois o oxigênio está
entre dois carbonos.
37)E
a)Errada. Apresenta 4 vezes o átomo de nitrogênio
como heteroátomo.
b)Errada. Não possui nenhum carbono ligado a
outros 3 carbonos.
c)Errada. É um composto orgânico.
d)Errada. Todos os carbonos fazem dupla ligação,
sendo hibridizados em sp2.
e)Certa.
38)Resposta: 19 e 5
H
H
H
H
H
H
4
H
Ligações sigma: são as ligações simples e uma das duas
na ligação dupla, 19.
* Não esqueça de somar as ligações entre carbono e
hidrogênio.
Ligação pi: uma das duas na ligação dupla, 5.
42)B
Para ser considerado aromático, o composto deve ter um
ou mais anéis aromáticos, que podem estar conjugados
ou isolados. Cada anel deve ter 6 carbonos e 3 ligações
duplas alternadas.
43)D
H
Química E
São acíclicos (abertos) os compostos: 1 e 2
São monocíclicos (um ciclo) os compostos: 4 e 5
São bicíclicos (dois ciclos) os compostos: 3 e 6
Dois ou mais anéis podem ligar-se e formar sistemas
bicíclicos ou policíclicos, que, em geral, ocorrem ligados
por um dos três modos: em junção, o mais comum,
compartilham átomos de carbono; anéis unidos por
pontes, também comuns, compartilham dois átomos
de carbono não adjacentes (carbono "cabeça de ponte",
essa ponte podendo conter um ou mais carbonos); e,
por último, compostos espirocíclicos, em que dois anéis
compartilham somente um átomo de carbono, sendo
estes compostos mais raros.
GABARITO
44)A
50)C
I. Certa.
II. Certa. Os hidrocarbonetos são apolares e por isso
as interações intermoleculares são de dipolo induzido.
III.Errada. A densidade do petróleo é menor que a da
água, motivo pelo qual esse líquido flutua na água.
IV.Errada. O petróleo não se mistura com água.
a)Errada. A eficiência aumenta com o custo do combustível. Lenha e carvão, por exemplo, têm menor
custo, porém são menos eficientes.
b)Errada. Depende do combustível renovável, alguns
podem ser mais eficientes, outros não.
c)Certa. A eficiência passa de 30% para quase 60%.
d)Errada. A eficiência passa de pouco menos de 60%
para pouco mais de 60% (menos de 10%).
e)Errada. O combustível para sofrer a combustão
precisa ser vaporizado.
45)C
A graxa é um derivado do petróleo e por isso predominam hidrocarbonetos que são apolares. Para a remoção
de graxa, é necessário o uso de um solvente apolar. Das
opções apresentadas, apenas a gasolina é molécula
apolar (hidrocarboneto).
51)B
46)a)Para o metano, a fórmula mínima é a mesma fórmula
molecular: CH4
Massa molar:C: 12 x 1 = 12
H: 1 x 4 = 4
16 g/mol
b)CH4 + 2O2 → CO2 + 2H2O
metano + oxigênio
gás carbônico + água
47) a)CH4 + 2O2 → CO2 + 2H2O
b)16 g _____ –890 kJ
x _____ –222,6 kJ
x = 4 g
52)E
∆Hoc = –890 kJ/mol
Determinação da quantidade de energia produzida por
mol de CO2:
Álcool: 1 g ______ 30 kJ
46 g ______ x x = 1380 kJ
48)A
Em relação às massas dos combustíveis, observa-se
pela análise da tabela que 1 kg de GNV produz mais
energia que 1 kg de gasolina. Todavia, 1 kg de gasolina
ocupa um espaço muito menor que 1 kg de GNV, pois a
densidade da gasolina é muito maior. Logo, um menor
volume de gasolina produzirá muito mais energia. Para
produzir energia semelhante é preciso um volume muito
maior do gás. O armazenamento sob pressão permite
que se tenha uma quantidade suficiente de gás para
que o veículo possa rodar quantidade suficiente de
quilômetros (autonomia).
A maioria das formas de produção de energia se baseia
na produção de gases que fazem trabalho.
49)E
a)Errada. O consumo por km seria menor com óleo
de girassol (mais econômico).
b)Errada. Com ambos os combustíveis pode-se atingir
a velocidade máxima da máquina, variando apenas
o consumo do combustível.
c)Errada. Como o óleo de girassol é mais econômico,
o combustível acabaria em maior tempo.
d)Errada. Como o combustível é mais eficiente, deve
gerar maior potência.
e)Certa. O combustível é mais eficiente e, portanto,
libera mais energia por litro.
C2H5OH + 3O2 → 2CO2 + 3H2O ∆Hc = –1380 kJ/mol
2 mol de CO2 ______ –1380 kJ
1 mol de CO2 ______
y
y = 690 kJ/mol de CO2 Gasolina: 1 g _____ 47 kJ
114 g _____ x
x = 5358 kJ
C8H18 + 25/2O2 → 8CO2 + 9H2O ∆Hc = –5358 kJ/mol
8 mol de CO2 _____ –5358 kJ
1 mol de CO2 _____
y
y = 669,75 kJ/mol de CO2
Química E
5
GABARITO
Gás natural: 1 g _____ 54 kJ
16 g _____ x
x = 864 kJ
CH4 + 2O2 → 1CO2 + 2H2O ∆Hc = –864 kJ/mol
1 mol de CO2 _____ –864 kJ/mol de CO2
Gás natural (864 kJ/mol CO2); álcool (690 kJ/mol CO2); gasolina (669,75 kJ/mol CO2).
Ordem decrescente de produção de energia
53)E
58)06
É importante dar ênfase a esse tipo de pergunta para
o aluno que costuma assinalar "alcano". É importante
lembrar que a função orgânica é hidrocarboneto, sendo
alcano uma subfunção.
O carbono assimétrico precisa ter 4 ligantes diferentes.
Pelo enunciado, a cadeia deve conter uma ligação
dupla (etênica).
H
54)B
CH2
Apesar de ser um termo em desuso, a palavra "olefina"
refere-se aos alcenos (compostos com uma dupla
ligação entre carbonos).
55)B
59)B
Os hidrocarbonetos gasosos na temperatura ambiente
são os que possuem cadeia pequena (de até 4 carbonos). Nas alternativas A, D e E, os compostos não são
hidrocarbonetos.
Quanto maior a massa da cadeia, maiores são os
pontos de fusão e ebulição. Isso deixa como opção
as alternativas B e C (a alternativa E é um álcool).
A cadeia da alternativa C é menos ramificada, e por isso
suas moléculas têm maior interação com moléculas adjacentes (interações intermoleculares). Quanto maiores
o número e a intensidade de ligações intermoleculares,
maiores serão os pontos de fusão e ebulição.
O metano (CH4) é um gás que não possui cor (incolor)
nem cheiro (inodoro). Considerado um dos mais simples hidrocarbonetos, possui pouca solubilidade na
água e, quando adicionado ao ar, torna-se altamente
explosivo.
60)D
( 7 ) – anel aromático.
( 2 ) – cadeia aberta com uma ligação dupla.
( 5 ) – cadeia fechada com ligações simples.
( 3 ) – cadeia aberta com uma ligação tripla.
( 6 ) – cadeia fechada com uma ligação dupla.
( 1 ) – cadeia aberta com ligação simples.
( 4 ) – cadeia aberta com duas duplas ligações.
6
CH3
CH3
57)B
C*
CH2
56)C
CH
Química E
Os hidrocarbonetos saturados de cadeia aberta possuem fórmula geral CnH2n+2, ou seja, o número de
hidrogênios em relação ao de carbonos é o dobro mais
2 unidades.
5 . 2 = 10 + 2 = 12