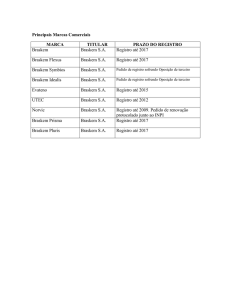
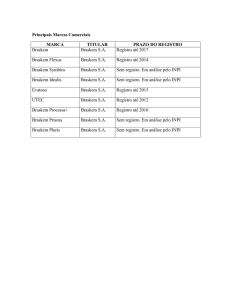
ESTUDO DA DEPOSIÇÃO DE FILMES DE PRATA POR REDUÇÃO QUÍMICA EM
SUBSTRATOS ISOLANTES SrTiO3.
Fernanda Cunha Clementoni Nogueira, Carlos Alberto Moreira dos Santos e Antonio Jefferson da
Silva Machado.
Departamento de Engenharia de Materiais – DEMAR - Faenquil
A eletrodeposição de filmes supercondutores da fase YBa2Cu3O7-δ tem mostrado
resultados promissores quanto a sua qualidade morfológica e cristalográfica, bem como quanto as
suas propriedades supercondutoras, em substratos isolantes de SrTiO3. Entretanto, para que a
eletrodeposição nestes substratos isolantes seja possível, é necessário inicialmente a deposição de
um filme metálico para promover a condutividade elétrica inicial do substrato. Em geral, um
filme de prata é depositado sobre estes substratos (SrTiO3) pelos métodos convencionais de
vácuo, como por exemplo “laser e sputtering” entre outros. Este passo inicial não permite que
todo o processo seja comandado por eletrodeposição. Neste trabalho, estamos propondo a
deposição de prata sobre SrTiO3 por um processo de redução química. Esta deposição é feita
usando-se uma solução amoniacal de prata e sulfato de hidrazina como agente redutor. Serão
mostrados resultados de um estudo sistemático da cinética e mecanismo desta reação de redução.
Além disto também serão mostrados resultados sobre o acompanhamento da relação epitaxial do
filme em função da espessura de prata depositada , através de resultados de difração de raios x,
varredura ômega, que comprovam a excelente orientação preferencial do filme obtido.
Palavras chave : deposição por redução química, relação epitaxial, cinética de reação
ABSTRACT
The electrodeposition process, reveal promissory results for synthesis of the thin films
superconductors, in insulator substrates (SrTiO3) . However its necessary promote the initial
conductive of the surface in the insulator substrate, that is used as cathode electrode in
electrodeposition process. This is make by vacuum process as well as laser ablation, sputtering
etc. This step is limited by substrate geometry and by high cost of operation. In this work we
presented on alternative proposed for silver deposition in insulator substrate, as single crystal of
SrTiO3 and sapphire. Is showed results about the kinetics reaction of silver as a function of
reagents (Ag and N2H6SO4) and the influence in the oriented preferred of the silver with the
substrate.
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14801
1 - Introdução
A eletrodeposição de filmes supercondutores da fase YBa2Cu3O7-δ tem mostrado
resultados promissores quanto a sua qualidade morfológica e cristalográfica, bem como quanto as
suas propriedades supercondutoras, em substratos isolantes de SrTiO3 [1-4] Entretanto, para que a
eletrodeposição nestes substratos isolantes seja possível, é necessário inicialmente a deposição de
um filme metálico para promover a condutividade elétrica inicial do substrato. Em geral, um
filme de prata é depositado sobre estes substratos (SrTiO3) pelos métodos convencionais de
vácuo, como por exemplo laser e sputtering entre outros [1-2]. Os requisitos necessários para que
o filme eletrodepositado do material supercondutor seja de boa qualidade, são: condutividade
elétrica homogênea da prata depositada, crescimento orientado com relação ao substrato
(epitaxia), aderência e morfologia de alta qualidade. Estes requisitos são atingidos quando a
deposição de prata é feita pelos processos de alto vácuo. Entretanto, estes processos apresentam
uma série de desvantagens, como por exemplo, alto custo e limitação quanto ao tamanho e
geometria do substrato. Estas limitações terão implicações imediatas no custo do filme
eletrodepositado. Desta maneira faz-se necessário o desenvolvimento de uma tecnologia
alternativa às técnicas de vácuo mencionadas acima, para deposição de prata em substratos
isolantes. Alguns processos de deposição de prata são puramente químicos (electroless) e muito
mais baratos que os processos de vácuo, como por exemplo a deposição de prata usada na
indústria de espelhos. Em particular para fabricação de espelhos, é usado uma solução amoniacal
de prata juntamente com formaldeído como agente redutor. Neste processo deposita-se cerca de
1g/m2 de prata sobre os vidros pré tratados. Esta massa de prata depositada sobre 1 m2 de vidro,
leva a um filme de cerca de 1000 Å de espessura. Entretanto não há na literatura nenhum
resultado, de um estudo sistemático que permita entender a reação em questão, e assim permitir o
controle de deposição, quanto as suas qualidades morfológicas e cristalográficas.
Neste trabalho é mostrado um estudo sistemático da cinética de reação de deposição da
prata, usando sulfato de hidrazina como agente redutor, sobre substrato de SrTiO3
monocristalino. Os resultados apontam evidências que a prata e o sulfato de hidrazina, possuem
ordem parcial igual 1. Além disto, os resultados sugerem que as concentrações dos elementos (
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14802
prata e sulfato de hidrazina) não tem influência na orientação preferencial do filme produzido,
com relação ao substrato.
2 – PROCEDIMENTO EXPERIMENTAL
A deposição de prata via processo de redução química é viável, quando ocorre a
complexação da prata num meio amoniacal. Esta solução é preparada, adicionando-se ao nitrato
de prata (AgNO3) uma solução de hidróxido de amônio (NH4OH), que obedece as seguintes
reações:
AgNO3 + NH4OH → AgOH + NH4NO3
(1)
AgOH + 2 NH4OH → [Ag(NH3)2]OH + 2 H2O
(2)
Na etapa seguinte, o complexo de prata amoniacal ([Ag(NH3)2]OH), mostrado na reação
2, reage com sulfato de hidrazina (N2H6SO4), e é reduzido na superfície do substrato como Agº.
Para acompanhar a influência dos dois reagentes no depósito sobre os substratos estudados, várias
concentrações de N2H6SO4 e [Ag(NH3)2]OH de 2.5, 5 e 10 g/l e 10,20 e 40 g/l respectivamente
foram preparadas. Inicialmente fixou-se a concentração de prata em 40 g/l e foi feito o
acompanhamento da reação em função da concentração de N2H6SO4, em seguida o mesmo
procedimento foi adotado fixando-se a concentração de N2H6SO4 e variando-se a concentração de
prata. Em cada experimento procedeu-se da seguinte forma: a) limpeza do substrato com uma
escova de cerdas macias e ativação da superfície com cloreto estanoso, b) lava-se o substrato
ativado com água destilada para retirar o excesso de cloreto estanoso, c) verte-se sobre o substrato
já preparado, as soluções de prata amoniacal e de N2H6SO4 em volumes iguais, d) a cada
deposição, o filme produzido é secado e pesado em balança analítica, com precisão de 0,1 µg.
Após a pesagem o filme é retirado com auxilio de uma solução concentrada de ácido nítrico, e) o
procedimento foi repetido para tempos de 2, 4, 5, 7, 10, 20 e 25 minutos, para estudar a
dependência de N2H6SO4 e prata na reação em questão. Todos os experimentos foram feitos em
triplicata para iestimar o erro experimental.
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14803
Após a deposição dos filmes, estes passaram por uma análise de difração de raios-x θ/2θ,
e por varredura ômega, para verificar a qualidade cristalográfica dos filmes obtidos.
3 – RESULTADOS E DISCUSSÕES
A figura 1, mostra o comportamento da massa de prata depositada em função do tempo,
para uma concentração de N2H6SO4 de 5 g/l e de prata de 10 g/l. Nota-se que a massa de prata
depositada tem um comportamento exponencial com o tempo, atingindo uma saturação próximo
de 15 minutos. O ajuste dos pontos pode ser entendido pela equação
m = mf + mfe-t/4,34
(3)
onde m é a massa de prata depositada, mf a massa da saturação e t o tempo de depósito.
Massa de Ag depositada (g)
0,0010
0,0008
0,0006
0,0004
0,0002
0,0000
0
5
10
15
20
25
Tempo (min)
Figura 1 – Dependência da massa de prata depositada em função do tempo, para uma
concentração de prata de 10g/l e uma concentração de N2H6SO4 de 5 g/l.
A dependência da massa de prata depositada em função do tempo, para concentrações de
prata de 10, 20 e 40g/l, e de N2H6SO4 de 5g/l, é mostrada na figura 2. É possível observar que a
massa de saturação é proporcional as concentrações de prata.
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14804
0,0035
Massa de Ag depositada (g)
0,0030
0,0025
40g/l
0,0020
20g/l
0,0015
10g/l
0,0010
0,0005
0,0000
0
5
10
15
20
25
Tempo (min)
Figura 2 – Dependência da massa de prata depositada em função do tempo, para as concentrações
de 10, 20 e 40g/l de prata. A massa de saturação é proporcional à concentração de prata no meio
reacional.
Isto é uma evidência, que a velocidade de reação é diretamente proporcional a
concentração de prata no meio reacional. Sendo assim, é esperado que se todas as curvas
obedecem a equação 3, um gráfico de ln(1-m/mf) versus tempo, tem que representar a mesma reta
para todos os dados experimentais. Estes resultado é apresentado na figura 3, onde podemos
observar que a expressão acima é diretamente proporcional ao tempo, sugerindo que esta é uma
cinética de primeira ordem com relação a prata.
4,0
3,5
-Ln(1-m /m f)
3,0
2,5
2,0
1,5
K=0,21 m in
-1
1,0
0,5
0,0
0
5
10
15
20
25
T em po (m in)
Figura 3 – Ajuste dos dados pela expressão ln(1-m/mf) .Todos os valores de massa de prata
depositada, para todas as concentrações de prata, podem ser descritos pela mesma reta, sugerindo
que primeira ordem com relação a prata
Com o objetivo de verificar o comportamento do N2H6SO4 na cinética de deposição da
prata, o mesmo experimento foi feito, fixando-se a concentração de prata amoniacal em 40g/l, e o
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14805
comportamento foi estudado para as concentrações de 2.5, 5 e 10 g/l de N2H6SO4. Os resultados
deste experimento indicam que o comportamento é similar ao comportamento da prata no meio
reacional, ou seja a massa de prata depositada é proporcional à concentração de N2H6SO4. Estes
resultados estão sumarizados na figura 4, onde é possível observar que todos os pontos
experimentais, são descritos pela mesma reta de ln(1-m/mf) em função do tempo. Estes resultados
também sugerem uma cinética de primeira ordem com relação ao sulfato de hidrazina.
7
Eq.: ln (1 - m/m f ) = -t / 4,73
6
-ln(1-m/mf)
5
4
3
2
K=0,21 m in
-1
1
0
0
5
10
15
20
25
Tempo (min)
Figura 4 – Dependência linear da cinética de deposição da prata em função do tempo, para várias
concentrações de sulfato de hidrazina, sugerindo uma cinética de primeira ordem
A difração de raios x para um filme de prata de aproximadamente 1,0 µm, é mostrado na
figura 5. É possível observar excelente orientação preferencial, na direção (111) para o filme
obtido, com a concentração de prata de 40g/l.
700
Intensidade (Unid. Arb.)
500
400
(111)
600
Intensidade (U.A.)
350
300
250
∆θ =0,2
200
o
150
100
50
0
17
18
19
20
21
22
θ
300
200
100
35
36
37
38
39
40
2θ
Figura 5 – Espectro de difratometria de raios x θ/.2θ, mostrando apenas o pico relativo ao plano
cristalográfico (111). A excelente orientação cristalográfica é comprovada pela varredura ômega,
que apresenta largura a meia altura de apenas 0,2ºo, mostrada no topo da figura.
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14806
Entretanto para filmes de espessuras superiores a mostrada na figura 5, até o limite de
aproximadamente 2,0 µm, com outras concentrações de prata e sulfato de hidrazina, o
crescimento é perfeitamente orientado, exibindo somente o pico referente ao plano (111),
confirmado pela varredura ômega, que apresenta largura a meia altura de apenas 0,6o . Este
resultado sugere que as concentrações dos reagentes, não tem influência na orientação da prata
depositada, com o substrato, não afetando portanto o processo de nucleação do filme.
4 – Conclusões
Este trabalho apresenta um estudo sistemático, da cinética de deposição de prata
via processo de redução química sobre substratos monocristalinos de SrTiO3, onde podemos
concluir que a reação de deposição do filme de prata, apresenta ordem parcial com relação a prata
e o sulfato de hidrazina igual a um. O que sugere ordem global dois para a reação de redução da
prata. Os resultados mostram que a orientação preferencial do filme obtido, não tem relação com
as concentrações de prata e sulfato de hidrazina usadas neste estudo. Este fato permite concluir
que estas concentrações não afetam o processo de nucleação do filme.
5 – Agradecimentos
Os autores agradecem o apoio financeiro dado pela FAPESP através do projeto de número
00/09341-5.
6 – Referências
[1] - R. N. Bhattacharya, P. A. Parilla, L. L. Roybal, A. Mason, A. Swartzlander, R. K.
Ahrenkid and S. H. Whang, Minerals Material Soc. USA (1991).
[2] - R. N. Bhattacharya, P. A. Parilla, R. Noufi, P. Arendt and N. Elliot, J. Electrochem.
Soc., 139, 67-69, (1992)
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14807
[3] – Machado, A. J. S, Kopelevich, Y., dos Santos, C. A. M and Moehlecke, S.,
Superconducting YBa2Cu3O7-δ films on SrTiO3 via electrodeposition process, aceito para
publicação no Physica C.
[4] - Antonio Jefferson da Silva Machado, Tese de Doutorado, Departamento de
Engenharia dos Materiais – Faenquil, Jan/2000.
[5] – Ivan Grozdanov, Applied Surface Science, 84, 325-329, (1995)
[6] – Keuller, J. N., Lorenzen, L.,Sanderson, R. D., Prozesky, V. and Przybylowicz, W. J.,
Thin Solid Films, 347, 91-98, (1999).
CONGRESSO BRASILEIRO DE ENGENHARIA E CIÊNCIA DOS MATERIAIS, 14., 2000, São Pedro - SP. Anais
14808