Clinical Case Study
Estudo do Caso Clínico
Interpretation of HIV Serologic Testing Results
Vinay S. Mahajan1, Christine A. Pace2 and Petr Jarolim1,*
Interpretação dos Resultados de Testes Sorológicos de HIV
Vinay S. Mahajan1, Christine A. Pace2 and Petr Jarolim1,*
1 Departments of Pathology and
2 Internal Medicine, Brigham and Women's Hospital, Boston, MA.
Envie correspondência para esse autor para: Department of Pathology, Brigham and Women's Hospital,
75 Francis St., Boston, MA 02115. Fax 617-731-4872; e-mail [email protected].
CASO
Um paciente de 33 anos visitou a clínica de
de HIV de acordo com as atuais recomenda-
pacientes externos em Brigham e o Hospital
ções do CDC (1). O teste de HIV [HIV 1/O/2
das Mulheres para um acompanhamento de
Enhanced (EHIV)], que foi realizado no anali-
rotina para obesidade, apnéia obstrutiva do
sono, rinite alérgica, e depressão. Ele foi man-
sador ADVIA Centaur (Siemens Healthcare
Diagnostics), produziu um resultado reativo.
tido em um aparelho de pressão das vias aé-
De acordo com o protocolo do teste desenvol-
reas positivo contínuo
noturno, spray nasal
vido pelo fabricante, a amostra inicialmente
loratadina, duloxetina, e fluticasona. Ele foi
reativa foi reanalisada em duplicata após cen-
um residente de Boston e não tinha viajado
trifugação; ambos resultados foram reativos.
para fora do país. Ele negou uso de droga in-
O teste positivo foi seguido por uma análise
travenosa ou comportamento sexual de alto
confirmatória western blot (WB)3 , que produ-
risco, e não tinha recebido qualquer produto
ziu um resultado indeterminado. A presença
sanguíneo. Ele tinha recebido sua mais recen-
de uma banda isolada p24 no WB (GS Wes-
te vacina contra gripe cerca de 6 meses antes.
tern HIV-1; Bio-Rad Laboratories) foi uma
Ele foi examinado para diabetes tipo 2 e hiperlipidemia. Como parte do tratamento clíni-
preocupação com relação a possível precoce
soroconversão do HIV.
co de rotina, também lhe foi oferecido teste
QUESTÕES PARA SEREM CONSIDERADAS
1. Que fatores são conhecidos por causarem resultados falso-positivos de testes sorológicos de HIV ?
2. Que fatores são conhecidos por causarem um resultado indeterminado do WB?
3.
Que teste adicional ou histórico clínico seria de ajuda na avaliação de um paciente
com um resultado indeterminado do WB?
Clinical Case Study
Estudo do Caso Clínico
DISCUSSÃO
O teste Siemens EHIV realizado nesse caso é
gicos falso-positivos para
HIV
é a recente
um imunoensaio quimioluminométrico da mi-
vacinação contra gripe ou uma infecção viral
cropartícula que liga antígeno duplo que de-
incidental
tecta anticorpos contra p24, gp41, gp120 (do
gripe e infecções virais, resultados falso-
HIV-1), gp36 (do HIV-2), e um peptídeo sinté-
positivos de imunoensaios de HIV-1 têm sido
tico do grupo O HIV-1 (Fig. 1). Um resultado
positivo indica a presença de anticorpos que
relatados em uma variedade de outras condições, tais como doença autoimune, falha re-
reconhecem qualquer um desses antígenos,
nal, fibrose cística, gravidez múltipla, trans-
independente do seu isótopo ou subclasse.
fusões de sangue, doenças do fígado, consu-
Embora tais imunoensaios de terceira geração
mo de substância parenteral, hemodiálise, e
do HIV tenham melhorado bastante a sensibi-
vacinações contra hepatite B e raiva (4). Des-
lidade e especificidade analíticas, resultados
falso-positivos não foram eliminados comple-
se modo, um resultado positivo em um teste
de screening do HIV deve ser seguido por um
tamente. Uma causa comum de testes soroló-
teste confirmatório mais específico.
(2, 3). Além da vacinação contra
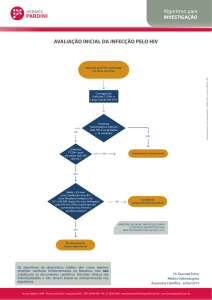
Fig. 1.
Testes sorológicos de HIV. O diagnóstico de infecção de HIV é baseado na detecção de anticorpos
HIV contra múltiplos antígenos HIV. Anticorpos contra HIV são examinados com um teste tal como
um imunoensaio da micropartícula que liga antígeno duplo (esquerda) e individualmente confirmados com um WB (direita). O WB do HIV do paciente nesse estudo do caso é mostrado na faixa direita
distante.
Clinical Case Study
Estudo do Caso Clínico
Double antigen-bridge immunoassay – imunoensaio de duplo antígeno
Chemiluminescent dye – corante quimioluminescente
Strong positive - forte positivo
Weak positive - fraco positivo
Negative – negativo
Case study patient – paciente do caso de estudo
WB é rotineiramente usado para confirmar um resultado reativo do exame sorológico do HIV. Esses
testes, que contêm ou lisado viral ou proteínas recombinantes do HIV, permitem a determinação da
especificidade antigênica dos anticorpos no soro do paciente. O tipo predominante de HIV nos Estados Unidos é o HIV-1. Um teste confirmatório para infecção por HIV-1 foi recomendado porque
esse paciente não tinha viajado para qualquer parte do mundo com uma alta prevalência do HIV-2,
tal como África Ocidental. As principais especificidades dos anticorpos detectadas na análise do WB
do HIV-1 incluem gp160, gp120, p65, p55, gp41, p40, p31, e p24. Para ser relatado como positivo, o teste WB requer reatividade contra as bandas gp41 e gp120/160 codificadas pelo gene env4
(gp160, glicoproteína de envelope ) ou contra qualquer uma dessas bandas env + a banda 24 codificada pelo gag [Pr55(Gag)]. Tal resultado é altamente específico para a presença de infecção por
HIV (5). Um resultado negativo implica a ausência de qualquer uma das bandas acima. O resultado é
chamado de indeterminado quando o perfil da banda não satisfaz os critérios para um resultado positivo. O WB do paciente produziu um resultado indeterminado. Nesse caso, o resultado foi relatado
como indeterminado porque uma acentuada banda p24 e uma fraca banda p40 foram observadas.
Após exposição ao HIV, um indivíduo geral-
da infecção por HIV incluem infecção com
mente leva pelo menos 3 semanas para de-
HIV-2
senvolver um título do anticorpo suficiente
indeterminado do WB pode também surgir de
para ser detectado por um imunoensaio de
anticorpos que fazem reatividade cruzada
terceira geração do HIV. Esse período é cha-
com antígenos do HIV, tais como aqueles as-
mado de "janela da soro conversão." Visto
que anticorpos para p24 se desenvolvem
sociados com infecção por HTLV; com vacinação contra gripe, hepatite, ou raiva; ou com
cedo durante o curso da infecção, um padrão
manipuladores de animais expostos aos vírus
indeterminado do WB visto durante essa janela
incomuns. Anticorpo não específico se ligando
está frequentemente
associado com uma
aos componentes celulares não virais na pre-
banda p24 isolada (6). Análise qualitativa do
paração do antígeno do HIV WB pode produzir
PCR de transcrição reversa para HIV é usada
um resultado indeterminado do WB. Tais re-
para examinar ou confirmar a presença de
sultados podem estar associados a frequentes
infecção por
HIV durante a janela de soro
transfusões, uso de drogas injetáveis, doença
conversão, e o exame pode se tornar positivo
do fígado, gravidez múltipla, fator reumatói-
em até 10 dias após exposição (7). Teste do
de, linfoma, esclerose múltipla, vários distúr-
ácido nucleico (NAT) para HIV também é usa-
bios autoimunes, um resultado positivo no
do quando um raro genótipo HIV é suspeita-
rápido teste da reagina do plasma, e hemo-
do; tal teste desempenha um papel crítico no
diálise crônica (6).
exame do HIV neonatal, devido à interferência
dos anticorpos maternos. Além da precoce
soro conversão, outras causas dos resultados
indeterminados do WB do HIV-1 no cenário
e
AIDS avançada (6). Um resultado
O paciente foi contactado para acompanhamento dos seus resultados do teste do HIV e
possível NAT. Em questionamento adicional,
entretanto, ele lembrou de que ele tinha rece-
Clinical Case Study
Estudo do Caso Clínico
bido uma vacina experimental do HIV
>5
Participantes de testes de vacinas são aconse-
anos antes. Vacinas do HIV podem incluir ou
lhados a se submeterem ao teste do HIV ex-
proteínas codificadas gag ou env ou ambas.
clusivamente com o grupo de pesquisas da
Vacinas destinadas a induzir imunidade medi-
vacina. Períodos de acompanhamento em tais
ada pelas células também podem obter uma
testes se estendem por décadas, entretanto, e
resposta humoral e produzir soro positividade
pacientes podem não se lembrar de todos os
induzida pela vacina. A maioria dos receptores
detalhes.
das vacinas gag têm bandas p24, p40, e /ou
Alergia e Doenças Infecciosas proveu os parti-
p55 em seus WB (8). Receptores de vacinas
cipantes dos testes das vacinas do HIV apoia-
env podem ter bandas
gp41, gp120, e
dos pelo NIH com um número gratuito para
gp160. Tais resultados do WB são frequente-
assistência como também cartões de identifi-
mente relatados como
Portanto, o Instituto Nacional de
indeterminados, mas
cação que documentam a participação no es-
alguns receptores de vacinas do HIV podem
tudo (9). Um grande número de testes expe-
satisfazer os critérios para um resultado po-
rimentais de vacinas do HIV têm sido empre-
sitvo do
Esses pacientes podem
endido durante as 2 últimas décadas, e existe
apresentar um verdadeiro desafio diagnóstico.
uma população firmemente crescente de re-
HIV WB.
Os resultados do teste do HIV dos receptores
das vacinas podem ser facilmente mal interpretados e podem ter um impacto social negativo (9). Por causa dos procedimentos cegos
de muitos planos de testes de vacinas, nem os
pacientes nem os pesquisadores podem saber
se um placebo ou uma vacina experimental foi
administrada. Soro positividade induzida pela
vacina pode potencialmente levar ao reconhecimento dos participantes do estudo assim
como dos pesquisadores, com um risco de
ceptores de vacinas experimentais do HIV que
se apresentam para exame do HIV. Essa tendência é provável que continue, especialmente
considerando os resultados encorajadores de
recente teste de vacinas do HIV na Tailândia
(10). Má interpretação dos resultados dos testes do HIV em voluntários para testes de vacinas fora dos locais pode ser evitada através de
melhor comunicação entre os pesquisadores
das vacinas do HIV e os provedores locais de
testes diagnósticos.
comprometer os dados do estudo. Portanto,
A decisão para NAT confirmatório foi deferida,
teste do HIV dos participantes dos testes das
e o grupo de pesquisas das vacinas foi notifi-
vacinas é geralmente realizado em laborató-
cado para interpretação, acompanhamento, e
rios designados com apropriados protocolos
aconselhamento apropriados com relação ao
de anonimato que podem fornecer interpreta-
resultado do exame do HIV do paciente, de
ção dos resultados sem o risco de reconheci-
acordo com o protocolo de estudo. Esse pro-
mento. Os resultados do teste do HIV em re-
cedimento garantiu que tanto o paciente
ceptores de vacinas precisam ser confirmados
quanto os pesquisadores ficassem sem saber
com NAT.
se o paciente recebeu um placebo ou uma dose do teste da vacina experimental.
PONTOS PARA SEREM LEMBRADOS
Testes sorológicos falso-positivos do HIV podem ser causados por recente vacinação contra gripe, infecções virais incidentais, doença autoimune, falha renal, fi-
Clinical Case Study
Estudo do Caso Clínico
brose cística, gravidez múltipla, transfusões de sangue, doenças do fígado, consumo de substância parenteral, hemodiálise, ou vacinações contra hepatite B e
raiva.
Um resultado indeterminado do WB pode ser causado por um fraco título de anticorpos anti–HIV-1 (como visto na soroconversão precoce), AIDS avançada, infecção com um tipo incomum de HIV, ou receptores de vacinas experimentais do
HIV. Ele também pode ser causado pela presença de anticorpos que fazem reatividade cruzada contra antígenos do HIV (infecção viral incidental; vacinação contra gripe, hepatite, ou raiva; ou infecção por HTLV) ou reatividade aos componentes não virais do WB (vários distúrbios autoimunes, gravidez múltipla, e receptores de múltiplas transfusões de sangue).
Um resultado indeterminado do WB deve ser acompanhado com NAT qualitativo
se soro conversão precoce
é suspeitada, com um imunoensaio de repetição e
análise do WB realizados em 2–4 semanas. Embora a US Food and Drug Administration não tenha esclarecido o uso da carga viral quantitativa para diagnóstico
do HIV, a carga viral é improvável de ser <5000 cópias /mL durante infecção
aguda do HIV. Reatividade persistente do teste de screening do anticorpo com
simultânea falta de qualquer mudança no padrão do WB sugere a ausência de infecção por HIV.
A um crescente número de receptores de vacinas experimentais do HIV, que podem causar resultados falso-positivos nos testes sorológicos do HIV, está sendo
oferecido exame do HIV. Sempre que possível, teste para HIV em tais pacientes é
melhor realizado em consulta com o grupo de pesquisas das vacinas responsável
pelo teste. Esse procedimento garantirá adequada interpretação dos resultados
dos testes sem comprometer os dados do estudo.
Notas de Rodapé
3
Abreviações não padronizadas:
WB, western blot; NAT, teste do ácido nucleico.
4
Genes:
env, gp160, glicoproteína de envelope [HIV-1 gene]; gag, Pr55(Gag) [HIV-1 gene].
Contribuições dos Autores: Todos os autores confirmaram que eles contribuíram para o conteúdo
intelectual desse paper e satisfizeram os 3 seguintes requisitos: (a) contribuições significantes para
a concepção e design, aquisição de dados, ou análise e interpretação dos dados; (b) rascunhando ou
revisando o artigo para conteúdo intelectual; e (c) aprovação final do artigo publicado.
Revelações dos Autores de Potenciais Conflitos de Interesse: Na submissão do manuscrito, todos os
autores completaram o formulário de Revelações de Potenciais Conflitos de Interesse. Potenciais
conflitos de interesse:
Emprego ou Liderança: Nada a declarar.
Consultor ou Papel Consultivo: P. Jarolim, Gerson Lehrman Group e T2 Biosystems.
Clinical Case Study
Estudo do Caso Clínico
Posse dos Valores: Nada a declarar.
Honorários: P. Jarolim, Siemens Healthcare Diagnostics e Ortho Clinical Diagnostics.
Fundo de Pesquisas: P. Jarolim, Siemens Healthcare Diagnostics e Roche Diagnostics.
Testemunho Hábil: Nada a declarar.
Papel do Patrocinador: As organizações patrocinadoras não desempenharam papel algum no design
do estudo, escolha dos pacientes inscritos, revisão e intepretação dos dados, ou preparação ou
aprovação do manuscrito.
Recebido para publicação em 26 de Outubro de 2009. Aceito para publicação em 22 de Março de
2010.
Referências
1. Branson BM, Handsfield HH, Lampe MA, Janssen RS, Taylor AW, Lyss SB, Clark JE. Revised recommendations for HIV testing of adults, adolescents, and pregnant women in health-care settings. MMWR Recomm Rep 2006;55(RR-14):1–17.
2. Erickson CP, McNiff T, Klausner JD. Influenza vaccination and false positive HIV results. N Engl J
Med 2006;354:1422–3.
3. Simonsen L, Buffington J, Shapiro CN, Holman RC, Strine TW, Grossman BJ, et al. Multiple false
reactions in viral antibody screening assays after influenza vaccination. Am J Epidemiol
1995;141:1089–96.
4. Celum CL, Coombs RW, Jones M, Murphy V, Fisher L, Grant C, et al. Risk factors for repeatedly
reactive HIV-1 EIA and indeterminate western blots. A population-based case-control study.
Arch Intern Med 1994;154:1129–37.
5. Interpretive criteria used to report western blot results for HIV-1-antibody testing—United
States. MMWR Morb Mortal Wkly Rep 1991;40:692–5.
6. Guan M. Frequency, causes, and new challenges of indeterminate results in Western blot confirmatory testing for antibodies to human immunodeficiency virus. Clin Vaccine Immunol
2007;14:649–59.
7. Feinberg MB. Changing the natural history of HIV disease. Lancet 1996;348:239–46.
8. Quirk EK, Mogg R, Brown DD, Lally MA, Mehrotra DV, DiNubile MJ, Robertson MN. HIV seroconversion without infection after receipt of adenovirus-vectored HIV type 1 vaccine. Clin Infect Dis
2008;47:1593–9.
9. Allen M, Lau CY. Social impact of preventive HIV vaccine clinical trial participation: a model of
prevention, assessment and intervention. Soc Sci Med 2008;66:945–51.
10. Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S, Kaewkungwal J, Chiu J, Paris R, et al. Vaccination
with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand. N Engl J Med 2009;361:2209–
20.
Clinical Case Study
Estudo do Caso Clínico
Comentário
Frederick S. Nolte*
Department of Pathology and Laboratory Medicine, Medical University of South Carolina,
Charleston, SC.
Envie correspondência para o autor para: Medical University of South Carolina, Pathology and Laboratory
Medicine, 165 Ashley Ave., Suite 309, MSC 908, Charleston, SC 29425. Fax 843-792-7060; e-mail [email protected].
Esse relatório do caso acrescenta vacinação
O Teste Qualitativo HIV-1 RNA APTIMA (Gen-
contra HIV à lista das causas bem conhecidas
Probe), atualmente o único NAT que foi libe-
dos resultados falso-positivos nos testes de
rado pela FDA para diagnóstico da infecção,
screening dos anticorpos do HIV e ilustra os
pode ser usado para diagnosticar infecções
problemas frequentemente associados com a
agudas e neonatais, confirmar resultados po-
interpretação dos WBs. Meios oportunos e efi-
sitivos em testes de screening de anticorpos,
cazes de confirmar testes de screening do HIV
e resolver resultados indeterminados do WB.
têm se tornado crescentemente importantes à
Como os autores salientam, um NAT foi o
medida em que mais centros integram o scre-
próximo passo na investigação diagnóstica,
ening do HIV à rotina do tratamento clínico
mas ele foi deferido quando o histórico de
como recomendado pelo CDC.
vacinação foi obtido.
Em muitos cenários de laboratórios, NATs pa-
Os raros indivíduos que são afetados com
ra RNA do HIV-1 estão mais largamente dis-
HIV-1 mas que progridem para AIDS, ou mui-
poníveis e menos caros do que WB e não es-
to lentamente ou de maneira alguma, apre-
tão sujeitos aos resultados indeterminados.
sentam outro dilema diagnóstico. Nesses não
Embora NATs quantitativos do HIV-1 não te-
progressores a longo prazo, anticorpo do
nham sido liberadas pela US Food and Drug
HIV-1 é facilmente demonstrado, mas esses
Administration (FDA) para diagnóstico, eles
têm sido usados por anos para avaliar pacien-
indivíduos mostram baixas ou indetectáveis
cargas do RNA do HIV-1 nos testes disponí-
tes considerados agudamente infectados. Es-
veis para laboratórios clínicos. Controladores
ses pacientes tipicamente possuem altas car-
de viremia possuem cargas virais baixas mas
gas virais variando de 105 a 106 cópias/mL,
prontamente mensuráveis. Controladores de
e os resultados não apresentam problemas
elite suprimem o HIV para concentrações ex-
com interpretação. Os relatórios de resultados
falso-positivos nos testes de carga viral todos
tremamente baixas, que são mensuráveis
apenas com as técnicas laboratoriais mais
ocorreram com um único método ( teste Ver-
analiticamente sensíveis.
sant bDNA; Siemens Healthcare Diagnostics);
os resultados foram <104 cópias/mL.
Notas de Rodapé
Contribuições dos Autores: Todos os autores confirmaram que eles contribuíram para o conteúdo
intelectual desse paper e satisfizeram os 3 seguintes requisitos: (a) contribuições significantes para
a concepção e design, aquisição de dados, ou análise e interpretação dos dados; (b) rascunhando ou
revisando o artigo para conteúdo intelectual; e (c) aprovação final do artigo publicado.
Clinical Case Study
Estudo do Caso Clínico
Revelações dos Autores de Potenciais Conflitos de Interesse: Na submissão do manuscrito, todos os
autores completaram o formulário de Revelações de Potenciais Conflitos de Interesse. Potenciais
conflitos de interesse:
Emprego ou Liderança: Nada a declarar.
Consultor ou Papel Consultivo: F.S. Nolte, Gen-Probe e Abbott Molecular.
Posse dos Valores: Nada a declarar.
Honorários: Nada a declarar.
Fundo de Pesquisas: Nada a declarar.
Testemunho Hábil: Nada a declarar.
Papel do Patrocinador: As organizações patrocinadoras não desempenharam papel algum no design
do estudo, escolha dos pacientes inscritos, revisão e interpretação dos dados, ou preparação ou
aprovação do manuscrito.
Recebido para publicação em 23 de Julho de 2010. Aceitopara publicação em 2 de Agosto de 2010.
Comentário
Bernard M. Branson*
National Center for HIV/AIDS, Viral Hepatitis, STD, and TB Prevention, CDC, Atlanta, GA.
Envie correspondência para o autor para: National Center for HIV/AIDS, Viral Hepatitis, STD, and TB Prevention, 1600 Clifton Rd., N.E., Atlanta, GA 30333. Fax 404-639-0897; e-mail [email protected].
Esse caso ilustra um cenário que os clínicos
apresentação, vacinação contra gripe também
provavelmente vão encontrar mais frequente-
foi implicada como uma causa de um teste de
mente
à medida em que exame do HIV for
screening reativo do HIV com resultados inde-
crescentemente se integrando à rotina do tra-
terminados do western blot. Tais casos, en-
tamento clínico. Reatividade cruzada não es-
tretanto, são geralmente caracterizados por
pecífica dos anticorpos com o antígeno p24
reatividade do Western blot
do HIV em pessoas que não estão infectadas é
gp160 (precursor) ou gp41 (trans-membrana)
a causa mais comum para teste de screening
por causa da surpreendente homologia entre
repetidamente reativo do HIV e resultados in-
as moléculas da trans-membrana das proteí-
determinados do Western blot. Entretanto,
nas envelope do HIV-1 e a proteína envelope
visto que os testes de screening de terceira
da gripe, a hemaglutinina. Apesar da ausên-
geração (sensíveis à IgM) tais como o EHIV
(Siemens) detectam anticorpos 2 ou mais se-
cia dos clássicos fatores de risco para HIV,
permanece importante garantir que pacientes
manas antes que as bandas apareçam no
com resultados indeterminados do
Western blot, resultados indeterminados tam-
blot não estejam infectados. Recentes obser-
bém podem indicar infecção muito recente do
vações têm demonstrado que aproximada-
HIV. Geralmente, bandas p24 ou gp41 são as
mente 50% das pessoas cuja infecção do HIV é
primeiras a aparecer no Western blot
após
descoberta durante exame de rotina não ma-
infecção. Adicionalmente complicando essa
nifestam fatores de risco tradicionais. Resolu-
às proteínas
Western
Clinical Case Study
Estudo do Caso Clínico
ção de um resultado indeterminado do Wes-
sultados indeterminados do Western blot de
tern blot requer ou o teste diagnóstico quali-
repetição
tativo do RNA ou a carga viral quantitativa do
sência de infecção por HIV e permitem que os
RNA para documentar a ausência do RNA do
pacientes sejam tranquilizados de que não
HIV ou um Western blot de repetição após 4
estão infectados.
4 semanas após confirmam a au-
semanas. Resultados negativos do RNA ou re-
Notas de Rodapé
Contribuições dos Autores: Todos os autores confirmaram que eles contribuíram para o conteúdo
intelectual desse paper e satisfizeram os 3 seguintes requisitos: (a) contribuições significantes para
a concepção e design, aquisição de dados, ou análise e interpretação dos dados; (b) rascunhando ou
revisando o artigo para conteúdo intelectual; e (c) aprovação final do artigo publicado.
Revelações dos Autores de Potenciais Conflitos de Interesse: Nenhum autor declarou qualquer po-
tencial conflito de interesse.
Papel do Patrocinador: As organizações patrocinadoras não desempenharam papel algum no design
do estudo, escolha dos pacientes inscritos, revisão e interpretação dos dados, ou preparação ou
aprovação do manuscrito.
Recebido para publicação em 22 de Julho de 2010. Aceito para publicação em 26 de Julho de 2010.
“This article has been translated with the permission of AACC. AACC is not responsible for the accuracy
of the translation. The views presented are those of the authors and not necessarily those of the AACC
or the Journal. Reprinted from Clin Chem, 2010; 56: 10 1523-1526, by permission of AACC. Original copyright © 2009 American Association for Clinical Chemistry, Inc. When citing this article, please refer to
the original English publication source in the journal, Clinical Chemistry.”
“Este artigo foi traduzido com a permissão da AACC. AACC não é responsável pela acurácia da tradução.
Os pontos de vista apresentados são aqueles dos autores e não necessariamente os da AACC ou do Jornal. Reimpresso da ClinChem, 2010; 56: 10 1523-1526, por permissão da AACC. Cópia original © 2009
American Association for Clinical Chemistry, Inc. Quando citar este artigo, por favor refira-se à fonte de
publicação original em inglês na revista,Clinical Chemistry.”