UNIVERSIDADE FEDERAL DO RIO DE JANEIRO
INSTITUTO DE BIOFÍSICA CARLOS CHAGAS FILHO
NOTAS DE AULA - FUNDAMENTOS DE BIOFÍSICA II
FISICO-QUÍMICA DE BIOMEMBRANASç
EQUILÍBRIO ELETROQUÍMICO E TRANSPORTE
Gilberto Weissmuller
Nice Maria Americano Costa
Paulo Mascarello Bisch
INTRODUÇÃO
No âmbito da célula, um dos processos mais importantes para a vida é o
transporte de matéria através das membranas celulares e daquelas intracelulares.
A membrana plasmática, por exemplo, funciona como uma barreira
seletivamente permeável entre o meio intracelular e o extracelular, assegurando que
moléculas e íons essenciais, tais como glicose, aminoácidos, lipídios, K+, Na+ e Ca2+,
penetrem na célula, que compostos metabólicos permaneçam no seu interior e,
também, que o produto tóxico do metabolismo seja expelido.
Através da membrana interna da mitocôndria, são transportados prótons, para
a região intermembranar, (íons H+), imprescindíveis na síntese do ATP, bem como as
próprias moléculas de ATP recém sintetizadas.
Pela carioteca – membrana que envolve o núcleo da célula – atravessam
moléculas vitais: nucleotídeos, RNA, ATP e proteínas.
Os transportes transmembranares controlam tudo aquilo que pode passar entre
células e entre compartimentos dentro de uma célula, garantindo com isso que o
metabolismo seja regulado e dirigido. Em síntese, os transportes existem para garantir
o funcionamento de nossas “usinas”, controlando o fluxo de seus “insumos” e também
de seus “dejetos” e ainda para criar condições de armazenamento de energia
necessária para realização de muitos processos celulares.
À luz de fenômenos físico-químicos, aqui, vamos dedicar nossa atenção à
análise das possibilidades e das condições de transporte de matéria e de
armazenamento de energia através de membranas.
Preliminarmente, faremos uma revisão de alguns conceitos básicos de
Eletricidade, indispensáveis à compreensão da origem biológica dos fenômenos
1
elétricos constatados na célula e de como eles interferem nos processos vitais de
transporte transmembranar.
Em seguida, discutiremos como o equilíbrio químico se estabelece quando os
solutos são eletricamente carregados e quando a própria membrana semipermeável é
carregada, tal como ocorre para membranas celulares. Estas, constituídas por lipídios,
podem ter a cabeça polar eletricamente carregada, separando soluções iônicas de
diferentes concentrações. Neste tópico, analisaremos como a difusão de íons através
de membranas semipermeáveis provoca o aparecimento de um potencial elétrico
através da membrana.
Finalmente, no terceiro tópico, serão discutidos os conceitos de transporte
passivo e do transporte ativo, sob a perspectiva termodinâmica do equilíbrio
eletroquímico (equilíbrio químico entre espécies carregadas eletricamente).
REVISÃO DE ELETRICIDADE
Lei de Coulomb
Existem dois tipos de carga elétrica: positiva e negativa. As partículas
elementares que possuem carga são os elétrons (negativos) e os prótons (positivos).
Quando uma partícula – composta por muitos átomos ou moléculas –, inicialmente
neutra, torna-se eletricamente carregada, é porque ela recebeu ou perdeu elétrons.
Partículas carregadas – até mesmo elétrons e prótons – são chamadas íons. Os
positivos são chamados cátions e os negativos, ânions.
As partículas carregadas interagem por meio de forças atrativas ou repulsivas
de acordo com a regra: cargas iguais se repelem e opostas se atraem. A intensidade
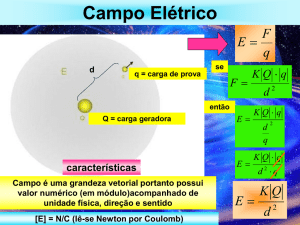
da força elétrica é dada pela lei de Coulomb: a força entre duas cargas elétricas é
proporcional ao produto das cargas e inversamente proporcional ao quadrado da
distância entre elas. Formalmente, esta lei se expressa por:
F =k
Q1Q2
,
d2
onde, k é a constante de Coulomb, que vale k = 9 × 109
Nm 2
, Q1 e Q2 são as cargas
C2
e d é a distância entre elas.
As forças elétricas são forças intensas; na presença destas, as forças
gravitacionais podem ser desconsideradas; um número relativamente pequeno de
elétrons gera forças enormes. Um exemplo simples ilustra esse fato.
2
Considere duas pequenas esferas de ferro, com raio de 1 cm, cada uma
contendo, inicialmente cerca de um mol de ferro (6,02 x 1023 átomos), entre as quais
ocorre uma transferência de elétrons. Suponha que um número de elétrons, muito
menor que 1023, tenha sido transferido de uma esfera para a outra: um elétron a cada
bilhão de átomos (1ppb). Se a distância entre as esferas for 10 cm, pela lei de
Coulomb, calculamos que o valor desta força é equivalente ao peso de 0,8 toneladas.
Esse exemplo é útil para mostrar como uma pequena alteração entre cargas
provoca o surgimento de uma força muito grande.
Em uma solução eletrolítica, os íons podem se mover de um ponto ao outro
facilmente; quando um íon se distancia relativamente dos outros, a força eletrostática
que surge por esta separação de cargas atuará de modo a anulá-la, mantendo a
solução eletricamente neutra em todos os pontos a todo instante.
Campo elétrico e potencial elétrico
Toda carga Q elétrica modifica as propriedades do espaço a sua volta de tal
forma que uma outra carga q trazida a um ponto desse espaço experimenta uma força
elétrica. Diz-se então que a carga Q cria um campo elétrico a sua volta.
Com este conceito de campo elétrico, podemos considerar que a força que a
carga q experimenta é devida a ele, tornando-se desnecessário nos referirmos
diretamente à carga Q. Dizemos que
F =qE
A força é o produto da carga q pelo campo elétrico na posição da carga onde
ela se encontra. Claramente, o valor do campo deve ser tal que reproduza exatamente
o valor da força calculada pela lei de Coulomb.
Trabalhar com o conceito de campo elétrico é vantajoso. Uma noção de campo
análoga, e, em particular, uma situação onde o campo é constante, é o campo
gravitacional. Para este campo, dizemos que a força peso de um corpo é igual a sua
massa multiplicada pela aceleração da gravidade,
P = mg
2
onde g = 10 m/s (nas proximidades da superfície da terra); estamos fazendo o mesmo
raciocínio: a terra gera nas proximidades de sua superfície um campo gravitacional e a
força é a massa multiplicada pela intensidade do campo (g).
A analogia com a situação gravitacional pode ainda ser usada para entender
uma outra grandeza elétrica importante: o potencial elétrico. Para tanto, vamos lançar
mão da noção de trabalho realizado por uma força.
3
O trabalho W realizado por uma força F, ao longo de uma distância x é W = F
x. Se pensarmos no trabalho realizado pela força peso sobre um corpo caindo de uma
altura h da superfície da terra, calculamos que este trabalho será W = m g h. Desta
relação, podemos então concluir que o campo gravitacional cria, em relação à
superfície da Terra, uma nova propriedade: uma capacidade potencial de realizar
trabalho a partir de cada altura h. Esta capacidade potencial vale gh, que multiplicada
pela massa m, resultará no trabalho realizado. Note que a capacidade de realizar
trabalho depende apenas do campo gravitacional e da altura, propriedades do espaço.
Vamos utilizar estas noções para analisar a situação de uma configuração de
cargas, como a da Figura 1: duas superfícies condutoras paralelas carregadas com
cargas contrárias. Ela será importante para a discussão de fenômenos elétricos nas
células.
E
Figura 1 Superfícies condutoras paralelas carregadas com cargas opostas.
A atração eletrostática entre as cargas opostas, numa placa e noutra, e a
repulsão entre as cargas iguais na mesma placa levará a uma distribuição uniforme
dessas cargas nas superfícies condutoras, expressa pela densidade superficial de
cargas σ (unidades em Coulomb por metros quadrados). Pode-se mostrar que tal
distribuição gera um campo elétrico constante e confinado à região entre as placas
E = 4π kσ
onde k é a constante de Coulomb, já citada.
Uma carga q colocada entre as placas sofre a ação de uma força devido ao
campo elétrico E, dada por F = q E. O trabalho desta força, ao longo de uma distância
∆x = x - x 0 será, portanto,
W = q E ∆x ,
medido em N x m = Joule.
4
Usando a analogia discutida anteriormente para o campo gravitacional,
podemos concluir que o campo elétrico E também cria, em relação a uma posição de
referência, uma capacidade de realizar trabalho, agora, de origem elétrica. Esta
capacidade potencial que o campo elétrico tem de realizar trabalho por unidade de
carga é chamada de potencial elétrico. Como ela é sempre medida em relação a um
ponto de referência, ela é dada por
V - V0 = − E ∆x
onde V0 é o potencial no ponto de referência. Novamente, assim como para o campo,
esta é uma propriedade atribuída ao espaço. O sinal negativo indica que o potencial
elétrico cresce no sentido contrário ao sentido do campo elétrico.
Observe que este valor é apenas uma capacidade de realizar trabalho e não o
trabalho realizado, o qual depende da carga que será deslocada pelo campo (note que
a acepção da palavra potencial indica exatamente que não seja um trabalho, mas uma
possibilidade dele).
Com estas noções, vamos analisar a situação para a distribuição de cargas em
placas paralelas da Figura 1, por meio da Figura 2.
V
E
Vc= Vd
Va= Vb
l
a
b
c
d
x
Figura 2 Perfil do potencial elétrico através de placas carregadas. A distância entre as
placas é l.
Entre os pontos a e b, o campo elétrico é nulo. Portanto a capacidade de
realizar trabalho entre estes dois pontos também é nula. Pela relação anterior,
escrevemos então Vb - Va = 0 , o que significa que o potencial não se altera, Vb = Va .
Entre os pontos c e d, como o campo elétrico também é zero, ocorre o mesmo,
Vc = Vd . Entretanto, no trecho bc, isto é, entre as placas,o campo tem um valor
5
constante E, e a diferença de potencial será Vc - Vb = E l , onde
l é a distância entre
as placas. Como se vê, a diferença de potencial em um campo elétrico constante,
como no caso das placas paralelas, varia linearmente com a distância, como mostra a
Figura 2. Em síntese, o potencial elétrico permanece constante fora das placas, onde
o campo elétrico é nulo (o campo está confinado entre as placas) e varia linearmente
entre as placas devido ao campo constante.
Um íon positivo (cátion) tenderá a se mover espontaneamente de uma região
de maior para uma região de menor potencial elétrico. Retomando a analogia
mecânica, é o que ocorre quando um corpo cai de uma altura h.
Não se deve ser confundir potencial elétrico com a energia potencial elétrica.
Em casa dispomos de tomadas que disponibilizam 120 Volts. A energia elétrica
consumida dependerá do aparelho que se liga na tomada. No mesmo intervalo de
tempo, uma lâmpada de 100 Watts consome mais energia do que uma lâmpada de 40
Watts mas, é claro, ilumina mais.
Campos elétricos podem ser gerados na natureza por dois mecanismos
diferentes: separação de cargas e variação de campo magnético. Em uma
hidroelétrica, a força da água é usada para movimentar grandes magnetos próximos a
fios. O movimento dos ímãs gera campos elétricos e a diferença de potencial que
chega até a sua casa pelos fios. Como vimos no estudo das reações de oxi-redução,
em pilhas e baterias, reações químicas provocam a separação de cargas entre os dois
pólos gerando a diferença de potencial.
Veremos, a seguir, que nas células o potencial é principalmente resultado da
separação de cargas provocado pelo processo de difusão. Proteínas que transportam
carga líquida para um dos lados da membrana, como a Na/K-ATPase, também
causam separação de cargas através da membrana – elas também contribuem para o
surgimento do potencial elétrico.
Corrente elétrica
Correntes elétricas são cargas em movimento; ou seja, um fluxo de cargas
elétricas que pode se dar pelo deslocamento de elétrons livres, as correntes elétricas
em um metal e, também, pelo movimento de íons, em uma solução. A água pura é má
condutora de eletricidade, porém, íons dissolvidos na água a tornam boa condutora.
6
EQUILÍOBRIO QUÍMICO EM SOLUÇÕES ELETROLÍTICAS
A difusão promove o processo de homogeneização dos solutos em uma
solução aquosa. O mesmo processo ocorre para solutos carregados eletricamente.
Como discutido anteriormente, um número relativamente pequeno de cargas gera
grandes
forças;
os
íons
em
uma
solução
se
distribuem
de
forma
que
macroscopicamente o líquido seja neutro; quaisquer separações de cargas no líquido
causadas pelo movimento aleatório são compensadas por forças de atração e/ou
repulsão eletrostática. Portanto, ao colocarmos sal em um copo de água, em qualquer
região do líquido, o sódio e o cloro estarão presentes em iguais concentrações.
O que acontece quando a solução é posta em contato com uma distribuição de
cargas: por exemplo, quando uma superfície plana carregada negativamente é
mergulhada na solução?
Os íons positivos serão atraídos pela superfície e os negativos serão repelidos
e, portanto, a solução ficará com uma fina camada de cargas nas proximidades da
superfície, de espessura da ordem de 10Å.
Eletro-osmose e a origem do potencial de membrana através de uma membrana
semipermeável
Vamos discutir agora como uma membrana semipermeável neutra ao separar
duas soluções iônicas (também inicialmente neutras), porém de diferentes
concentrações, leva ao surgimento de uma diferença de potencial elétrico entre as
duas soluções.
Na Figura 3, está delineado um experimento simples, no qual uma membrana
semipermeável leva ao aparecimento de uma diferença de potencial entre dois
compartimentos.
Uma cuba com água é dividida ao meio por uma membrana permeável apenas
ao íon potássio (K+). No compartimento esquerdo, colocamos uma grande quantidade
de cloreto de potássio (KCl), e, no da direita, apenas uma pequena quantidade,
levando, portanto, a uma grande diferença de concentração – digamos 10 para 1. Esta
situação simula a diferença de concentração entre os meios intra- e extra-celular.
7
Alta
concentraçã
Baixa
concentraçã
K
K
Cl
i
Cl
e
Figura 3 Origem do potencial elétrico em membranas semipermeáveis. A membrana é permeável apenas
+
ao íons K . No lado esquerdo da membrana (i) temos uma maior concentração de KCl, simulando o meio
intracelular e o lado direito simula o meio extracelular (e).
Nesta situação, o sistema não está em equilíbrio. O potássio, por existir em
muito maior concentração do lado esquerdo, difundirá pela membrana em busca do
equilíbrio. O cloro não atravessa porque a membrana não lhe é permeável.
Entretanto,
quando
os
íons
K+
atravessam
a
membrana,
deixam
-
desemparelhados os contra-íons Cl do lado esquerdo, fazendo surgir aí uma carga
líquida negativa e, no lado direito, uma carga positiva de mesmo valor. Lembrando que
existe a atração entre os pares de cargas contrárias através da membrana, podemos
também concluir que as cargas permanecem próximas à superfície da membrana; as
negativas na face esquerda e as positivas na face direita. A membrana carrega-se,
então, de forma análoga às placas metálicas paralelas discutidas anteriormente. Tal
distribuição de cargas cria uma diferença de potencial elétrico através da membrana –
o potencial de membrana – similar à apresentada na Figura 2.
Nessas circunstâncias, íons K+ que estão do lado esquerdo experimentarão a
ação competitiva de duas forças opostas: i) a tendência à difusão pela diferença de
concentração e ii) a atração eletrostática pela carga líquida negativa.
Quando estas duas forças se compensarem, o sistema estará no equilíbrio
eletroquímico.
Como visto no início, uma pequena separação de cargas leva ao surgimento de
grandes forças eletrostáticas. No equilíbrio eletroquímico, apenas uma pequena fração
dos íons K+ terá atravessado a membrana, o que é insuficiente para alterar
significativamente as concentrações dos compartimentos da Figura 3, mas o bastante
para gerar uma diferença de potencial mensurável através da membrana.
Observe que quanto maior a diferença inicial entre as concentrações dos
compartimentos, maior será a diferença de potencial estabelecida ao fim do processo,
pois maior será o efeito da difusão, levando a uma maior separação de cargas.
8
As células animais apresentam uma diferença de potencial elétrico através da
membrana plasmática, que surge pela difusão de K+ por seus canais seletivos. O
modelo do nosso experimento simples descreve bem o fenômeno.
Em 1890, o físico-químico alemão Wilhelm Ostwald mostrou que a relação
entre a diferença de potencial e a concentração, no equilíbrio eletroquímico, tem a
forma
∆V = Vi − Ve = 2,3
onde, os índices
C
RT
log e
zF
Ci
i e e indicam os compartimentos intra e extracelular, V é o potencial
elétrico, C é a concentração, R é a constante dos gases, T é a temperatura absoluta
(medida em Kelvin), z é a valência do íon (+1 para o íon potássio) e F é a constante de
Faraday. Essa equação é um caso particular, para a situação de equilíbrio, da
equação de Nernst.
Existem duas possíveis maneiras de se interpretar tal equação:
1. Se, de alguma maneira, mantemos uma diferença de concentração de uma
espécie de íon através da membrana (Ce ≠ Ci ) , surgirá, através dela, uma
diferença de potencial elétrico, ∆V , cujo valor é calculado pela equação de
Nernst;
2. Se, de alguma maneira, uma diferença de potencial elétrico é imposta entre
os lados da membrana, o íon em questão assumirá uma diferença de
concentração entre os lados da membrana.
Como um exemplo, podemos calcular a diferença de potencial que surgirá
através da membrana, caso o meio intracelular seja 10 vezes mais concentrado que o
extracelular. À temperatura ambiente, T=298K, R=8.314 Jmol-1K-1 e a constante de
Faraday F=96 492C mol-1, portanto, a 25 °C, para um íon monovalente, calculamos,
para o potencial de membrana:
Vi − Ve = 59,2 log
Ce
Ci
= −59.2 mV
Potencial eletroquímico
9
A equação de Nernst pode ser deduzida a partir do potencial químico, se na
sua definição considerarmos o efeito produzido pela presença de cargas elétricas.
Como vimos anteriormente, o potencial químico, para uma solução diluída foi
definido por
µα = µα0 + RT ln Cα
onde, µ α0 é o potencial químico padrão e Cα a concentração da espécie α.
Lembrando que o potencial químico mede a variação da energia livre de Gibbs
de um sistema, por mol de substância acrescida (ou retirada), mantidas constantes as
demais variáveis termodinâmicas, sendo as espécies carregadas, ele deve ser
acrescido de um termo que responda pelo comportamento da espécie suscetível a
estímulos elétricos. O potencial químico, chamado agora potencial eletroquímico,
passa a ser expresso, então, como
µα = µα0 + RT ln Cα + zα FV
onde zα é a carga do íon da espécie α, F a constante de Faraday e V o potencial
elétrico medido em relação a um nível de referência.
Considerando, que nas condições do nosso modelo da Figura 3, o potencial
eletroquímico dos dois lados da membrana não é o mesmo devido à diferença de
concentrações e também à dos potenciais elétricos, eles são dados:
no lado interno (i), por
µαi = µα0 + RT ln Cαi + zα FV i
e, no externo (e), por
µαe = µα0 + RT ln Cαe + zα FV e
O equilíbrio eletroquímico, então, se expressará por
µαe = µαi .
ou
RT ln Cαe + zα FV e = RT ln Cαi + zα FV i
10
que nos leva ao resultado encontrado por Ostwald:
∆V = V i − V e =
Ce
RT
ln αi
zα F Cα
Tal resultado nos leva a concluir que o equilíbrio eletroquímico de íons para os
quais a membrana lhe seja permeável não se caracteriza pela sua homogeneização,
como no caso das moléculas neutras, mas sim, pelo surgimento de um potencial
elétrico que contrabalança a difusão.
Em outras palavras, se o soluto porta uma carga líquida, tanto seu gradiente de
concentração, quanto o potencial de membrana, influencia seu transporte, como
veremos a seguir.
TRANSPORTE ATRAVÉS DA MEMBRANA
Transporte passivo
A difusão é um fenômeno que promove o movimento de moléculas de solutos
em soluções. Ela está intimamente relacionada com a diferença de concentração do
soluto em duas regiões do solvente. Um fluxo líquido de moléculas surge na presença
de um gradiente de concentração. Logo, se na natureza verificam-se situações nas
quais existe um gradiente de concentração para uma substância, nelas, estão criadas
as condições para que ocorra a difusão das moléculas desta substância, ou, o
transporte dessas moléculas da região de maior concentração para a de menor
concentração. A difusão é, portanto, potencialmente, um primeiro mecanismo de
transporte a considerar aqui.
No nível celular, a existência de gradientes de concentração através das
membranas é fato para inúmeras espécies químicas (tanto íons, quanto moléculas
neutras), como sabemos.
Conhecemos a situação, por exemplo, para o O2, cuja concentração no meio
externo é maior que no citoplasma, onde é consumido, e para o CO2, que,
inversamente, tem a concentração maior no citoplasma, onde é produzido, que no
meio extracelular. Tais moléculas são transportadas diretamente através da
membrana por difusão no sentido do gradiente de concentração correspondente como
mostrado na Figura 4(a). Outras espécies químicas mantêm gradientes de
concentração entre os meios intra e extra celulares, mas dado ao seu tamanho ou
natureza hidrofílica, não conseguem atravessar a membrana. Nesse caso, o processo
11
de sua difusão é mediado por uma proteína que facilita a passagem da molécula. Na
Figura 4 (b) e (c), você pode ver a ilustração de duas dessas situações: difusão
facilitada por um canal e por uma proteína transportadora.
O2
citosol
Meio
extracelular
CO2
b)
a)
Ocorre uma mudança
conformacional, expondo o
sítio de ligação para o
citosol.
Glut-1 é uma proteína de
membrana, mostrando seu
sítio de ligação voltado
para a parte extracelular.
A glicose é liberada para o citosol.
Finalmente, uma nova mudança
conformacional, leva a proteína
para sua conformação inicial.
A glicose liga-se a
glut-1 vinda do lado
extracelular.
c)
Figura 4 Transporte passivo. a) transporte direto; b) transporte facilitado por
proteínas canais e c) transporte facilitado por canais transportadores.
Observe que o transporte de matéria nesses casos se deu por difusão (direta
ou facilitada por proteínas) às expensas da energia armazenada no gradiente de
concentração. Tal energia armazenada (energia potencial) é devida à distribuição
espacial da massa; um gradiente de concentração diferente de zero expressa
justamente uma situação com acúmulo de massa numa região frente a uma escassez
em outra. Por isso falamos de uma energia de configuração; uma energia armazenada
em virtude da configuração do sistema, que é medida em termos da diferença de
potencial químico.
Para analisarmos o transporte de espécies químicas carregadas, íons, através
da membrana, temos que levar em conta, além da presença do gradiente de
concentração, a existência do potencial elétrico que surge, como visto antes, quando
12
há a seletividade da membrana. Para analisar o transporte dos íons Na+ e K+ através
da membrana plasmática, vamos considerar uma situação mais complexa que a
discutida na Figura 3, mas mais próxima do que ocorre nas células: uma cuba
contendo dois tipos diferentes de íons positivos, como mostrado na Figura 5.
100 mM
10 mM
i
K
+
10 mM
+
Na
Cl
100 mM
-
Cl
K
+
+
Na
-
e
Figura 5 A membrana é permeável apenas aos íons K+ e Na+. A concentração
iônica é agora idêntica em ambos os lados da membrana. O meio de alta
concentração de potássio simula o meio intracelular (i) e o de alta
concentração de sódio, o meio extracelular (e).
Suponha que ambos os íons passam por canais que podem estar fechados ou
abertos. Se o canal de sódio estiver fechado inicialmente, o equilíbrio se estabelece
exatamente como na Figura 3 e o perfil de potencial fica como mostrado na Figura 2.
Imagine agora que o canal de potássio seja fechado e o de sódio seja aberto. Neste
caso, a concentração do íon Na+ é maior fora da célula e o potencial elétrico também é
maior fora, como mostrado nas Figuras 2 e 5.
Sob tais circunstâncias, se olhássemos só sob o aspecto do gradiente de
concentração, diríamos que um íon Na+ seria compelido a entrar na célula, levado pela
difusão. Se olhássemos só sob o aspecto do potencial elétrico, diríamos que, sendo
um íon positivo, o campo elétrico criado na membrana compeliria o íon a entrar na
célula, levado pela força elétrica. Como tais forças são independentes uma da outra e
agem no mesmo sentido, o efeito resultante é de cooperação, ou da soma das duas.
Logo, o íon Na+ penetra no citoplasma levado pelas duas forças. Em outras palavras,
o transporte se dá às expensas da energia armazenada no gradiente de concentração
do Na+, mas também da energia armazenada no campo elétrico, o qual foi criado
anteriormente pelo transporte do K+. Observe que agora a energia de configuração do
sistema, além daquela da massa, engloba também a configuração das cargas elétricas
nele existentes; a do íon (a ser transportado) frente àquelas devidas ao potencial
13
elétrico. Isso implicou em ampliar o conceito de potencial químico antes referido
(associado apenas à configuração de massa) para que ele englobe também a
contribuição de origem elétrica.
Os casos discutidos até aqui são exemplos do tipo de transporte chamado
passivo. O transporte passivo é aquele que ocorre pela tendência espontânea de uma
espécie química se mover de uma posição onde a energia armazenada é mais alta
para outra mais baixa. Nos casos discutidos para moléculas neutras, uma tal situação
fica determinada pelo sentido da região de concentração mais alta para a mais baixa,
ou a favor do gradiente de potencial químico, que, nestes casos, se expressa pelo
gradiente de concentração. No caso de íons, a situação energeticamente favorável fica
definida levando-se em consideração tanto o gradiente de concentração como o do
potencial
elétrico;
ou
o
gradiente
do
potencial
eletroquímico.
A
situação
energeticamente favorável, nesses casos, é aquela no sentido do potencial
eletroquímico mais alto para o mais baixo. Lembrando que o potencial eletroquímico
tem duas contribuições que se somam, sendo que uma delas, a elétrica, pode ser
negativa, é possível verificar que teremos três possibilidades: a) quando o gradiente
de concentração e o gradiente do potencial elétrico têm o mesmo sentido, como é o
caso discutido para o Na+; b) quando o gradiente de concentração e o do potencial
elétrico têm efeitos em sentidos contrários, e a contribuição da diferença da
concentração sobrepuja a do potencial elétrico; c) quando o gradiente de concentração
e o do potencial elétrico têm efeitos em sentidos contrários, e a contribuição elétrica
sobrepuja a diferença de concentração.
Estas três possibilidades são mostradas na Figura 6.
Figura 6 O sentido e a intensidade do transporte passivo são determinados pelo
gradiente de concentração e pelo gradiente de potencial elétrico. a) ambos no
14
mesmo sentido levam a um intenso transporte (flecha grande); b) se em sentidos
opostos, mas com o gradiente de concentração dominando, o transporte ocorre no
sentido de maior para menor concentração; c) se em sentidos opostos, mas com o
gradiente de potencial elétrico dominando, o transporte ocorre contra o gradiente de
concentração.
O transporte passivo ocorrerá sempre em todo sistema no qual a distribuição
da espécie, entre os meios extra e intracelular, difira daquela verificada no equilíbrio
termodinâmico.
Transporte ativo
Voltemos agora ao nosso exemplo do Na+ entrando na célula impelido pelas
forças dos dois gradientes (de concentração e de potencial elétrico) para analisar o
outro tipo de transporte. Se o único transporte do Na+ através da membrana se desse
como discutido anteriormente, isto é, fosse apenas o passivo, com passar do tempo, a
concentração do Na+ no interior da célula tenderia a se igualar à concentração do meio
extracelular, fazendo desaparecer o seu gradiente de concentração e cessando o
transporte. Entretanto, o gradiente de concentração do Na+ se mantém à razão
maiores que de 1 para 10 – para células mamárias de animais, a concentração de Na+
no citosol é de 12 mM, enquanto no sangue a concentração é de 145mM. Surge então
a questão: como tal gradiente é mantido, se tanto o gradiente de concentração quanto
o potencial de membrana – da ordem de -70mV – favorecem a homogeneização do
íon nos dois meios? Em termos de energia, esta questão se coloca: como um íon de
Na+ consegue energia para sair da célula movendo-se contra seu gradiente de
potencial eletroquímico? Fazendo uma analogia com o potencial gravitacional, seria
equivalente a perguntar: como uma pessoa faz para conseguir energia para ser levada
do térreo aos andares superiores de um prédio? Se a resposta é “ora, usa
simplesmente o elevador”, estamos na pista certa para entender o transporte ativo.
Lembramos, no entanto, que todo elevador exige necessariamente uma fonte de
energia para subir.
O transporte ativo de moléculas ou íons através das membranas da célula é
aquele que se verifica contra seus gradientes do potencial eletroquímico às custas de
uma energia extra fornecida a essas partículas.
De uma maneira geral, o transporte ativo ocorre mediado por uma proteína que
funciona como uma bomba. Ele está sempre acoplado com uma “fonte” que fornece a
energia necessária para acionar a bomba. Freqüentemente, essa fonte de energia é a
reação química da hidrólise do ATP.
15
Um exemplo de transporte ativo conhecido é o realizado pela bomba K/NaATPase, que é justamente o responsável pela manutenção dos gradientes de
concentração destes íons através da membrana plasmática. É por esse transporte
realizado pela bomba que os íons de Na+ saem e os de K+ entram na célula, movendose, respectivamente, contra seus gradientes de potencial eletroquímico. Na Figura 7
você pode ver um esquema do transporte ativo realizado pela bomba K+/Na+.
citosol
membrana
meio
extracelular
Concentração
de K+
ATP
K+
K+
ADP
Na+
Na+ Na
+
Concentração
de Na+
.
Figura 7 Transporte ativo da bomba Na/K-ATPase.
Do ponto de vista termodinâmico, podemos analisar os fenômenos de
transporte através da membrana, calculando a variação da energia livre de Gibbs.
Para o transporte passivo de substância neutra, a variação da energia livre de
Gibbs por mol, é dada pela diferença entre os potenciais químicos nas soluções de
diferentes concentrações, em cada lado da membrana:
∆Ge→i = µαe − µαi = RT ln
Cαi
Cαe
onde ∆Ge→i é a diferença entre o potencial químico da espécie α no lado externo e o
seu valor no lado interno da membrana. Para que tenhamos ∆Ge→i < 0 , isto é, para
que a difusão espontânea se dê de fora para dentro, é necessário que tenhamos
Cαi < Cαe , isto é, a concentração da espécie α do lado externo seja maior que do
interno. Dito de outra forma, havendo um gradiente de potencial químico, a difusão
ocorrerá a favor deste gradiente.
16
Se, ao contrário, Cαi > Cαe , o transporte da espécie de fora para dentro não
será espontâneo; ele só ocorrerá se alguma energia for fornecida à molécula; teremos
então o transporte ativo.
Para o caso da espécie ser um íon, temos que levar em conta na nossa análise
o potencial eletroquímico.
Consideremos a situação específica da bomba de Na/K, focando nossa
atenção no íon Na+, cuja concentração fora é da ordem de 10 vezes a de dentro.
Verifiquemos agora qual é a variação da energia livre de Gibbs por mol no transporte
deste íon do meio interno para o externo, ou seja, calculemos ∆Gi →e .
Usando a definição do potencial eletroquímico, temos
e
i
e
i
∆Gi→e = µ Na
− µ Na
= RT ln C Na
+ FV e − ( RT ln C Na
+ FV i )
∆Gi→e = RT ln
e
C Na
+ F (V e − V i )
i
C Na
Para a temperatura de 37ºC e levando em conta que a diferença de potencial
elétrico do meio externo para o interno é de 70mV, a equação acima fornece
∆Gi→e = 12,7 kJ / mol , um valor positivo, mostrando que o transporte nesta direção,
contra o gradiente do potencial eletroquímico, não é espontâneo, necessitando
portanto de um aporte de energia.
Essa energia necessária pode ser provida por uma reação química, com
∆GR < 0 , suficiente para tornar ∆Gi→e negativo.
O movimento do íon para fora da célula pode então ser representado por
∆Gi→e = RT ln
e
C Na
+ F (V e − V i ) + ∆GR
i
C Na
Sabemos que, para a hidrólise de um mol de ATP, ∆GR = −30kJ / mol . Se
portanto, a reação acoplada ao processo for a hidrólise do ATP, o ∆Gi→e para o será
-17kJ/mol, mostrando que, nessas condições, esse transporte ocorrerá. Observe que,
para o Na+, o transporte ativo ocorre contra o gradiente de concentração e,
simultaneamente, contra o gradiente de potencial elétrico. Já para o K+, o transporte
17
ativo ocorre contra o gradiente de concentração, mas a favor do gradiente de potencial
elétrico.
Na Figura 8, está mostrado um interessante exemplo de transporte ativo que
consegue a energia para ir contra seu gradiente de potencial eletroquímico
aproveitando o transporte passivo de outra espécie. Trata-se da bomba Na+/glicose
que ocorre, por exemplo, nas células epiteliais do intestino para absorção da glicose e
nas células renais para a reabsorção. Note que o Na+ está sendo transportado
passivamente – a favor de seu gradiente de potencial eletroquímico – enquanto a
molécula de glicose é transportada ativamente contra seu gradiente de potencial
eletroquímico (no caso só de concentração, pois a molécula é neutra) as custas da
energia liberada pelo transporte passivo do sódio.
citosol
membrana
meio
extracelular
Concentração
de glicose
Na+
Concentração
de Na+
Figura 8 Transporte ativo da glicose impulsionado pelo transporte passivo do sódio.
O gradiente de potencial eletroquímico é um mecanismo importante do qual a
célula se vale para armazenar energia. Nas mitocôndrias, a energia química da glicose
é armazenada na forma de um gradiente eletroquímico de H+ antes de ser finalmente
transferida às moléculas de ATP. Na fotossíntese, também ocorre a produção de ATP
por um gradiente de prótons, com a diferença que o gradiente acumula energia
proveniente da luz absorvida. A energia acumulada no ATP volta a ser convertida em
gradientes eletroquímicos por bombas que realizam transporte ativo, Na/K-ATPase,
por exemplo. Esse gradiente é agora utilizado para, por exemplo, transportar
moléculas necessárias à célula, como a glicose.
Além disso, nas células excitáveis, como as nervosas e musculares, a
existência de gradientes permite outro processo biológico importante: a sinalização por
18
impulsos elétricos. Parte da energia armazenada nos gradientes é dissipada cada vez
que um sinal elétrico é enviado, portanto, o gradiente requer constante regeneração
por parte da Na/K-ATPase.
O ATP é a “moeda” energética das células. Aqui pode-se perceber que as
células trabalham com um complexo sistema “financeiro”.
Os fenômenos elétro(químicos) na célula têm, em síntese, as seguintes
funções:
1. armazenamento de energia – para processos de transporte como o da glicose
entrando com o sódio;
2. manutenção da diferença de concentração de solutos para manter o equilíbrio
osmótico;
3. produção do ATP nas membranas da mitocôndria e dos cloroplastos servindo como
uma forma intermediária de armazenamento de energia nas células;
4. produção de sinais elétricos através de células excitáveis – células nervosas e
musculares.
CONCLUSÃO
A bioeletricidade é uma característica de todos os tecidos vivos, animal e
vegetal. Luigi Galvani, professor de Anatomia na Universidade de Bolonha fez tal
constatação, em 1780, quando, verificou uma contração do músculo dissecado da
perna de um sapo ao ser tocado pelo pólo de uma máquina de eletricidade estática; a
perna do sapo movimentou-se como se estivesse viva. Galvani, com suas
experiências, concluiu que eletricidade era também gerada por corpos de animais,
existindo uma íntima relação entre a vida e ela; denominou-a de “eletricidade animal”
ou “força vital”, considerando-a similar, mas algo distinta da eletricidade natural de
raios e máquinas de eletricidade. Alessandro Volta, um físico também italiano e amigo
de Galvani, apaixonado pela eletricidade, repetiu as experiências, confirmou os
resultados obtidos, mas discordou da interpretação dada por Galvani; para ele a
eletricidade observada originava-se não do tecido animal, mas teria sido gerada pelo
contato entre dois tipos de metal manipulados por Galvani em suas experiências,
funcionando o músculo do sapo apenas como um detector de pequenas diferenças de
potencial. Uma contenda científica entre os dois estabeleceu-se por muitos anos, ao
longo dos quais inúmeras experiências foram feitas por ambos com diferentes animais,
cujos músculos ou nervos eram submetidos a cargas elétricas; cada qual queria provar
a sua tese. Foi no bojo dessa “briga” científica, que, em 1800, Volta, para provar que
19
Galvani estava errado, construiu a pilha elétrica, ou bateria, constituída de uma série
de discos metálicos de dois metais diferentes, separados por papelão embebido em
soluções acidas ou salinas. A pilha ou bateria de Volta constitui uma das mais
importantes descobertas ou invenções científicas, uma vez que se trata do primeiro
método criado para armazenar energia elétrica, possibilitando a geração e
manutenção de corrente elétrica.
Podemos observar então que pesquisas em Biologia, no século XVIII,
desencadearam importantes avanços no conhecimento da Física sobre a natureza dos
fenômenos elétricos, que, uma vez desenvolvidos e bem compreendidos, permitiram,
mais modernamente, identificar o papel central que a bioeletricidade desempenha nos
fenômenos vitais.
A bioeletricidade responde pelos processos de transporte através das
membranas celulares, que controlam a formação e dissipação de gradientes de
concentração de íons e de gradientes de potencial elétrico. Estes gradientes, tal como
a pilha ou bateria de Volta, armazenam energia eletroquímica, a qual pode ser
convertida e disponibilizada em outras formas que são usadas pelos organismos em
inúmeros processos.
O debate Galvani versus Volta foi um dos episódios mais importantes da
História da Ciência, principalmente, pelo elevado espírito científico com que se travou.
Galvanismo foi o termo, generosamente, cunhado por Volta, que disse sobre o
trabalho de Galvani: “ele contém uma das mais belas e surpreendentes descobertas”.
Ambos estavam certos. Havia dois importantíssimos fenômenos: a eletrogênese
bimetal e a bioeletrogênese animal.
REFERÊNCIAS
Alberts, Bruce - Biologia Molecular da Célula, Quarta Edição, Artmed Editora – 2004.
20