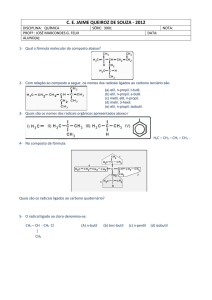
Apostila de Química 27 – Polímeros
1.0 Definições
Monômeros – Moléculas pequenas.
Polímeros – União de vários monômeros pela polimerização.
2.0 Polímeros Sintéticos
2.1 Polímeros de Adição
As substâncias devem possuir pelos menos 1 dupla de ligação entre carbonos –
Durante a polimerização, 1 das ligações π é quebrada.
Monômero
Etileno
Forma Condensada
CH2 = CH2
Polímero
Polietileno
Forma Condensada
(CH2 – CH2)n
Propileno
CH2 = CH – CH3
Polipropileno
(CH2 – CH – CH3)n
Estireno
CH2 = CH – C6H5
(CH2 – CH – C6H5)n
Cloreto de vinila
CH2 = CH – Cl
Tetrafluoretileno
CF2 = CF2
Poliestireno
Policloreto de vinila
(PVC)
Politetrafluoretileno
(PTFE) ou Teflon
CH2 = CH – CN
Policianeto de vinila
ou Poliacrilonitrila
(CH2 – CH – CN)n
CH2 = CHO – C – CH3O
Poliacetato de vinila
(PVA)
Polieritreno ou
Borracha sintética
(CH2 – CHO – C – CH3O)n
Cianeto de
vinila ou
Acrilonitrila
Acetato de
vinila
Eritreno
CH2 = CH – CH = CH2
(CH2 – CH – Cl)n
(CF2 – CF2)n
(CH2 – CH – CH = CH2)n
2.2 Polímeros de Condensação
Formados pela reação entre 2 monômeros diferentes, com a eliminação de
moléculas pequenas.
As substâncias não precisam apresentar 2 ligações entre carbonos.
É necessária a existência de 2 tipos de grupos funcionais diferentes.
Monômero
Forma Condensada
Ácido tereftálico +
Etileno-glicol
(etanodiol)
Ácido adípico
(hexanodióico) +
Hexametilenodiamina
(1, 6-hexanodiamina)
Siloxano
COOH – C6H4 – COOH
+
HO – CH2 – CH2 – OH
COOH – (CH2)4 –
COOH
+
NH2 – (CH2)6 – NH2
CH3 – Si(OH)2 – CH3
OH – C6H4 – C(CH3)2 –
C6H4 – OH
+
Cl – CO – Cl
C6H5 – OH
+
CH2O
Difenol-propano +
Fosgênio
Fenol comum +
Formol (metanal)
Molécula
Eliminada
Polímero
Forma Condensada
H2O
Poliéster
(COO – C6H4 – COO – CH2
– CH2 – O)n
H2O
Poliamida
(CO – (CH2)4 – CONH –
(CH2)6 – CONH – (CH2)4 –
CO)n
H2
Silicone
(CH3 – Si(O)2 – CH3)n
HCl
Policarbonato
Grupo característico:
(COOO)n
H2O
Polifenol
OH – C6H4 – CH2 – C6H4 OH
3.0 Polímeros Naturais
3.1 Borracha
Obtida da seringueira por incisão em seu caule – Obtém-se um líquido leitoso:
látex.
Polímero de adição.
Monômero
Forma Condensada
Polímero
Forma Condensada
2-metil-1, 3butadieno ou
Isopreno
CH2 = C(CH3) – CH = CH2
Polisopreno ou
Borracha natural
(CH2 – C(CH3) = CH – CH2)n
3.1.1 Vulcanização
O látex é precipitado – Massa viscosa, que é a borracha natural.
Utilização limitada – Quebradiça nos dias frios e gosmenta no dias quentes.
Ao ser aquecida com enxofre, gera-se a borracha vulcanizada – Material
bastante elástico que não sofre alterações significativas a mudanças de
temperatura, além de ser bastante resistente ao atrito.
3.2 Polissacarídeos
Polimerização de monossacarídeos gera o amido, glicogênio e a celulose.
Polímero de condensação.
Monômero
Forma Condensada
Glicose, Frutose e
Galactose
C6H12O6
Molécula
Eliminada
Polímero
Forma Condensada
H2O
Sacarose,
lactose e
maltose
C12H22O11
Amido – Importante fonte de carboidratos.
Dissacarídeo mais importante – Sacarose, açúcar de cana ou açúcar comum.
Polissacarídeo mais abundante na natureza – Celulose.
3.3 Proteínas ou Polipeptídios
Formado a partir da união de aminoácidos.
Presente em todas as células, vivas, enzimas, fibras musculares, cabelo e pele.
Polímero de condensação – A interação ocorre entre o grupo ácido (COOH) e o
grupo básico (NH2).
Monômero
Forma Condensada
Molécula
Eliminada
Polímero
Forma Condensada
Aminoácido
R – CH(NH2) COOH
H2O
Proteína
(CH2(NH2) – CONH –
CH(CH3) – COOH)n