Estudo das Dispersões e Química Orgânica
Disciplina: Química
Professor: Márcio Gomes
2º/Ens. Médio Turma___
1)
Na mistura uma das espécies (disperso) pode espalhar-se na outra (dispersante) na forma de pequenas partículas. Neste
caso, a mistura é chamada de dispersão. Com base nas dispersões coloidais, assinale verdadeiro ou falso:
a)
b)
c)
d)
e)
Nevoeiro, xampu e leite são exemplos de substâncias no estado coloidal, classificadas como aerossóis.
Leite, maionese e crema de leite são exemplos de substâncias no estado coloidal, classificadas como emulsões.
Geleia, xampu e chantilly são exemplos de substâncias no estado coloidal, classificadas como espumas.
Manteiga, queijo e geleia são exemplos de substâncias no estado coloidal, classificadas como géis.
Ligas metálicas, fumaça e asfalto são exemplos de substâncias no estado coloidal, classificadas como sóis.
2)
Quando bebemos um copo de refrigerante comum, estamos ingerindo uma solução de açúcares, extratos, aromatizantes,
acidulantes, corantes, gás carbônico, entre outras substâncias, tudo dissolvido em água. Todo sistema formado por várias
substâncias é chamado de dispersão. Com base nos estudos das dispersões, assinale verdadeiro ou falso.
a)
b)
c)
Uma dispersão coloidal constitui um sistema homogêneo.
Dispersão de álcool (etanol) na gasolina é certamente uma solução.
Uma dispersão em que as partículas dispersas são visíveis a olho nu e/ou com o auxilio de microscópio comum é,
certamente uma dispersão grosseira.
Uma dispersão em que as partículas dispersas atravessam o filtro comum é, certamente uma dispersão coloidal.
Uma dispersão em que as partículas não se sedimentam nem mesmo sob a ação de ultracentrifugadores é, certamente uma
solução.
d)
e)
3)
Com base nas características das partículas do disperso, identifique o tipo de dispersão.
a)
b)
c)
d)
e)
f)
g)
Partículas com diâmetro 10 cm.. ________________
São separadas do dispergente apenas por um ultrafiltro. ______________
São observadas a olho nu ou com a ajuda de um microscópio comum. ________________
Possui aspecto visual uniforme, mesmo ao ser examinado num ultramicroscópio. _______________
Manteiga, spray de desodorante e geleia, são exemplos de ___________________
Só podem ser separadas do solvente por processos físicos, como a destilação, por exemplo. _______________
Não se sedimentam pela ação da gravidade; na verdade, sua sedimentação só é obtida pelo uso de uma ultracentrífuga.
__________________
4)
Classifique as soluções abaixo quanto à condutibilidade
elétrica:
a)
b)
c)
d)
e)
6)
-3
LiOH em água;
sulfato de sódio em água;
acetona em água;
HNO3 com água;
C6H12O6 em água.
_______________
_______________
_______________
_______________
_______________
5)
a)
b)
c)
d)
e)
Classifique, quanto ao estado de agregação, as seguintes
soluções:
gás oxigênio dissolvido no lago;
______________
iodo dissolvido em clorofórmio;
______________
liga de cobre e estanho.
______________
gás de cozinha;
______________
hidrogênio retido em platina em pó. ______________
As concentrações das soluções podem ser expressas pela relação:
Com base nessa informação, responda:
O valor dessa relação é menor para soluções concentradas do que
para soluções diluídas de um mesmo soluto?
7)
Um técnico dispunha de 200 mL de solução aquosa de NaBr, com concentração igual a 8 g/L. Após dissolver 2,0g de NaBr
puro nessa amostra, qual será a nova concentração da amostra, em g/L?
8)
a)
b)
100 g de NaOH dissolvidos em 400 mL de água forneceram 420 mL de solução. Calcule:
a concentração em g/L;
a densidade da solução em g/L.
9)
A concentração molar, mol/L, da glicose (fórmula
molecular C6H12O6) numa solução aquosa que contém
9 g de soluto em 500 mL de solução é igual a:
a)
b)
c)
d)
e)
0,01
0,10
0,18
1,00
1,80
10) A concentração de íons fluoreto em água de uso
–5
doméstico é de 5,0 · 10 mol/L. Se uma pessoa tomar
3,0 litros dessa água por dia, ao fim de um dia a massa
de fluoreto, em miligramas, que essa pessoa terá
ingerido será igual a:
a) 0,9
b) 1,3
c) 5,7
d) 2,85
e) 15
11) O sulfato de sódio deca-hidratado (Na2SO4.10H2O) é um composto de ação laxante, conhecido como sal de Glauber. Uma
colher de café, com 6,44 g de sal de Glauber, foi adicionada a um copo com 500 mL de água. Calcule a concentração em
mol/L da solução.
Dados: massas atômicas: H = 1; C = 12; O = 16; F = 19; Na = 23 e S = 32.
12) No rótulo de um frasco de laboratório lê-se:
KOH (aq)
C = 80 g/L
d = 1,2 g/cm3
a)
b)
c)
d)
e)
Qual o solvente?
Qual o nome do soluto?
3
Qual a massa de soluto, em gramas, em 1000 cm de solução?
3
Qual a massa, em gramas, de cada dm de solução?
3
Qual a massa, em Kg, em 200 cm de solução?
13) Uma cozinheira bem informada sabe que a água contendo sal de cozinha dissolvido ferve a uma temperatura mais elevada
do que a água pura e que isso pode ser vantajoso em certas preparações. Essa cozinheira coloca 117 g de NaCl em uma
panela grande. Calcule o volume necessário de água para a cozinheira preparar uma solução 0,25 mol/L de NaCl.
Dados: massas atômicas: Na = 23 e Cl = 35,5.
14) No preparo de 2 L de uma solução de ácido sulfúrico foram gastos 19,6 g do referido ácido. Calcule a concentração molar
+
2(mol/L) da solução e dos íons H e SO4 .
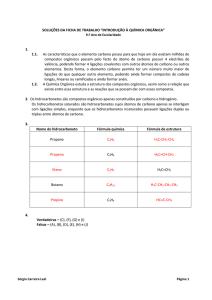
15) Com base nas propriedades e nos exemplos abaixo, complete se é orgânico ou inorgânico:
a)
b)
c)
d)
e)
Um lixo com papel rasgado ____________________
Gasolina e óleo diesel
____________________
Em geral são iônicos
____________________
NaHCO3 e H4[Fe(CN)6
____________________
Plásticos de polietileno
____________________
f)
g)
h)
i)
j)
CH3COOH e C12H22O11
Em geral não são inflamáveis
Vitaminas e proteínas
Sucatas de ferro e zinco
Soda cáustica e cal
____________________
___________________
____________________
____________________
____________________
16) A respeito dos compostos orgânicos, assinale verdadeiro ou falso:
a)
b)
c)
d)
e)
Os compostos orgânicos somente poderão ser sintetizados pelos organismos vivos, daí a qualificação de orgânicos.
Os compostos orgânicos são compostos de carbono, embora algumas substâncias que contém esse elemento sejam
estudadas também entre os compostos inorgânicos (CO2, HCN, etc.).
A existência de um grande número de compostos de carbono está relacionada com a capacidade de o átomo de carbono
formar cadeias, associadas à sua tetracovalência.
Nos compostos de carbono, a ligação covalente é mais frequente.
Os compostos orgânicos são regidos por leis e princípios próprios não aplicáveis a compostos inorgânicos.
17) Complete com hidrogênio a cadeia carbônica:
a)
b)
c)
d)
e)
C ≡ C – C = C = C – C – N , responda:
Quantos hidrogênios completam a cadeia carbônica?
Qual a fórmula molecular do composto?
Quantas ligações sigmas e pi, apresenta o composto?
Quais os tipos de hibridização dos carbonos presentes no composto?
Qual o ângulo e a geometria apresentado pelo carbono ligado ao nitrogênio?
18) Um produto natural encontrado em algumas plantas leguminosas apresenta a seguinte estrutura:
a)
b)
c)
d)
e)
19)
Que tipo de hibridação apresenta cada um dos átomos de carbono dessa
estrutura?
Quantas são as ligações sigma e pi presentes nessa substância?
Qual a fórmula molecular do composto?
Qual o ângulo das ligações do carbono que apresenta dois oxigênios?
Qual o número de carbono com geometria tetraédrica?
Em uma indústria havia um depósito com varias sobras de materiais: caixas de papelão para embalagem, pedaços de isopor,
aparas de alumínio, tijolos de barro, blocos de concreto, sacos de cimento, um rolo de corda de náilon e alguns caibros de
madeira. Essas sobras foram separadas em três partes, metais, material orgânico e material inorgânico. Que materiais
ficaram em cada parte?
20) As gomas de mascar são produzidas com derivados do
acetato de vinila:
Segundo o composto acima, pode-se afirmar que:
a)
b)
c)
d)
e)
É um composto inorgânico.
Apresenta fórmula molecular, C4H6O.
Apresenta 11 ligações sigma (σ) e duas ( π)..
2
Todos os carbonos apresentam hibridação sp .
Um carbono apresenta geometria linear.
21)
a)
b)
c)
d)
e)
A uréia é um composto orgânico cristalino, incolor, de
fórmula CO(NH2)2. Em nosso organismo, a uréia formase principalmente no fígado, sendo filtrada pelos rins e
eliminada na urina ou pelo suor. O átomo de carbono de
sua estrutura apresenta quantas ligações sigmas e
quantas ligações pi, respectivamente?
3e1
4e2
6e2
7e1
4e1