QUÍMICA A – FÍSICO-QUÍMICA PROF. RODRIGO
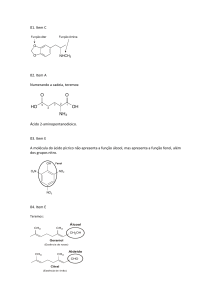
e) A variação de energia Gibbs padrão para esta reação é de –
30,2 kcal.mol–1.
Química A – 2ª Série – 2º Trimestre – Tarefa 17 – Entropia
e energia livre.
(MACK-SP)
C grafite (s) + O2(g) CO2(g)
C diamante (s) + O2(g) CO2(g)
Química A – 2ª Série – 2º Trimestre – Tarefa 18 – Cinética
H = - 94,0 kcal
H = - 94,5 kcal
Relativamente às equações anteriores, fazem-se as seguintes
afirmações:
I - C (grafite) é a forma alotrópica menos energética.
II - As duas reações são endotérmicas.
III - Se ocorrer a transformação de C (diamante) em C (grafite)
haverá liberação de energia.
IV - C (diamante) é a forma alotrópica mais estável.
São corretas:
01. A amônia é empregada como matéria prima na fabricação
de fertilizantes nitrogenados. É obtida industrialmente por
síntese total, como mostra a reação:
N2(g) + 3H2(g) → 2NH3(g)
O quadro a seguir mostra a variação do número de mols de
nitrogênio durante essa reação.
Mols de N2
20
10
5
2
a) I e II, somente.
X b) I e III, somente.
c) I, II e III, somente.
d) II e IV, somente.
e) I, III e IV, somente.
02. (Fuvest ) Pode-se conceituar energia de ligação química
como sendo a variação de entalpia (ΔH) que ocorre na quebra
de 1 mol de uma dada ligação.
Assim, na reação representada pela equação:
NH3(g)→N(g)+3H(g); ΔH=1170 kJ/molNH3
são quebrados 3 mols de ligação N-H, sendo, portanto, a
energia de ligação N-H igual a 390kJ/mol.
Sabendo-se que na decomposição:
N2H4(g)→2N(g) +4H(g); ΔH=1720 kJ/mol N2H4g)
são quebrados ligações N-N e N-H, qual o valor, em kJ/mol, da
energia de ligação N-N ?
a) 80
Xb) 160
c) 344
d) 550
e) 1330
Tempo (min)
0
2
5
10
Considere rendimento de 100% no processo e condições
normais de temperatura e pressão. Assim, a velocidade média
da reação em mol/min, no intervalo de 0 a 2 minutos, em
função do consumo de N2, equivale a:
Xa) 5
b) 4
c) 6
d) 8
e) 1
02. (MACKENZIE) A combustão da gasolina pode ser
equacionada por:
C8H18 + 25/2 O2→8 CO2 + 9 H2O
03. Qual dos seguintes processos envolve uma diminuição da
entropia?
Considere que após uma hora e meia de reação foram
produzidos 36 mols de CO2. Dessa forma, avelocidade de
reação, expressa em número de mols de gasolina consumida
por minuto, é de:
a) a sublimação do dióxido de carbono
b) a dissolução do NaCℓ na água
c) a decomposição de N2O4 (g) a NO2 (g)
d) a evaporação do etanol
Xe) congelamento da água líquida a gelo
a) 3,0
b) 4,5
c) 0,1
d) 0,4
Xe) 0,05
04. Qual reação deve ter uma variação negativa na entropia?
a) 2 NH 3 → N2 (g) + 3 H2 (g)
Xb) CaO(s) + CO2 (g) → CaCO3 (s)
c) NaCℓ(s) → Na+ (aq) + Cℓ-(aq)
d) N2O4 (g) → 2 NO2 (g)
e) 2C(s) + O2 (g) → 2CO(g)
05. (UTFPR) O benzeno (C6H6) é um produto altamente tóxico,
cancerígeno, produzido industrialmente por ser matéria prima
para uma série de compostos. Uma das reações de obtenção
do benzeno é:
6 C(s)+ 3 H2(g) → C6H6(ℓ) .
A 25°C esta reação possui os seguintes dados
termodinâmicos:
ΔHo = + 12 kcal.mol–1; ΔSo = – 61cal.K–1mol–1.
Com base nestas informações pode-se afirmar que:
a) a reação é exotérmica e espontânea.
Xb) a reação não é espontânea nesta temperatura.
c) a reação é exotérmica.
d) a variação de energia Gibbs padrão para esta reação é de
+18,2 kcal.mol–1.
03. (UNIOESTE)As advertências sobre a possibilidade de
substâncias antropogênicas afetarem a camada de ozônio na
estratosfera começaram a aparecer em 1970. Entre 1981 a
1986, verificou-se que houve uma redução na concentração de
ozônio de 210 para 110 DU (DU é a unidade de concentração
do ozônio no ar), redução esta constante de ano para ano.
Sabendo que a reação de decomposição segue a equação 2
O3 → 3 O2 , a alternativa que possui a afirmativa correta é:
a) A velocidade de formação do oxigênio e da decomposição
do ozônio são iguais.
Xb) A velocidade de formação do oxigênio é 30 DU/ano.
c) A velocidade de formação do oxigênio é 20 DU/ano.
d) A velocidade de formação do oxigênio é 10 DU/ano.
e) A velocidade de reação é 30 DU/ano.
04. Com relação à reação: 2 A + 3 B→2 C + D podemos
afirmar que:
a) os reagentes (A e B) são consumidos com a mesma
velocidade.
Xb) a velocidade de desaparecimento de A é igual à velocidade
de aparecimento de C.
c) a velocidade de aparecimento de D é três vezes maior que a
velocidade de desaparecimento de B.
d) os produtos (C e D) são formados com a mesma velocidade.
e) a velocidade de desaparecimento de A é a metade da
velocidade de aparecimento de D.
05. O gráfico a seguir representa a variação das concentrações
das substâncias X, Y e Z durante a reação em que elas tomam
parte.
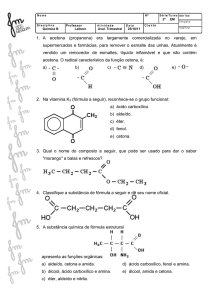
4. Ligando-se grupos Cℓ- a um radical etanoíla, a um radical
fenila e a uma etila teremos respectivamente:
a) um álcool, um fenol e um ácido carboxílico;
b) um fenol, um ácido e um álcool;
c) um álcool, um ácido e um ácido;
d) um fenol, um álcool e um ácido carboxílico;
Xe) um haleto de ácido, um haleto aromático e um haleto de
alquila.
5. (USF – SP) – Dadas as fórmulas moleculares: C2H6, CH4O,
H3CCOCℓ e C6H6, os compostos representados são,
respectivamente:
a) etano, álcool etílico, ácido fórmico e ciclohexadieno;
b) etileno, álcool metílico, ácido metanóico e benzeno;
c) etano, metóxi, formol e ciclo-hexeno;
d) etileno, metanol, formaldeído e hexatrieno;
xe) etano, metanol, cloreto de etanoíla e benzeno.
A equação que representa a reação é:
a) X + Z → Y.
b) X + Y →Z.
c) X →Y + Z.
d) Y →X + Z.
Xe) Z→X + Y.
06. (UNESP) Dentre as fórmulas a seguir, a alternativa que
apresenta um sal de ácido carboxílico é
2011 – 2ª Série Química Orgânica – 2º Trimestre – Tarefa
17: derivados de ácidos
a) CH3-CHCℓ-CHO
b) (CH3)3C-CH2Cℓ
Xc) (CH3)3COO-Na+
d) CH3-CH2-CH2-O-Na+
e) CH3-CH(O-Na+)-CH3
2011 – 2ª Série Química Orgânica – 2º Trimestre – Tarefa
18: Funções mistas
01. A que corresponde a fórmula a seguir:
H3C–CH2–COO-Na+
a) ácido butanóico;
b) ácido sódio-butanóico;
c) ácido sódio-etanóico;
d) acetato de sódio;
Xe) propanoato de sódio.
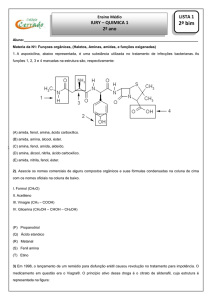
02. Dados os compostos:
O
O
-
Cl
+
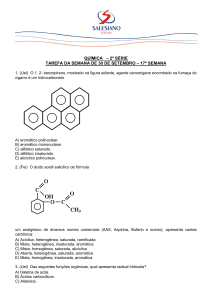
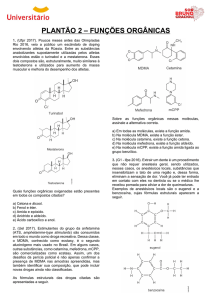
1. (UFG) O aspartame é utilizado como edulcorante em
alimentos dietéticos. Assim que ingerido, ele é convertido em
fenil-alanina, um aminoácido, através de uma reação de
hidrólise, conforme equação química da figura 1.
No organismo humano, o excesso desse aminoácido é
metabolizado, inicialmente, pela enzima fenil-alaninahidroxilase, que realiza uma hidroxilação na posição para do
anel aromático produzindo outro aminoácido, a tirosina.
Pessoas portadoras de uma herança autossômica recessiva
para o gene que codifica tal enzima não conseguem realizar
essa etapa do metabolismo e, portanto, não podem ingerir
alimentos que contenham fenil-alanina, ou seu precursor, em
grandes quantidades. Essa falha no metabolismo é conhecida
como fenilcetonúria e seus portadores como fenilcetonúricos.
O Na
e
Assinale a alternativa em que aparece o nome das duas
estruturas na ordem apresentada:
a) cloreto de benzoíla e ácido benzoato
b) benzoato de cloro e benzoato de sódio
c) cloro benzeno e sódio benzeno
Xd) cloreto de benzoíla e benzoato de sódio
e) ácido clórico e ácido sódico.
03. Assinale a alternativa correta quanto a relação fórmulafunção:
a) (R2)O → éster;
b) AR – OH → ácido carboxílico;
c) R – CO2H → aldeído;
d) R – Cℓ → éter;
Xe) AR – COCℓ → haleto de ácido.
De acordo com os dados apresentados, a hidrólise do
aspartame ocorre nas ligações que caracterizam os seguintes
grupos funcionais:
a) amina e éster.
b) amina e éter.
c) amida e éster.
d) amida e ácido carboxílico.
e) amina e ácido carboxílico.
2. (FGV) A figura apresenta a estrutura química de dois
conhecidos estimulantes.
Considerando-se esse composto, é CORRETO afirmar que ele
apresenta os seguintes grupos funcionais:
a) amina, cetona, fenol e éter.
b) amida, cetona, álcool e éster.
c) amida, fenol e éter.
d) amina, éster e álcool.
A cafeína, quase todas as pessoas a consomem diariamente
ao tomarem um cafezinho. A anfetamina é considerada uma
droga ilícita, e algumas pessoas fazem o uso desta droga,
como caminhoneiros, para provocar insônia, e jovens,
obsessivos por sua forma física, para provocar perda de apetite
e redução de peso. A perda de apetite gerada pelo seu uso
constante pode transformar-se em anorexia, um estado no qual
a pessoa passa a sentir dificuldade para comer, resultando em
sérias perdas de peso, desnutrição e até morte. A substância
que apresenta carbono assimétrico e os grupos funcionais
encontrados nas estruturas destes estimulantes, são,
respectivamente,
a) anfetamina, amida e cetona.
b) anfetamina, amida e amina.
c) anfetamina, amina e cetona.
d) cafeína, amina e amida.
e) cafeína, amina e cetona.
3. (PUC-RJ) A dipirona sódica e o paracetamol são fármacos
que se encontram presentes em medicamentos analgésicos e
antiinflamatórios.
Considerando a estrutura de cada composto, as ligações
químicas, os grupamentos funcionais e a quantidade de
átomos de cada elemento nas moléculas, marque a opção
correta.
a) A dipirona sódica é uma substância insolúvel em água.
b) Apenas o paracetamol é uma substância aromática.
c) A massa molecular da dipirona sódica é menor que a do
paracetamol.
d) Na dipirona sódica, identifica-se um grupo sulfônico.
e) O paracetamol e a dipirona sódica são aminoácidos.
4. (PUC-MG) A gingerona é um componente do gengibrerizoma (ou caule subterrâneo) do Zingiber officinale, de
fórmula:
6. (PUC-RS) Flavorizantes artificiais procuram imitar o sabor e
o aroma de alimentos produzidos artificialmente. Dentre esses
compostos sintéticos, destacam-se os ésteres. Um exemplo de
éster que pode ser usado como aditivo alimentar é
a) CH3COOH
b) CH3CH2COCH2CH3
c) CH3CH2CH2OH
d) CH3CH2CH2COOCH2CH3
e) C6H5OCH3
7. (UERJ) As fragrâncias características dos perfumes são
obtidas a partir de óleos essenciais.
Observe as estruturas químicas de três substâncias
comumente empregadas na produção de perfumes:
O grupo funcional comum às três substâncias corresponde à
seguinte função orgânica:
a) éter
b) álcool
c) cetona
d) aldeído
e) ácido carboxílico
8. (UFRS) Os LCDs são mostradores de cristal líquido que
contêm em sua composição misturas de substâncias
orgânicas.
A substância DCH-2F é um cristal líquido nemático utilizado na
construção de mostradores de matriz ativa de cristais líquidos.
Sua estrutura está representada a seguir.
A substância DCH-2F é um
a) isocianeto aromático.
b) cianeto aromático.
c) haleto orgânico.
d) alcano saturado.
e) hidrocarboneto aromático.
9. (UNESP)
Ele apresenta grupos funcionais de:
a) éter, fenol e cetona.
b) fenol, éster e aldeído.
c) álcool, éster e aldeído.
d) álcool, éter e cetona.
5. (PUC-MG) O estimulante cardíaco e respiratório metamivam
possui a fórmula estrutural a seguir.
Excluindo as funções amina e ácido carboxílico, comuns a
todos os aminoácidos, as demais funções presentes na
molécula do dipeptídio são:
a) álcool, éster e amida.
b) éter e amida.
c) éter e éster.
d) amida e éster.
e) álcool e amida.
10. (UNIFESP) Analgésicos ácidos como aqueles à base de
ácido acetilsalicílico provocam em algumas pessoas sintomas
desagradáveis associados ao aumento da acidez estomacal.
Em substituição a esses medicamentos, podem ser ministrados
outros que contenham como princípio ativo o paracetamol
(acetaminofen), que é uma base fraca. O meio estomacal é
predominantemente ácido, enquanto que o meio intestinal é
predominantemente básico, o que leva à absorção seletiva nos
dois órgãos de medicamentos administrados pela via oral.
Considere a figura com a estrutura do acetaminofen e as
seguintes afirmações:
I. O acetaminofen apresenta fórmula molecular C8H9NO2
II. O grupo funcional amida é que confere o caráter básico do
acetaminofen.
III. A absorção do ácido acetilsalicílico em um indivíduo é maior
no estômago do que no intestino, devido ao baixo pH do suco
gástrico.
IV. Os fenóis apresentam menor acidez do que os ácidos
carboxílicos.
São corretas as afirmações
a) I, II, III e IV.
b) I, II e III, somente.
c) I, II e IV, somente.
d) II, III e IV, somente.
e) III e IV, somente.