Revisional Química - 1° ano EM (1° bimestre)
Professor: Herbert Aleixo
1) O modelo atômico de Bohr pode ser considerado um aprimoramento do
modelo atômico proposto por Rutherford. Qual a principal diferença
proposta no modelo de Bohr em relação ao modelo proposto por seu
mestre Rutherford?
2) Como Niels Bohr explicou o fato de um gás emitir radiação ao ser
submetido à uma descarga elétrica, e essa radiação apresentar linhas
específicas para cada elemento químico?
3) Descreva as principais características do modelo atômico atual.
4) Quantos prótons, nêutrons e elétrons há em um átomo de
64Zn?
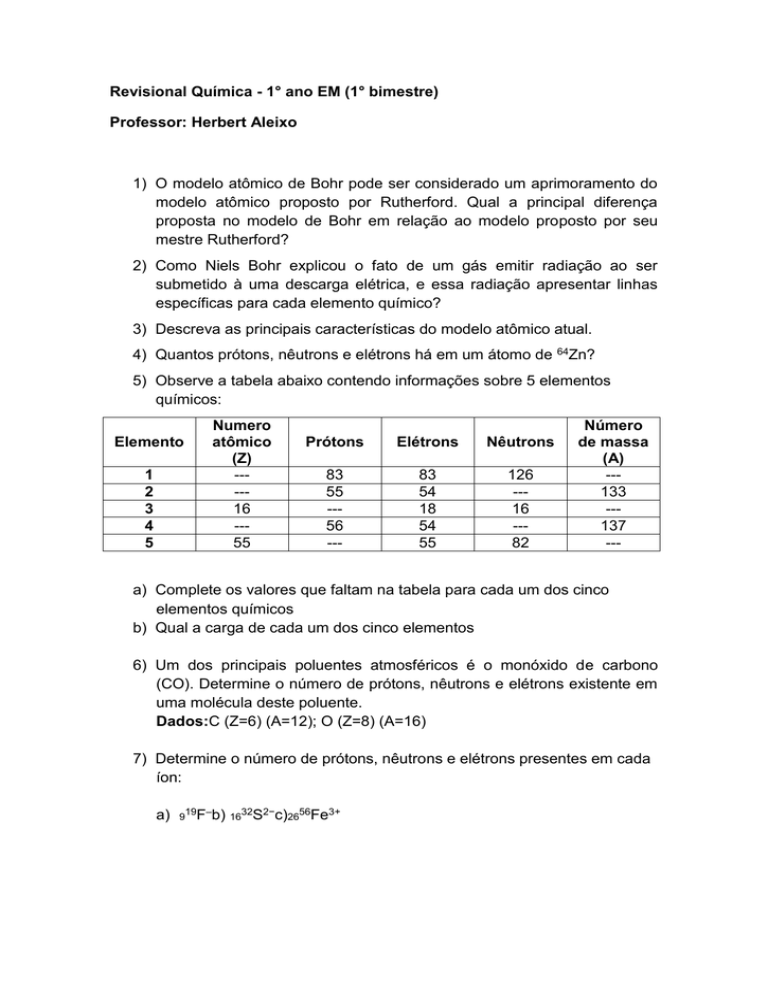
5) Observe a tabela abaixo contendo informações sobre 5 elementos
químicos:
Elemento
1
2
3
4
5
Numero
atômico
(Z)
----16
--55
Prótons
Elétrons
Nêutrons
83
55
--56
---
83
54
18
54
55
126
--16
--82
Número
de massa
(A)
--133
--137
---
a) Complete os valores que faltam na tabela para cada um dos cinco
elementos químicos
b) Qual a carga de cada um dos cinco elementos
6) Um dos principais poluentes atmosféricos é o monóxido de carbono
(CO). Determine o número de prótons, nêutrons e elétrons existente em
uma molécula deste poluente.
Dados:C (Z=6) (A=12); O (Z=8) (A=16)
7) Determine o número de prótons, nêutrons e elétrons presentes em cada
íon:
a)
19 –
32 2−
56
3+
9 F b) 16 S c)26 Fe
8) Os átomosM e
características:
N
são
isóbaros
e
apresentam
as
seguintes
Determine os números atômicos e os números de massa de M e N.
9) Faça a distribuição eletrônica em subníveis de energia para os seguintes
átomos em seus estados fundamentais:
a) 18Arb) 78Au
10)Faça a distribuição eletrônica dos íons a seguir:
a) 35Br− b)40Zr4+ c) 6C4−
11)Um elemento químico tem o orbital 3d5 como subnível mais energético.
Qual é esse elemento químico? (faça a distribuição eletrônica deste
elemento no seu estado fundamental)
12)A configuração eletrônica da camada de valência de um cátion X2+de
um determinado elemento químico é dada por 3s2 3p6 3d10. Determine o
número atômico e o nome deste elemento químico.
13)Determine os números quânticos do último elétron do subnivel mais
energético para os seguintes casos:
a) Sc (Z=21) b) Fe2+ (Z=26) c) Cl− (Z=17)
14)(UFPR) O último elétron de um átomo neutro apresenta o seguinte
conjunto de números quânticos n = 4; l = 1; m = 0; s= + 1/2.
Convencionando que o primeiro elétron a ocupar um orbital possui
número quântico de spin igual a – 1/2 calcule o número atômico desse
átomo.
15)Um determinado elemento químico possui apenas 4 camadas
eletrônicas e três elétrons desemparelhados na camada de valência.
Determine o número quântico deste elemento químico.












