Mestrado em História e Filosofia das Ciências
Filosofia das Ciências da Natureza
A Termodinâmica de Estruturas Emergentes
Fernando M.S. Silva Fernandes
Email: [email protected]
http://elixir.dqb.fc.ul.pt/~fsilva/home
Centro de Ciências Moleculares e Materiais (CCMM)
Departamento de Química e Bioquímica
Faculdade de Ciências, Universidade de Lisboa
Resumo
Considerando a diversa formação dos mestrandos, o tema será tratado de forma
mais qualitativa. Embora haja quantificações, não se ultrapassa as operações
aritméticas elementares, a função logaritmo e o conceito intuitivo de probabilidade.
Após uma breve introdução histórica, abordam-se conceitos fundamentais (energia,
temperatura, entropia, etc.) a par das leis da Termodinâmica.
Destaca-se a energética do metabolismo (de glúcidos, lípidos e proteínas) versus o
crescimento da população mundial. Mostra-se que estruturas químicas emergentes,
por exemplo as que suportam a Vida (estruturas dissipativas), são condicionadas
pela 2ª lei da Temodinâmica. E que os respectivos processos podem
ser compreendidos através de modelos simples, como os da máquina de Carnot e
células de combustível.
Finalmente, aborda-se a origem do Universo e da Vida sob um ponto de vista
filosófico-científico.
Bibliografia:
"Order and Chaos. Laws of Energy and Entropy", S. A. Angrist; L.G. Hepler, Penguin
Books, 1973.
"The 2nd Law. Energy, Chaos and Form", P.W. Atkins, Freeman and Company,
1994.
"The Grand Design", S. Hawking; L. Mlodinow, Bantam Press, 2010.
População mundial
Filosofia da Ciência
•
•
•
•
•
•
•
•
Em última instância, questionar a essência das coisas, processos e ideias
(modelos, teorias...)
Conhecimento básico dos assuntos, através de modelos simples
Um modelo simples é uma construção mental que capte a essência, não as
tecnicalidades
Os modelos simples podem definir classes de universalidade: aspectos
aparentemente diferentes unificados como manifestações de princípios
fundamentais e abrangentes
A Termodinâmica trata das conversões e transferências de energia
Tem implicações profundas na emergência de estruturas complexas como
as que suportam a Vida, e em aplicações industriais variadas
E, também, na evolução das visões sócio-económicas ao longo dos
séculos
Um modelo simples da Termodinâmica é a máquina a vapor de Carnot
Aeolipile, Hero de Alexandria (século 1, AD)
Máquinas a Vapor (Revolução Industrial)
Máquinas a vapor
Componentes de máquinas a vapor
•
•
Um dos grandes impulsionadores da revolução industrial em Inglaterra, através da
máquina a vapor: James Watt (1736 – 1819)
O proponente da unidade de potência cavalo-vapor (horsepower, hp)
Potência - Cavalo
•
•
1 foot = 12 inches = 30,48 cm; 1 lb (pound) = 0,454 kg; 1 horsepower = 750 W
“Had James Watt been more scientist and less salesman, he might have chosen a
laboratory animal such as the guinea-pig for his standard. Then advertisements for
today´s automobiles might have been able to go to superlatives with statements like:
1.272.000 pigpower to keep you cruising at turnpike speeds all day!
(without even a hint of odour)
História da Termodinâmica (séculos 18 e 19)
Antoine Lavoisier 1743 -1794
Sadi Carnot 1796 - 1832
Benjamim Thompson (Count Rumford) 1753 - 1814
Sadi Carnot
(citação de P. Atkins)
•
•
•
•
•
•
One cause of France’s defeat had been her industrial inferiority
The contrast between France’s and England’s use of steam epitomized the
difference
Sadi Carnot saw that taking away England’s steam engine would remove
the heart of her military power:
Gone would be her coal, for the mines would no longer be pumped
Gone would be her iron, for with wood in short supply, coal was essential to
ironmaking
Gone, then, would be her armaments
História da Termodinâmica (séculos 18 e 19)
Émile Clapeyron 1799 - 1864
Hermann von Helmholtz 1821 - 1894
Julius Mayer 1814 - 1878
James Joule 1818-1889
Julius Mayer (médico do barco Java, através dos trópicos)
Hemoglobina
História da Termodinâmica (séculos 19 e 20)
Rudolf Clausius 1822 - 1888
Ludwig Boltzmann 1844 - 1906
William Thomson (Lord Kelvin) 1824 - 1907
Josiah Gibbs 1839 - 1903
Máquina e ciclo de Carnot
A ausência de uma fonte fria
impossibilita a obtenção de
trabalho útil
A dissimetria
•
•
•
•
•
O calor não pode ser completamente convertido em trabalho numa
máquina cíclica: alguma quantidade tem de fluir para uma fonte fria
A Natureza aceita a equivalência entre calor e trabalho, mas exige
uma contribuição quando o calor é convertido em trabalho
A Natureza não taxa a conversão de trabalho em calor: podemos
desperdiçar completamente qualquer trabalho em calor por fricção,
p.ex.
É somente o calor que não pode ser completamente convertido em
trabalho
Eis a dissimetria: o calor é taxado; o trabalho não
Sejamos rigorosos
•
•
•
•
•
•
•
Calor e trabalho designam métodos, não designam coisas
Não pode engarrafar-se calor e derramá-lo de um objecto para outro. O
mesmo quanto ao trabalho
Ambos os termos identificam modos de tranferência de energia
Aquecer um objecto significa tranferir energia para ele por um modo
especial: usando a diferença de temperaturas entre uma fonte quente e o
objecto. Arrefecer um objecto significa transferir energia do objecto, sob a
influência da diferença de temperaturas entre ele e uma fonte fria
O calor não é uma forma de energia: é o nome de um método para
transferir energia
Trabalho é o que se faz quando se quer alterar a energia dum objecto por
um processo que não envolve diferença de temperaturas: levantar um peso
do chão altera a sua energia e implica trabalho
Tal como o calor, trabalho não é uma forma de energia: é o nome de um
método para tranferir energia
Relaxemos a linguagem
•
•
•
•
•
“Calor foi convertido em trabalho”, é uma expressão usual
Rigorosamente, dever-se-ia dizer: “energia foi tranferida duma fonte
por aquecimento e, então, transferida realizando trabalho”
Tal conduz a uma verbosidade por vezes massiva!
Assim, falando sobre calor e trabalho usaremos uma linguagem
mais “relaxada”. Utilizaremos expressões como “calor flui para um
sistema”
No entanto, sempre que o fizermos, juntaremos um “sussuro”: “mas
nós sabemos o que isso realmente significa”!
Equivalência entre trabalho e calor (Joule)
•
•
•
•
•
Trabalho converte-se em calor
Como métodos de transferência de energia são equivalentes
Assim, exprimem-se nas mesmas unidades da energia: caloria,
quilocaloria, Joule, quiloJoule...
1 J = 4,184 cal
Veremos as características particulares do calor e trabalho sob o ponto de
vista molecular
Enunciados da 2ª Lei da Termodinâmica
•
Kelvin: um processo cíclico
cujo único resultado seja a
absorção de calor de um
reservatório e a sua conversão
completa em trabalho útil, é
impossível
•
Clausius: um processo cíclico
cujo único resultado seja a
transferência de calor de uma
fonte fria para uma fonte
quente, é impossível
Equivalência dos enunciados de Kelvin e de Clausius
•
•
•
A falsidade do enunciado de Kelvin implica a falsidade do enunciado de
Clausius
A falsidade do enunciado de Clausius implica a falsidade do enunciado de
Kelvin
Conclusão: os dois enunciados são equivalentes
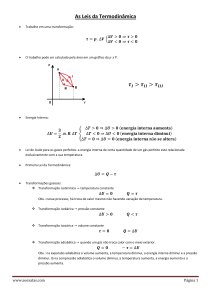
1ª lei da Termodinâmica
•
•
•
•
•
1ª lei: a energia total do universo é constante
O universo é a união do sistema e da vizinhança
De acordo com a lei os processos A→B→C→D são possíveis
Os processos A→E e A→F são impossíveis
A energia do universo surge assim como uma propriedade indicadora da
possibilidade ou impossibilidade de processos (transformações,
reacções...)
Máquina perpétua de 1ª espécie: um sonho impossível
•
•
•
•
O fluxo da água na base do tanque movimenta a roda
A roda moe o trigo e opera uma bomba para que a água retorne ao tanque
Infelizmente a bomba nunca pode retornar suficiente água de modo a que o
moinho opere perpetuamente sem interferência externa
De contrário a 1ª lei seria violada, pois parte da energia é sempre
consumida na moagem do trigo.
2ª lei da Termodinâmica em acção
•
•
•
•
De início o sistema está a temperatura mais alta do que a vizinhança
Energia é transferida espontaneamente do sistema para a vizinhança até
que se atinja o equilíbrio térmico (steady state) onde as temperaturas do
sistema e vizinhança se igualam. A 1ª lei não é violada
A temperatura surge assim como uma propriedade indicadora do equilíbrio
térmico (lei zero da Termodinâmica)
O processo inverso não é espontâneo, embora seja possível
Entropia: uma propriedade indicadora de
espontaneidade
•
•
•
•
•
Se a entropia dum estado B do universo for maior do que a dum estado A, então o
estado B pode ser atingido, espontaneamente, a partir do estado A
A entropia aumenta quando um sistema é aquecido e diminuí quando o sistema é
arrefecido. Mantem-se invariável quando é realizado trabalho.
Quanto maior for a temperatura à qual o calor entra num sistema menor será a sua
variação de entropia
Variação de entropia (dS) = Calor transferido (dQ) / Temperatura (T)
dS(univ.) = dS (sist.) + dS (viz.) ; dQ > 0 – calor entra; dQ < 0 – calor sai
A→B e A→C, são processos espontâneos
A→D não é espontâneo
Unificação dos enunciados de Kelvin e de Clausius
•
•
•
Ambos os processos, anti-Kelvin e anti-Clausius, implicam uma diminuição
da entropia do universo. Portanto, não são espontâneos, são anti-naturais.
Para a produção de trabalho útil requerem-se sempre processos
naturalmente espontâneos
2ª Lei da Termodinâmica: processos naturais (espontâneos)
aumentam a entropia do universo
O Inevitável
Algum calor obtido da fonte quente tem sempre de ser transferido para a fonte
fria de modo a nela gerar suficiente entropia que compense a diminuição de
entropia da fonte quente, aumentando assim a entropia do universo.
Ou seja, num processo natural há sempre degradação de energia!
Degradação
•
•
•
•
A energia transferida para a fonte fria só estará disponível para produzir trabalho se
tivermos uma outra fonte ainda mais fria
Assim, a energia armazenada a altas temperaturas tem uma “qualidade” melhor:
energia de alta qualidade está disponível para produzir trabalho; energia de baixa
qualidade (energia degradada ou corrompida) está menos disponível
A entropia identifica a maneira como a energia está armazenada: se a alta
temperatura, a variação de entropia associada a qualquer transferência por calor é
relativamente pequena e a energia tem qualidade elevada; se a mesma quantidade
de energia está armazenada a baixa temperatura, a variação de entropia associada
a qualquer tranferência por calor é relativamente alta e a sua qualidade é
relativamente baixa
Como o aumento de entropia do universo é o indicador de processos naturais
(espontâneos) que correspondem à energia ser armazenada a cada vez mais baixas
temperaturas, então: a direcção de processos naturais é a de causar um declínio da
qualidade da energia, ou seja, os processos espontâneos da Natureza levam à
degradação (corrupção) da qualidade da energia
Um alerta
•
•
•
•
•
•
•
A 1ª lei estabelece que a energia do universo é constante. Quando se queimam
combustíveis fósseis (carvão, petróleo, núcleos atómicos...) não se diminui a
quantidade de energia. Assim, nunca poderá haver uma crise de energia, pois a
energia do universo é sempre constante. Contudo, cada queima espontânea
aumenta a entropia do universo, ou seja, diminui a qualidade da sua energia
A sociedade tecnológica queima cada vez com maior intensidade os seus recursos,
aumentando inexoravelmente a entropia do universo e a degradação do seu
conteúdo energético
Não estamos no meio duma crise energética, mas no patamar duma crise entrópica
A civilização moderna vive da degradação dos armazéns de energia do universo
Não é necessário conservar energia pois a Natureza fá-lo automaticamente. O que
urge é cuidar da sua qualidade
Temos de encontrar meios de projectar e manter a civilização com menores
produções de entropia
A conservação da qualidade da energia é a essência do problema e o nosso
dever para o presente e futuro
Eficiência
•
•
•
•
•
•
•
•
•
O valor mínimo de calor transferido para a fonte fria tem de ser sempre o suficiente
para aumentar a sua entropia de modo a pelo menos igualar a diminuição de
entropia da fonte quente
dS (f.q.) = -dQ(f.q.) / T(f.q.)
dS (f.f.) = +dQ(f.f.) / T(f.f.)
Calor mínimo para a fonte fria = Calor da fonte quente x [ T(f.f.) / T(f.q.) ]
Calor da f.q. – Calor mínimo para a f.f. = Trabalho máximo
Eficiência = Trabalho máximo/Calor da f.q. = 1 – [ T(f.f.) / T(f.q.) ]
A eficiência é independente da substância operacional utilizada na máquina, apenas
depende das temperaturas das fontes
Atenção: as temperaturas consideradas são expressas em graus Kelvin
(temperaturas absolutas); T (K) = t (ºC) + 273,15
Quanto maior a T(f.q.) e menor a T(f.f.) maior será a eficiência a qual, contudo, não
pode ser > 1, pois então a 1ª lei seria violada. Assim, T < 0 K não é admissível
No entanto, se T(f.f.) = 0 K a eficiência é 1. Será possível atingir o zero absoluto?
3ª lei da Termodinâmica
•
•
•
•
Descendo sucessivamente a temperatura da fonte fria numa máquina de
Carnot aumentaria, certamente, a sua eficiência
Contudo, para obter todo o trabalho útil implicaria máquinas cada vez
maiores
O zero absoluto exigiria uma máquina de dimensões infinitas!
3ª lei da Termodinâmica: o zero absoluto é inatingível num número
finito de passos
Átomos, moléculas e iões em ação
•
•
•
•
•
•
•
A matéria é constituída por átomos, moléculas e iões em constante movimento e
interação
Dum modo geral, designamos esses constituintes por partículas
A energia das partículas é, essencilamente, de dois tipos: cinética e potencial
A energia cinética corresponde ao movimento: quanto maior a rapidez do movimento
maior será a energia cinética
A energia potencial está relacionada com as localizações espaciais. Uma partícula
no campo gravitacional da Terra tem energia potencial que depende da altura
(distância da partícula à Terra) a que se encontra: quanto maior a altura maior será a
energia potencial. Tal como a energia potencial de duas partículas depende da
distância entre elas.
Qualquer sistema macroscópico tem um nº de partículas da ordem de 1023 (nº de
Avogadro)
A energia total dum sistema termodinâmico, tal como os nºs de Avogadro de
moléculas de água num copo, é a soma das energias cinéticas e energias potenciais
de todas as partículas
Conservação de energia
•
•
•
A soma das energias cinéticas e potencial dum sistema isolado (i.e.não
sujeito a interferências externas) é constante (1ª lei)
Por exemplo, num pêndulo: no máximo de amplitude a energia potencial da
partícula é máxima e a energia cinética é mínima; no mínimo de amplitude
a energia cinética é máxima e a energia potencial é mínima
No entanto, ao longo do movimento, a soma das duas energias tem sempre
o mesmo valor: energia cinética converte-se em energia potencial e viceversa
Modos de movimento: coerente e incoerente
•
•
•
Numa bola de ténis a mover-se como um todo, as moléculas têm
movimentos coerentes: todas no mesmo sentido e direção
Numa bola parada a temperatura finita, as moléculas têm movimentos
incoerentes (caóticos): diferentes sentidos e direções; movimentos témicos
Assim, uma bola a temperatura finita que se mova como um todo possui
simultaneamente movimentos moleculares corentes e incoerentes
Calor e trabalho em termos moleculares
•
•
O trabalho estimula movimentos moleculares coerentes
O calor estimula movimentos moleculares incoerentes
Trabalho e Calor
Trabalho: transferência de energia
através de movimentos organizados.
Calor: transferência de energia através
de movimentos desorganizados
(caóticos), i.e. movimentos térmicos.
Um modelo do universo
1600 partículas
Temperatura
•
•
•
•
•
As partículas têm energia ɛ (Non) ou energia 0 (Noff)
Temperatura = A(ɛ) / ln (Noff / Non)
Sistema: Noff = 60; Non= 40, donde T = 2,47 supondo A(ɛ) = 1
Vizinhança: Noff = 1500; Non = 0, donde T = 0
Este é um estado inicial do universo-modelo
Evolução espontânea para o equilíbrio térmico
(a)
•
•
•
•
(b)
Em (a) : Tsist = 0,72 ; Tviz = 0,23
Em (b) : Tsist = 0,27 ; Tviz = 0,27
No estado final as temperaturas são iguais, ou seja, atinge-se o
espontaneamente o equilíbrio térmico
Note-se que a energia da vizinhança é muito superior à energia do sistema
Flutuações: simulação computacional
•
•
•
•
Verde: flutuações da temperatura do sistema (100 átomos)
Amarelo: flutuações da tempertura da vizinhança (1500 átomos)
As duas temperaturas flutuam em torno do mesmo valor médio
Em sistemas com nºs de Avogadro de átomos as flutuações serão insignificantes
Processos Espontâneos são Irreversíveis
Transformações Espontâneas
Entropia, dispersão, caos, degradação
Os processos espontâneos aumentam a entropia do universo. Nos estados finais,
embora a energia do universo não tenha variado (é uma constante, 1ª lei) a energia
encontra-se mais dispersa (caótica, degradada) do que nos estados iniciais.
Probabilidade dos estados finais >>>> Probabilidade dos estados iniciais
Calores de Combustão e Metabolismo
Ciclos alimentares
300 trutas são necessárias para manter 1 homem durante 1 ano
1 truta deve consumir 90.000 rãs, as quais devem consumir 27
milhões de gafanhotos que se sustentam de 1.000 toneladas de
erva.
Metabolismo basal
Taxa de consumo energético dum ser que não tenha comido recentemente,
em repouso e acordado, num ambiente ameno. Num adulto: ~1.000 kcal/dia.
Homem médio e saudável: ~75.000 kcal armazenadas
Considerando os ciclos alimentares, energia proveniente do Sol, etc, estimase o máximo sustentável da população mundial : 15-30 biliões
População mundial
Aminoácidos e Proteínas
Hemoglobina
Acoplamento
(a)
(b)
O acoplamento (b) permite naturalmente a inversão da direcção
espontânea de um dos processos quando não acoplado (a)
Síntese de Proteínas
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O, espontânea
ADP → ATP, não-espontânea, induzida pela oxidação da glicose
ATP → ADP, espontânea
Aminoácidos → Proteínas, não-espontânea, induzida pela decomposição do ATP
Estruturas do ATP e ADP
em formas ionizadas
Célula Animal
Mais estruturas dissipativas
Ilya Prigogine, 1917-2003
Reacção de Belousov-Zhabotinsky (BZ)
Poesia e Literatura
Demónio de Maxwell
Negentropia em acção: paga-se!
Questões!!!
•
O nosso conhecimento presente da física e da química é
praticamente completo, e os seus conceitos permitem-nos explicar
a Vida sem a intervenção de qualquer “life principle”.
• Consideramos que a Vida obedece a todas as leis da física e da
química, mas sentimos que é necessária “qualquer coisa” mais
antes que possamos compreender plenamente a Vida.
• Os organismos vivos comportam-se de modo completamente
diferente da matéria inerte. O seu comportamento não pode ser
compreendido sem referência a um “life principle”. A Vida é uma
excepção à 2ª lei da Termodinâmica e o novo princípio terá de
explicar fenómenos que são contrários à 2ª lei.