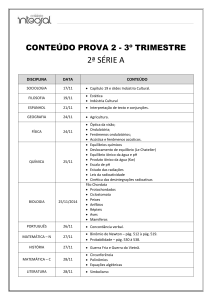
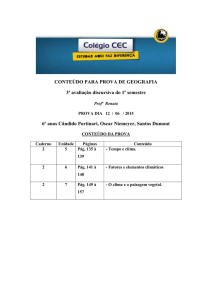
COLÉGIO XIX DE MARÇO
Educação do jeito que deve ser
2016
2ª PROVA PARCIAL DE QUÍMICA
Aluno(a):
Ano:
Nº
1º
Turma:
Data: 23.06.2016
Professor(a): Paulo Fernando
Nota:
Valor da Prova:
40 pontos
Orientações gerais:
1) Número de questões desta prova:15
2) Valor das questões: Abertas (5): 4 pontos cada. Fechadas (10): 2 pontos cada.
3) Provas feitas a lápis ou com uso de corretivo não têm direito à revisão.
4) Aluno que usar de meio ilícito na realização desta prova terá nota zerada e conceituação
comprometida.
5) Tópicos desta prova: Oxidação e redução. Balanceamento. Ácidos nomenclatura.
Ligações químicas. Tamanho e raio dos átomos. Isótopos, isóbaros e isótonos.
1ª Questão: a) Dê o conceito de oxidação.
b) Dê o conceito de redução.
c) Dê a definição de nox.
2ª Questão: Quando limpamos um objeto de prata, estamos removendo Ag 2S. Assim, estamos
tirando prata do objeto. Com o passar do tempo, após sucessivas limpezas, pouca prata restará no
objeto. No comercial de TV do produto TARN-X, o locutor informava que TARN-X limpa sem tirar a
prata. É possível?
É possível! Um dos meios (diferente do TARN-X) consiste em envolver o objeto em folha de alumínio,
mergulhando-o, em seguida, em solução diluída de NaHCO3 (bicarbonato de sódio), e aquecendo-o
ligeiramente. Como o alumínio sofre oxidação mais facilmente que a prata, o Al é oxidado, enquanto
os íons Ag+ são reduzidos a prata metálica.
Al +
Ag2S →
Al2S3 + Ag
O redutor é:
a) Al
b) Ag2S
c) S2d) Ag
e) Al3+
2ª PP de Química/ 1º Ano / Paulo Fernando/ Pág. 1
3ª Questão: Em um exemplar do jornal Folha de São Paulo, encontra-se um artigo sobre trabalhos
de Louis Ignarro, Prêmio Nobel de Medicina de 1998. Na abertura desse artigo, o articulista diz que o
óxido nítrico, substância cujo uso medicinal deu origem ao viagra (medicamento contra impotência),
poderá gerar outros filhos: remédio contra a arteriosclerose (endurecimento das artérias) e
hipertensão. Sabendo que o óxido nítrico, NO, pode ser obtido pela combustão da amônia (NH3),
reação que produz também água, a soma dos coeficientes estequiométricos da equação representativa
e o oxidante dessa reação estão na alternativa:
a) 4 e O2
b) 9 e NH3
c) 14 e NH3
d) 19 e O2
e) 25 e O2
4ª Questão: Representar as equações de ionização total dos ácidos em meio aquoso:
a) H2SO4
→
b) H3PO4
→
c) HNO3
→
d) HClO3
→
e) H2SO3
→
5ª Questão: As figuras abaixo representam, esquematicamente, estruturas
substâncias, à temperatura ambiente.
de diferentes
Sendo assim, as figuras I, II e III podem representar, respectivamente:
a) cloreto de sódio, dióxido de carbono e ferro.
b) cloreto de sódio, ferro e dióxido de carbono.
c) dióxido de carbono, ferro e cloreto de sódio.
d) ferro, cloreto de sódio e dióxido de carbono.
e) ferro, dióxido de carbono e cloreto de sódio.
2ª PP de Química/ 1º Ano / Paulo Fernando/ Pág. 2
6ª Questão: A história do seriado Breaking Bad gira em torno de um professor de Química do Ensino
Médio com uma esposa grávida e um filho adolescente que sofre de paralisia cerebral. Quando é
diagnosticado com câncer, ele abraça uma vida de crimes, produzindo e vendendo metanfetaminas.
Considere os elementos químicos e seus respectivos números atômicos, representados na figura:
Esses elementos podem formar o composto:
a) molecular, BaBr
b) molecular, BaBr2
c) iônico, BaBr
d) iônico, BaBr2
e) iônico, Ba2Br
7ª Questão: a) Quem é maior Na ou Na+? Dado: Na = 11
b) Qual o fator influente?
c) Quem tem maior número de elétrons?
8ª Questão:
Na tabela periódica abaixo, alguns elementos químicos foram representados
aleatoriamente por algarismos romanos.
2ª PP de Química/ 1º Ano / Paulo Fernando/ Pág. 3
A respeito de tais elementos, é correto afirmar que:
a) VI é o elemento mais eletronegativo.
b) I, II e IV são líquidos à temperatura ambiente.
c) III e VII são denominados elementos representativos.
d) VII é um halogênio e IX pertence ao grupo 15.
e) 3s23p2 é a configuração eletrônica da camada de valência de V.
9ª Questão: Nas espécies químicas Kl, Cl 2 e BrO3- , os halogênios têm, na ordem dada, números de
oxidação:
a) +1, -1 e -5
b) -1, 0 e -3
c) -1, 0 e +3
d) -1, 0 e +5
e) +1, 0 e -3
10ª Questão: a) A partir do H3PO4 (ácido fosfórico) deduzir as fórmulas dos ácidos meta e piro.
b) Dar as nomenclaturas dos ácidos:
1) HCl
…………………………………………………………….
2) H2SO3
…………………………………………………………….
3) H2SO4
…………………………………………………………….
4) HNO2
…………………………………………………………….
5) HNO3
…………………………………………………………….
11ª Questão: O elemento químico B possui 20 nêutrons, é isótopo do elemento químico A, que possui
18 prótons, e isóbaro do elemento químico C, que tem 16 nêutrons. Com base nessas informações,
pode-se afirmar que os elementos químicos A, B e C apresentam, respectivamente, números atômicos
iguais a:
a) 16, 16 e 20
b) 16, 18 e 20
c) 16, 20 e 21
d) 18, 16 e 22
e) 18, 18 e 22
12ª Questão: O hidrogênio comum (número de massa 1 e número atômico 1), o hidrogênio deutério
( número de massa 2 e número atômico 1) e o hidrogênio trítio ( número de massa 3 e número
atômico 1) são:
a) isótopos
b) isóbaros
c) isótonos
d) isômeros
e) alótropos
2ª PP de Química/ 1º Ano / Paulo Fernando/ Pág. 4
13ª Questão: A equação abaixo representa uma reação possível pelo contato, em presença de saliva,
de uma obturação de ouro e outra de prata:
Au3+ +
Ag
→
Ag+ +
Au
Nesta equação, após ajustada, a soma de todos os coeficientes (reagentes e produtos), considerando
os menores inteiros, é:
a) 4
b) 6
c) 8
d) 12
e) 16
14ª Questão: A fórmula do ácido metafosfórico é:
a) H3PO6
b) H3PO3
c) H3PO2
d) H4P2O7
e) HPO3
15ª Questão: Balancear as equações por oxi-redução:
a)
MmO2
+
b)
MnO4-
+
HCl
H+
+
→
Cl-
MnCl2
→
+
Mn2+
H2O
+
Cl2
+
Cl2 +
H2O
2ª PP de Química/ 1º Ano / Paulo Fernando/ Pág. 5