FCAV/UNESP
DISCIPLINA: Química Orgânica
ASSUNTO: Hidrocarbonetos
1
HIDROCARBONETOS
São compostos orgânicos formados exclusivamente
por átomos de carbono e de hidrogênio.
Subdivisões:
Fonte: PERUZZO, 2006.
2
HIDROCARBONETOS
Podem ser obtidos a partir da destilação fracionada do
petróleo.
Fonte: PERUZZO, 2006.
Esquema de uma torre de fracionamento
3
Gráfico do Ponto de Ebulição de Hidrocarbonetos
de Cadeia Aberta, Normal e Saturada em Função do
Número de Carbonos Presentes na Molécula
Fonte: PERUZZO, 2006.
4
FRAÇÕES TÍPICAS DO PETRÓLEO
Fonte: PERUZZO, 2006.
5
HIDROCARBONETOS
Os nomes alcanos, alcenos, alcinos, alcadienos,
ciclanos, ciclenos e aromáticos designam subgrupos
aos quais os hidrocarbonetos pertencem.
Fonte: PERUZZO, 2006.
6
HIDROCARBONETOS
Fonte: PERUZZO, 2006.
7
NOÇÕES DA NOMENCLATURA IUPAC
PARA COMPOSTOS ORGÂNICOS
A nomenclatura de compostos orgânicos segue as
regras elaboradas pela IUPAC.
IUPAC União Internacional de Química Pura e
Aplicada.
De acordo com as regras da IUPAC, o nome de um
composto orgânico é formado pela união de três
fragmentos: prefixo + infixo + sufixo.
8
NOÇÕES DA NOMENCLATURA IUPAC
PARA COMPOSTOS ORGÂNICOS
O prefixo, a parte inicial, indica o número de
átomos de carbono presentes na molécula.
Fonte: PERUZZO, 2006.
9
NOÇÕES DA NOMENCLATURA IUPAC
PARA COMPOSTOS ORGÂNICOS
O infixo indica o tipo de ligação química entre
os átomos de carbono.
Fonte: PERUZZO, 2006.
10
NOÇÕES DA NOMENCLATURA IUPAC
PARA COMPOSTOS ORGÂNICOS
O sufixo, a parte final, indica a classe funcional
do composto.
Fonte: PERUZZO, 2006.
11
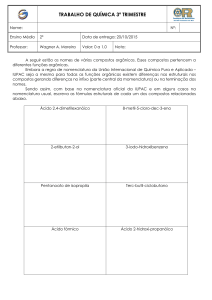
Exercício 1: dado o nome oficial dos hidrocarbonetos a seguir,
desenhe a sua fórmula estrutural.
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
etano
propano
eteno
etino
butano
pentano
propino
but-1-eno
but-2-eno
but-1-ino
but-2-ino
buta-1,2-dieno
hexa-1,3,5-trieno
ciclopropano
o) ciclobutano
p) ciclopentano
q) ciclobuteno
r) ciclopenteno
s) ciclohexa-1,3,5-trieno
t) cicloocta-1,4-dieno
12
COMPOSTOS ORGÂNICOS RAMIFICADOS
CONCEITO DE CADEIA PRINCIPAL
Nos Hidrocarbonetos: a cadeia principal é a maior
sequencia de átomos de carbono que contém as ligações
duplas e/ou triplas (se houver).
Nas demais classes de compostos orgânicos: a
cadeia principal é a maior sequencia de átomos de
carbono que contém o grupo funcional.
Os carbonos que não fazem parte da cadeia principal
pertencem às ramificações (ou grupos substituintes).
No caso de duas sequencias igualmente longas, a cadeia
principal é a mais ramificada.
13
Fonte: PERUZZO, 2006.
14
GRUPOS SUBSTITUINTES ORGÂNICOS
A expressão grupos substituintes orgânicos ou,
simplesmente grupos orgânicos é usada para
designar qualquer grupo de átomos que apareça
com frequência nas moléculas orgânicas.
Exemplos:
15
GRUPOS SUBSTITUINTES ORGÂNICOS
• Grupos importantes com três átomos de carbono:
• Grupos importantes com quatro átomos de carbono:
16
17
GRUPOS SUBSTITUINTES ORGÂNICOS
18
HIDROCARBONETOS RAMIFICADOS:
Nomenclatura
1. Localize a cadeia principal.
2. Numere os carbonos da cadeia principal. Para decidir por qual
extremidade deve começar a numeração, se baseie nos
seguintes critérios:
Se a cadeia for insaturada, comece pela extremidade que
apresente insaturação mais próxima a ela.
Se a cadeia for saturada, comece pela extremidade
que tenha uma ramificação mais próxima a ela.
19
HIDROCARBONETOS RAMIFICADOS:
Nomenclatura
3. Escreva o número de localização da ramificação e, a seguir,
separando com um hífen, o nome do grupo orgânico que
corresponde à ramificação.
4.
Finalmente, escreva o nome do hidrocarboneto
correspondente à cadeia principal, separando-o do nome
da ramificação por um hífen.
20
Exercício 2: escreva o nome oficial para cada um dos
hidrocarbonetos a seguir, nos quais a cadeia principal já está
identificada (em azul) e numerada.
a)
b)
c)
21
d)
g)
e)
f)
22
h)
i)
j)
k)
23
l)
m)
24
HIDROCARBONETOS DE CADEIA MISTA:
Nomenclatura
1. A atribuição do nome para um hidrocarboneto (HC) de cadeia
mista é similar à nomenclatura de HC de cadeia aberta
ramificada.
2. Se houver dois substituintes diferentes, estes deverão ser
citados em ordem alfabética, atribuindo-se o número 1 ao
substituinte que será citado primeiro, de acordo com a ordem
alfabética.
3. Se houver mais de dois substituintes, estes também serão
citados em ordem alfabética, atribuindo-se o número 1 ao
substituinte que permitir que um segundo substituinte receba
o menor número possível.
25
HIDROCARBONETOS DE CADEIA MISTA:
Nomenclatura
4. Para moléculas derivadas do benzeno, que apresentem
dois (e não mais que dois) substituintes ligados ao anel,
podem ser usados os prefixos orto (o), meta (m) e para (p).
orto: indica posição 1,2;
meta: indica posição 1,3;
para: indica posição 1,4.
26
HIDROCARBONETOS DE CADEIA MISTA:
Nomenclatura
5. No naftaleno é comum indicar a posição do substituinte pelas
letras gregas e . Entretanto, a nomenclatura IUPAC, que
considera a numeração estabelecida a seguir, pode ser usada
mesmo quando houver mais de um substituinte no naftaleno.
27
Exercício 3: escreva o nome oficial para cada um dos
hidrocarbonetos a seguir.
a)
d)
b)
e)
c)
f)
28
g)
i)
h)
j)
29
k)
l)
m)
n)
q)
o)
r)
p)
30
s)
u)
t)
v)
31
Exercício 4: a) quais compostos apresentados no exercício 1 são
isômeros constitucionais ou planos? Justifique a sua reposta. b)
Indique quais moléculas do exercício 3 são isômeros planos ou
constitucionais.
32
CONFORMAÇÕES DE ALCANOS
Conformações: diferentes arranjos espaciais dos
átomos, resultantes da rotação em torno de uma
ligação simples.
Uma
conformação
confórmero.
específica
é
denominada
Fonte: KOTZ, 2005.
33
CONFORMAÇÕES DO ETANO
EXEMPLO: rotação de 60o em torno da ligação C – C,
fixando-se o carbono 2.
Fonte: BARBOSA, 2004.
34
CONFORMAÇÕES DO ETANO
CONFORMAÇÃO
EM OPOSIÇÃO
CONFORMAÇÃO
ECLIPSADA
Fonte: BARBOSA, 2004.35
CONFORMAÇÕES DO ETANO
A conformação eclipsada é a conformação menos
estável, por que em nenhuma outra conformação as
ligações C – H estão tão próximas.
Na conformação eclipsada a repulsão entre os
elétrons das ligações C – H e também entre os
átomos de H é maior.
36
CONFORMAÇÕES DO CICLOEXANO
As duas conformações preferenciais adotadas pelo
cicloexano são denominadas cadeira e bote.
Essas formas podem se interconverter.
Forma cadeira: é a mais estável, pois permite
que os átomos de hidrogênio, apresentem a maior
separação possível.
37
CONFORMAÇÕES DO CICLOHEXANO
Fonte: BARBOSA, 2004.
38
CONFORMAÇÕES DO CICLOEXANO
Fonte: BARBOSA, 2004.
39
RESSONÂNCIA
Ocorre quando uma molécula pode ser representada
por duas ou mais estruturas que diferem apenas no
arranjo dos elétrons.
A molécula não é satisfatoriamente representada pelas
estruturas isoladamente, ou seja, a molécula é um
híbrido de suas estruturas de ressonância.
EXEMPLO: BENZENO
40
Devido à ressonância, não existem
ligações simples e duplas no
benzeno.
No benzeno as ligações C – C têm
caráter intermediário entre simples
e dupla.
As
informações
acima
são
confirmadas por experiências que
mostram que a distância das
ligações C – C no benzeno é
intermediária entre a das ligações
simples e a das duplas ligações.
Fonte: PERUZZO, 2006.
41
Fonte: PERUZZO, 2006.
42
Fonte: PERUZZO, 2006.
43
Estruturas de Lewis para o íon acetato
44
FORÇAS INTERMOLECULARES EM HC
E SUAS PROPRIEDADES FÍSICAS
De modo geral, compostos e grupos que possuem
apenas carbono, hidrogênio e halogênios, são pouco
polares.
Grupos como: -OH, -NH2, -COOH e –COO- quando
presentes
nas
moléculas,
conferem-lhes
características polares.
Nos estados condensados, moléculas apolares se
mantém unidas por Forças de London ou dipolo
instantâneo-dipolo induzido.
45
Interações Dipolo Instantâneo-Dipolo Induzido
46
FORÇAS INTERMOLECULARES EM HC
E SUAS PROPRIEDADES FÍSICAS
As temperaturas de fusão e ebulição dos hidrocarbonetos
normalmente se elevam com aumento da superfície de
contato entre as moléculas.
Fonte: BARBOSA, 2004.
47
FORÇAS INTERMOLECULARES EM HC
E SUAS PROPRIEDADES FÍSICAS
Fonte: BARBOSA, 2004.
48
FORÇAS INTERMOLECULARES EM HC
E SUAS PROPRIEDADES FÍSICAS
Alcanos: pouco polares. São totalmente insolúveis
em água e solúveis em solventes pouco polares
como por exemplo, éter dietílico, clorofórmio,
benzeno e tolueno.
Alcenos e alcinos, também são pouco polares e
em função disso insolúveis em água e solúveis em
solventes pouco polares.
49