Grupo do Nitrogênio
Shriver Cap. 11
p. 405-422
Lee Cap. 14
p. 236-266
Russel v2 Cap. 21
p. 1090-1091
1077-1078
Brown Cap. 22
p. 827-837
Kotz Cap. 21
p. 282-287
Atkins & Jones
Cap. 14
p. 665-673
2
1
CONFIGURAÇÃO E POSIÇÃO NA TABELA
TODOS ELEMENTOS DO GRUPO 15/ VA
[GÁS NOBRE] ns2 np3
Grupo do nitrogênio 15/VA
Nitrogênio e Fósforo são não metal;
Arsênio e Antimônio são semi-condutores;
Bismuto é metal.
Os estados de oxidação variam desde -3 a +5
Os elementos do grupo do nitrogênio são
importantes para a vida, geologia e indústria. O
nitrogênio é único da família no estado gasoso
forma diatômica e ocupa o 2º lugar no ranking
dos produtos químicos mais produzidos no
mundo.
2
Grupo do nitrogênio 15/IVA
Nitrogênio, Fósforo, Arsênio,
Antimônio, Bismuto
Propriedades físicas (fonte: Lee)
Propriedade
N
P
AS
Sb
Bi
N° Atômico
7
15
33
51
4p3
5s2 5p3
80
614 (sub.)
631
83
[Xe] 4f14
5d10 6s2
6p3
271
-196
277
-
1750
1564
1402
2856
4578
7475
9445
1012
1907
2914
4914
6274
830
1595
2440
4260
5400
703,3
1610
2466
4370
5400
Propriedades
Não metal
Não metal
947
1798
2745
4837
6043
Semicondutor
Metal
Metal
Fonte natural
Ar
atmosférico
Configuração
eletrônica
[He]
2s2 2p3
[Ne]
3s2 3p3
P. Fusão (°C)
-210
P. Ebulição (°C)
1° EI1
2° EI2
3° EI3
4° EI4
5° EI4
KJ/mol
KJ/mol
KJ/mol
KJ/mol
KJ/mol
Hidroxiapatita
Ca5(PO4)3
[Ar]3d10
4s2
[Kr]4d10
Arsenopirita
Estibina
FeAsS
Sb2S3
Bismutinita
Bi2S3
3
Nitrogênio
GRUPO 15/ VA
Número atômico = 7
1s2 2s2 2p3 5 elétrons
[He] 2s2 2p3
Nitrogênio
Daniel Rutherford em 1772, descobriu o nitrogênio , com
experimentos envolvendo ratos, percebia-se que os ratos
morriam em uma jarra fechada após consumir todo
oxigênio, logo o “ar nocivo” remanescente era o nitrogênio.
O nitrogênio é encontrado na atmosfera em mais de 78% e na crosta terrestre na
forma de sais como o nitrato de potássio, KNO3 (salitre da Índia) e nitrato de
sódio, NaNO3 (salitre do Chile).
4
Composição do ar atmosférico.
Abundância dos elementos na crosta terrestre.
Nitrogênio
Propriedades do nitrogênio:
Fórmula N2;
Gás incolor;
Inodoro;
Sem sabor;
Ponto de ebulição: -196ºC
Estado de oxidação
Exemplos
+5
N2O5, HNO3, NO3-
+4
NO2, N2O4
+3
HNO2, NO2-, NF3
+2
NO
+1
N2O, H2N2O2, N2O2-2, HNF2
0
N2
-1
NH2OH, NH2F
-2
N2F4
-3
NH3, NH4+, NH2-
5
Nitrogênio
Propriedades do nitrogênio:
N2 é pouco reativa devido a forte ligação
tripla N≡N, 941kJ/mol. Quando as
substâncias se queimam ao ar, normalmente
reagem com O2, mas não reagem com N2.
Entretanto, quando magnésio queima ao ar,
forma-se o nitreto de magnésio (Mg3N2).
3 Mg (s) + N2 (g) Mg3N2 (s)
O nitreto de magnésio (Mg3N2) é uma base de Bronsted forte, reage
com água para formar amônia.
Mg3N2 (s) + 6 H2O (l) 2 NH3 (aq) + 3 Mg(OH)2 (s)
Nitrogênio
Preparação e utilização do nitrogênio
O gás nitrogênio é obtido pela destilação
fracionada do ar líquido, estima-se que
sejam produzidos 36 milhões de
toneladas/ano nos EUA.
A baixa reatividade do N2, permite usálo no embalo de alimentos, fabricação de
metais e dispositivos eletrônicos.
O principal uso é na fabricação de
fertilizantes, a partir de amônia.
6
Destilação fracionada de ar
Nitrogênio
Compostos de nitrogênio com hidrogênio
No laboratório amônia, NH3 pode ser preparado pela
ação de NaOH com um sal de amônio.
NH4Cl (aq) + NaOH (aq) NH3 (g) + H2O (l) + NaCl (aq)
A produção comercial de NH3 é realizada pelo processo Haber
N2 (g) + 3 H2 (g) 2 NH3 (g)
Aproximadamente são produzidos 16 milhões de
toneladas de amônia e 75% é usado na preparação de
fertilizantes.
7
PROCESSO HABER
N2 + 3 H2 2 NH3
Fritz Haber
1868-1934
Nitrogênio
Compostos de nitrogênio com hidrogênio
Hidrazina, N2H4 apresenta ligação N-N, o qual é instável, logo o
composto e empregado como combustível de foguetes. A síntese pode
ser feita a partir de hipoclorito e amônia.
2 NH3 (aq) + OCl -(aq) N2H4 (aq) + Cl -(aq) + H2O(l)
A reação é complexa, envolvendo a formação de
cloroamina (NH2Cl) que é muito tóxico. Por isso
que há advertência na embalagem de alvejantes
para não serem misturados com produtos com
amônia.
8
pKa = 10,72
pKa = 10,64
pKa = 9,7
pKa = 9,26
(CH3)2NH > CH3NH2 > (CH3)3N > NH3
Compostos de nitrogênio com hidrogênio
9
Óxidos e oxiácidos de nitrogênio
Óxido nitroso (N2O): é um gás incolor e conhecido
como gás hilariante, o qual foi usado no passado como
anestésico.
NH4NO3 (s) N2O (g) + H2O(g)
Óxido nítrico (NO): é um gás incolor e tóxico, sendo
preparado pela redução do ácido nítrico com Cu ou Fe.
8HNO3 + 3Cu → 3Cu(NO3)2 + 4H2O + 2NO
4NH3 + 5O2 → 4NO + 6H2O
Dióxido nitroso (NO2): é um gás marrom-amarelado, tóxico e sufocante.
2 HNO3 → N2O5 + H2O
2 N2O5 → 4 NO2 + O2
2 NO + O2 → 2 NO2
2 NO2 N2O4
10
Ácido nítrico
4HNO3 → 2H2O + 4NO2 + O2 (72°C)
HNO3 + H2O → H3O+ + NO3C + 4HNO3 → CO2 + 4NO2 + 2H2O
Mg(s) + 2HNO3 (aq) → Mg(NO3)2 (aq) + H2 (g)
TNT: 2 C7H8 + 3 HNO3 → C7H5N3O6 + 3 H2O
TNG: C3H5(OH)3 → 4 C3H5(ONO2)3 +3 H2O
TNT: 2 C7H5N3O6 → 3 N2 + 5 H2O + 7 CO + 7 C
TNG: 4 C3H5(ONO2)3 → 12CO2 +10 H2O +5 N2 +2NO
11
Óxidos e oxiácidos do nitrogênio
Preparação:
NH4NO3(s) NO2(g) + 2H2O(g)
3Cu(g) + 2NO3-(aq) + 8H+(aq) 3Cu2+(aq) + 2NO(g) + 4H2O(l)
4 NH3(g) +5O2(g) 4NO(g) + 6H2O(g) (processo de Ostwald)
4 HNO3(aq) 4NO2(g) + O2(g) + 2H2O(l) (na presença de luz)
O processo de Ostwald é a rota comercial para o NO:
4 NH3(g) +5O2(g) 4NO(g) + 6H2O(g) (processo de Ostwald)
HNO3
Ácido Nítrico em 3 etapas:
– oxidação da NH3 por O2 para formar NO
(catalisador Pt);
– oxidação do NO por O2 para formar NO2
(o NO que não reagiu é reciclado);
– NO2 é dissolvido em água para formar ácido
nítrico.
12
PROCESSO OSTWALD: ÁCIDO NÍTRICO
NH3 é oxidada na superfície da
Pt em ar, levando a NO e NO2.
NO2 reage com água fornecendo
HNO3.
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(g)
2 NO(g) + O2(g) 2 NO2(g)
3 NO2(g) + H2O(l) 2 HNO3(aq) + NO(g)
HNO3
Cu
Al
O ácido nítrico, reage com materiais que contem proteinas semelhante a pena
mostrada na primeira figura, após a reação a pena branca torna-se amarela.
13
O nitrogênio desproporciona-se na produção de ácido nítrico:
3NO2(g) + H2O(l) 2H+(aq) + 2NO3-(aq) + NO(g)
O NO é um neurotransmissor importante (faz com que os músculos que
recobram os vasos sanguíneos relaxem).
Ácidos comuns: HNO3 (nítrico) e HNO2 (nitroso).
O ácido nítrico é um ácido forte.
O ácido nítrico concentrado oxidará a maior parte dos metais:
NO3-(aq) + 2H+(aq) + e- NO2(g) + H2O(l), E = 0,79 V
NO3-(aq) + 4H+(aq) + 3e- NO2(g) + 2H2O(l), E = 0,96 V
O ácido nítrico é usado para a fabricação de fertilizantes (NH4NO3),
remédios, plásticos e explosivos.
O ácido nitroso (fraco, Ka = 4,5 10-4) não é estável e desproporciona-se
em NO e HNO3.
Gás de cor acastanhada de
cheiro forte e irritante, muito
tóxico,
é
um
poderoso
oxidante que, nas reações na
atmosfera originando o ácido
nítrico. Causam
impacto
ambiental, como as chuvas
ácidas e a eutrofização de
lagos e rios.
14
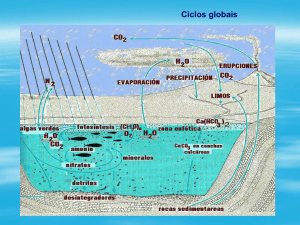
Ciclo do nitrogênio
Fixação de nitrogênio no solo através da simbiose de leguminosas e
cianobacterias, atráves da enzima nitrogenase.
15
Fósforo
Propriedades do fósforo:
Na caixa de fósforo há o trisulfeto de
tetrafósforo, P4S3. A fricção converte a
energia cinética em calor o qual se inicia
uma
reação
termodinâmicamente
exotérmica.
Fósforo
OCORRÊNCIA, ISOLAMENTO E PROPRIEDADES DO FÓSFORO
Existem dois alótropos do fósforo: vermelho e branco.
O fósforo branco é altamente reativo (reage espontaneamente com
oxigênio ao ar).
Conseqüentemente, o fósforo branco é armazenado na água.
Se o fósforo branco é aquecido à 400 C na ausência de ar, ele se
converte em fósforo vermelho.
O fósforo vermelho é o alótropo mais estável e normalmente não é
armazenado sob água.
16
Fósforo: Alotropia
17
HALETOS DE FÓSFORO
O fósforo forma variedades de tri- e pentahaletos.
O mais importante: PCl3 usado em sabão, detergente, plástico e na
produção de inseticida.
Preparação de haletos de fósforo: 2P(s) + 3Cl2(g) 2PCl3(l)
Na presença de cloro em excesso: PCl3(l) + Cl2(g) PCl5(s)
Exceção: uma vez que o F2 é um oxidante forte, obtem-se direto:
2P(s) + 5F2(g) 2PCl5(g)
Na presença de água a hidrólise ocorre facilmente:
PF3(g) + 3H2O(l) H3PO4(aq) + 3HF(aq)
PCl5(l) + 4H2O(l) H3PO4(aq) + 5HCl(aq)
18
Reações com fósforo
COMPOSTOS OXI DE FÓSFORO
O óxido de fósforo(III), P4O6 é preparado através da reação de
fósforo branco com ar, sendo o óxido de fósforo(V), P4O10 com
excesso de oxigênio.
O óxido de fósforo(V), P4O10 é também preparado através da
oxidação do P4O6.
Nos óxidos de fósforo, os átomos de P adotam a estrutra tetraédrica.
O óxido de fósforo(III), P4O6 produz ácido fosforoso, H3PO3 em
água.
O H3PO3 é um ácido diprótico fraco (o H ligado ao P não é ácido).
O óxido de fósforo(V), P4O10 produz ácido fosfórico, H3PO4.
O P4O10 é usado como um agente de secagem por causa de sua
afinidade com a água.
O ácido fosfórico é um dos ingredientes da Coca-Cola.
19
Os ácidos fosfórico e fosforoso sofrem reações de condensação.
O ácido fosfórico e seus sais são usados em detergentes (como
Na5P3O10) e fertilizantes (de rochas fosfáticas extraídas de minas).
Os compostos de fósforo são importantes em sistemas biológicos
como o trifosfato de adenosina (ATP) que armazena energia nas
células.
Produção de fósforo em forno elétrico
20
Fósforo em fertilizantes
21
Sarin é uma substância tóxica que atua essencialmente sobre o sistema
nervoso. Muito utilizada em guerra química. O sarin é um composto
organofosforado. Essa classe de compostos foi sintetizada pela primeira
vez em 1936 pelo químico Gerhard Schrader, que tentava desenvolver
pesticidas de uso agrícola. O caso mais recente de utilização de sarin foi
um atentado terrorista ao metrô de Tóquio, no Japão, em 1995. A seita
japonesa radical Verdade Suprema foi a responsável pelo atentado, que
deixou doze mortos e 5 mil feridos. Outro composto organofosforado de
efeito devastador é o tabun
22
As2S3 Sb2S3 As4S4
23
Usos do Arsênio:
Arsênio é letal, DL = 130mg.
Preservativos de árvores contra insetos.
CCA = Arsenito cromato de cobre(II) Complexo de cobre(II)
com sal quarternário de amônio.
Contaminação da água com Arsênio:
O arsênio na forma de óxidos
é conhecido como veneno. O
problema é a contaminação
do lençol freático.
24