Química Orgânica
Macromoléculas - massa superior a 1kDa
A maioria das biomoléculas contém apenas 3 a 6 elementos diferentes, no entanto, a maioria
são moléculas complexas e longas. De entre esses elementos, verifica-se que:
C, H e O estão sempre presentes;
N está presente em várias;
S e P estão presentes em algumas
Versatilidade do átomo de carbono
Estrutura tetraédrica:
As ligações simples contêm mais flexibilidade (360º) do que as ligações duplas;
As ligações triplas não são frequentes nas biomoléculas.
Hidrocarbonetos - molécula composta apenas por C e H. Podem ser:
Alcanos: compostos apenas por ligações simples;
Alcenos: possuem pelo menos uma ligação dupla entre os átomos de carbono;
Alcinos: possuem pelo menos uma ligação tripla entre os átomos de carbono;
Alifáticos: não possuem estruturas aromáticas (anel benzénico ou derivados);
Aromáticos: possuem pelo menos um anel benzénico ou derivados (carbohidrato de
forma cíclica e com 3 ligações duplas entre os carbonos);
Grupos funcionais
Os grupos funcionais são grupos específicos de átomos que alteram a reactividade das
moléculas em que se inserem. O mesmo grupo funcional sofre modificações químicas iguais ou
semelhantes, independentemente do tamanho da molécula onde se insere, ou seja, o
contexto químico da molécula é bastante relevante para a sua reactividade. As biomoléculas
possuem número limitado de grupos funcionais que determinam as suas propriedades físicoquímicas.
Grupos Funcionais a saber:
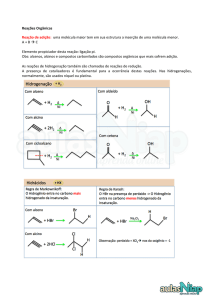
Hidróxido (álcool) : R-OH
Carbonilo:
Aldeído: R-COOH (posicionado na extremidade da
molécula);
Cetona: R1-COO-R2 (ocupa posição intermédia na.
Carboxilo: R-COO-HO
Amina: R-NH2
Amida: R-COO-NH2
Éster: R1-COO-O-R2
Éter: R1-O-R2 (assume posição interior)
Anidride (2 carboxilos): R1- COO-O-COO-R2
Sulfidril: R-SH
Fosforil: R-O-POO-OH-OH
Dissulfide: R1-S2-R2
Metil: CH3
Etil: C2H5
Fenil
(composto
hidrocarbonatado
aromático
–
anel
benzénico)
Nota: O metil, o etil e o fenil não são verdadeiramente considerados como grupos funcionais
por não alterarem significativamente a reactividade da molécula ou condicionarem as suas
características físico-químicas.
Isomeria
Isómeros: moléculas diferentes, com composição igual, mas geometria diferente. Têm de ter a
mesma fórmula química. Podem ser:
Constitucionais1: diferem entre si no padrão de ligações covalentes
Estereoisómeros: têm o mesmo padrão de ligações covalentes; podem ser:
Conformacionais (alinhamento): conseguem interconverter-se por rotação de
uma só ligação; esta interconversão não requer clivagem de ligações
covalentes, havendo manutenção da configuração; há uma rotação de 360
segundo o eixo da ligação covalente simples (elevada flexibilidade conferida
por esta ligação);
Configuracionais (relação geométrica covalente entre um conjunto de
átomos): a interconversão entre configurações requer clivagem de ligações
covalentes. Estes, por sua vez, podem ser:
o Geométricos1: diferem no arranjo dos substituintes numa
porção rígida da molécula. Podem ser:
Cis : quando elementos estão na mesma linha
horizontal;
Trans: quando os elementos substituintes estão num
plano oblíquo;
o Ópticos: diferem na orientação dos substituintes em torno de
um carbono quiral/assimétricos (4 substituintes diferentes).
Podem ser:
Enantiómeros2: apresentam uma configuração diferente
em todos os carbonos quirais; as moléculas são simétricas
entre
si
e
têm
propriedades
físicas
e
químicas
semelhantes; diferem nas propriedades biológicas;
Diastereoisómeros: mantêm a configuração de pelo menos
um carbono quiral, caso haja mais do que um; possuem
diferentes propriedades físicas e químicas;
Interacções
1
Os isómeros constitucionais e geométricos diferem entre si no ponto de fusão, ponto de ebulição,
solubilidade e estrutura cristalina.
2
Mistura racémica: solução onde estão presentes dois enantiómeros de uma molécula.
Interacções não covalentes – são mais fracas do que as covalentes, no entanto, o efeito
cumulativo das mesmas assume uma força substancial que pode conferir estabilidade
intermolecular. Estas ligações:
Determinam as propriedades biológicas das biomoléculas;
Influenciam solubilidade das moléculas em meio aquoso devido às ligações de H e das
interacções ião-dipolo ou dipolo-dipolo que as moléculas formam com a água
(molécula polar – dipolo);
Influencia a estrutura das biomoléculas;
Electronegatividade - capacidade de um átomo aceitar densidade electrónica ou nuvem
electrónica. A título de exemplo temos o flúor com maior tendência para aceitar electrões de
outra nuvem electrónica, sendo este o elemento mais electronegativo da TP.
Forças covalentes: consistem na partilha de electrões, sendo esta possível entre compostos
com electronegatividade próxima.
Forças não covalentes:
Ligações (pontes) de hidrogénio: envolvem um H de uma molécula polar e um par de
electrões não ligantes de um átomo muito electronegativo (O, N e F) de outra
molécula;
Interacções ião-dipolo: envolvem um ião e uma parte polar de uma molécula:
Se for catião: atrai o pólo negativo da molécula polar, já que tem carga
positiva;
Se for anião: atrai o pólo positivo da molécula polar, já que tem carga negativa
Interacções dipolo-dipolo: envolvem duas partes polares de duas moléculas.
Há relações de atracção e repulsão de acordo com a carga predominante em
cada pólo
Forças de dispersão de London – dipolo instantâneo-dipolo induzido;
Forças de van der Waals – interacções dipolo-dipolo + forças de dispersão de London:
Quando as moléculas são apolares, não há cargas permanentes presentes, mas, em vez disso,
há cargas instantâneas: como os electrões nas moléculas estão em constante movimento, há
instantes em que pode haver uma distribuição assimétrica de cargas, ao que se chama dipolos
instantâneos que, devido ao movimento dos electrões, possuem uma direcção diferente e
desaparecem numa fracção de microssegundos. As cargas muito pequenas de um momento
dipolar instantâneo podem induzir um momento dipolar numa molécula não polar vizinha,
conduzindo a uma pequena atracção entre elas. A segunda também se torna, então,
susceptível a criar dois pólos que terão sido induzidos pela outra molécula em momento dipolo
instantâneo. Esta dispersão de cargas é denominada por dispersão de London.
Polarizabilidade – facilidade com que a nuvem de electrões de uma molécula pode ser
distorcida por uma carga vizinha. Em geral, a polarizabilidade aumenta com o tamanho da
nuvem electrónica.
Macromoléculas
As macromoléculas têm múltiplos locais susceptíveis a estabelecer ligações não covalentes,
sendo que o efeito cumulativo dessas forças fracas é enorme. A estrutura mais estável de uma
macromolécula é aquela em que as interacções não covalentes estão maximizadas.