PROVA DE FÍSICA
2º ANO - 4ª MENSAL - 1º TRIMESTRE
TIPO A
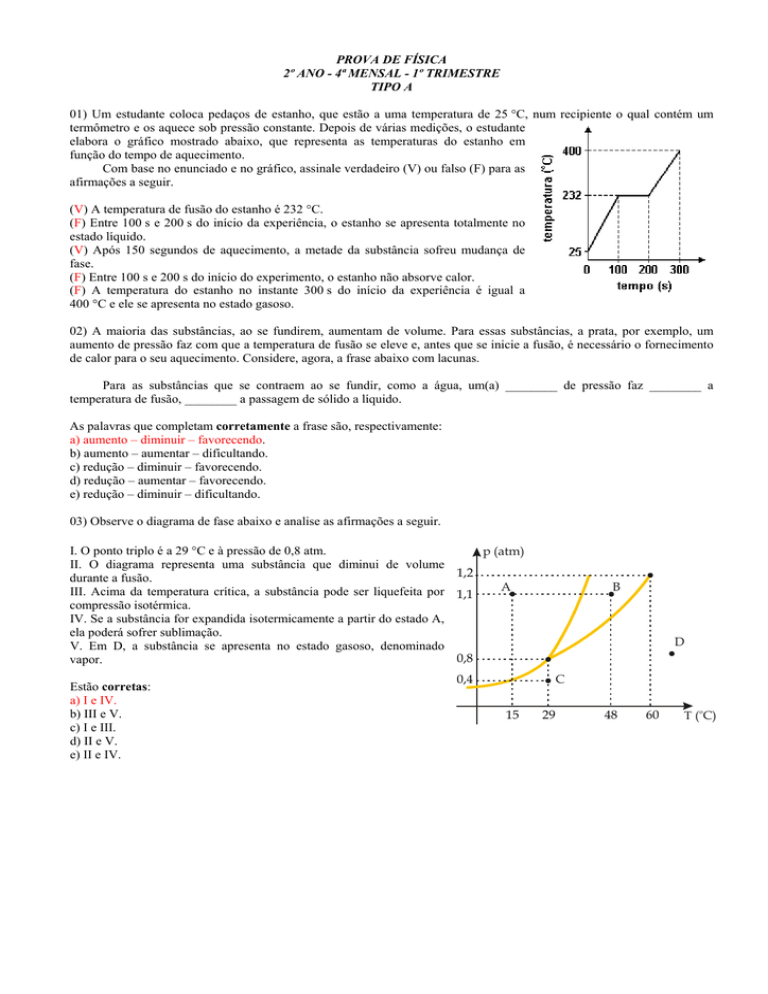
01) Um estudante coloca pedaços de estanho, que estão a uma temperatura de 25 °C, num recipiente o qual contém um
termômetro e os aquece sob pressão constante. Depois de várias medições, o estudante
elabora o gráfico mostrado abaixo, que representa as temperaturas do estanho em
função do tempo de aquecimento.
Com base no enunciado e no gráfico, assinale verdadeiro (V) ou falso (F) para as
afirmações a seguir.
(V) A temperatura de fusão do estanho é 232 °C.
(F) Entre 100 s e 200 s do início da experiência, o estanho se apresenta totalmente no
estado líquido.
(V) Após 150 segundos de aquecimento, a metade da substância sofreu mudança de
fase.
(F) Entre 100 s e 200 s do início do experimento, o estanho não absorve calor.
(F) A temperatura do estanho no instante 300 s do início da experiência é igual a
400 °C e ele se apresenta no estado gasoso.
02) A maioria das substâncias, ao se fundirem, aumentam de volume. Para essas substâncias, a prata, por exemplo, um
aumento de pressão faz com que a temperatura de fusão se eleve e, antes que se inicie a fusão, é necessário o fornecimento
de calor para o seu aquecimento. Considere, agora, a frase abaixo com lacunas.
Para as substâncias que se contraem ao se fundir, como a água, um(a) ________ de pressão faz ________ a
temperatura de fusão, ________ a passagem de sólido a líquido.
As palavras que completam corretamente a frase são, respectivamente:
a) aumento – diminuir – favorecendo.
b) aumento – aumentar – dificultando.
c) redução – diminuir – favorecendo.
d) redução – aumentar – favorecendo.
e) redução – diminuir – dificultando.
03) Observe o diagrama de fase abaixo e analise as afirmações a seguir.
I. O ponto triplo é a 29 °C e à pressão de 0,8 atm.
p (atm)
II. O diagrama representa uma substância que diminui de volume
1,2
durante a fusão.
A
III. Acima da temperatura crítica, a substância pode ser liquefeita por 1,1
compressão isotérmica.
IV. Se a substância for expandida isotermicamente a partir do estado A,
ela poderá sofrer sublimação.
V. Em D, a substância se apresenta no estado gasoso, denominado
0,8
vapor.
Estão corretas:
a) I e IV.
b) III e V.
c) I e III.
d) II e V.
e) II e IV.
B
D
0,4
C
15
29
48
60
Τ (oC)
04) Uma fonte fornece a 600 g de uma substância calor com potência constante de 2400 cal/min, fazendo com que a massa
da substância mude de fase. Quanto tempo é necessário, em segundos, para mudar de fase 1/5 da massa total da substância?
(Dado: calor latente de transformação L = 50 cal/g)
atenção! apenas 1/5 de 600g mudaram de estado físico, isto é, 120g
Q
∆t
Q
∆t =
P
m.L
∆t =
P
120.50
∆t =
2400
P=
∆t =
5
minutos
2
∆t = 150 segundos
05) No interior de um calorímetro ideal, temos 550 g de água a 80 °C. Determine a massa de gelo, inicialmente a –20 °C,
que devemos colocar nesse recipiente para que possamos obter somente água a 20 °C.
(Dados: Lfusão= 80 cal/g; Lvaporização= 540 cal/g)
Qagua + Qgelo = 0
ma .ca .∆Ta + m.cg .∆T1 + m.L f + m.ca .∆T2 = 0
550.1.(20 − 80) + m.0, 5.(0 − (−20)) + m.80 + m.1.(20 − 0) = 0
−33000 + 10m + 80m + 20m = 0
110m = 33000
m = 300 g
06) O aquecimento de 300 g de água a 80 °C para a fase gasosa a 110 °C é feito por uma fonte calorífica. Sabendo que o
calor latente de vaporização da água é igual a 540 cal/g, o calor específico do vapor d’água vale 0,5 cal/g °C e o calor
específico da água é igual a 1 cal/g °C, calcule a quantidade total de calor fornecida à massa de vapor d'água.
Qt = Qs1 + QLf + Qs 2
Qt = m.c1.∆T1 + m.L f + m.c2 .∆T2
Qt = 300.1.(100 − 80) + 300.540 + 300.0,5.(110 − 100)
Qt = 6000 + 162000 + 1500
Qt = 169500cal
07) Colocam-se 50 g de gelo a 0 °C em 100 g de água. Após certo tempo, verifica-se que existem 30 g de gelo boiando na
água. Admitindo que não ocorreu troca de calor com o ambiente e que o calor latente de fusão do gelo é 80 cal/g, determine
a temperatura inicial da água.
Qgelo + Qagua = 0
m.L f + m.ca .∆T2 = 0
(50 − 30).80 + 100.1.(0 − T ) = 0
1600 − 100T = 0
100T = 1600
T = 16º C
PROVA DE FÍSICA
2º ANO - 4ª MENSAL - 1º TRIMESTRE
TIPO B
01) O esquema da panela de pressão e um diagrama de fase da água são apresentados a seguir.
A vantagem do uso de panela de pressão é a rapidez para o
cozimento de alimentos, e isso se deve à:
a) pressão no seu interior, que é igual à externa.
b) temperatura de seu interior, a qual está acima da de
ebulição da água no local.
c) quantidade de calor adicional que é transferida à panela.
d) quantidade de vapor a qual é liberada pela válvula.
e) espessura da sua parede, que é maior que a das panelas
comuns.
02) Observe o diagrama de fase a seguir e analise as afirmativas abaixo.
I. Abaixo da temperatura crítica, a substância pode ser liquefeita por
p (atm)
compressão isotérmica.
II. A 0,8 atm, podemos encontrar a substância no estado sólido, líquido e 1,2
gasoso.
III. O diagrama representa uma substância que diminui de volume durante a 1,1 A
fusão.
IV. Se a substância for expandida isotermicamente a partir do estado A, ela
poderá sofrer sublimação.
V. Em D, a substância se encontra no estado gasoso, denominado vapor.
0,8
Estão corretas:
a) I, II e IV.
b) III, IV e V.
c) I e III.
d) I, II, III e IV.
e) II, III e IV.
B
D
C
0,4
5
29
48
60
Τ (oC)
03) Uma fonte térmica fornece calor a um cubo de 100 g de certa substância, inicialmente no estado sólido, com uma
potência constante de 450 cal/min. O gráfico da temperatura da substância, em função do tempo em contato com a fonte,
está representado a seguir.
Analise as afirmações seguintes relativas a essa situação e coloque V para a(s) verdadeira(s) e F para a(s) falsa(s).
(F) A temperatura de solidificação da substância é 80 °C.
(V) Após 8 minutos de aquecimento, a substância se encontra no
estado líquido.
(V) A temperatura de solidificação da substância é 50 °C.
(V) Após 10 minutos de aquecimento, a substância recebe 4500
cal.
(V) Após 4 minutos de aquecimento, metade da substância sofre
mudança de fase.
04) Colocam-se 50 g de gelo a 0 °C em 200 g de água. Após certo tempo, verifica-se que existem 30 g de gelo boiando na
água. Admitindo que não ocorreu troca de calor com o ambiente e que o calor latente de fusão do gelo é 80 cal/g, determine
a temperatura inicial da água.
Qgelo + Qagua = 0
m.L f + m.ca .∆T2 = 0
(50 − 30).80 + 200.1.(0 − T ) = 0
1600 − 200T = 0
200T = 1600
T = 8º C
05) Uma fonte fornece a 600 g de uma substância calor com potência constante de 2400 cal/min, fazendo com que a massa
da substância mude de fase. Quanto tempo é necessário, em segundos, para mudar de fase 1/5 da massa total da substância?
(Dado: calor latente de transformação L = 40 cal/g)
atenção! apenas 1/5 de 600g mudaram de estado físico, isto é, 120g
Q
∆t
Q
∆t =
P
m.L
∆t =
P
120.40
∆t =
2400
∆t = 2 minutos
P=
∆t = 120 segundos
06) No interior de um calorímetro ideal, temos 550 g de água a 80 °C. Calcule a massa de gelo, inicialmente a –20 °C, que
devemos colocar nesse recipiente para que possamos obter somente água a 20 °C.
(Dados: Lfusão= 80 cal/g; Lvaporização= 540 cal/g)
Qagua + Qgelo = 0
ma .ca .∆Ta + m.cg .∆T1 + m.L f + m.ca .∆T2 = 0
550.1.(20 − 80) + m.0, 5.(0 − (−20)) + m.80 + m.1.(20 − 0) = 0
−33000 + 10m + 80m + 20m = 0
110m = 33000
m = 300 g
07) O aquecimento de 100 g de água a 80 °C para a fase gasosa a 110 °C é feito por uma fonte calorífica. Considerando que
o calor latente de vaporização da água é igual a 540 cal/g, o calor específico do vapor d’água vale 0,5 cal/g °C e o calor
específico da água é igual a 1 cal/g °C, determine a quantidade total de calor fornecida à massa de vapor d’água.
Qt = Qs1 + QLf + Qs 2
Qt = m.c1.∆T1 + m.L f + m.c2 .∆T2
Qt = 100.1.(100 − 80) + 100.540 + 100.0,5.(110 − 100)
Qt = 2000 + 54000 + 500
Qt = 56500cal
PROVA DE FÍSICA
2º ANO - 4ª MENSAL - 1º TRIMESTRE
TIPO C
01) Um corpo de 100 g de massa é aquecido por uma fonte de calor de potência constante. O gráfico abaixo representa a
variação da temperatura do corpo, inicialmente no estado sólido, em função do tempo.
T(°C)
100
60
20
0
3
8
13
t(min)
O calor específico desse material, na fase sólida, é de 0,6 cal/g °C e, no estado líquido, 1,0 cal/g °C. Determine a
potência da fonte calorífica e o calor latente de fusão da substância.
Q
∆t
m.c.∆T
P=
∆t
100.0, 6.(60 − 20)
P=
3
2400
P=
3
cal
P = 800
min
P=
Q
∆t
m.L
P=
∆t
P.∆t
L=
m
800.(8 − 3)
L=
100
4000
L=
100
P=
L = 40
cal
g
02) Em uma vasilha há um bloco de gelo de 100 g a 0 °C. Qual a quantidade mínima de água a 20 °C (temperatura
ambiente) que deve ser adicionada ao gelo para fundi-lo completamente? (O calor latente de fusão do gelo é 80 cal/g.)
Qgelo + Qagua = 0
m.L f + m.ca .∆T2 = 0
100.80 + m.1.(0 − 20) = 0
8000 − 20m = 0
20m = 8000
m = 400 g
03) O aquecimento de 200 g de água a 60 °C para a fase gasosa a 120 °C é feito por uma fonte calorífica. Sabendo que o
calor latente de vaporização da água é igual a 540 cal/g, o calor específico do vapor d’água vale 0,5 cal/g °C e o calor
específico da água é igual a 1 cal/g °C, calcule a quantidade total de calor fornecida à massa de vapor d’água.
Qt = Qs1 + QLf + Qs 2
Qt = m.c1.∆T1 + m.L f + m.c2 .∆T2
Qt = 200.1.(100 − 60) + 200.540 + 200.0,5.(120 − 100)
Qt = 8000 + 108000 + 2000
Qt = 118000cal
04) Num calorímetro ideal encontram-se 90 g de gelo a –10 °C. Colocando-se 200 g de água nesse calorímetro, observa-se
que 2/3 do gelo se funde, sobrando no final uma mistura de gelo e água. Qual a temperatura inicial da água sabendo-se que
o calor específico do gelo é 0,5 cal/g °C e seu calor latente de fusão, 80 cal/g?
Qgelo + Qagua = 0
m.ca .∆T1 + m.L f + m.ca .∆T2 = 0
2
90.0,5(0 − (−10)) + 90.80 + 200.1.(0 − T ) = 0
3
450 + 4800 − 200T = 0
200T = 5250
T = 26, 25º C
05) Observe o diagrama de fase a seguir e analise as afirmativas abaixo.
ANULADA
I. Abaixo da temperatura crítica, a substância pode ser liquefeita por expansão isotérmica.
II. A 100 atm de pressão, a substância pode ser liquefeita isobaricamente.
III. A 280 °C, pode ocorrer uma condensação isotérmica se submetermos a substância a um processo de compressão.
IV. O ponto crítico ocorre a 0,01 °C.
V. BC será uma curva de condensação se estivermos fornecendo energia para a substância.
Estão corretas:
a) I, III e V.
b) I, II e III.
c) II, III e IV.
d) III, IV e V.
e) I, IV e V.
06) Analise as afirmações seguintes e assinale V para a(s) verdadeira(s) e F para a(s) falsa(s).
(V) Durante a mudança de fase, enquanto o calor é fornecido, a temperatura permanece constante.
(V) A temperatura de ebulição de uma substância depende da pressão.
(F) Num processo calorimétrico, sempre que fornecemos energia para uma substância, sua temperatura aumenta.
(V) Calor latente de uma substância é a quantidade de calor fornecida a ela para promover, em um grama dessa substância,
sua mudança de fase.
(V) Podemos alterar a temperatura de solidificação de uma substância se alterarmos a pressão enquanto retiramos calor
desta.
07) Quando aquecemos um corpo qualquer, inicialmente no estado sólido, sem alterarmos a pressão:
a) sua temperatura aumenta indefinidamente.
b) sua temperatura estabiliza quando começa a mudança de fase e depois aumenta indefinidamente.
c) sua temperatura se estabiliza cada vez que ocorre uma mudança de fase.
d) sua temperatura não se altera em nenhum momento.
e) nada podemos afirmar, pois não sabemos seu calor específico nem seu calor latente de mudança de fase.
PROVA DE FÍSICA
2º ANO - 4ª MENSAL - 1º TRIMESTRE
TIPO D
01) O aquecimento de 100 g de água a 40 °C para a fase gasosa a 120 °C é feito por uma fonte calorífica. Sabendo que o
calor latente de vaporização da água é igual a 540 cal/g, o calor específico do vapor d'água vale 0,5 cal/g °C e o calor
específico da água é igual a 1 cal/g °C, determine a quantidade total de calor fornecida à massa de vapor d'água.
Qt = Qs1 + QLf + Qs 2
Qt = m.c1.∆T1 + m.L f + m.c2 .∆T2
Qt = 100.1.(100 − 40) + 100.540 + 100.0,5.(120 − 100)
Qt = 6000 + 54000 + 1000
Qt = 61000cal
02) Um corpo de 300 g de massa é aquecido por uma fonte de calor de potência constante. O gráfico abaixo representa a
variação da temperatura do corpo, inicialmente no estado sólido, em função do tempo.
T(°C)
120
80
40
0
3
8
13
t(min)
O calor específico desse material, na fase sólida, é de 0,6 cal/g °C e, no estado líquido, 1,0 cal/g °C. Calcule a
potência da fonte calorífica e o calor latente de fusão da substância.
Q
∆t
m.c.∆T
P=
∆t
300.0, 6.(80 − 40)
P=
3
7200
P=
3
cal
P = 2400
min
P=
Q
∆t
m.L
P=
∆t
P.∆t
L=
m
2400.(8 − 3)
L=
300
12000
L=
300
P=
L = 40
cal
g
03) Em uma vasilha há um bloco de gelo de 50 g a 0 °C. Qual a quantidade mínima de água a 20 °C (temperatura ambiente)
que deve ser adicionada ao gelo para fundi-lo completamente? (O calor latente de fusão do gelo é 80 cal/g.)
Qgelo + Qagua = 0
m.L f + m.ca .∆T2 = 0
50.80 + m.1.(0 − 20) = 0
4000 − 20m = 0
20m = 4000
m = 200 g
04) Num calorímetro ideal encontram-se 180 g de gelo a –20 °C. Colocando-se 300 g de água nesse calorímetro, observa-se
que 2/3 do gelo se funde, sobrando no final uma mistura de gelo e água. Qual a temperatura inicial da água sabendo-se que
o calor específico do gelo é 0,5 cal/g °C e seu calor latente de fusão, 80 cal/g?
Qgelo + Qagua = 0
m.ca .∆T1 + m.L f + m.ca .∆T2 = 0
2
180.0,5(0 − (−10)) + 180.80 + 300.1.(0 − T ) = 0
3
1800 + 9600 − 300T = 0
300T = 11400
T = 38º C
05) Observe o diagrama de fase a seguir e assinale V na(s) afirmação(ões) verdadeira(s) e F na(s) falsa(s).
(F) Abaixo da temperatura crítica, a substância pode ser liquefeita por expansão isotérmica.
(V) A 100 atm de pressão, a substância pode ser liquefeita isobaricamente.
(V) A 280 °C, pode ocorrer uma condensação isotérmica se submetermos a substância a um processo de compressão.
(F) O ponto crítico ocorre a 0,01 °C.
(F) BC será uma curva de condensação se estivermos fornecendo energia para a substância.
06) Analise as afirmativas abaixo:
I. Durante a mudança de fase, enquanto o calor é fornecido, a temperatura permanece constante.
II. A temperatura de ebulição de uma substância depende da pressão.
III. Num processo calorimétrico, sempre que fornecemos energia para uma substância, sua temperatura aumenta.
IV. Calor sensível de uma substância é a quantidade de calor fornecida a ela para promover, em um grama dessa substância,
sua mudança de fase.
V. Podemos alterar a temperatura de solidificação de uma substância se alterarmos a pressão onde ela se encontra
Estão corretas:
a) I, III e V.
b) I, II e III.
c) II, III e IV.
d) III, IV e V.
e) I, IV e V.
ANULADA
07) Quando aquecemos um corpo qualquer, inicialmente no estado sólido, sem alterarmos a pressão:
a) sua temperatura aumenta indefinidamente.
b) sua temperatura estabiliza quando começa a mudança de fase e depois aumenta indefinidamente.
c) sua temperatura se estabiliza cada vez que ocorre uma mudança de fase.
d) sua temperatura não se altera em nenhum momento.
e) nada podemos afirmar, pois não sabemos seu calor específico nem seu calor latente de mudança de fase.










