UFRPE: Física Geral II
Márcio Cabral de Moura
1
1. Calor
2 aulas, 4 horas: Capítulos 19 e 20 do Fundamentos de Física 2, de D. Halliday, R. Resnick e
J. Walker, 4ª edição.
1.1 Calor, temperatura e princípio zero da termodinâmica
Calor é a energia (interna) que é transferida entre um sistema e seu ambiente, devido a uma
diferença de temperatura entre eles.
Energia interna ou térmica: soma das energias cinética e potencial, associada aos movimentos
aleatórios dos átomos, moléculas e estruturas constituintes do objeto.
Calor é diferente de temperatura.
Calor = Q
Q < 0 se a energia interna é transferida do sistema para o ambiente.
[Q] = J
1 J = 0,2389 cal = 9,481x10-4 Btu
1 Cal = 1.000 cal = 3,969 Btu = 4.186 J
Nosso “sentido de temperatura” não é muito confiável.
Temperatura é uma das 7 grandezas fundamentais do SI
[T] = K (kelvin)
T > 0 K (sempre)
Lei ou princípio zero da termodinâmica: “Se dois corpos A e B estão em equilíbrio térmico
com um terceiro corpo T, então, estão em equilíbrio térmico um com o outro”. Ou, “todo
corpo tem uma propriedade chamada temperatura. Quando dois corpos estão em equilíbrio
térmico, suas temperaturas são iguais”.
1.2 Propriedades, grandeza e substância termométricas. Escalas termométricas.
O volume de um líquido pode aumentar com a temperatura, ou o comprimento de uma barra
de metal, ou a resistência elétrica de um fio, ou a pressão exercida por um gás confinado.
Qualquer uma dessas propriedades pode ser usada para medir a temperatura.
T(ºC) = T(K) - 273,15
Congelamento da água Ebulição da água
Temperatura (ºC) 0
100
Temperatura (ºF) 32
212
Exemplo 1: Achar a equação que relaciona a escala Celsius com a Farenheit a partir dos
dados da tabela acima. T(ºC) = (T(ºF)-32)-5/9
∆T(K) = ∆T(ºC)
∆T(ºF) = 1,8-∆T(ºC)
Problemas sugeridos: 19.5E, 19.8P, 19.10E, 19.16P, 19.17P, 19.19P
1.3 Calor específico e capacidade térmica
Capacidade calorífica (C): Constante de proporcionalidade entre uma quantidade de calor e a
variação de temperatura que esta mesma quantidade de calor produz no objeto.
Q = C-(Tf - Ti) = C-∆T
calor específico (c): capacidade calorífica por unidade de massa: c = C/m
cágua = 1 cal/g-ºC = 1 Btu/lb-ºF = 4.190 J/kg-K
UFRPE: Física Geral II
Márcio Cabral de Moura
2
O valor do calor específico varia se a pressão é mantida constante, ou o volume é mantido
constante. Principalmente para gases.
Mudança de fase: calores de transformação: Q = L-m
Substância
c (cal/g-K)
Chumbo
Tungstênio
Prata
Cobre
Alumínio
Latão
Granito
Vidro
Gelo (-10ºC)
Mercúrio
Álcool
Água do mar
Água doce
0,0305
0,0321
0,0564
0,0923
0,215
0,092
0,19
0,20
0,530
0,033
0,58
0,93
1,00
c (J/kg-K)
T fusão (K)
LF (kJ/kg)
T ebulição (K)
LV (kJ/kg)
128
134
236
386
900
380
790
840
2.220
140
2.430
3.900
4.190
601
3.653
1.235
1.356
933
23,2
2.017
6.203
2.323
2.868
2.723
858
234
11,4
630
296
273
333
373
2.256
105
207
2.336
4.730
Exemplo 2: Quanto calor é preciso para que 720 g de gelo a -10ºC passe para o estado líquido
a 15 ºC?
Exemplo 3: Se o pedaço de gelo do exemplo anterior só tivesse recebido 210 kJ, qual seria o
seu estado final e qual será a sua temperatura?
Problemas sugeridos: 20.10E, 20.13E, 20,16P, 20.21P
1.4 Transmissão de calor
A transmissão de calor pode se dar por condução, convecção e radiação
Condução: Transmissão por uma placa de área A e comprimento L: H =
TQ − TF
Q
= k⋅A
t
L
k é a condutividade térmica e depende do material da placa.
TQ − TF
resistência térmica R = L/k
H=A
R
Material
Aço inox
Chumbo
Alumínio
Cobre
Prata
k (W/m-K)
14
35
235
401
428
Material
Ar (seco)
Hélio
Hidrogênio
k (W/m-K)
0,026
0,15
0,18
Material
Lã de vidro
Fibra de vidro
Pinho branco
Vidro de janela
Espuma de poliuretano
k (W/m-K)
0,043
0,048
0,11
1,0
0,024
Convecção: fluidos que em contato com um corpo com temperatura diferente da sua mudam
de densidade e estabelece uma corrente (de convecção)
Radiação: As ondas eletromagnéticas são emitidas por todos os corpos e elas conduzem
energia. Todos os corpos também absorvem ondas eletromagnéticas.
Exemplo 4: A roupa preta dos beduínos e as correntes de convecção.
Problemas sugeridos: 20.46E, 20.48E, 20.51E, 20.52P, 20.53P
UFRPE: Física Geral II
Márcio Cabral de Moura
3
2. Mudança de Estado
2 aulas, 4 horas: Capítulos 20 e 21
2.1 Calor sensível e calor latente
Calor sensível é o calor absorvido ou cedido ao ambiente devido a uma diferença de
temperatura, sem que ocorra mudança de estado.
O calor latente é o calor absorvido ou cedido durante uma mudança de estado.
AB - Sólido, calor sensível
BC - Sólido + líquido, calor latente, TF = temperatura
de fusão
CD - Líquido, calor sensível
DE - Líquido + vapor (gás), calor latente, TE =
temperatura de ebulição
EF - Gás, calor sensível
Como já vimos: QS = m-c-∆t
QL = m-L
2.2 Mudança de estado
Toda matéria, dependendo da temperatura, pode se apresentar em três estados: sólido, líquido
e gasoso.
As possíveis mudanças de estado, quando uma substância recebe ou cede calor, são:
2.3 Ponto triplo. Diagrama de fases
P
TF
Líquido
TE
Sólido
Ponto triplo
Gás
T
O ponto triplo é o ponto onde coexistem em
equilíbrio as fases de vapor, líquida e sólida de uma
substância.
Um diagrama de fases é uma forma comum de
representar as várias fases de uma substância e as
condições nas quais cada fase existe.
Um diagrama de fase é um gráfico da pressão em
função da temperatura. As linhas no diagrama
representam as condições de Temperatura e Pressão
nas quais uma mudança de fase está em equilíbrio,
ou seja, num ponto sobre a linha é possível que duas
ou três fase coexistam em equilíbrio. Nas outras
regiões do gráfico, apenas uma fase pode existir em
UFRPE: Física Geral II
Márcio Cabral de Moura
4
equilíbrio .
2.4 Gás e vapor: temperatura e ponto crítico
Se observarmos os diagramas de fases anteriores, notaremos que a linha que separa a fase
líquida da gasosa tem um fim, em certo valor de temperatura e pressão. Esse é o ponto crítico.
Para temperaturas acima desse valor não há transição de fase entre gás e líquido (não há calor
latente), apenas sensível.
2.5 Soluções: Pressão osmótica
Membranas semipermeáveis: são membranas existentes na natureza que tem a capacidade de
deixar passar somente líquido (a água), ou solvente, mas não deixar passar sais dissolvidos na
solução. Na verdade o que se verifica é uma propriedade seletiva, isto é, o solvente água passa
de um lado para o outro da membrana com muito mais facilidade do que os solutos (sais )
existentes. As paredes das células dos seres vivos são membranas semipermeáveis naturais,
regulando a passagem de sais e nutrientes para dentro da célula ou para fora dela.
Osmose: definida como a passagem espontânea, seja do solvente puro para a solução, seja de
uma solução diluída para uma solução concentrada, quando as duas fases líquidas estão
separadas por uma membrana semipermeável. A osmose é devida à diferença de potencial
químico dos dois lados da membrana. O tipo de membrana não importa, requer-se apenas que
seja permeável somente ao solvente. Também não apresenta importância a natureza do soluto,
basta que o soluto contenha uma substância que não atravessa a membrana.
Pressão osmótica é a diferença entre as pressões hidrostáticas em ambos os lados da
membrana.
P = M-R-T, onde M é a molaridade (quantidade de matéria em moles por volume em litros) da
solução, T é a temperatura em Kelvin e R é a constante dos gases ideais: R = 8,31 J/mol-K =
0,0821 l-atm/mol-K
UFRPE: Física Geral II
Márcio Cabral de Moura
5
3. Termodinâmica
3 aulas, 6 horas: Capítulos 20, 21 e 22
3.1 Calor e trabalho. Primeiro Princípio da Termodinâmica
Um sistema também pode trocar energia com seu ambiente por meio do trabalho. O trabalho
realizado por um sistema ao se expandir ou contrair de um volume inicial Vi a um volume
Vf
final Vf é: W = ∫ pdV
Vi
Primeira lei da termodinâmica: ∆U = Q - W
U é a energia interna do sistema e depende apenas de seu estado, ou seja, temperatura, pressão
e volume.
Se o sistema ganha calor, Q > 0; se o sistema perde calor, Q < 0.
W é o trabalho realizado pelo sistema. Se o sistema se expande conta uma força externa,
W > 0; se o sistema se contrai devido a uma força externa, W < 0.
Q e W dependem do processo. U não depende.
Processo adiabático: Q = 0, U = -W
Processo isocórico:
W = 0, U = Q
Processo cíclico: U = 0, W = Q
Expansão livre: Q = U = W = 0
Problemas sugeridos: 20.35E, 20.36E, 20.37E, 20.38E, 20.39E e 20.40E
3.2 Energia interna. Equação de Estado
A energia interna de um sistema só depende de seu estado.
A equação que relaciona os estados de um sistema é a chamada equação de estado.
Equação dos gases ideais: P-V = n-R-T, onde R = 8,31 J/mol-K
Problemas sugeridos: 21.6E, 21.8E, 21.9E, 21.11E, 21.13P, 21.18P e 21.22P
3.3 Transformações reversíveis e irreversíveis
Algumas transformações, na natureza, são reversíveis, como água em gelo e vice-versa, e
outras são irreversíveis, como uma xícara quebrada voltar a ser inteira, exatamente como ela
era antes.
3.4 Análise das transformações
3.5 Ciclos. Segundo princípio da termodinâmica
Segunda lei da termodinâmica:
“Não é possível transformar calor completamente em trabalho, com nenhuma outra mudança
ocorrendo no ambiente”
Ou,
“Não é possível que o calor seja transmitido de um corpo para outro, que esteja à temperatura
mais alta, sem que outra mudança ocorra no ambiente”
Ou,
“Não existem máquinas térmicas perfeitas”
Ou,
“Não existem refrigeradores perfeitos”
Ou,
UFRPE: Física Geral II
Márcio Cabral de Moura
6
“Em qualquer processo termodinâmico que vai de um estado de equilíbrio para outro, a
entropia do conjunto sistema + ambiente aumenta ou permanece constante”
A energia interna de um gás depende apenas de sua temperatura.
Portanto, num processo isotérmico, ∆U = 0, ou seja, Q = W.
Um dispositivo que transforma calor em trabalho, enquanto opera em um ciclo, é chamado de
máquina térmica, ou máquina, ou motor.
Durante cada ciclo, energia é extraída como calor QQ de um reservatório à temperatura TQ
(fonte quente), uma parte sendo transformada em trabalho útil W e o resto sendo
descarregado (perdido) como calor QF para um reservatório à temperatura TF (fonte fria).
Numa máquina ideal, QF = 0.
Como a máquina opera em ciclo, ∆U = 0 W = Q, ou seja, |W| = |QQ| - |QF|
A eficiência térmica de uma máquina é definida como sendo a razão entre o trabalho
QQ − QF
W
realizado por ciclo, pelo calor absorvido por ciclo: e =
=
QQ
QQ
O objetivo do refrigerador é transferir calor do reservatório de baixa temperatura para o
reservatório de alta temperatura, realizando o menor trabalho possível sobre o sistema. Num
refrigerador ideal, W = 0. O coeficiente de performance de um refrigerador é definido como
QF
QF
=
. Tipicamente, K = 5, num refrigerador caseiro e varia entre 2 e
sendo: K =
W
QQ − QF
3 para um condicionador de ar.
A máquina ideal: a máquina de Carnot: Nenhuma máquina real, operando entre 2
temperaturas, pode ter uma eficiência maior que a da máquina de Carnot operando entre essas
mesmas temperaturas. Na realidade, todas as máquinas reversíveis, operando entre um dado
par de temperaturas, têm exatamente a mesma eficiência que um máquina de Carnot entre as
mesmas temperaturas.
A máquina ou ciclo de Carnot consiste em 2
p
a
processos isotérmicos e 2 adiabáticos.
QQ
Por se tratar de um ciclo .: ∆U = 0
De a para b, ∆U = 0 (isoterma), logo, para um gás
b
V
TQ ideal: Q Q = WQ = nRTQ ln b
Va
d
Da
mesma
forma,
de
c
para
d:
c
T
V
F
QF
Q F = WF = nRTF ln c
Vd
V
Nos processos adiabáticos: TQ Vbγ −1 = TF Vcγ −1 e
TQ Vaγ −1 = TF Vdγ −1
Logo,
e Carnot =
Vb Vc
=
Va Vd
TQ − TF
TQ
QQ
QF
=
TQ
TF
, assim, a eficiência do ciclo de Carnot (motor) é:
e o coeficiente de performance de um refrigerador que funcione com base
num ciclo de Carnot é: K Carnot =
TQ
TQ − TF
UFRPE: Física Geral II
Márcio Cabral de Moura
7
Problemas sugeridos: 22.1E, 22.2E, 22.3E, 22.6E, 22.7E, 22.8E, 22.11E, 22.12E, 22.17E,
22.22P, 22.29P
3.6 Entropia e desordem
f
f
dQ
dQ
e ∫ dS = 0, ou S f − S i = ∫ dS = ∫
(processos reversíveis)
T
T
i
i
Para processos reversíveis, a entropia do sistema pode aumentar, diminuir ou permanecer
constante. A variação da entropia do ambiente do sistema será sempre igual em módulo, mas
de sinal oposto à do sistema. Assim, num processo reversível, a entropia do sistema +
ambiente permanece constante.
Para encontrar a variação da entropia num processo irreversível entre dois estados de
equilíbrio, encontre um processo reversível ligando estes mesmos estados e calcule a variação
da entropia para este processo.
Um processo espontâneo é aquele que ocorre sem nenhuma causa externa, sendo devido
somente à constituição interna do sistema onde ocorre o processo.
As únicas mudanças possíveis num sistema isolado são aquelas em que a entropia do sistema
aumenta ou permanece constante e a energia interna não varia.
A entropia permanece a mesma apenas para processos reversíveis. Nenhum processo natural é
completamente reversível.
Resumo da 1ª e 2ª Leis da Termodinâmica: “A energia do universo permanece constante; a
entropia do universo sempre aumenta.
Embora considerações sobre a entropia e a energia interna revelem se um processo pode
ocorrer espontaneamente, nada nos dizem sobre quando ele ocorrerá.
S = kblnω, kb = 1,381 x 10-23 J/K
dS =
Problemas sugeridos: 22.34E, 22.35E, 22.36P
UFRPE: Física Geral II
Márcio Cabral de Moura
8
4. Campo elétrico
2 aulas, 4 horas: Capítulos 23, 24 e 26
4.1 Carga elétrica. Lei de Coulomb
A intensidade da interação elétrica de uma partícula com objetos ao redor dela depende
de sua carga elétrica, que pode ser positiva ou negativa. Cargas de mesmo sinal se repelem e
cargas de sinais opostos se atraem. Um objeto com quantidades iguais das duas espécies de
caga está eletricamente neutro, enquanto um objeto com carga não equilibrada está
eletricamente carregado.
Condutores são materiais em que um número significativo de partículas carregadas
(elétrons, nos metais) podem mover-se livremente. As partículas carregadas nos materiais não
condutores ou isolantes não podem se mover livremente. Quando uma certa quantidade de
carga se move através de um material, dizemos que existe uma corrente elétrica no material.
Carga é representada por q ou por Q.
[q] = Coulomb = C
A carga elétrica é quantizada: qualquer carga pode ser escrita como n-e, onde n é um
inteiro positivo ou negativo e e é uma constante da natureza, chamada de carga elementar
(e = 1,60x10-19 C).
A carga elétrica é conservada: a carga líquida (soma algébrica) de qualquer sistema
isolado não pode variar.
A lei de Coulomb descreve a força eletrostática (força elétrica, na situação em que as
cargas estão paradas) entre duas cargas elétricas puntiformes q1 e q2 em repouso (ou quase em
repouso) e separadas por uma distância r:
1 q 1q 2
Lei de Coulomb: F =
, onde ε0 = 8,85x10-12 C2/N-m2 é a constante de
4πε 0 r 2
permissividade. 1/4πε0 = 8,99x109 N-m2/ C2.
A força de atração ou de repulsão entre cargas puntiformes em repouso atua ao longo da
linha que une as duas cargas. Quando mais de duas cargas estão presentes, a lei de Coulomb
vale para cada par de partículas. A força resultante sobre cada carga é encontrada, usando o
princípio da superposição, pela soma vetorial das forças exercidas sobre a carga por cada uma
das outras.
Uma casca uniformemente carregada atrai ou repele uma partícula carregada, exterior à
casca, como se toda a carga da casca estivesse concentrada em seu centro.
Uma casca uniformemente carregada não exerce nenhuma força eletrostática sobre uma
partícula carregada que esteja localizada em seu interior.
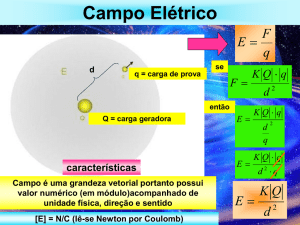
4.2 Campo elétrico. Intensidade
Um meio de explicar a força eletrostática entre cargas é supor que cada carga cria um
campo elétrico no espaço ao seu redor. A força eletrostática exercida sobre qualquer uma das
cargas deve-se, portanto, ao campo elétrico criado no local da carga considerada por todas as
outras cargas.
O campo elétrico E é definido, em qualquer ponto, em termos da força eletrostática
F
r
r F
que seria exercida sobre uma carga teste positiva q0 colocada naquele ponto: E =
q0
[E] = N/C
UFRPE: Física Geral II
Márcio Cabral de Moura
9
O módulo do campo elétrico E criado por uma carga puntiforme q a uma distância r da carga
1 q
vale: E =
. E aponta radialmente para fora da carga puntiforme se ela for positiva, e
4πε 0 r 2
radialmente para dentro da carga puntiforme se ela for negativa.
Quando uma carga puntiforme q é colocada num campo elétrico E, criado por outras cargas, a
força eletrostática F que atua sobre a carga puntiforme é: F = qE. Nessa equação vetorial, q
pode ser positiva ou negativa. A força F tem a mesma direção e o mesmo sentido de E, se q
for positiva, e a mesma direção mas sentido oposto ao de E se q for negativa.
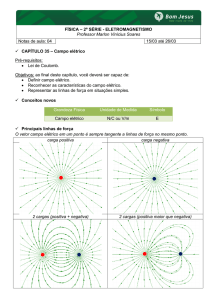
4.3 Linhas de força. Campo uniforme
As linhas do campo elétrico fornecem um meio de visualizarmos a direção, o sentido e o
módulo do campo elétrico. O vetor campo elétrico em qualquer ponto é tangente a uma linha
do campo. A separação das linhas do campo em qualquer região é proporcional ao módulo do
campo elétrico naquela região. As linhas do campo se originam sobre cargas positivas e
terminam sobre cargas negativas.
4.4 Energia potencial elétrica. Trabalho. Potencial eletrostático.
A variação ∆U na energia potencial elétrica U de uma carga puntiforme quando ela se
move de um ponto inicial i para um ponto final f num campo elétrico é: ∆U = Uf - Ui = -Wif,
onde Wif é o trabalho realizado pelo campo elétrico sobre a carga puntiforme. Definindo-se o
zero da energia potencial no infinito, a energia potencial elétrica U da carga puntiforme num
ponto particular é: U = -Wif. Aqui, Wif é o trabalho realizado pelo campo elétrico sobre a
carga puntiforme quando ela se move do infinito até o ponto.
Definimos a diferença de potencial ∆V entre dois pontos num campo elétrico como:
W
∆V = Vf − Vi = − if , sendo q0 uma carga de teste positiva sobre a qual o campo realiza
q0
W
trabalho. O potencial num ponto é: V = − ∞f . [V] = volt = V
q0
Os pontos sobre uma superfície equipotencial têm todos o mesmo potencial. O trabalho
realizado sobre uma carga teste, movendo-se de uma determinada superfície para outra, é
independente das localizações dos pontos inicial e final sobre elas e da trajetória que une os
pontos. O campo elétrico E é sempre perpendicular às superfícies equipotenciais.
A componente de E em qualquer direção é o negativo da taxa de variação do potencial
∂V
∂V
∂V
com a distância naquela direção: E x = −
, Ey = −
, Ez = −
∂x
∂z
∂y
A energia potencial elétrica de um sistema de cargas puntiformes é igual ao trabalho
necessário para reunir o sistema com as cargas inicialmente em repouso e infinitamente
1 q 1q 2
distantes umas da outras. Para 2 cargas a uma distância r uma da outra: U = W =
4πε 0 r
Uma carga em excesso colocada sobre um condutor estará, no equilíbrio, localizada
sobre a superfície externa do condutor. A carga leva todo o condutor, incluindo a superfície e
os pontos internos, a um potencial uniforme. Gaiola de Faraday e poder das pontas.
UFRPE: Física Geral II
Márcio Cabral de Moura
5. Corrente elétrica
3 aulas, 6 horas: Capítulos
5.1 Intensidade de corrente elétrica e densidade de corrente
5.2 Resistência e lei de Ohm
5.3 Potência e energia
5.4 Força eletromotriz
5.5 Circuitos de CC
10