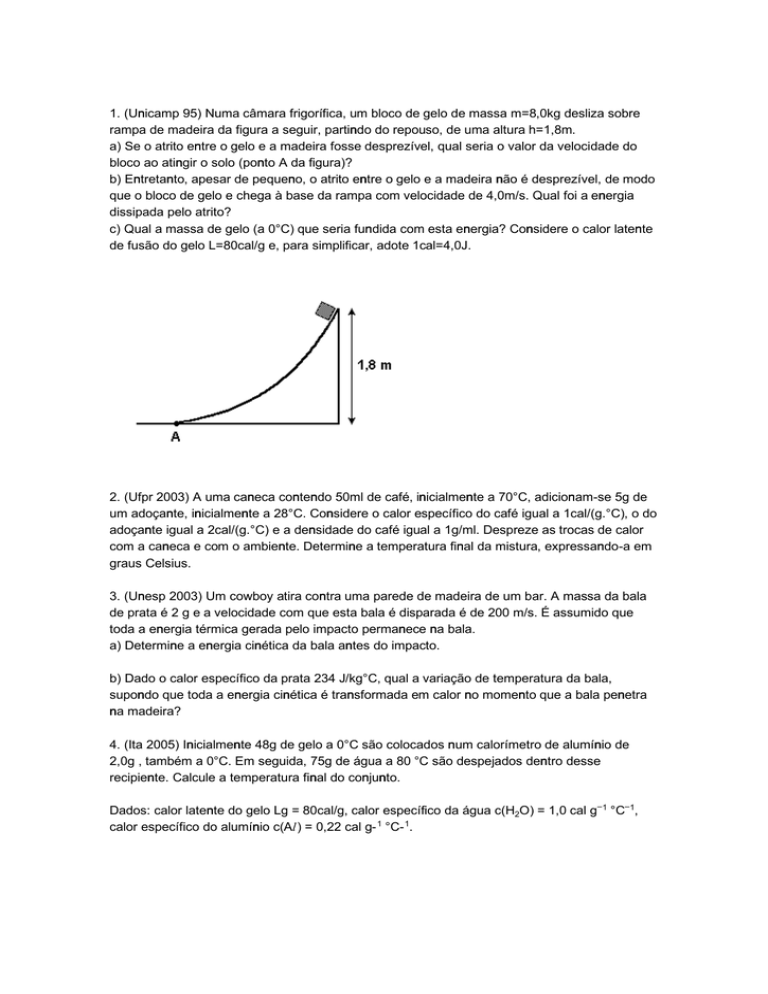
1. (Unicamp 95) Numa câmara frigorífica, um bloco de gelo de massa m=8,0kg desliza sobre
rampa de madeira da figura a seguir, partindo do repouso, de uma altura h=1,8m.
a) Se o atrito entre o gelo e a madeira fosse desprezível, qual seria o valor da velocidade do
bloco ao atingir o solo (ponto A da figura)?
b) Entretanto, apesar de pequeno, o atrito entre o gelo e a madeira não é desprezível, de modo
que o bloco de gelo e chega à base da rampa com velocidade de 4,0m/s. Qual foi a energia
dissipada pelo atrito?
c) Qual a massa de gelo (a 0°C) que seria fundida com esta energia? Considere o calor latente
de fusão do gelo L=80cal/g e, para simplificar, adote 1cal=4,0J.
2. (Ufpr 2003) A uma caneca contendo 50ml de café, inicialmente a 70°C, adicionam-se 5g de
um adoçante, inicialmente a 28°C. Considere o calor específico do café igual a 1cal/(g.°C), o do
adoçante igual a 2cal/(g.°C) e a densidade do café igual a 1g/ml. Despreze as trocas de calor
com a caneca e com o ambiente. Determine a temperatura final da mistura, expressando-a em
graus Celsius.
3. (Unesp 2003) Um cowboy atira contra uma parede de madeira de um bar. A massa da bala
de prata é 2 g e a velocidade com que esta bala é disparada é de 200 m/s. É assumido que
toda a energia térmica gerada pelo impacto permanece na bala.
a) Determine a energia cinética da bala antes do impacto.
b) Dado o calor específico da prata 234 J/kg°C, qual a variação de temperatura da bala,
supondo que toda a energia cinética é transformada em calor no momento que a bala penetra
na madeira?
4. (Ita 2005) Inicialmente 48g de gelo a 0°C são colocados num calorímetro de alumínio de
2,0g , também a 0°C. Em seguida, 75g de água a 80 °C são despejados dentro desse
recipiente. Calcule a temperatura final do conjunto.
Dados: calor latente do gelo Lg = 80cal/g, calor específico da água c(H‚O) = 1,0 cal g­¢ °C­¢,
calor específico do alumínio c(AØ) = 0,22 cal g-¢ °C-¢.
5. (Uerj 2005) O supermercado necessita diariamente de gelo em escamas. A potência P
dissipada pela máquina empregada para fabricá-lo é de 360 cal/s.
Sabendo que a temperatura da água ao entrar na máquina é de 20°C, determine:
a) o calor liberado por 150 kg de água ao ser transformada integralmente em gelo a - 3°C;
b) a energia dissipada pela máquina, em joules, em 5 h de funcionamento.
6. (Unesp 2006) Um aquecedor elétrico fechado contém inicialmente 1kg de água a
temperatura de 25°C e é capaz de fornecer 300 cal a cada segundo. Desconsiderando perdas
de calor, e adotando 1 cal/(g°C) para o calor específico da água e 540 cal/g para o calor
latente, calcule
a) o tempo necessário para aquecer a água até o momento em que ela começa a evaporar.
b) a massa do vapor formado, decorridos 520 s a partir do instante em que o aquecedor foi
ligado.
7. (Unesp 92) Um bloco de massa m desliza sem atrito sobre a superfície indicada na figura a
seguir.
Se g é a aceleração da gravidade, a velocidade mínima v que deve ter para alcançar a altura h
é:
a) 2Ë(gh)
b) Ë(2gh)
c) Ë(gh)/2
d) Ë(gh/2)
e) 2Ë(2gh)
8. (Unitau 95) Quando um objeto está em queda livre,
a) sua energia cinética se conserva.
b) sua energia potencial gravitacional se conserva.
c) não há mudança de sua energia total.
d) a energia cinética se transforma em energia potencial.
e) nenhum trabalho é realizado sobre o objeto.
9. (Fatec 99) O gráfico a seguir representa o aquecimento de 3,0kg de uma determinada
substância inicialmente no estado sólido. O aquecimento é feito por meio de uma fonte de
potência constante 600W.
O calor específico dessa substância no estado líquido, em J/(g°C), é:
a) 0,72
b) 0,90
c) 2,0
d) 8,2
e) 10,0
10. (Pucmg 2004) Dois corpos X e Y recebem a mesma quantidade de calor a cada minuto. Em
5 minutos, a temperatura do corpo X aumenta 30°C, e a temperatura do corpo Y aumenta
60°C.
Considerando-se que não houve mudança de fase, é correto afirmar:
a) A massa de Y é o dobro da massa de X.
b) A capacidade térmica de X é o dobro da capacidade térmica de Y.
c) O calor específico de X é o dobro do calor específico de Y.
d) A massa de Y é a metade da massa de X.
11. (Pucrs 2003) A temperatura de um corpo de 500g varia conforme ilustra o gráfico.
Sabendo-se que o corpo absorve calor a uma potência constante de 10,0cal/s, conclui-se que o
calor específico do material que constitui o corpo é
a) 0,40cal/g.°C.
b) 0,50cal/g. C.
c) 0,60cal/g.°C.
d) 0,70cal/g.°C.
e) 0,80cal/g.°C.
12. (Pucsp 2001) Um aquecedor de imersão (ebulidor) dissipa 200W de potência, utilizada
totalmente para aquecer 100g de água, durante um minuto.
Qual a variação de temperatura sofrida pela água? Considere 1cal=4J e c(água)=1cal/g°C.
a) 120° C
b) 100° C
c) 70° C
d) 50° C
e) 30° C
13. (Ufal 99) Uma panela de ferro, de massa igual a 600g, tem calor específico igual a
0,11cal/g°C e outra panela de alumínio, de massa igual a 300g, tem calor específico igual a
0,22cal/g°C.
Analise as afirmações que seguem referentes a essas panelas
( ) A capacidade térmica da panela de ferro é igual a 66cal/°C.
( ) A capacidade térmica da panela de alumínio é 220cal/°C.
( ) A energia interna das duas panelas tem o mesmo valor.
( ) Para aquecer 200g de água na panela de ferro, de 20°C para 30°C, a água absorverá 660
calorias.
( ) Para aquecer 200g de água na panela de alumínio, de 20°C para 30°C, a panela sozinha
absorverá 660 calorias.
14. (Ufrrj 2000) Uma pessoa bebe 200 gramas de água a 20 °C. Sabendo-se que a
temperatura do seu corpo é praticamente constante e vale 36,5 °C, a quantidade de calor
absorvido pela água é igual a
a) 730 cal.
b) 15600 cal.
c) 3300 cal.
d) 1750 cal
e) 0,01750 cal.
15. (Fatec 2006) O gráfico a seguir é a curva de aquecimento de 10g de uma substância, à
pressão de 1 atm.
Analise as seguintes afirmações :
I. a substância em questão é a água.
II. o ponto de ebulição desta substância é 80°C.
III. o calor latente de fusão desta substância é 20cal/g .
Das afirmações apresentadas,
a) todas estão corretas.
b) todas estão erradas.
c) somente I e II estão corretas.
d) somente II e III estão corretas.
e) somente I está correta
16. (Fgv 2005) Um suco de laranja foi preparado em uma jarra, adicionando-se a 250 mL de
suco de laranja a 20°C, 50 g de gelo fundente. Estabelecido o equilíbrio térmico, a temperatura
do suco gelado era, em °C, aproximadamente,
Dados:
calor específico da água = 1 cal/g°C
calor específico do suco de laranja = 1 cal/g°C
densidade do suco de laranja = 1 × 10¤ g/L
calor latente de fusão do gelo = 80 cal/g
a) 0,5.
b) 1,2.
c) 1,7.
d) 2,4.
e) 3,3.