![termoquímica CEFARMA [Modo de Compatibilidade]](//s1.studylibpt.com/store/data/003176228_1-5be104b429d976a28526593eeb6f49ee-768x994.png)
[email protected]
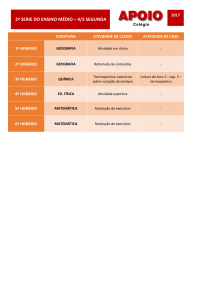
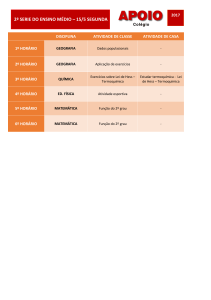
Termoquímica
PROFª. KAÍZA CAVALCANTI
Processos Químicos
Processos Físicos
Quando ocorre uma alteração qualitativa
do sistema, dos tipos de substâncias
presentes ou de suas proporções.
Quando ocorre uma alteração qualitativa
do sistema, dos tipos de substâncias
presentes ou de suas proporções.
Termoquímica é o estudo das quantidades
Termoquímica
de calor liberadas ou absorvidas durante
as reações químicas.
Reações químicas exotérmicas
Reações químicas endotérmicas
Combustão do metanol:
Decomposição do dióxido de carbono:
2 CH4O(g) + 3 O2(g) → 2 CO2(g) + 4 H2O(l) ∆H = - 1.452,6 kJ
2 CO2(g) → 2 CO(g) + O2(g) ∆H = + 565,6 kJ
Decomposição do Nitrato de amônio:
Formação de ozônio a partir de oxigênio:
2 NH4NO3(s) → 2 N2 (g) + O2(g) + 4 H2O(l) ∆H = - 411,2 kJ
3 O2(g) → 2 O3(g)
∆H = + 426,9 kJ
1
[email protected]
Termoquímica
PROFª. KAÍZA CAVALCANTI
Reações químicas exotérmicas
Reações químicas endotérmicas
Quando a energia interna total dos reagentes
(energia inicial) for maior do que a energia
interna total dos produtos formados (energia
final), o excesso de energia será liberado.
Quando a energia interna total dos reagentes
(energia inicial) for menor do que a energia
interna total dos produtos formados (energia
final), a energia que falta será absorvida.
2
[email protected]
Termoquímica
PROFª. KAÍZA CAVALCANTI
Reação de Formação
(Calor padrão de formação)
Exemplos de reações de formação:
2C(grafite) + 3H2(g) + ½ O 2(g) → C2H5OH(l)
H2(g) + ½ O 2(g) → H2O(l)
∆Hf = - 277,5 kJ/mol
Entalpia (ou calor) padrão de formação de
uma substância é a variação de entalpia verificada
na formação de 1 mol da substância, a partir das
substâncias simples correspondentes, estando
todas no estado padrão e estados físicos (e
alotrópicos) mais estáveis.
Cálculo de ∆H de uma reação
Para a formação da água: H2(g) + ½ O2(g) → H2O(l)
∆Hf= - 286,6 kJ/mol
H2(g) + S(rômbico) + 2O2(g) → H2SO4(l) ∆Hf = - 813,0 kJ/mol
Exemplo: calcular o calor da combustão do CO,
a partir dos calores de formação do CO2 e do CO,
a 298 K, respectivamente, - 94,052 kcal/mol e –
26,416 kcal/mol.
CONVENÇÃO:
A entalpia padrão das substâncias
simples no estado de agregação mais
estável é ZERO.
3
[email protected]
Termoquímica
PROFª. KAÍZA CAVALCANTI
Cálculo de ∆H de uma reação (Lei de Hess)
LEI DE HESS
EXEMPLO: C(graf) + O2(g) → CO2(g)
A variação de entalpia (quantidade de
calor liberada ou absorvida) em uma
reação química depende apenas dos
estados inicial e final da reação.
CAMINHO 1
C(graf) + O2(g) → 2 CO2(g) ∆H = - 393,3 kJ
CAMINHO 2
1 – As equações termoquímicas podem ser somadas
como se fossem equações matemáticas.
C(graf) + ½ O2(g) → CO(g)
∆H = - 110,3 kJ
CO(g) + ½ O2(g) → CO2(g) ∆H = - 283,3 kJ
2 – Invertando uma equação termoquímica, deve-se
trocar o sinal de ∆H.
3
–
Multiplicando
(ou
dividindo)
uma
equação
termoquímica por um número diferente de zero, o valor
de ∆H também deve ser multiplicado (ou dividido) por
esse número.
Exemplo: calcule o calor da reação do S(s)
com O2(g) formando SO3(g).
S(s) + O2(g) → SO2(g) ∆H = - 296,8 kJ
SO2(s) + ½ O2(g) → SO3(g) ∆H = - 97,8 kJ
4
[email protected]
Termoquímica
PROFª. KAÍZA CAVALCANTI
Energia de Ligação
Cálculo de ∆H de uma reação
2 HI(g) + Cl2(g) → 2 HCl(g) + I2(g)
Energia de ligação é a variação de entalpia
(quantidade de calor absorvida) verificada na
quebra de 1 mol de uma determinada ligação
química, supondo-se todas as substâncias no
estado gasoso, a 25ºC e 1 bar.
∆H = −173,9kJ
A quebra de ligações é sempre um
processo endotérmico; portanto
∆H é sempre positivo.
A formação de ligações é sempre um
processo exotérmico; portanto ∆H
é sempre negativo.
Exemplo: calcule o calor da reação a seguir
através dos valores de energia de ligação:
CH4(g) + 2 O2(g) → CO2(g) + H2O(g)
5
[email protected]
Termoquímica
PROFª. KAÍZA CAVALCANTI
Cálculo de ∆G de uma reação
Espontaneidade e Equilíbrio de
uma reação química
G = H − TS
∆G 0 = ∆H 0 − T∆S 0
A variação da energia de Gibbs ou
variação de energia livre representa
a máxima energia disponível para a
realização de trabalho.
Exemplo 1: a hidrazina, N2H4, é utilizada
como combustível de foguetes, altamente
energético. A síntese de N2H4 a partir de N2 e
H2 seria interessante, pois esses reagente são
• Se ∆G0 < 0 → a reação é espontânea.
• Se ∆G0 = 0 → a reação está em equilíbrio.
• Se ∆G0 < 0 → a reação não é espontânea.
Exemplo 2: qual deve ser a temperatura para
que essa reação seja espontânea?
baratos. Sabendo-se o ∆H0, + 50,63 kJ/mol, e
o ∆S0, - 331,4 J/K, dessa reação a 298 K,
preveja se a mesma será espontânea ou não :
N2(g) + 2 H2(g) → N2H4(l).
6
[email protected]
Termoquímica
PROFª. KAÍZA CAVALCANTI
Espontaneidade e Equilíbrio de uma reação química
Tipo
∆H0
∆S0
Processo espontâneo?
1
Processo exotérmico
∆H0 < 0
Mais desordem
∆S0 > 0
Espontâneo sob todas as condições.
2
Processo exotérmico
∆H0 < 0
Menos desordem
∆S0 < 0
Depende das magnitudes relativas de ∆H e ∆S.
Mais favorável a baixas temperaturas.
3
Processo endotérmico
∆H0 > 0
Mais desordem
∆S0 > 0
Depende das magnitudes relativas de ∆H e ∆S.
Mais favorável a altas temperaturas.
4
Processo endotérmico
∆H0 > 0
Menos desordem
∆S0 < 0
Não é espontâneo sob todas as condições.
Exemplo 1: para a reação de combustão a
seguir, ∆H0 = - 5315 kJ e ∆S0 = + 310,8 J/K.
Exemplo 2: para a reação de formação de NO2
a partir de N2, ∆H0 = 66,2 kJ e ∆S0 = - 121,5
Explique as condições de espontaneidade da
reação. C4H10(g) + 13 O2(g) → 8 CO2(g) + 10 H2O(g).
J/K. Explique as condições de espontaneidade
da reação. N2(g) + 2 O2(g) → 2 NO2(g).
7
![termoquímica CEFARMA [Modo de Compatibilidade]](http://s1.studylibpt.com/store/data/003176228_1-5be104b429d976a28526593eeb6f49ee-768x994.png)