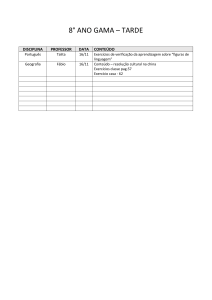
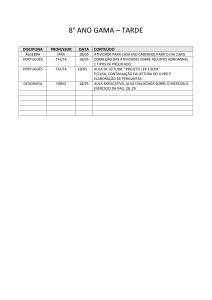
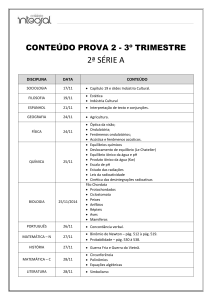
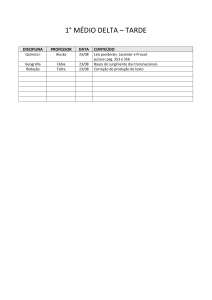
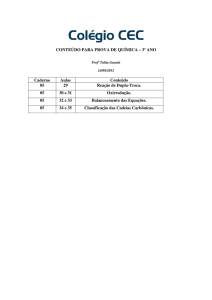
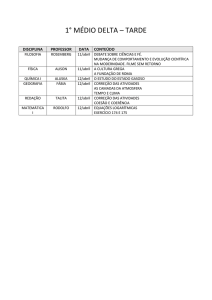
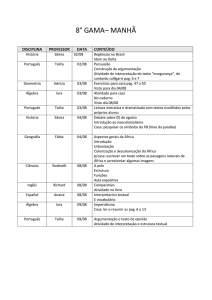
Equilíbrio Iônico
Talita M.
Equilíbrio Iônico
• Equilíbrio iônico = equilíbrio com participação
de íons. Ex.:
HAc + H2O H3O+ + Ac-
De forma simplificada:
HAc H+ + AcEquilíbrio Iônico – Talita M.
Constante de ionização Ki
HAc + H2O H3O+ + AcKc = [H3O+] . [Ac-]
[HAc] . [H2O]
• Como a água é solvente, consideramos sua
concentração constante. Logo:
[H2O] . Kc = [H3O+] . [Ac-]
Ki = [H3O+] . [Ac-]
[HAc]
[HAc]
Equilíbrio Iônico – Talita M.
Constante de ionização Ki
• Ácidos: Ka
HCN + H2O H3O+ + CNKa = [H3O+] . [CN-] = 4,9 . 10-10
[HCN]
• Bases: Kb
NH3 + H2O NH4+ + OHKb = [NH4+] . [OH-] = 1,8 . 10-5
[NH3]
Equilíbrio Iônico – Talita M.
Constante de ionização Ki
• Observação para poliácidos (liberam 2 ou mais H+):
H2 SO4 2 H+ + SO42• Ka1
H2 SO4 H+ + HSO4Ka1 = [H+] . [HSO4-] = 103
[H2 SO4]
• Ka2
HSO4- H+ + SO42Ka2 = [H+] . [SO42-] = 1,2 . 10-2
[HSO4-]
Equilíbrio Iônico – Talita M.
Força de ácidos e bases
• Quanto maior a constante de ionização (Ki) mais
forte é o ácido ou a base.
HCN H+ + CNKa = [H+] . [CN-] = 4,9 . 10-10
[HCN]
HCl H+ + ClKa = [H+] . [Cl-] = 107
[HCl]
Equilíbrio Iônico – Talita M.
Equilíbrio Iônico – Talita M.
Força de ácidos e bases
Grau de ionização (α)
α = número de moléculas ionizadas
número de moléculas iniciais
HCN H+ + CN1000 10 10
moléculas íons íons
α = 10/1000
α = 0,010 ou 1,0 %
FRACO
HCl H+ + Cl1000 920 920
moléculas íons íons
α = 920/1000
α = 0,92 ou 92%
FORTE
Equilíbrio Iônico – Talita M.
Força de ácidos e bases
Tipo de ácido
α
Fortes
α>50%
Semifortes
10%≤α≤50%
Fracos
α<10%
Exemplos
HCl, HBr, HI,
H2SO4, HNO3,
HClO4
HF, H3PO4,
HNO2
HCN, H2S,
H2CO3, H3BO3
Apenas 3 hidrácidos são fortes: HI (α= 100%), HBr (α= 95%) e HCl
(α= 90%)
Força de oxiácidos
Regra de Linus Pauling
m = átomos de O - átomos de H ionizáveis
• H ionizável DEVE estar ligado à O
ácido hipofosforoso
m= 2-1 = 1
• Quanto maior m, mais forte o ácido.
Equilíbrio Iônico – Talita M.
Equilíbrio Iônico – Talita M.
Força de ácidos e bases
Tipo de ácido
Muito Fortes
Fortes
Semifortes
Fracos
m
3
2
1
0
Exemplos
HClO4, HMnO4
H2SO4, HNO3
H3PO4, HNO2
HClO, H3BO3
H2CO3 pela regra, m=3-2=1, semiforte, porém é fraco por ser
instável: H2CO3 CO2 + H2O