1
FUNÇÕES QUÍMICAS
1 - Introdução
Nas ligações vimos que os átomos se
combinam para formarem as substâncias químicas, que podem ser iônicas, moleculares ou metálicas.
Essas substâncias são classificadas em
orgânicas ou inorgânicas de acordo com a presença ou não do elemento químico carbono.
Os compostos que apresentam o elemento químico carbono, como o metano (CH4), álcool etílico (C2H5OH), sacarose (C12H22O11) e
outros, são classificados como orgânicos e estudados na química orgânica. Os compostos formados pelos demais elementos químicos, como
a água (H2O), ácido sulfúrico (H2SO4), hidróxido de sódio (NaOH), óxido de cálcio (CaO), e
outros, são classificados como inorgânicos e são
estudados na química inorgânica.
Obs.: os compostos, como CO, CO2 H2CO3,
Na2CO3 e outros, contém carbono mas são estudados na química inorgânica.
O número de substâncias conhecidas
atualmente é muito grande e para facilitar o seu
estudo se faz necessário classificá-las em grupos
de acordo com suas propriedades químicas.
De acordo com suas propriedades químicas os compostos são classificados em grupos
ou funções químicas.
Função química é um conjunto de
substâncias que apresentam propriedades químicas semelhantes.
Na química inorgânica temos quatro
principais funções químicas, que são: ácido,
base, sal e óxido.
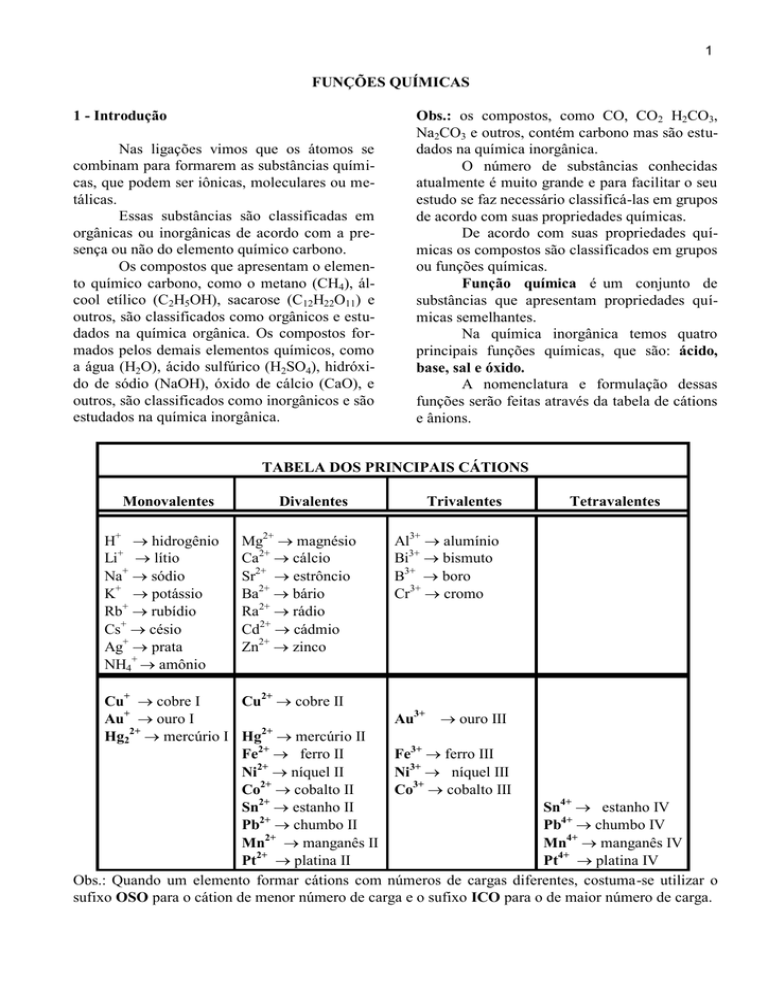
A nomenclatura e formulação dessas
funções serão feitas através da tabela de cátions
e ânions.
TABELA DOS PRINCIPAIS CÁTIONS
Monovalentes
H+ hidrogênio
Li+ lítio
Na+ sódio
K+ potássio
Rb+ rubídio
Cs+ césio
Ag+ prata
NH4+ amônio
Divalentes
Mg2+ magnésio
Ca2+ cálcio
Sr2+ estrôncio
Ba2+ bário
Ra2+ rádio
Cd2+ cádmio
Zn2+ zinco
Trivalentes
Tetravalentes
Al3+ alumínio
Bi3+ bismuto
B3+ boro
Cr3+ cromo
Cu+ cobre I
Cu2+ cobre II
+
Au ouro I
Au3+ ouro III
Hg22+ mercúrio I Hg2+ mercúrio II
Fe2+ ferro II
Fe3+ ferro III
Ni2+ níquel II
Ni3+ níquel III
2+
Co cobalto II
Co3+ cobalto III
Sn2+ estanho II
Sn4+ estanho IV
Pb2+ chumbo II
Pb4+ chumbo IV
Mn2+ manganês II
Mn4+ manganês IV
2+
Pt platina II
Pt4+ platina IV
Obs.: Quando um elemento formar cátions com números de cargas diferentes, costuma-se utilizar o
sufixo OSO para o cátion de menor número de carga e o sufixo ICO para o de maior número de carga.
2
TABELA DOS PRINCIPAIS ÂNIONS
Monovalentes
H
hidreto
-
OH
-
hidróxido
fluoreto
-
F
-
cloreto
-
brometo
Cl
Br
iodeto
-
I
CN cianeto
-
Bivalentes
O
2-
óxido
2-
sulfeto
S
SO3
SO4
2-
sulfito
2-
sulfato
2-
S2O3 tiossulfato
CO3
2-
carbonato
2-
CrO4 cromato
ClO- hipoclorito
Cr2O7 dicromato
ClO2- clorito
SiO3 metassilicato
ClO3- clorato
HPO3 fosfito
ClO4- perclorato
MnO4 manganato
2-
Trivalentes
N
3-
PO4
Tetravalentes
nitreto
3-
BO3
3-
ortossilicato
4-
pirofosfato
SiO4
borato
P 2 O7
ferrocianeto
4-
arsenito
As2O7 piroarseniato
3-
arseniato
Sb2O7
3-
antimonito
3-
antimoniato
AsO4
SbO4
(orto)fosfato
4-
3-
AsO3
SbO3
[Fe(CN)6]
4-
4-
piroantimoniato
3-
[Fe(CN)6] ferricianeto
2-
2-
2-
BrO- hipobromito
BrO3- bromato
hipoiodito
IO-
IO3 iodato
-
IO4- periodato
NO2- nitrito
NO3- nitrato
CNO- cianato
MnO4- permanganato
H2PO2-
PO3
-
hipofosfito
metafosfato
H3CCOO acetato
-
2 - Estudo dos Ácidos
Equações de ionização:
2.1 - Conceito de Arrhenius.
Ácido é toda substância que em água se
ioniza produzindo como cátion somente o íon
H+.
O íon H+ é responsável pelas propriedades que caracterizam os ácidos, e que veremos
posteriormente.
Obs.: O átomo de hidrogênio que, em solução
aquosa, se transforma em H+ é denominado de
hidrogênio ionizável ou hidrogênio ácido.
a) HCl
b) HCN
c) H2SO4
d) H3PO4
e) H4SiO4
H2O
H2O
H2O
H2O
H2O
H+ + ClH+ + CN-
2 H+ + SO423 H+ + PO434H+ + SiO44-
3
H2O
f) HNO3
g) H2CrO4
h) H3BO3
i) H4P2O7
{
H2O
H2O
e) ionização do H4SiO4
H2O
4 H+ + SiO444 H3O+
4 H3O+ + SiO44-
{
H4SiO4 água
4 H + + 4 H2O
H4SiO4 + 4 H2O
+
O conceito de ácido segundo Arrhenius,
deveria ser alterado pois sabe-se, atualmente,
que o íon H+ não existe livre em solução aquosa
e sim na forma de íon H3O+ (hidrônio ou hidroxônio), conforme equação:
H+
3 H+ + PO433 H3O+
3 H3O+ + PO43-
água
H3PO4
+
3 H + + 3 H2O
H3PO4 + 3 H2O
+ H2O
f) ionização do HNO3
H3O+
g) ionização do H2CrO4
Então, as equações de ionização acima
seriam melhor representadas por:
Exemplos:
a) ionização do HCl.
{
HCl
água
+ H+ + H O
2
HCl + H2O
H+ + ClH3O+
H3O+ + Cl-
h) ionização do H3BO3
i) ionização do H4P2O7
b) ionização do HCN
{
HCN
água
+ H+ + H O
2
HCN + H2O
H+ + CNH3O+
H3O+ + CN-
c) ionização do H2SO4
{
água
H2SO4
+
2 H + + 2 H2O
H2SO4 + 2 H2O
d) ionização do H3PO4
2 H+ + SO422 H3O+
2 H3O+ + SO24
Observação:
Quando um ácido apresenta dois ou mais
de hidrogênios ionizáveis, sua ionização se dará
por etapas, ou seja, a liberação destes não ocorre de forma direta e sim em etapas.
Exemplos:
a) ionização em etapas do H2SO4
H2SO4
HSO4
água
H2SO4
água
{
+
ou
água
a
H+ + HSO4 ( 1 etapa)
2H+ + SO4
( 2a etapa)
2 H+ + SO42- (total)
4
H2SO4 + H2O
HSO4 + H2O
{
+
H2SO4 + 2 H2O
a
H3O+ + HSO4 ( 1 etapa)
H3O+ + SO42- ( 2a etapa)
2
2 H3O+ + SO4- (total)
b) ionização em etapas do H2S
Diácidos: são ácidos que apresentam
dois hidrogênios ionizáveis por molécula.
Exemplos:
H2S, H2SO4, H2MnO4, H3PO3.
Triácidos: são ácidos que apresentam
três hidrogênios ionizáveis por molécula.
Exemplos:
H3PO4, H3AsO4.
c) ionização do em etapas do H3PO4
Tretrácidos: são ácidos que apresentam
quatro hidrogênios ionizáveis por molécula.
2.2 - Classificação dos ácidos
A classificação dos ácidos pode ser:
Exemplos:
H4P2O7, H4[Fe(CN)6].
Nos hidrácidos todos os hidrogênios são
ionizáveis e para os oxiácidos, são ionizáveis os
hidrogênios ligados a átomos de oxigênio.
a) Quanto à volatilidade.
Os ácidos, sendo todos compostos moleculares, podem ser encontrados no estado sólido
(H3BO3), líquido (H2SO4) ou gasoso (HCl), nas
condições ambientes.
Os ácidos que apresentam pontos de ebulição elevados como H2SO4 (340oC) e H3PO4
(220oC) são considerados fixos. Os que apresentam pontos de ebulição baixos, como HNO3
(86oC) e os gasosos como HCl, HCN, e outros,
são considerados voláteis.
d) Quanto ao grau de ionização (força).
Grau de ionização () de um ácido é a
relação entre o número de moléculas ionizadas
(ni) pelo número total de moléculas dissolvidas
(nd).
Exemplo:
Para o HCl, a cada 100 moléculas dissolvidas, 92 se ionizam. Logo,
b) Quanto a presença ou não de oxigênio.
Hidrácidos: são ácidos que não apresentam oxigênio na molécula.
Exemplos:
HCl, HBr, H2S, HCN.
Oxiácidos: são ácidos que apresentam
oxigênio na molécula.
Exemplos:
HNO3, H2SO4, H3PO4, H2CO3.
c) Quanto ao número de hidrogênios ionizáveis ou hidrogênios ácidos.
Monoácidos: são ácidos que apresentam
apenas um hidrogênio ionizável por molécula.
Exemplos:
HCl, HBr, HNO3, HCNO, H3PO2.
O grau de ionização () normalmente é
expresso em percentagem, por isso o do HCl é
igual a 92%.
De acordo com o grau de ionização dos
ácidos, podemos classificá-los em:
Ácidos Fortes: são ácidos que apresentam 50%.
Exemplos:
HI ( = 97%)
HCl ( = 92%)
HClO4 ( = 97%),
H2SO4 ( = 61%).
Ácidos Moderados ou Semifortes: são
ácidos que apresentam 5% < < 50%.
5
Exemplos:
HF ( = 8,1%)
f) HNO3
H3PO4 ( = 27%).
Ácidos Fracos: são ácidos que apresentam 5%.
Exemplos: H2CO3 ( = 0,06%)
HCN ( = 0,002%).
Um modo mais prático para se determinar a força dos ácidos comuns, é através das
regras de Pauling, onde temos:
Hidrácidos: são fortes os ácidos HI,
HBr, HCl. O HF é moderado e os demais hidrácidos são fracos.
Oxiácidos: a força dos oxiácidos pode
ser determinada pela diferença entre o número
de átomos de oxigênio e o número de átomos de
hidrogênios ionizáveis na molécula. Quanto
maior for a diferença, maior será a força do ácido.
_
o
_
o
> 1 (ácido forte)
n de
hidrogênios
moderado)
) =< 11 (ácido
(oxigênios
) - (n deionizáveis
(ácido fraco)
Obs.: O H2CO3 apresenta a diferença entre o
número de oxigênios e hidrogênios ionizáveis
igual a 1, mas é um ácido fraco por que se decompõe facilmente, de acordo com equação:
H2CO3 H2O + CO2
Exemplos:
a) HClO4
(4 oxigênios) - (1 hidrogênio) = 3 (forte).
b) H2SO4
(4 oxigênios) - (2 hidrogênios) = 2 (forte).
c) H3PO4
(4 oxigênios) - (3 hidrogênios) = 1 (moderado).
d) H3BO3
(3 oxigênios) - (3 hidrogênios) = 0 (fraco)
e) HMnO4
g) HClO3
H2CO3
2.3 - Nomenclatura e Formulação.
Existem várias maneiras de nomear e
formular os ácidos. A que adotaremos é através
da tabela de ânions. A tabela apresenta o nome
dos ânions com terminação ato, eto ou ito, mas
o nome dos ácidos apresenta terminação ídrico,
ico ou oso.
Para se determinar a nomenclatura dos
ácidos, devemos encontrar o ânion correspondente, na tabela de ânions, e trocar a terminação
conforme o quadro abaixo.
TERMINAÇÃO
ÂNION
ÁCIDO
ATO
ICO
ETO
ÍDRICO
ITO
OSO
Encontrando o ânion correspondente e
trocando a terminação, o nome do ácido é dado
por:
Ácido ...........(terminação do ânion trocada)
Obs.: Uma maneira prática para encontrar o
ânion correspondente é através da sua carga,
que é igual ao número de hidrogênios ionizáveis
existentes por molécula do ácido.
Exemplos:
Escrever o nome dos seguintes ácido.
a) HNO3
6
Este ácido apresenta 1 hidrogênio ionizável, por isso, temos o ânion NO3- (monovalente). Na tabela de ânions, encontramos o NO3com o nome nitrato. Trocando a terminação
(ATO por ICO) temos o nome Nítrico. Então o
nome da substância HNO3, é ácido nítrico.
b) H2S ácido sulfídrico (proveniente do ânion bivalente sulfeto)
a) ácido nitroso: o ânion correspondente é o
nitrito (NO2-) e o número de hidrogênios que
devemos acrescentar é 1, logo a fórmula do
ácido é HNO2.
b) ácido iodídrico: HI (ânion correspondente é
o iodeto I-)
c) ácido arsênico: H3AsO4 (ânion correspondente é o arseniato AsO43-)
c) HClO2 ácido cloroso (proveniente do
ânion monovalente clorito)
d) ácido clórico:
d) HBr
e) ácido ciânico:
e) HCN
f) ácido permangânico:
f) H2SO4
g) ácido sulfídrico:
g) H2CO3
h) ácido fluorídrico:
h) H3PO4
i) ácido antimônico:
i) H3BO3
Os prefixos: orto, meta e piro utilizados
na nomenclatura, estão relacionados com o grau
de hidratação dos ácidos.
O prefixo orto, meta e piro são usados
para os ácidos que apresentam, respectivamente
maior, menor e intermediário grau de hidratação.
A fórmula dos ácidos meta e piro, podem ser determinadas através do ácido orto.
j) HClO
l) H3AsO3
Para a formulação dos ácidos utilizamos
o procedimento inverso da nomenclatura, ou
seja, troca-se a terminação do ácido pela terminação do ânion correspondente e localiza-o na
tabela de ânions. Acrescenta-se tantos hidrogênios quanto for a carga do ânion.
H+ + Axânion
HxA
meta = orto - H2O
piro = 2 orto - H2O
Exemplos:
a) Ácido metafosfórico:
H3PO4 - H2O
ác. (orto)fosfórico
=
HPO3
ác. metafosfórico
ácido
Exemplos:
Escrever a fórmula dos seguintes ácidos:
b) Ácido pirofosfórico:
2 H3PO4 - H2O = H4P2O7
ác. (orto)fosfórico
ác. pirofosfórico
7
Alguns ácidos são muito utilizados no
nosso estudo, por esta razão procure memorizar
o nome e a fórmula dos seguintes ácidos.
HF
HCl
HBr
HI
H2S
HCN
HNO3
H2SO4
H2CO3
H3PO4
H3BO3
ácido fluorídrico.
ácido clorídrico.
ácido bromídrico.
ácido iodídrico.
ácido sulfídrico.
ácido cianídrico.
ácido nítrico.
ácido sulfúrico.
ácido carbônico.
ácido fosfórico.
ácido bórico
2.4 - Propriedades dos Ácidos.
a) Os ácidos são compostos moleculares, e podem se apresentar no estado sólido, líquido
ou gasoso, nas condições ambientes.
b) Os ácidos em solução aquosa conduzem corrente elétrica devido a ionização.
c) Ligar hidrogênio a oxigênio na forma
HO. Exceção: H3PO3 e H3PO2.
d) Ligar o grupo HO ao elemento central.
e) Caso o elemento central não tenha completado o número de ligações covalentes permitidas,
de acordo com o grupo da tabela periódica a
que pertence, ligar o um dos oxigênios remanescentes com dupla ligação. Se estiver completo fazer ligação(ões) dativa(s) com o(s) oxigênio(s).
Exemplo:
a) Construir a fórmula estrutural do H3PO4.
Considerando o H3PO4 onde o P(Família
5A) é o elemento central, devendo fazer 3 ligações covalentes simples de acordo com o grupo
da tabela periódica que o mesmo pertence. Os 4
oxigênios devem estar em volta do P. Ligar os
H aos oxigênios formando o grupo H___O___,
ligando este ao P através de ligações simples a
fim de obter o octeto de cada átomo.
c) Ação sobre indicadores ácido-base.
O
O
Indicadores
Fenolftaleína
Metilorange
Tornassol
Azul de bromotimol
Coloração (meio ácido)
Incolor
vermelha
vermelha
amarela
d) Os ácidos reagem com metais menos reativos
que o hidrogênio da série de reatividade dos
metais, liberando gás hidrogênio.
e) Os ácidos reagem com carbonatos liberando
gás carbônico.
f) Os ácidos neutralizam as bases.
2.5 - Fórmula Estrutural dos Oxiácidos.
Para montar a fórmula estrutural de um
oxiácido (HxEOy) devemos considerar as seguintes regras:
a) Identificar o elemento central (E).
H
O
P
O
H
H
O
P
O
O
H
H
O
Como o P já tem o octeto completo, devemos
montar assim uma ligação dativa entre o oxigênio e o P.
O
H
O
P
O
H
O
H
b) Construir a fórmula estrutural do H2SO4.
c) Construir a fórmula estrutural do HNO3
b) Colocar os oxigênios em volta do elemento
central (E).
H
8
d) Construir a fórmula estrutural do H2CO3.
e) Construir a fórmula estrutural do HNO3.
f) Construir a fórmula estrutural do HClO4.
c) H2S
______________________________________
______________________________________
d) HNO3
______________________________________
______________________________________
e) H4As2O7
______________________________________
______________________________________
f) HCIO4
______________________________________
______________________________________
h) Construir a fórmula estrutural do H3PO3.
EXERCÍCIOS
g) H3PO4
______________________________________
______________________________________
1) Escrevas as equações de ionização total dos
seguintes ácidos:
a) H2SO4
3) Cite três propriedades dos ácidos.
R.:____________________________________
______________________________________
______________________________________
b) H3PO4
c) H3 [Fe(CN)6]
d) H2CO3
2) Classifique os ácidos abaixo quanto a presença de oxigênio, número de hidrogênios ionizáveis e força.
a) HBr
______________________________________
______________________________________
b) HClO
______________________________________
______________________________________
4) Qual a característica dos ácidos cujos nomes
terminam por ídrico.
R.:____________________________________
______________________________________
5) Em cada um dos grupos, disponha os ácidos
em ordem crescente de força:
a) H2S, HI, HF
______________________________________
______________________________________
b) HNO3, HNO2
______________________________________
______________________________________
c) HClO4, HClO3, HClO2, HClO
______________________________________
______________________________________
d) HClO4, H2SO4, H3PO4, HClO
______________________________________
______________________________________
9
n) ácido cianídrico
_____________________
o) ácido arsênico
_____________________
6) Dê o nome dos seguintes ácidos:
a) H3PO2
___________________________
p) ácido pirofosfórico ____________________
b) H4P2O7
___________________________
c) HF
___________________________
d) H3BO3
___________________________
e) H3PO3
___________________________
f) H2S
___________________________
g) HIO2
___________________________
h) HCN
___________________________
i) HNO3
___________________________
j) H3AsO4
___________________________
q) ácido ciânico
7) Dê a fórmula molecular e a estrutural dos
ácidos :
a) ácido iódico
b) ácido sulfúrico
l) H4Fe(CN)6 ___________________________
7) Escreva a fórmula dos seguintes ácidos:
a) ácido sulfúrico
_____________________
b) ácido nitroso
_____________________
c) ácido hipofosforoso
_______________
d) ácido fosfórico
_____________________
e) ácido iódico
_____________________
f) ácido periódico
_____________________
g) ácido nítrico
_____________________
c) ácido carbônico
d) ácido nitroso
e) ácido nítrico
h) ácido manganoso _____________________
i) ácido carbônico
_____________________
j) ácido brômico
_____________________
k) ácido metafosfórico
f) ácido perclórico
_______________
l) ácido hipocloroso _____________________
m) ácido sulfuroso
_____________________
_____________________
g) ácido sulfuroso
10
8) Por que o ácido hipofosforoso (H3PO2) e o
ácido fosforoso H3PO3), apesar de possuírem
três hidrogênios nas respectivas moléculas,
não são triácidos? Justifique através da fórmula estrutural.
9) Em que condições os ácidos conduzem corrente elétrica? Justifique a sua resposta exemplificando através da equação de ionização.
______________________________________
______________________________________
______________________________________
______________________________________
10) Complete a tabela abaixo, seguindo o exemplo do ânion brometo:
Ânion
Nome do
ânion
brometo
Ácido
Fórmula do
ânion
Br-
Nome do
ácido
Ác. bromídrico
Classificação
Fórmula do
ácido
HBr
SO42ác. nítrico
H2CrO4
CNOfosfato
ác. iódico
H3BO3
MnO4cianeto
HNO2
hipoclorito
ClO2ác. clórico
HClO4
sulfito
Fác. brômico
HBrO
hipoiodito
S2ác. iódico
Presença de
oxigênio
hidrácido
Número de
H+
monoácido
Força
forte
11
3 - Estudo das Bases
3.1 - Conceito de Arrhenius.
Base é toda substância que em água se
dissocia, produzindo como ânion, somente o íon
OH-.
O íon OH-, denominado de hidróxido, é
responsável pelas propriedades que caracterizam as bases.
Equações de dissociação:
a) NaOH
Na+
b) Ca(OH)2
H2O
Ca2+ + 2 OH-
H2O
Al3+ + 3 OH-
c) Al(OH)3
d) KOH
e) Ba(OH)2
f) Fe(OH)3
Fracas: bases pouco dissociadas. São as
demais bases.
Exemplos: AgOH, Zn(OH)2, Al(OH)3, NH4OH.
3.3 - Nomenclatura e formulação.
Como as bases são formadas por um
cátion geralmente metálicos e por um ânion
(OH), a nomenclatura e a formulação das bases
são determinadas através da tabela de cátions.
+ OH-
H2O
Insolúveis: são todas as demais bases.
Exemplos: Al(OH)3, Fe(OH)3, Sn(OH)4.
c) Quanto à Força.
Fortes: bases muito dissociadas. São
bases fortes dos metais alcalinos e alcalinos
terrosos: (cálcio, bário e rádio).
Exemplos: NaOH, KOH, Ca(OH)2.
H2O
Nomenclatura:
H2O
H2O
Hidróxido de ......................................
nome do cátion
3.2 - Classificação das bases.
Exemplos:
-
a) Quanto ao número de OH .
a) NaOH
hidróxido de sódio
b) AgOH
hidróxido de prata
-
Monobases: apresentam apenas um OH .
Exemplos:
NaOH, KOH, NH4OH.
Dibases: apresentam dois OH-.
Exemplos:
Ca(OH)2, Ba(OH)2, Mg(OH)2.
Tribases: apresentam três OH-.
Exemplos:
Al(OH)3, Fe(OH)3.
Tetrabases: apresentam quatro OH-.
Exemplos:
Sn(OH)4, Pb(OH)4.
b) Quanto à solubilidade em água.
Solúveis: são as bases de metais alcalinos e amônio.
Exemplos: NaOH, KOH, NH4OH.
Pouco solúveis: são as bases de metais
alcalinos terrosos.
Exemplos: Ca(OH)2, Ba(OH)2, Mg(OH)2.
c) Fe(OH)3 hidróxido de ferro III
d) Cu(OH)2
e) LiOH
f) Sn(OH)4
Obs.: A amônia NH3, conhecida como amoníaco é um composto molecular e gasoso que ao
dissolver-se em água sofrem ionização produzindo como ânion o íon OH-. O produto da reação da amônia com água forma um composto
que pode ser representado por NH4OH, denominado de hidróxido de amônio (este só existe em
água). O fenômeno pode ser representado pela
equação:
NH3(g) + H2O(l)
NH4+(aq) + OH(aq)
NH4OH
12
Formulação:
Procura-se o cátion correspondente na
tabela e acrescenta-se um número OH-., igual a
carga do cátion.
Mex+ + OH-
Me(OH)x
Exemplos:
a) Hidróxido de lítio:
cátion: Li+ (monovalente)
no de OH-.= 1 OHfórmula da base: LiOH
b) Hidróxido de bário:
cátion: Ba2+ (divalente)
no de OH-. = 2 OHfórmula da base: Ba(OH)2
NH4OH
Ca(OH)2
Mg(OH)2
Al(OH)3
Cu(OH)2
AgOH
Fe(OH)3
hidróxido de amônio
hidróxido de cálcio
hidróxido de magnésio
hidróxido de alumínio
hidróxido de cobre II
hidróxido de prata
hidróxido de ferro III
3.4 - Propriedades das bases.
a) As bases, em geral, são iônicas por isso
quanto ao estado físico são sólidos, exceto o
NH4OH que só existe em solução aquosa..
b) Ação das bases sobre indicadores:
c) Hidróxido de alumínio:
meio
meio
indicadores
ácido
básico
fenolftaleína
incolor vermelha
metilorange
vermelha amarela
tornassol
vermelha
azul
azul de bromotimol amarela
azul
d) Hidróxido de ferro III:
c) As bases neutralizam os ácidos.
e) Hidróxido de zinco:
f) Hidróxido de ouro III:
g) Hidróxido de magnésio:
Algumas bases são muito utilizados no
nosso estudo, por esta razão procure memorizar
o nome e a fórmula das seguintes bases:
NaOH
KOH
hidróxido de sódio
hidróxido de potássio
d) A maioria das bases metálicas quando aquecidas se decompõem em óxido e água. As
bases dos metais alcalinos resistem ao aquecimento e podem ser fundidas.
Exemplos:
a) Cu(OH)2
CuO + H2O
b) Ca(OH)2
CaO + H2O
Obs.: O NH4OH se decompõem, segundo a equação:
NH4OH
NH3 + H2O
e) As bases conduzem corrente elétrica em solução aquosa. As bases de metais alcalinos,
também conduzem no estado fundido.
EXERCÍCIOS
1) Escreva a equação de dissociação iônica das
bases:
a) hidróxido de lítio
13
b) hidróxido de magnésio
e) hidróxido de zinco
c) hidróxido ferro III
f) hidróxido de mercúrio II
d) hidróxido de zinco
g) hidróxido prata
e) hidróxido ouro III
2) Cite três propriedades das bases.
R.:____________________________________
______________________________________
______________________________________
h) hidróxido de estanho IV
3) Classifique quanto à força, número de OH- e
à solubilidade em água, as seguintes bases:
j) hidróxido de cádmio
a) Pb(OH)2
b) KOH
c) Mn(OH)4
d) Sr(OH)2
e) Fe(OH)3
f) Co(OH)3
4) Obtenha a fórmula das seguintes bases:
a) hidróxido de sódio
b) hidróxido níquel III
c) hidróxido de magnésio
d) hidróxido de estanho II
i) hidróxido cobre II
5) Dê os nomes das bases:
a) KOH
_________________________
b) Ba(OH)2
_________________________
c) Mg(OH)2
_________________________
d) Bi(OH)3
_________________________
e) LiOH
_________________________
f) Be(OH)2
_________________________
g) Al(OH)3
_________________________
h) Cr(OH)3
_________________________
i) NH4OH
_________________________
j) AgOH
_________________________
6) Dê o nome das seguintes bases empregando
os sufixos oso e ico para os cátions:
a) Fe(OH)2
_________________________
b) Cu(OH)2
_________________________
c) Pt(OH)4
_________________________
d) Sn(OH)4
_________________________
e) Ni(OH)3
_________________________
f) Fe(OH)3
_________________________
14
j) Hg2(OH)2
_________________________
g) CuOH
_________________________
l) Au(OH)3
_________________________
h) Co(OH)2
_________________________
m) Ni(OH)2
_________________________
i) AuOH
_________________________
10) Complete a tabela abaixo, seguindo o exemplo do hidróxido de lítio:
Nome da base
Hidróxido de lítio
Fórmula da base Solubilidade
LiOH
Ca(OH)2
Hidróxido de prata
Al(OH)3
Hidróxido de magnésio
Fe(OH)2
Hidróxido de ouro III
KOH
Hidróxido de cádmio
NH4OH
Hidróxido de zinco
CuOH
Hidróxido de bário
Pb(OH)4
Hidróxido de sódio
Sr(OH)2
Hidróxido de césio
Ra(OH)2
Hidróxido de ferro III
Hg(OH)2
Hidróxido de rubídio
Ni(OH)3
Hidróxido de ouro I
Co(OH)3
solúvel
Número de OH-
Força
monobase
forte
45












