
FACULDADE TECSOMA
Curso biomedicina
Marco Antônio Silvério Ribeiro
COMPARAÇÃO METODOLÓGICA PARA A ANÁLISE DA TIRA
REATIVA DE URINA E SEDIMENTOSCOPIA URINÁRIA:
leucocitúria e hematúria
Paracatu – MG
2012
Marco Antônio Silvério Ribeiro
COMPARAÇÃO METODOLÓGICA PARA A ANÁLISE DA TIRA
REATIVA DE URINA E SEDIMENTOSCOPIA URINÁRIA:
leucocitúria e hematúria
Monografia apresentada ao Curso de
Biomedicina da Faculdade TECSOMA,
como requisito parcial para obtenção de
título de Bacharel em Biomedicina
Orientador temático: MS. Cláudia Peres da Silva
Co-orientador temático: Betânia Nunes Oliveira
Orientador Metodológico: Geraldo Benedito Batista
Paracatu – MG
2012
Marco Antônio Silvério Ribeiro
COMPARAÇÃO METODOLÓGICA PARA A ANÁLISE DA TIRA
REATIVA DE URINA E SEDIMENTOSCOPIA URINÁRIA:
leucocitúria e hematúria
Monografia apresentada ao Curso de
Biomedicina da Faculdade TECSOMA,
como requisito parcial para obtenção de
título de Bacharel em Biomedicina
________________________________________
Cláudia Peres da Silva (Orientador temático) – Faculdade TECSOMA
_________________________________________
Geraldo Benedito Batista (Orientador metodológico) – Faculdade TECSOMA
_________________________________________
Márden Mattos Junior – Faculdade TECSOMA
Paracatu, 15 de junho de 2012.
Aos meus pais, amigos e familiares
por todo o incentivo e carinho.
AGRADECIMENTOS
Agradecer primeiramente a minha família pelo apoio incondicional. A
meus pais, Alzira e Antônio, e meus irmãos, Paulo e Cláudia, que contribuíram
e incentivaram em meus estudos.
A todos os professores que passaram pela minha vida acadêmica, em
especial Camila Henriques Coelho, o maior exemplo de profissional biomédico
ao qual pude conhecer durante a minha formação e Rita de Cássia Medeiros,
que repassou valiosos ensinamentos.
Aos meus amigos, sempre presentes, Gabriela, Daiana, Phellipe,
Ueliton, Mara e Agda, o meu muito obrigado.
A minha orientadora Cláudia Peres da Silva e co-orientadora Betânia
Nunes Oliveira que me ampararam no desenvolvimento e conclusão deste
trabalho.
E a todos que direta ou indiretamente auxiliaram para a realização desta
pesquisa.
“Hoje, a urinálise é a arte da fita de imersão. É uma tecnologia
relegada a segundo plano e muitas vezes banida a um canto obscuro
do laboratório. Entretanto, com a aplicação de certos cuidados e de
atenção, é um dos mais valiosos entre todos os exame laboratoriais.”
(CIRIADES, 2010, p. 174).
RESUMO
Este estudo traz um comparativo entre as tiras reagentes de urina das marcas
Biocolor e Uriquest plus em comparação a sedimentoscopia urinária avaliandose a hematúria e a leucocitúria. O objetivo foi comparar os resultados para a
hematúria e a leucocitúria entre as marcas de tiras reagentes Biocolor e
Uriquest plus utilizadas no exame químico da urina com a sedimentoscopia
urinária. Utilizou como grupo de estudo, pacientes atendidos no Laboratório
Paulo Netto do município de João Pinheiro/MG para realizar o EAS. Os
resultados da análise física, química e da sedimentoscopia urinária foram
comparados observando-se o indício, presença ou ausência de hematúria,
hemoglobinúria
e
leucocitúria,
avaliando-se
em
caráter
estatístico
a
sensibilidade, especificidade, concordância e valores preditivos positivos e
negativos de cada etapa para com o comparativo das tiras reativas. As tiras
foram avaliadas quanto à reação química adotada para cada kit, largura da tira
e das almofadas reagentes, tempo para ocorrer à reação, visibilidade e
estabilidade da reação. Considerou-se hematúria valores superiores a duas
hemácias por campos contados, assim como valores superiores a cinco
leucócitos por campos contados, considerou-se como leucocitúria. Na tira
reativa de urina, considerou-se hematúria, resultados positivos para a tira
reativa de urina, diferenciando a hematúria de hemoglobinúria, assim como
reação positiva para a esterase de leucócitos, foi considerado leucocitúria. 67
pacientes participaram do estudo, sendo que 42 (64%) são do sexo feminino e
25 (36%) são do sexo masculino. Dos pacientes que apresentaram resultados
positivos para hematúria/hemoglobinúria e leucocitúria na tira reativa de urina,
9 (82%) são do sexo feminino e 2 (18%) do sexo masculino. As 3 (27%)
amostras positivas para leucocitúria foram de pacientes do sexo feminino. A
concentração de hemácias e leucócitos mostraram concordância entre os
métodos selecionados de 97% e 100%, respectivamente, demonstrando que a
tira reativa de urina apresentou boa precisão e concordância com a análise
física e a sedimentoscopia urinária.
Palavras-chave: Tira reativa de urina. Hematúria. Leucocitúria
ABSTRACT
This investigation brings a compare among the urine reative strips from Biocolor
and Uriquest plus marks in comparasion with urine sedimentoscopy evaluating
hematuria and leukocyturia. The purpose was compare the results for
hematuria an leukocyturia among the marks Biocolor and Uriquest plus of urine
reative
strips,
used
in
the
urine
chemical
examination,
with
urine
sedimentoscopy. It was used as the studied group, pacients submitted to EAS
examination at Paulo Netto’s Laboratory from the city of João Pinheiro/MG. The
results from the physical and chemical analysis and the urine sedimentoscopy
were compared observing the clue, presence and abscense of hematuria, free
hemoglobin and leukocyturia, evaluating the statiscal charater of sensibility,
specificity, concordance and positive and negative predictives values from each
step for a comparative of the reagent strips. The strips were evaluated from the
chemical reaction adopted for each kit, the strip width and the reagent pad, time
to occur the reaction, visibility and stability of the reaction. It was considered
hematuria values higher than two erythrocytes from counted field, as well as
values higher than five leukocytus from counted field was considered
leukocyturia. In the urine reative strip, it was considered hematuria, positive
results for the urine reative strip, differentiating hematuria from hemoglobinuria,
as well as positive reaction for leukocytes esterase, was considered
leukocyturia. 67 pacients were included in this investigation, being 42 (64%) of
them female and 25 (36%) are male. From the patients that showed positive
results for hematuria/hemoglobinuria and leukocyturia in the urine reative strips,
9 (82%) are female and 2 (18%) are male. The 3 (27%) positive samples for
leukocyturia were from female patients. The concentration of erythrocytes and
leukocytes showed concordance among the selected methods of 97% and
100%, respectively, showing that the urine reative strip presented precision and
strong concordance with the physical analisys and urine sedimentoscopy.
Keywords: Reagent strips of urine. Hematuria. Leucocyturia.
LISTA DE ABREVIATURAS
a.C. – antes de Cristo
ADH – Hormônio antidiurético
dL – Decilitros
Fig. – Figura
Graf. – Gráfico
h – Horas
H1 – hematúria
H2 – hemoglobinúria
L – Litros
ml – Mililitros
mm – Milímetros
MG – Minas Gerais
pH – Potencial de hidrogenização
pKa – Constante de dissociação
Rpm – Rotações por minuto
TFG – Taxa de filtração glomerular
LISTA DE FIGURAS
FIGURA 1 – Sistema urinário ........................................................................... 22
FIGURA 2 – Processo de filtração e processamento tubular ........................... 26
FIGURA 3 – Fisiologia renal ............................................................................. 29
FIGURA 4 – Tira reativa de urina Uriquest plus, Labtest ................................. 35
FIGURA 5 – Tira reativa de urina Biocolor, Bioeasy ........................................ 36
FIGURA 6 – Tabela de cores para Glicose Tira Uriquest plus, Labtest ........... 37
FIGURA 7 – Tabela de cores para Glicose Tira Biocolor, Bioeasy .................. 37
FIGURA 8 – Tabela de cores para Hemácias/sangue Tira Uriquest plus,
Labtest e Biocolor, Bioeasy .......................................................... 38
FIGURA 9 – Tabela de cores para Esterase leucocitária Tira Uriquest plus,
Labtest e Biocolor, Bioeasy .......................................................... 40
FIGURA 10 – Tabela de cores para Nitrito Tira Uriquest plus, Labtest e
Biocolor, Bioeasy ....................................................................... 41
FIGURA 11 – Tabela de cores para Bilirrubina Tira Uriquest plus, Labtest ..... 42
FIGURA 12 – Tabela de cores para Bilirrubina Tira Uriquest plus, Labtest ..... 43
FIGURA 13 – Tabela de cores para Urobilinogênio Tira Uriquest plus,
Labtest e Biocolor, Bioeasy ....................................................... 44
FIGURA 14 – Tabela de cores para pH Tira Uriquest plus, Labtest
Biocolor, Bioeasy ....................................................................... 45
FIGURA 15 – Tabela de cores para Densidade Tira Uriquest plus, Labtest e
Biocolor, Bioeasy ....................................................................... 46
FIGURA 16 – Tabela de cores para Proteínas Tira Uriquest plus, Labtest e
Biocolor, Bioeasy ....................................................................... 47
FIGURA 17 – Tabela de cores para Corpos cetônicos Tira Uriquest plus,
Labtest e Biocolor, Bioeasy ....................................................... 48
FIGURA 18 – Tabela de cores para Ácido ascórbico Tira Uriquest plus,
Labtest ....................................................................................... 49
LISTA DE GRÁFICOS
GRÁFICO 1 Distribuição do total de amostras em relação ao sexo ................. 57
GRÁFICO 2 Distribuição de amostras positivas para hematúria/hemoglobinúria
e leucocitúria em relação ao sexo ................................................ 58
LISTA DE QUADROS
QUADRO 1 Influência pré-analítica.................................................................. 17
QUADRO 2 Aspecto e cor da urina .................................................................. 34
QUADRO 3 Avaliação das tiras reativas de urina Uriquest plus e Biocolor ..... 59
LISTA DE TABELAS
TABELA 1 Classificação dos resultados semiquantitativos: bactérias, cilindros,
muco, células epiteliais e cristais .................................................... 55
TABELA 2 Comparação entre as tiras reativas de urina e a sedimentoscopia
para hematúria/hemoglobinúria e leucocitúria ................................ 60
TABELA 3 Concordância entre a contagem de hemácias e reações positivas
para sangue na tira reativa de urina ............................................... 61
TABELA 4 Concordância entre a contagem de leucócitos e reações positivas
para esterase de leucócitos na tira reativa de urina ....................... 61
SUMÁRIO
1 INTRODUÇÃO ............................................................................................. .16
1.1 Justificativa............................................................................................... 19
1.2 Objetivos .................................................................................................. 20
1.2.1 Objetivo geral ........................................................................................ 20
1.2.2 Objetos específicos............................................................................... 20
2 URINÁLISE ................................................................................................... 21
2.1 Sistema urinário ....................................................................................... 21
2.2 Anatomia e fisiologia renal ...................................................................... 23
2.3 Fisiologia renal ........................................................................................ 26
2.3.1 Filtração ................................................................................................. 27
2.3.2 Reabsorção tubular ............................................................................... 27
2.3.3 Secreção tubular ................................................................................... 28
2.3 Formação da urina .................................................................................. 29
2.4 Fisiopatologia ........................................................................................... 30
2.5 Elementos anormais e sedimento .......................................................... 31
2.5.1Análise física .......................................................................................... 32
2.5.1.1 Cor ....................................................................................................... 32
2.5.1.2 Aspecto .............................................................................................. 33
2.5.1.3 Volume urinário .................................................................................. 33
2.5.2 Tiras reativas ......................................................................................... 35
2.5.2.1 Glicose ............................................................................................... 37
2.5.2.2 Hemácias/sangue ............................................................................... 38
2.5.2.3 Esterase leucocitária.......................................................................... 39
2.5.2.4Nitrito .................................................................................................... 40
2.5.2.5 Bilirrubina ........................................................................................... 42
2.5.2.6 Urobilinogênio ................................................................................... 43
2.5.2.7 pH ........................................................................................................ 44
2.5.2.8 Densidade ........................................................................................... 45
2.5.2.9 Proteínas ............................................................................................. 46
2.5.2.10 Corpos cetônicos ........................................................................... 47
2.5.2.11 Ácido ascórbico................................................................................ 48
2.5.3 Sedimentoscopia urinária..................................................................... 49
2.5.3.1 Hemácias............................................................................................. 49
2.5.3.2 Leucócitos ......................................................................................... 50
2.5.3.3 Outros elementos ............................................................................... 50
4 METODOLOGIA ........................................................................................... 52
4.1 Análise física da urina.............................................................................. 53
4.2 Análise química da urina ......................................................................... 54
4.2.1 Tira Biocolor ......................................................................................... 54
4.2.2 Tira Uriquest plus .................................................................................. 54
4.3 Sedimentoscopia urinária........................................................................ 55
5 RESULTADOS .............................................................................................. 57
6 DISCUSSÃO ................................................................................................. 62
7 CONCLUSÃO ............................................................................................... 63
REFERÊNCIAS ................................................................................................ 64
APÊNDICES .................................................................................................... 67
16
1 INTRODUÇÃO
O exame de urina proporciona informações relevantes sobre a função
renal, hepática, equilíbrio ácido-básico, metabolismo de carboidratos e
infecções do trato urinário. Pela sua simplicidade, baixo custo e fácil obtenção
é considerado um exame de rotina. (BIOEASY, 2010; COLOMBELI, 2006;
RAVEL, 2009; STRASINGER; DI LORENZO, 2009).
Basicamente o exame de urina divide-se em três etapas: exame físico,
químico e a sedimentoscopia urinária. (COSTAVAL et al., 2001).
O exame físico de urina inclui a descrição de características físicas,
como cor, aspecto e volume urinário. (MUNDT; SHANAHAN, 2012).
No exame químico, é feita a análise dos constituintes bioquímicos da
urina através de tiras reagentes, com o objetivo de tornar a determinação de
elementos da urina mais rápida, mais simples e mais econômica. Ela permite
avaliar dez ou mais parâmetros bioquímicos clinicamente importantes, como
urobilinogênio, glicose, corpos cetônicos, bilirrubina, proteína, nitrito, potencial
de hidrogenização (pH), densidade, sangue e leucócitos. (BIOEASY, 2010;
COLOMBELI; FALKENBERG, 2006).
“Há algumas variações relativas a reações químicas, sensibilidade,
especificidade, e ocorrência de substâncias interferentes entre as tiras reativas
de urina presentes no mercado.” (STRASINGER; DI LORENZO, 2009, p. 162).
As tiras Biocolor contêm um suporte com 10 parâmetros em detrimento da tira
Uriquest plus que apresenta 11, como diferencial o acréscimo da reação para o
ácido ascórbico e variações entre as reações para a glicose, urobilinogênio,
sangue, nitrito, leucócitos e densidade. (BIOEASY, 2010; LABTEST, 2009).
Inúmeras variáveis podem intervir no desempenho da fase analítica e,
consequentemente, na exatidão e precisão dos resultados dos exames, vitais
para a conduta médica e, em última instância, para o bem-estar do paciente. A
contaminação menstrual, enzimas bacterianas, ácido ascórbico e formol são
alguns interferentes, em destaque a interferência de medicamentos em
análises clínicas que assume importante papel na rotina laboratorial por
interferir nos ensaios e modificar o diagnóstico clínico-laboratorial. (FERREIRA
et al., 2009; LABTEST, 2009; STRASINGER; DI LORENZO, 2009).
17
Nas reações para a tira reativa de urina podem ocorrer falso-negativos e
falso-positivos em todos os parâmetros analisados na tira pela ação de
diversas classes de medicamentos. (BIOEASY, 2010; LABTEST, 2009).
A bula da marca Bayer Multistix® 10 SG destaca suas limitações na
presença de captopril, fato também relatado por Labtest (2009), no qual age
interferindo na sensibilidade do teste de hemoglobina em tira reagente para
exame de urina, acarretando em um falso negativo. (STRASINGER; DI
LORENZO, 2009; LIESENFELD et al., 2009).
Segundo Bonini e colaboradores (2002), a literatura sobre erros
laboratoriais é escassa, mas foi possível verificar que uma grande parcela
destes erros ocorre nas fases pré ou pós-analíticas, evidenciando assim a
importância da etapa pré-analítica na incidência dos erros laboratoriais.
No quadro 1, Labtest (2009) relaciona alguns fatores pré-analíticos que
podem influenciar nos resultados obtidos na tira reativa.
Bilirrubina
Corpos cetônicos
Densidade
Glicose
Leucócitos
Nitrito
Ph
Proteína
Sangue
Urobilinogênio
Quadro 1 – Influência pré-analítica
Diminuição/Ausência
Aumento/Presença
Luz solar direta sobre a
______
amostra
Evaporação das cetonas Jejum
prolongado,
gravidez, exercício físico
Ingestão acentuada de
líquidos, utilização de
______
diuréticos
Bacteriúria
Intoxicação
com
chumbo, gravidez
______
Contaminação
com
secreção vaginal
Baixa
ingestão
de Crescimento bacteriano
vegetais, conversão de em urinas armazenadas
nitrito a nitrogênio
à temperatura ambiente
por mais de duas horas
Produção de amônia por
______
bactérias produtoras de
uréase
Gravidez
______
Contaminação
com
menstruação
Luz solar direta, amônia Acetona, bilirrubina
Fonte: Adaptado de LABTEST, 2009.
18
O exame químico para hemoglobina e esterase leucocitária fornecem
bons indicadores para a presença de sangue e leucócitos na urina. A
sedimentoscopia urinária detecta hemácias e leucócitos intactos, mas a
hemoglobina livre e leucócitos lisados não são detectados. (FULLER;
THREATTE; HENRY, 2008; STRASINGER; DI LORENZO, 2009).
Strasinger e Di Lorenzo (2009) citam que a técnica imprópria pode levar
a erros. Elementos formados como hemácias e leucócitos, sedimentam na
parte inferior da amostra e não serão detectados em uma amostra de urina não
homogeneizada.
“As áreas reagentes que sofrem influência frente à presença de ácido
ascórbico são glicose e sangue, por isso estão protegidos de sua ação
antioxidante reduzindo a frequência de resultados falso-negativos e a
necessidade de se obter nova amostra.” (LABTEST, 2009, p. 01). Bioeasy
(2010) salienta que a tira Biocolor detecta hemoglobina livre somente em
valores de ácido ascórbico inferiores a 50 mg/dL, ao qual deve ser avaliado
independentemente.
Lyon e colaboradores citado por Colombeli (2006), definiram em 58% a
sensibilidade da esterase de leucócitos para sua capacidade em prever a
quantidade de leucócitos no sedimento urinário, porém observaram uma
relação inversamente proporcional entre a densidade e a sensibilidade para a
esterase de leucócitos. Wallach (2011) reforça que o ensaio não oferece
condições para medir a concentração de leucócitos e desta forma, a
quantificação deve ser feita durante análise do sedimento urinário.
Em relação à interpretação de resultados positivos para a hematúria,
presença de sangue na urina e leucocitúria, presença de leucócitos na urina,
deve-se ater a algumas condições onde a sua presença não necessariamente
representa uma condição patológica. (CARMO et al., 2007; RAVEL, 2009).
Wallach (2011) exemplifica esta condição ao relatar que a hematúria pode ser
encontrada em até 18% das pessoas após exercício físico muito extenuante,
assim como Labtest (2009) ao citar que a presença de fluidos vaginais na urina
pode acarretar em falsos positivos para a leucocitúria.
No Brasil, devido à despadronização dos métodos de análise do
sedimento urinário, acarreta em problemas metodológicos, contribuindo para a
imprecisão dos resultados, todavia, devido à excreção normal de um número
19
pequeno de elementos celulares, a grande maioria dos resultados dos exames
em amostras normais não contaminadas mantém-se dentro dos valores
clínicos normais, independentemente do grau de centrifugação da amostra.
(BOTTINI; GARLIPP, 2006; RAVEL, 2009).
Atualmente, tanto o National Committee for Clinical Laboratory
Standards dos EUA como o European Urinalysis Guidelines sugerem a
padronização da contagem de células no exame de urina. O exame do
sedimento urinário, de grande utilidade clínica, deve ser realizado por meio de
um sistema automatizado e/ou de um procedimento padronizado em uma
câmara de contagem de células de volume pré-definido. (BOTTINI; GARLIPP
2006; COSTA et al., 2006).
Conforme foi citado no estudo de Costaval e outros (2001, p. 264) por
Ringsrud e Linné, orienta-se que a decisão de se realizar a
microscopia do sedimento deve ser de cada laboratório
individualmente, com base na característica de sua clientela, [...] e
sugere que [...] ela deve ser feita quando solicitada pelo clínico,
quando determinada pelo protocolo do laboratório ou quando se
encontram anormalidades no exame físico-químico.
Diversas técnicas laboratoriais para a análise da urina foram
implantadas na tentativa de se automatizar a análise química pela tira reativa
de urina e a microscópica do sedimento urinário, com o objetivo de auxiliar o
microscopista na liberação de resultados mais rápidos e precisos. Contudo, o
método manual ainda é o mais empregado, provavelmente devido a fatores
econômicos e/ou estruturais. (BOTTINI; GARLIPP, 2006; COLOMBELI;
FALKENBERG, 2006; COSTA et al., 2006; MUNDT; SHANAHAN, 2012).
1.1 Justificativa
Em exames de urina, boa parte dos estudos de interferência relacionase com a pesquisa de drogas de abuso ou hormônios, havendo relativamente
poucos estudos de interferência em fitas de urinálise e na prevalência de
hematúria e leucocitúria. (COLOMBELI, 2006, BASTOS; MARTINS; DE
PAULA; 2000). Sua aplicabilidade segundo Machado e colaboradores (2003),
em um resultado positivo na tira reagente é um pré-requisito usado com
segurança para que a sedimentoscopia urinária seja executada.
20
Alguns inconvenientes no uso de tiras reagentes semi-quantitativas são
os bem conhecidos resultados falso-positivos e falso-negativos, quando as
leituras não são padronizadas, principalmente, levando-se em conta a
qualidade das tiras, o tempo entre a imersão da tira reagente na urina que pode
provocar a saída de reagentes das almofadas e a leitura visual da cor
resultante
da
reação.
(LABTEST,
2009;
MACHADO
et
al.,
2003;
STRASINGER; DI LORENZO, 2009).
A meta do laboratório clínico é produzir resultados exatos e precisos.
Componentes endógenos e/ou exógenos presentes em fluidos biológicos
podem interferir na exata determinação de um analito. (FULLER; THREATTE;
HENRY, 2008; RAVEL, 2009). Define-se interferência como “o efeito da
substância presente na amostra que altera o valor correto do resultado,
usualmente expresso como concentração ou atividade para um analito”.
(COLOMBELI; FALKENBERG, 2006, p. 91).
1.2 Objetivos
A seguir estão descritos os objetivos propostos neste trabalho.
1.2.1 Objetivo geral
Comparar os resultados para a hematúria e a leucocitúria entre as
marcas de tiras reagentes Biocolor e Uriquest plus utilizadas no exame químico
da urina com a sedimentoscopia urinária.
1.2.2 Objetivos específicos
Associar os dados obtidos pelas tiras reagentes no exame químico da
urina com o exame físico da urina e a sedimentoscopia urinária;
Correlacionar os dados obtidos e avaliar a confiabilidade frente à
comparação dos métodos selecionados;
Coletar dados relevantes para o estudo através do uso da entrevista
estruturada, abordando possíveis interferentes.
21
2 URINÁLISE
O primórdio da medicina laboratorial se deu pela análise da urina. As
primeiras descrições datam de desenhos dos tempos das cavernas e nos
hieróglifos egípcios, como o de Edwin Smith Surgical Papyrus. (COLOMBELI,
2006; FUNCHAL; MASCARENHAS; GUEDES, 2008; FULLER; THREATTE;
HENRY, 2008; RAVEL, 2009; STRASINGER; DI LORENZO, 2009).
No século V antes de Cristo (a.C.), Hipócrates propôs em um livro sobre
“uroscopia” as primeiras etapas do exame de urina. Inicialmente analisando-se
parâmetros mais simples, como cor, odor e sabor, o exame de urina evoluiu,
ganhando complexidade, fato observado pela implantação do exame do
sedimento urinário e o desenvolvimento por Thomas Addis de métodos de
quantificação do exame microscópico de sedimento que surgiram no século
XVII, com a introdução do microscópio. (COLOMBELI; FALKENBERG, 2006;
STRASINGER; DI LORENZO, 2009).
A partir de 1827, o exame de urina começou a fazer parte do exame
médico de rotina do paciente, e no século XX, devido à expansão do
conhecimento técnico-científico, veio a se tornar a urinálise como ciência. Por
ser uma amostra de fácil obtenção e exigir métodos simples e baratos, e que
permite obter informações de muitas das principais funções metabólicas do
organismo é considerado exame de rotina, tendência atual da medicina
preventiva e de menores custos médicos. (FUNCHAL; MASCARENHAS;
GUEDES, 2008; FULLER; THREATTE; HENRY, 2008; STRASINGER; DI
LORENZO, 2009).
2.1 Sistema urinário
O sistema urinário é formado por quatro componentes principais, como
pode ser visualizado na Figura 1: o rim, local onde a urina é formada a partir da
filtração do sangue, os ureteres, que conduzem a urina até a bexiga, ao qual
armazena a urina produzida e a uretra que transporta a urina para ser
eliminada do organismo. (FUNCHAL; MASCARENHAS; GUEDES, 2008;
MUNDT; SHANAHAN, 2012).
22
Figura 1 – Sistema urinário
Fonte: MUNDT; SHANAHAN, 2012
Os rins são os meios primários para excretar os metabólitos, devendo
ser eliminados do organismo tão rapidamente quanto são produzidos.
(GUYTON; HALL, 2006). Removem do sangue os produtos de metabolismo
como a uréia, ácido úrico e creatinina, e retém substâncias valiosas tais como a
glicose, aminoácidos e proteínas. (BAYNES; DOMINICZAK, 2007; FULLER;
THREATTE; HENRY, 2008).
23
A função excretora dos rins inclui a filtração do plasma nos glomérulos,
transporte de água e solutos a partir do lúmen tubular de volta para o sangue
(reabsorção tubular), e a secreção de diferentes substâncias a partir das
células tubulares para o lúmen. (BAYNES; DOMINICZAK, 2007).
2.2 Anatomia e fisiologia renal
Os rins estão situados um de cada lado da coluna vertebral, no espaço
retroperitoneal. Cada rim de um humano adulto pesa cerca de 150 gramas e
tem o tamanho aproximado de uma mão fechada e por conta da localização
anatômica do fígado, o rim direito encontra-se ligeiramente mais abaixo do rim
esquerdo. É um órgão em forma de feijão, e sua borda medial contém uma
indentação, o hilo renal, através do qual a artéria renal penetra no rim, e a veia
renal e o ureter deixam o rim, assim como vasos linfáticos e o suprimento
nervoso. O rim é circundado por uma cápsula fibrosa resistente que protege as
estruturas internas, mais delicadas, encimado pela glândula adrenal. (COMPRINARDY; STELLA; OLIVEIRA, 2011; GUYTON; HALL, 2006; MUNDT;
SHANAHAN, 2012).
A dissecção longitudinal completa de um rim permite visualizar duas
regiões principais: uma mais externa, o córtex, e uma interna, denominada
como medula. A medula se divide em múltiplas massas teciduais com o
formato de cones, as pirâmides renais. Na base de cada pirâmide entre as
regiões cortical e medular, na borda externa da pelve estão divididas os cálices
maiores e menores, os quais coletam a urina dos túbulos de cada papila. As
paredes dos cálices, pelve e ureter contêm elementos contráteis que propelem
a urina em direção a bexiga, onde a urina é armazenada até que seja eliminada
pela micção. (GUYTON; HALL, 2006).
A bexiga é uma câmara de músculo liso composta de duas partes
principais: o corpo, a parte principal da bexiga e onde a urina é armazenada e o
colo, uma extensão afunilada do corpo, passando inferior e anteriormente ao
triângulo urogenital e conectando-se com a uretra. (GUYTON; HALL, 2006;
MUNDT; SHANAHAN, 2012).
O córtex e a medula renais contêm os túbulos renais, os túbulos dos
néfrons e os ductos coletores. O néfron é a principal unidade funcional do rim,
24
e possui mais de um milhão de néfrons em cada um, no entanto, ele não pode
regenerar
novos
néfrons.
Portanto
com
a
lesão
renal,
doença
ou
envelhecimento, há um gradual declínio no número de néfrons. (COMPRINARDY; STELLA; OLIVEIRA, 2011; GUYTON; HALL, 2006).
O néfron é constituído por um plexo capilar chamado glomérulo, pelo
qual grande quantidade de líquido é filtrada do sangue e um túbulo complexo,
no qual o líquido filtrado é convertido em urina no trajeto para a pelve renal. Ele
é dividido pela cápsula de Bowman, uma terminação de túbulo cega,
invaginada e dilatada, e os túbulos contorcidos proximal e distais, que se ligam
entre si pela alça de Henle, constituída pelo ramo descendente, curvatura em
grampo e ramo ascendente. (GUYTON; HALL, 2006; COMPRI-NARDY;
STELLA; OLIVEIRA, 2011; MUNDT; SHANAHAN, 2012). As paredes do ramo
descendente e da curvatura em grampo são muito finas e, portanto, são
denominadas de segmento fino da alça de Henle, e como seus nomes
denotam, possuem membranas finas, poucas mitocôndrias e níveis mínimos de
atividade metabólica, já o ramo ascendente por possuir paredes mais
espessas, são denominadas de segmento espesso do ramo ascendente, e por
possuírem células epiteliais espessas, apresentam alta atividade metabólica e
são capazes de reabsorção ativa de sódio, potássio e cloreto. (GUYTON;
HALL, 2006; LIESENFELD et al., 2009).
A função dos glomérulos é a filtração do plasma e para que ela ocorra à
pressão dos capilares dos glomérulos deve ser maior que a pressão dentro do
túbulo. (MUNDT; SHANAHAN, 2012). Na formação do glomérulo, a arteríola
aferente penetra na cápsula de Bowman, ramificando-se para aumentar a área
de filtração, reunifica-se e então sai como arteríola eferente. (COMPRI-NARDY;
STELLA; OLIVEIRA, 2011). O espaço formado entre a cápsula e o glomérulo
corresponde ao espaço de Bowman, onde o plasma dos capilares glomerulares
é filtrado. (MUNDT; SHANAHAN, 2012).
A filtração glomerular depende do tamanho da superfície de filtração e
da permeabilidade da barreira de filtração que inclui a camada de células
endoteliais com os poros característicos conhecidos como fenestrações. As
fenestrações na camada endotelial formam uma peneira filtrante que permite a
livre passagem de água e moléculas de baixo peso molecular. A filtração de
25
moléculas maiores através desta barreira é limitada pelo tamanho, forma e
carga elétrica. (BAYNES; DOMINICZAK, 2007).
O líquido filtrado dos capilares glomerulares flui para o interior da
cápsula de Bowman e daí para o interior do túbulo proximal, que se situa na
zona cortical renal. (GUYTON; HALL, 2006). No interior do córtex renal, as
células da arteríola aferente estabelecem contato com as células da mácula
densa do túbulo distal, formando o aparelho justaglomerular. Ele mantém a
pressão sanguínea em uma taxa relativamente constante, independente das
flutuações da pressão sanguínea sistêmica, pela regulação da dilatação e da
constrição da arteríola aferente, por meio de um mecanismo conhecido como
feedback tubuloglomerular. (MUNDT; SHANAHAN, 2012).
No túbulo proximal, todas as substâncias essenciais são completamente
reabsorvidas: glicose, aminoácidos, creatina, piruvato, lactato e ácido
ascórbico, todos eles absorvidos por transporte ativo por meio das membranas
celulares. Neste mesmo segmento, o sódio é reabsorvido pelo mecanismo de
bomba do sódio. A água, ácido carbônico (HCO3) e cloretos acompanham o
sódio por difusão passiva, e à medida que o filtrado desce pelo ramo
descendente da alça de Henle, perde um pouco de água para o fluído
intersticial, mas quando atravessa o ramo ascendente da alça, impermeável a
água, reabsorve mais sódio. Ao passar pelo túbulo contornado distal, todo o
sódio restante é reabsorvido em troca de potássio ou íons hidrogênio. Este
mecanismo envolve o hormônio aldosterona, um retentor de sódio. (BAYNES;
DOMINICZAK, 2007; COMPRI-NARDY; STELLA; OLIVEIRA, 2011).
Durante a passagem por este segmento e do ducto coletor primário,
pode ocorrer uma reabsorção facultativa da água, inteiramente dependente da
ação do hormônio antidiurético (ADH), também conhecido como vasopressina.
(COMPRI-NARDY; STELLA; OLIVEIRA, 2011). Embora os ductos coletores
medulares reabsorvam menos de 10% da água e do sódio filtrados, eles são o
local final para o processamento da urina e, portanto, tem um papel
extremamente importante na determinação da quantidade final de saída na
urina de água e de solutos. (GUYTON; HALL, 2006). Um desenho esquemático
do processo de filtração e processamento tubular pode ser visto na Figura 2.
26
Figura 2 – Processo de filtração e processamento tubular
Fonte: MUNDT; SHANAHAN, 2012
O fluxo de urina dos ductos coletores para o interior dos cálices
distende-os e aumenta sua atividade e com isso, iniciam-se contrações
peristálticas que se difundem para a pelve renal e ao longo do ureter,
propelindo a urina da pelve renal em direção à bexiga, até sua excreção, no
processo conhecido como micção. (FUNCHAL; MASCARENHAS; GUEDES,
2008).
2.3 Fisiologia renal
Os rins tomam parte em várias funções reguladoras: excreção de
metabólitos, tais como os produtos nitrogenados do catabolismo das proteínas
e ácidos e bases orgânicas e inorgânicas, eliminação de substâncias estranhas
ao organismo, regulação do equilíbrio ácido-básico, dos eletrólitos, como sódio,
potássio, cálcio e magnésio, osmolalidade dos líquidos corporais e da
concentração
de
eletrólitos,
regulação da
pressão
arterial, secreção,
metabolismo e excreção de hormônios, como a eritropoetina e renina bem
como a ativação da vitamina D e gliconeogênese. (GUYTON & HALL, 2006;
FULLER; THREATTE; HENRY, 2008).
Desta forma, o rim participa da homeostase por meio de três processos:
a filtração, na retenção de todas as substâncias de baixa massa molecular,
principalmente proteínas, a reabsorção seletiva, na seleção das substâncias
27
que devem retornar ao meio interno e a secreção, na expulsão das substâncias
que foram filtradas, mas devem ser excretadas em quantidade maior do que a
filtrada. Neste percurso, o volume, a composição e a osmolalidade do filtrado
glomerular são modificados durante o fluxo através dos túbulos renais.
(BAYNES; DOMINICZAK, 2007; COMPRI-NARDY; STELLA; OLIVEIRA, 2011,
GUYTON; HALL, 2006)
Desses processos citados resulta a urina, que reflete de forma direta as
alterações do meio interno e proporciona, por meio de sua análise, informações
valiosas sobre a patologia renal e do trato urinário, além de algumas moléstias
extra-renais.
(COMPRI-NARDY;
STELLA;
OLIVEIRA,
2011,
FULLER;
THREATTE; HENRY, 2008; RAVEL, 2009).
2.3.1 Filtração
Aproximadamente 120 mL/min, ou um quinto do fluxo plasmático renal é
filtrado através dos glomérulos para o interior da cápsula de Bowman,
formando o ultrafiltrado plasmático, um líquido essencialmente livre de
proteínas e desprovido de elementos celulares como as hemácias. (GUYTON;
HALL, 2006; MUNDT; SHANAHAN, 2012).
A taxa de filtração, conhecida como taxa de filtração glomerular (TFG), é
proporcional ao tamanho corporal e, portanto, varia de acordo com a idade e o
sexo. Ela é um indicador importante da função renal, sendo utilizada para
monitorar a progressão de doenças renais. (MUNDT; SHANAHAN, 2012).
A TFG é determinada pelo equilíbrio das forças hidrostáticas e
coloidosmóticas agindo através da membrana capilar e pelo coeficiente de
filtração capilar, o produto da permeabilidade e da área de superfície de
filtração dos capilares. (GUYTON; HALL, 2006).
2.3.2 Reabsorção tubular
À medida que o ultrafiltrado atravessa os túbulos proximais, uma grande
quantidade de água, cloreto de sódio, bicarbonato, potássio, cálcio,
aminoácidos, fosfato, proteína, glicose e outras substâncias necessárias ao
organismo são reabsorvidas e retornam a corrente sanguínea. Essas
28
substâncias são reabsorvidas em proporções variadas, de modo que as
proteínas e a glicose são quase totalmente reabsorvidas, ao passo que o
cloreto de sódio é reabsorvido apenas parcialmente, e não há reabsorção de
creatinina. (MUNDT; SHANAHAN, 2012).
Grande parte do filtrado é reabsorvido no túbulo proximal, devido as
suas características celulares especiais. As células epiteliais do túbulo proximal
mantêm o metabolismo elevado devido ao grande número de mitocôndrias,
necessárias para suportar muitos processos de transporte ativo. Além disso, as
células tubulares proximais apresentam uma borda em escova com
microvilosidades que fornecem uma área de superfície de membrana extensa
nos lados luminal e basolateral do epitélio para a reabsorção e a secreção.
Essas microvilosidades contêm diversas enzimas como a anidrase carbônica,
que auxiliam neste processo. (GUYTON; HALL, 2006).
O ramo descendente da alça de Henle é bastante permeável à água, em
contraste ao componente ascendente, incluindo tanto a porção fina quanto a
espessa, que é praticamente impermeável à água, uma característica
importante para a concentração da urina. No ramo ascendente, há reabsorção
ativa de sódio, cloreto, cálcio e magnésio devido à carga ligeiramente positiva
do lúmen tubular em relação ao líquido intersticial. Nesta seção do túbulo e na
sua porção restante, íons hidrogênio e amônia são secretados. Portanto, a
maior parte da água que chega a esse segmento permanece no túbulo, apesar
da reabsorção de grandes quantidades de soluto. (GUYTON; HALL, 2006;
MUNDT; SHANAHAN, 2012).
2.3.3 Secreção tubular
A secreção tem um papel importante na determinação das quantidades
de potássio, íons hidrogênio e outras poucas substâncias que são excretadas
na urina. (GUYTON; HALL, 2006). Contrário à reabsorção, a secreção tubular
envolve o envio de moléculas do sangue nos capilares peritubulares para o
filtrado tubular, visando sua excreção. (MUNDT; SHANAHAN, 2012).
O processo de secreção tubular remove produtos finais exógenos
indesejáveis que não são filtrados pelo glomérulo, inclusive diversos
medicamentos e toxinas, ao qual de outra forma não seriam excretados, isso
29
por estarem frequentemente ligados a proteínas carreadoras, impossibilitando
sua remoção da circulação durante a filtração glomerular. (COLOMBELI;
FALKENBERG, 2006; GUYTON; HALL, 2006; MUNDT; SHANAHAN, 2012).
Diversos íons são secretados, incluindo íons sódio, potássio, hidrogênio,
amônia, bicarbonato, e também ácido úrico e alguns ácidos e bases fracos.
Estes processos exigem alto gasto de energia por requerer transporte ativo
para esta atividade. (GUYTON; HALL, 2006). A Figura 3 resume os processos
de filtração, reabsorção e secreção necessários para a formação de urina.
Figura 3 – Fisiologia renal
Fonte: MUNDT; SHANAHAN, 2012
2.3 Formação da urina
“A água, os resíduos do metabolismo e os eletrólitos e não-eletrólitos em
excesso no meio interno são excretados por meio de um líquido corporal
chamado urina.” (COMPRI-NARDY; STELLA; OLIVEIRA, 2011, p. 122). A urina
é um ultrafiltrado plasmático e apresenta a mesma composição do plasma
sanguíneo, exceto pela menor concentração de proteínas de baixo peso
molecular por volta de 10 mg/dL. (MUNDT; SHANAHAN, 2012).
30
De acordo com Ciriades (2010), a urina, excretada pelos rins, é uma
solução cujo solvente é a água e cujo soluto é uma mistura de inúmeros
elementos químicos: proteínas, nitrogenados, aminoácidos, bases e ácidos
orgânicos, pigmentos sanguíneos, carboidratos, lipídeos, hormônios, vitaminas,
enzimas, sais orgânicos e inorgânicos e metabólitos finais e intermediários.
Variações nas concentrações destes solutos podem acontecer por
influência de diversos fatores, dentre os principais: atividade física, ingestão de
alimentos e líquidos, medicamentos, metabolismo corporal, funções endócrinas
e inclusive a posição corporal. (BAYNES; DOMINICZAK, 2007; CIRIADES,
2010; STRASINGER; LORENZO, 2009).
“Além de uma solução, a urina também é uma suspensão de elementos
figurados representados por micro-organismos, hemácias, leucócitos, células
de descamação, cristais, cilindros e outros.” (CIRIADES, 2010, p. 174). Estes
elementos são analisados no exame microscópico de rotina da urina, efetuado
no sedimento da urina centrifugada. (RAVEL, 2009). Algumas destas são
consideradas normais, ao passo que outras são observadas em diversos
distúrbios renais e metabólicos. (MUNDT; SHANAHAN, 2012).
No adulto normal, o fluxo sanguíneo para ambos os rins é de
aproximadamente 1.200 ml/min, o que contribui para aproximadamente 25% do
débito cardíaco. O volume do filtrado glomerular original de aproximadamente
180 L em 24 horas é reduzido para aproximadamente 1 a 2 L, dependendo das
condições de hidratação, tendo em vista que o volume mínimo necessário para
remover os produtos metabólicos, principalmente uréia e creatinina, é cerca de
0,5 L/24h, um fluxo extremamente alto comparado a outros órgãos. O propósito
deste fluxo adicional é suprir plasma suficiente para se ter altas taxas de
filtração glomerular que são necessárias para a regulação precisa dos volumes
dos líquidos corporais e concentrações de solutos. (BAYNES; DOMINICZAK,
2007; GUYTON; HALL, 2006; FULLER; THREATTE; HENRY, 2008).
2.4 Fisiopatologia
As doenças renais estão entre as causas mais importantes de óbito e de
incapacidade em diversos países em todo o mundo (GUYTON; HALL, 2006).
Certas doenças sistêmicas podem produzir alterações quantitativas ou
31
qualitativas dos constituintes urinários ou resultar na excreção de substâncias
anormais, sem considerar os efeitos diretos sobre os rins. Por outro lado, a
doença do trato urinário pode produzir sintomas sistêmicos notáveis. A
progressão ou a regressão das várias lesões provocadas pode ser monitorada
com um mínimo de estresse ao paciente por meio do exame de urina. (COSTA
et al., 2006; FULLER; THREATTE; HENRY, 2008; RAVEL, 2009).
Segundo Ravel (2009), o exame de elementos anormais e sedimento
(EAS)
representa
um
elemento
indispensável
da
patologia
clínica,
considerando-se que pode detectar doenças em qualquer parte do trato
urinário.
Desta forma, o EAS contribui significativamente para direcionar o
diagnóstico, baseado nos resultados obtidos das diversas moléstias que podem
refletir através da urina, desde hepatite, diabetes e intoxicação, assim como na
detecção de doenças renais, em destaque, a glomerulonefrite, a síndrome
nefrótica e até mesmo o câncer. (COLOMBELI; FALKENBERG, 2006; COSTA
et al., 2006; FULLER; THREATTE; HENRY, 2008; FERREIRA et al., 2009).
No que se refere às doenças renais, podemos classificá-las em quatro
categorias diferentes: insuficiência renal aguda, em que os rins param por
completo ou quase completamente, doença renal crônica, em que há uma
redução do número de néfrons, síndrome nefrótica, em que há um aumento da
permeabilidade glomerular dando como efeito perda de grande quantidade de
proteínas na urina e distúrbios tubulares específicos, como a deficiência de
reabsorção de glicose, diabetes insípido, dentre outras. Tais doenças podem
levar a alterações nas características físico-químicas da urina e/ou ainda nos
seus constituintes químicos. (COMPRI-NARDY; STELLA; OLIVEIRA, 2011).
2.5 Elementos anormais e sedimento
No Brasil, a realização do exame de urina, Urina tipo I ou EAS é
realizada em três etapas. A urina como solução é investigada por métodos
físicos, físico-químicos e químicos, correspondente a análise física e química
da urina e como suspensão é investigada ao microscópio óptico e por métodos
microbiológicos, relativo à análise do sedimento urinário. (CIRIADES, 2010;
COSTAVAL et al., 2001; RAVEL, 2009).
32
Costa e outros (2004) ressaltam que a aceitabilidade da amostra de
urina, deve ser avaliada segundo as condições de coleta, armazenamento e
identificação antes de se realizar o teste.
2.5.1 Análise Física
A urina apresenta uma composição básica composta essencialmente por
água, uréia, ácido úrico, creatinina, sódio, potássio, cloreto, cálcio, magnésio,
fosfatos, sulfatos e amônia, mas que pode variar segundo alguns fatores, assim
como, em algumas condições patológicas, onde determinadas substâncias
como corpos cetônicos, proteínas, glicose, porfirinas e bilirrubinas podem
acarretar em alterações tanto físicas como químicas. (MUNDT; SHANAHAN,
2012; COMPRI-NARDY; STELLA; OLIVEIRA, 2011).
Costa e outros (2004) citam que o exame físico da urina corresponde à
primeira análise a ser realizada na urina, onde pode ser observado
principalmente a cor, aspecto e volume urinário. Os achados nesta etapa
representam grande valor na confirmação ou explicação dos resultados da
análise química e da sedimentoscopia urinária.
2.5.1.1 Cor
O urocromo é o pigmento responsável pela coloração amarela
característica da urina de aspecto físico-químico normal, e sua excreção em
geral é proporcional a taxa metabólica, ao qual pode estar aumentada durante
processos febris e inanição. (FULLER; THREATTE; HENRY, 2008; COMPRINARDY; STELLA; OLIVEIRA, 2011).
Diferenças sutis na coloração da urina são indicativos rudimentares da
hidratação e concentração da urina. Em condições específicas, urina de tom
avermelhado ou acastanhado pode indicar a presença de sangue, sendo a cor
alterada mais comumente encontrada. Quando observada em mulheres, levar
em consideração a possibilidade de contaminação menstrual. (FUNCHAL;
MASCARENHAS; GUEDES, 2008; FULLER; THREATTE; HENRY, 2008).
Conforme a intensidade do sangramento pode-se classificar a hematúria em
microscópica, quando as hemácias só são visualizadas ao microscópio e
33
macroscópica, frente à mudança visível na cor da amostra de urina.
(LIESENFELD et al., 2009).
Em urinas de cor âmbar-escura, pode indicar alta concentração de
urobilina ou bilirrubina ou formação de metemoglobina, enquanto urina de
outras colorações podem surgir, de acordo com os alimentos e corantes em
pessoas geneticamente propensas e também por medicamentos que o
individuo consumir dentre outras condições patológicas e não patológicas.
(MUNDT; SHANAHAN, 2012; STRASINGER; DI LORENZO, 2009).
2.5.1.2 Aspecto
A urina normal é límpida, de aspecto claro, transparente, podendo estar
mais clara ou escura, dependendo de sua concentração. (COMPRI-NARDY;
STELLA; OLIVEIRA, 2011). Pelo exame visual da amostra homogeneizada em
frente a uma fonte luminosa, pode se determinar o aspecto da urina, ao qual
pode ser classificado como límpido, opalescente, ligeiramente turvo, turvo e
leitoso. (STRASINGER; DI LORENZO, 2009).
A turbidez é um elemento de diagnóstico variável e inclui diversas
entidades não patológicas. Ela pode ser resultante da precipitação de cilindros
ou de cristais amorfos, como fosfatos e uratos, e até mesmo por contaminação,
entretanto a presença de material particulado exige investigações, e está mais
associado ao crescimento bacteriano em infecções do trato urinário (ITUs),
principalmente em mulheres devido a alta prevalência e pela alta concentração
de leucócitos. (FULLER; THREATTE; HENRY, 2008; PEREIRA; BORDIGNON,
2011).
2.5.1.3 Volume urinário
Em condições normais, o principal fator determinante do volume urinário
é a ingestão de água, e esta quantidade de urina excretada está em relação
direta com o líquido extracelular, intracelular, a temperatura, o clima e a
sudorese. (COMPRI-NARDY; STELLA; OLIVEIRA, 2011).
Para efeito de padronização nacional é indicado à utilização de 10
mililitros (ml) para o EAS, ressalva casos onde seja usado um volume menor
34
decorrente de amostras difíceis, principalmente em neonatos e pacientes
anúricos. (ASSOCIAÇÂO BRASILEIRA DE NORMAS TÉCNICAS, 2005, p. 5).
O quadro 2 apresenta uma listagem abrangente das principais condições
que afetam o aspecto e cor da urina. (FULLER; THREATTE; HENRY, 2008).
Aspecto
Incolor
Turva
Leitosa
Quadro 2 – Aspecto e cor da urina
Causa
Considerações
Urina muito diluída
Poliúria, diabete insípido
Fosfatos, carbonatos
Solúvel em ácido acético
diluído
Uratos, ácido úrico
Dissolve em 60° C e em
álcalis
Leucócitos
Insolúvel em ácido
acético diluído
Eritrócitos
Sofrem lise em ácido
acético diluído
Bactérias, leveduras
Insolúvel em ácido
acético diluído
Mucina, filamentos
Podem apresentar
mucosos
floculação
Piúria
Insolúvel em ácido
acético diluído
Gordura: lipidúria,
Nefrose, Lesão por
opalescente,
esmagamento
Gordura: Quilúria,
Obstrução linfática
leitosa
Amarelo-alaranjada
Urina concentrada
Urobilina em excesso
Bilirrubina
Vermelha
Hemoglobina
Eritrócitos
Mioglobina
Vermelho-acastanhado
Marrom-preto
Beterraba
Contaminação com
sangue menstrual
Eritrócitos
Hemoglobina em
repouso
Metemoglobina
Metemoglobina
Febre, desidratação
Sem espuma amarela
Espuma amarela se
houver bilirrubina
suficiente
Positiva com tira reativa
para sangue
Positiva com tira reativa
para sangue
Positiva com tira reativa
para sangue
Genética
Coágulos, muco
pH ácido
Sangue, pH ácido
Fonte: Adaptado de FULLER; THREATTE; HENRY, 2008.
35
2.5.2 Tiras reativas
Com o objetivo de tornar o exame de urina mais rápido, simples e
econômico no laboratório clínico, fez-se a implantação do sistema de tiras
reativas na análise química da urina que permite verificar diversos parâmetros
bioquímicos, dentre eles: a glicose, hemácias/sangue, esterase de leucócitos,
nitrito, bilirrubina, urobilinogênio, pH, densidade, proteínas e corpos cetônicos,
facilitando a análise e acelerando a liberação de resultados. (MUNDT;
SHANAHAN, 2012; RAVEL, 2009; STRASINGER; DI LORENZO, 2009).
Uma tira reagente consiste em uma tira estreita de plástico com
pequenos campos afixados. Cada campo contém reagentes para uma reação
distinta, permitindo assim a realização simultânea de vários testes. Uma reação
química ocorre quando o campo entre em contato com a urina, daí as reações
são interpretadas pela comparação da cor produzida no campo com uma
tabela fornecida pelo fabricante. O tempo para as reações ocorrerem se
diferencia entre os testes e os fabricantes e pode variar de uma reação
imediata para o pH e para 120 segundos para leucócitos. A urina deve ser
testada à temperatura ambiente, uma vez que as reações enzimáticas sobre as
tiras dependem da temperatura. (MUNDT; SHANAHAN, 2012; STRASINGER;
DI LORENZO, 2009).
A seguir estão descritas as reações para os parâmetros analisados nas
tiras reativas de urina Uriquest plus da Labtest (FIG. 4) e Biocolor da Bioeasy
(FIG. 5), abordando o significado clínico além de possíveis interferentes.
(BIOEASY, 2010; LABTEST, 2009).
Figura 4 – Tira reativa de urina Uriquest plus, Labtest
Fonte: ENZIPHARMA, 2012
36
Figura 5 – Tira reativa de urina Biocolor, Bioeasy
Fonte: SUPRALAB, 2012
2.5.2.1 Glicose
A presença de quantidades detectáveis de glicose na urina é chamada
de glicosúria, e acontece quando a concentração de glicose no sangue
extrapola o limiar renal de absorção, geralmente em valores superiores a 180
ou 200 mg/dL, observada frequentemente no diabetes melito. Esse fenômeno
pode aparecer na urina em diferentes valores de glicose sanguínea, e nem
sempre se relaciona a hiperglicemia. Alguns fatores, como fluxo sanguíneo
glomerular, taxa de reabsorção tubular e fluxo urinário também influenciam no
aparecimento de glicosúria na tira reativa. (MUNDT; SHANAHAN, 2012;
FULLER; THREATTE; HENRY, 2008; RAVEL, 2009).
As determinações da glicose urinária são mais úteis para os
diabéticos bem controlados que não necessitam de ajustes
frequentes de insulina/agentes hipoglicemiantes. No diabetes
dependente de insulina, uma determinação negativa na urina
corresponde a uma ampla variedade de valores séricos de glicose:
isto é atribuído a uma grande variação no limiar renal para a glicose
em pacientes diabéticos, portanto as determinações urinárias podem
ser enganosas. O monitoramento domiciliar da glicose sanguínea
ainda é o método preferido. (FULLER; THREATTE; HENRY, 2008, p.
438).
Na tira reativa de urina ocorre uma reação específica para a glicose por
impregnação da zona de ensaio com uma mistura de oxidase e peroxidase
com o indicador cloridrato de tolidina para produzir uma reação enzimática
dupla sequencial. Na primeira etapa, a oxidase catalisa a reação entre a
glicose e o ar ambiente para produzir ácido glicônico e peróxido. Na segunda
37
etapa, a peroxidase catalisa a reação entre o peróxido e o cromógeno,
cloridrato de tolidina para formar um composto oxidado de cor variando de
verde claro à verde escuro (FIG. 6). (LABTEST, 2009; STRASINGER; DI
LORENZO, 2009).
Reação 1:
Glicose + O2
glicose oxidase
ácido glicônico + H2O2
Reação 2:
H2O2 + cromógeno
peroxidase
cromógeno oxidado
(1)
Figura 6 – Tabela de cores para Glicose Tira Uriquest plus, Labtest
Fonte: Criado pelo autor com dados extraídos de LABTEST, 2009
Apesar de apresentar o mesmo processo químico, a cor variante na
reação para a glicose da tira Biocolor vai de azul para marrom (FIG. 7).
(BIOEASY, 2011).
Figura 7 – Tabela de cores para Glicose Tira Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010
Resultados falsamente elevados podem ocorrer em urinas de densidade
específica baixa, e o contrário, de urinas com densidade específica elevada,
urina muito ácida e ocasionalmente o ácido ascórbico produzir falsos negativos.
(FULLER; THREATTE; HENRY, 2008; LABTEST, 2009). Bioeasy (2010) relata
que a tira de urina Biocolor não reage com a lactose, galactose e frutose e que
níveis elevados de corpos cetônicos pode levar a falsos negativos.
38
2.5.2.2 Hemácias/sangue
Segundo Ravel (2008), a presença de um número alterado de células
sanguíneas
na
urina
é
denominada
hematúria,
enquanto
o
termo
hemoglobinúria se refere à presença de hemoglobina livre em solução na urina,
e há também a mioglobinúria, uma condição rara, onde a mioglobina, uma
proteína encontrada em tecido muscular estriado, está presente na urina.
Através de testes químicos para hemoglobina associado à realização da
sedimentoscopia urinária é possível diferenciar a hematúria da hemoglobinúria,
cada uma delas com um significado clínico diferente.
(STRASINGER; DI
LORENZO, 2009). A hematúria está mais relacionada a doenças de origem
renal ou geniturinária nas quais o sangramento é resultado de trauma ou dano
aos órgãos desses sistemas, enquanto a hemoglobinúria indica hemólise
intravascular significante, como acontece em anemias hemolíticas, reações
transfusionais e infecções, primariamente não relacionada aos rins, embora
secundariamente possa resultar em dano renal. (FULLER; THREATTE;
HENRY, 2008; MUNDT; SHANAHAN, 2012).
Entretanto, a determinação das hemácias somente pela tira reativa pode
não ser eficiente. Um problema comum com esse método é a inibição da
hemoglobina por substâncias interferentes, comumente o ácido ascórbico, que
só enfatiza a necessidade de se realizar a sedimentoscopia urinária para a
triagem de hematúria. (FULLER; THREATTE; HENRY, 2008; WEIDE; LARA,
2005; LIESENFELD et al., 2009).
A reação para hemoglobina na tira reativa de urina é baseado na
atividade da pseudoperoxidase da hemoglobina e da mioglobina que catalisa a
oxidação do cromógeno tetrametil benzidina na presença de peróxido orgânico,
o qual tem cor verde azulada (FIG. 8). (BIOEASY, 2010; LABTEST, 2009).
Figura 8 – Tabela de cores para Hemácias/sangue Tira Uriquest plus,
Labtest e Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
39
H2O2 + cromógeno
heme
cromógeno oxidado + H2O
(2)
Atividade da peroxidase
De acordo com Labtest (2009), falsos negativos podem ocorrer em urina
de densidade específica, proteínas e nitrito aumentados, e na presença de
medicamentos, comumente o captopril. A reação não é afetada pelo ácido
ascórbico, devido à área reagente para hemoglobina/sangue estar protegida de
sua ação antioxidante, reduzindo a frequência de falso negativo, o mesmo não
ocorre para a tira de urina Biocolor, relatado por Bioeasy (2010).
2.5.2.3 Esterase de leucócitos
Indica o aumento de leucócitos na urina, ocasionado geralmente por
ITUs, sendo o leucócito mais comumente encontrado em uma amostra de urina
o neutrófilo. A pesquisa de ITUs também inclui a avaliação de pH, proteínas e
nitritos. Resultados mais precisos são obtidos com amostras frescas, não
centrifugadas e homogeneizadas, à temperatura ambiente. (COLOMBELI;
FALKENBERG, 2006; MUNDT; SHANAHAN, 2012; RAVEL, 2009).
“O teste de esterase leucocitária pode ser útil na avaliação da uretrite
suspeita em pacientes masculinos, e possui um valor preditivo negativo
elevado no contexto do diagnóstico.” (FULLER; THREATTE; HENRY, 2008, p.
449). Uma vantagem adicional do teste químico para esterase de leucócitos é
que ele detecta a presença de leucócitos que foram lisados, particularmente
em urina alcalina e diluída, os quais não aparecem na sedimentoscopia
urinária. (STRASINGER; DI LORENZO, 2009).
Os neutrófilos contêm enzimas denominadas esterases que podem ser
detectadas pela tira reativa de urina. A reação é baseada na hidrólise de
carboxilato heterocíclico pelas esterases dos neutrófilos liberando uma fração
capaz de reagir com um sal diazônio formando um pigmento violeta (FIG. 9).
(BIOEASY, 2010; LABTEST, 2009).
Reação 1:
Carboxilato heterocíclico
esterase
granulocítica
indoxil ou pirrol
40
Reação 2:
Indoxil ou pirrol + sal diazônio = cor púrpura
(3)
Figura 9 – Tabela de cores para Esterase de leucócitos Tira reativa
Uriquest plus, Labtest e Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
Altas concentrações de glicose e albumina, assim como a densidade
específica elevada e alguns antibióticos, como gentamicina e tetraciclina
podem levar a falsos negativos. Falsos positivos podem aparecer pela
presença de agentes oxidantes e contaminação com secreção vaginal.
(BIOEASY, 2010; LABTEST, 2009).
2.5.2.4 Nitrito
Muitas bactérias que são patógenos do trato urinário produzem uma
enzima denominada redutase, que tem a capacidade de reduzir nitrato a nitrito.
Organismos comuns capazes de causar ITUs, geralmente compreende
bactérias gram negativas, sendo o principal microorganismo isolado de ITUs a
Escherichia coli, seguido de Klebsiella, Enterobacter, Proteus, Pseudomonas,
dentre outros. (AMORIM; PACHECO; FERNANDES, 2008; RAVEL, 2009).
Os testes de tira reagente de urina para nitrito oferecem um método
rápido e indireto para a detecção precoce de bacteriúrias significantes e
assintomáticas. O objetivo é rastrear casos em que a necessidade de uma
cultura pode não ser aparente, mas não se destina a substituir a urocultura
como principal teste para o diagnóstico e o acompanhamento de infecção
bacteriana. Um teste negativo na tira de urina jamais deve ser interpretado
como indicador de ausência de infecção bacteriana. (MUNDT; SHANAHAN,
2012; STRASINGER; DI LORENZO, 2009).
A caracterização de uma infecção do trato urinário deve ser avaliada
pelo EAS, a urocultura e avaliação clínica. A urocultura é o principal artefato
41
para se identificar uma ITU, pois além de indicar a ocorrência de multiplicação
bacteriana no trato urinário, também permite a identificação do microorganismo causador e o estudo de sensibilidade pelos antibióticos, no entanto,
é importante destacar que o EAS é um ótimo auxiliar no que se diz respeito à
infecção do trato urinário. (AMORIM; PACHECO; FERNANDES, 2008).
Um teste de nitrito verdadeiro-positivo deve ser acompanhado por um
teste positivo para esterase leucocitária, o que aumenta a sensibilidade do
teste de esterase leucocitária para a detecção de ITUs. (RAVEL, 2009;
STRASINGER; DI LORENZO, 2009).
A base química do teste de nitrito é a capacidade de redução específica
de Griess que identifica a presença de nitritos formados por redução de nitratos
produzida por bactérias gram negativas pela ação do ácido sulfanílico e um
composto de quinolina, originando um composto diazônio. Como pode ser
observado na figura 10, qualquer tonalidade rosa deve ser interpretada como
teste positivo para nitrito. (BIOEASY, 2010; LABTEST, 2009).
Reação 1:
Nitrito + ácido p-arsanílico
composto de diazônio
Reação 2:
3-hidroxil-1,2,3,4 tetra-hidrobenzo-(h)-quinolina + composto diazônio = cor rosa (4)
Figura 10 – Tabela de cores para Nitrito Tira reativa Uriquest plus, Labtest
e Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
Labtest (2009) cita que altas concentrações de ácido ascórbico na urina
podem acarretar em falsos negativos. Falso positivo pode surgir na presença
de fenazopiridina. Bioeasy (2010) relata que densidade específica alta e urinas
alcalinas podem reduzir a sensibilidade do teste.
42
2.5.2.5 Bilirrubina
A bilirrubina é um produto da degradação da hemoglobina que se forma
nas células reticuloendoteliais do baço, fígado e medula óssea. A presença de
bilirrubina na urina é observada quando há aumento de bilirrubina conjugada
(direta) no sangue. Desta forma, a bilirrubina conjugada será filtrada e então
excretada na urina, sendo de suma importância na detecção de icterícia, assim
como em outras doenças hepáticas e em doenças hemolíticas. (COLOMBELI;
FALKENBERG, 2006; COMPRI-NARDY; STELLA; OLIVEIRA, 2011; FULLER;
THREATTE; HENRY, 2008; MUNDT; SHANAHAN, 2012).
Geralmente, a bilirrubina conjugada surge na urina por distúrbios no ciclo
de degradação normal, devido à obstrução do ducto biliar ou quando a
integridade do fígado está comprometida, gerando o refluxo de bilirrubina
conjugada para a circulação. A bilirrubina urinária fornece desta forma, além da
indicação precoce de doença hepática, a determinação da icterícia clínica do
paciente, pela ausência ou presença de bilirrubina na urina. (STRASINGER; DI
LORENZO, 2009).
A tira reagente de urina baseia-se na reação de acoplamento em meio
ácido com sal diazônio estabilizado e formação de cromógeno vermelho (FIG.
11). (LABTEST, 2009).
Bilirrubina glucoronato + sal diazônio
ácido
cromógeno vermelho
(5)
Figura 11 – Tabela de cores para Bilirrubina Tira reativa Uriquest plus,
Labtest
Fonte: Criado pelo autor com dados extraídos de LABTEST, 2009
Na presença de bilirrubina, produzirá uma cor rosa-bronzeada
proporcional a sua concentração na urina (FIG. 12). (BIOEASY, 2010).
Bilirrubina glucoronato + sal diazônio
ácido
cromógeno rosa-bronzeado (6)
43
Figura 12 – Tabela de cores para Bilirrubina Tira reativa Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010
Falsos negativos podem ocorrer em urinas com alta concentração de
ácido ascórbico ou nitrito ou expostas a luz por um período prolongado, onde é
foto-oxidado em biliverdina, ao qual não reage com testes diazóicos. Já os
falsos positivos podem aparecer em urinas com urobilinogênio elevado e pela
ação de alguns metabólitos de medicamentos, como a fenotiazina e a
clorpromazina, que produzem uma cor avermelhada no pH baixo da tira e
mascaram os resultados. (BIOEASY, 2010; LABTEST, 2009).
2.5.2.6 Urobilinogênio
O urobilinogênio é um produto metabólico da bilirrubina formado no
intestino por enzimas bacterianas. A maior parte do urobilinogênio é excretada
nas fezes como estercobilina, que se formam após a remoção de hidrogênio.
Uma pequena quantidade é excretada na urina, isso porque o sangue que
circula no fígado passa através dos rins e é filtrado pelo glomérulo. (FULLER;
THREATTE; HENRY, 2008; MUNDT; SHANAHAN, 2012).
O aumento de urobilinogênio pode acontecer em decorrência da maior
quantidade de bilirrubina excretada, de disfunção hepática e nos transtornos
hemolíticos e embora a tira reagente não possa detectar a ausência de
urobilinogênio na urina, é uma informação significativa do ponto de vista
diagnóstico. Ela representa obstrução do ducto biliar, que impede a passagem
de bilirrubina para o intestino, gerando como resultado fezes claras pela
ausência de urobilina.
(COMPRI-NARDY; STELLA; OLIVEIRA, 2011;
STRASINGER; DI LORENZO, 2009).
A tira reativa de urina utiliza a reação de acoplamento com sal diazônio,
formando pigmento de cor rosa (FIG. 13). (BIOEASY, 2010; LABTEST, 2009).
Urobilinogênio + sal diazônio
ácido
cromógeno vermelho
(7)
44
Figura 13 – Tabela de cores para Urobilinogênio Tira reativa Uriquest plus,
Labtest e Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
De acordo com Labtest (2009), a exposição da urina a luz por períodos
prolongados pode acarretar em resultados falsos negativos. Falso positivo
pode ocorrer pelo consumo de determinados medicamentos e corantes
diazóicos.
2.5.2.7 pH
O rim juntamente com o pulmão são os principais responsáveis por
manter o equilíbrio ácido-básico no organismo. O pulmão excreta dióxido de
carbono, enquanto a contribuição renal é a de reabsorver bicarbonato do
filtrado nos túbulos contornados e secretar íons amônio, fosfato de hidrogênio e
ácidos
inorgânicos
fracos.
(FULLER;
THREATTE;
HENRY,
2008;
STRASINGER; DI LORENZO, 2009).
Um individuo saudável costuma produzir a primeira urina da manhã com
pH ligeiramente ácido de 5,0 a 6,0, já um pH alcalino é encontrado após as
refeições. O pH das amostras aleatórias normais pode variar de 4,5 a 8,0.
Desta forma, não são atribuídos valores normais do pH urinário, devendo ser
considerado em conjunto com outras informações do paciente, como o
equilíbrio ácido-básico do sangue, a ingestão alimentar e o tempo de coleta da
amostra. (FUNCHAL; MASCARENHAS; GUEDES, 2008; STRASINGER; DI
LORENZO, 2009).
A reação da tira reativa de urina é uma combinação de dois indicadores
de pH que produzem cores laranja, amarela, verde e turquesa no intervalo de
pH de 5,0 a 9,0 (FIG. 14). (BIOEASY, 2010; LABTEST, 2009).
Vermelho de metila + H+
(vermelho – alaranjado
azul de bromotimol – H
amarelo) (verde
azul)
(8)
45
Figura 14 – Tabela de cores para pH Tira reativa Uriquest plus, Labtest e
Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
Labtest (2009) destaca que substâncias acidificantes, alcalinizantes e
também
a
contaminação
bacteriana
pode
acarretar
em
resultados
contraditórios.
2.5.2.8 Densidade
Definida pela razão do peso de dado volume de urina pelo mesmo
volume de água destilada, a densidade é de suma importância, pois trata-se de
um parâmetro da função tubular e afeta outros exames de urina. (COLOMBELI;
FALKENBERG, 2006; RAVEL, 2009).
O volume excretado e a concentração dos solutos da urina variam nos
rins para a manutenção da homeostasia dos líquidos e eletrólitos corporais.
Uréia, cloreto de sódio, sulfato e fosfato são os elementos que mais contribuem
para a densidade específica da urina normal. (CIRIADES, 2010).
A excreção de urina de baixa densidade pode ser observada em
diversas patologias, como pielonefrite e glomerunefrite, embora seja no
diabetes insípido onde esta característica prevaleça. A densidade alta pode ser
observada na desidratação, insuficiência adrenal, nas hepatopatias ou na
insuficiência cardíaca congestiva. Em amostras de um mesmo paciente, onde
não há variabilidade entre várias amostras e a densidade fixa próxima a 1.010
é um indicativo de dano renal grave, no qual a rompimento da capacidade de
concentração e diluição da urina. (FULLER; THREATTE; HENRY, 2008).
A tira reativa de urina é um método indireto para determinar a
densidade. É baseado na mudança de cor azul-esverdeada para verde amarelo
ou marrom claro em função da concentração de íons na amostra. O principio
desta metodologia baseia-se na alteração da pka (constante de dissociação)
dos polieletrólitos pré-tratados em relação à concentração iônica da urina.
Quando a concentração é alta, o pka é baixo, assim como o pH. O cromógeno
46
azul de bromotimol muda a cor relativa à concentração iônica e esta é
traduzida em valores de densidade (FIG. 15). (BIOEASY, 2010; COLOMBELI,
2006; FULLER; THREATTE; HENRY, 2008; LABTEST, 2009).
Figura 15 – Tabela de cores para Densidade Tira reativa Uriquest plus,
Labtest e Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
Conforme Bioeasy (2010) e Labtest (2009) descrevem, as urinas muito
alcalinas podem resultar em falsos negativos, assim como urinas muito ácidas
podem gerar falsos positivos e também proteinúrias moderadas e presença de
corpos cetônicos.
2.5.2.9 Proteínas
Comprovadamente a proteinúria, presença de quantidades detectáveis
de proteínas na urina acima de 30 mg/dL está associada à lesão renal.
Frequentemente associada com doença renal precoce, devido o limiar renal
para proteínas ser baixa faz do exame de proteínas na urina parte importante
do EAS. No entanto, existem condições fisiológicas que podem levar a
excreção aumentada de proteínas na urina na ausência de doença renal. Há
também alguns distúrbios renais onde há ausência de proteinúria. (MUNDT;
SHANAHAN, 2012; STRASINGER; DI LORENZO, 2009; VIEIRA, 2006).
Normalmente até 150 mg de proteínas são excretados na urina por dia,
aproximadamente um terço é albumina, e as proteínas remanescentes
compreendem as globulinas pequenas, incluindo as α, β, γ globulinas. A tira
reativa de urina é sensível a albumina, sendo a principal proteína observada na
urina de pacientes com doença glomerular, no entanto em lesões tubulares e
quando há quantidade exagerada de proteínas, é frequente o aparecimento de
proteínas de pequeno peso molecular, ao qual não é tão sensível a tira reativa.
(FULLER; THREATTE; HENRY, 2008; VIEIRA, 2006).
47
“As proteínas normalmente excretadas incluem uma mucoproteína
denominada proteína de Tamm-Horsfall, que não está contida no plasma,
sendo excretada pelos túbulos renais. Essa proteína forma a matriz da maioria
dos cilindros urinários.” (MUNDT, SHANAHAN, 2012).
A tira reativa baseia-se no principio de erro proteínico de um indicador
de pH. Uma vez que as proteínas apresentam carga em pH fisiológico, sua
presença induzirá uma alteração no pH e mudança da coloração amarela para
verde (FIG. 16). (BIOEASY, 2010; LABTEST, 2009; RAVEL, 2008).
Indicador (cor amarela) + prote na
pH 3,0
prote na + H+ indicador H+ (cor azul-verde) (9)
Figura 16 – Tabela de cores para Proteínas Tira reativa Uriquest plus,
Labtest e Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
De acordo com Bioeasy (2010) e Labtest (2009), detergentes não
iônicos e aniônicos podem gerar falsos negativos. Urinas com densidade
específica elevada e pH extremamente alcalino podem levar a falsos positivos.
2.5.2.10 Corpos cetônicos
Os corpos cetônicos são formados durante o catabolismo de ácidos
graxos em ácido β-hidroxibutírico, ácido acetoacético e a acetona. A sua
formação está relacionada com distúrbios metabólicos, nos quais lipídeos se
tornam a principal fonte energética ao invés dos carboidratos, entretanto, esta
fonte de energia proveniente de lipídeos quando ultrapassa a capacidade
metabólica é excretada na urina por meio dos rins, lembrando que a taxa de
excreção renal também é limitada, de modo que, quando a formação de corpos
cetônicos excede a sua utilização de excreção renal, observa-se o acúmulo no
plasma, sendo esta condição conhecida como cetose. (COMPRI-NARDY;
STELLA; OLIVEIRA, 2011; RAVEL, 2009).
48
Esta condição é comum no diabetes melito descompensado, jejum
prolongado (desidratação, vômitos, diarréia e febre) e doenças metabólicas
hereditárias. (LABTEST, 2009).
Utiliza a reação de nitroprussiato de sódio com ácido acetoacético e
acetona em meio alcalino formando um complexo violeta (FIG. 17). (BIOEASY,
2010; LABTEST, 2009; STRASINGER; DI LORENZO, 2009). Ravel (2009)
destaca que o método não mede o ácido β-hidroxibutírico e é pouco sensível à
acetona quando há presença de glicina.
Reação de nitroprussiato:
Ácido acetoacético + nitroprussiato de Na + glicina
pH
cor violeta
(10)
alcalino
Figura 17 – Tabela de cores para Corpos cetônicos Tira reativa Uriquest
plus, Labtest e Biocolor, Bioeasy
Fonte: Criado pelo autor com dados extraídos de BIOEASY, 2010 e LABTEST, 2009
Conforme descrito por Labtest (2009), falsos positivos podem ocorrer em
urinas de densidade específica elevada, na presença de alguns medicamentos,
em destaque o captopril, ao qual pode produzir reações coloridas atípicas.
2.5.2.11 Ácido ascórbico
Altas concentrações de ácido ascórbico na urina de indivíduos que
consomem grande quantidade de vitamina C podem interferir na determinação
de bilirrubina, nitrito e hemoglobina/sangue, gerando falso-negativos. O ácido
ascórbico é um parâmetro complementar, pois a ascorbúria não possui
significado clínico e em caso positivo, repetir pelo menos 24 horas após a
última ingestão de vitamina C. (LABTEST, 2009; MUNDT; SHANAHAN, 2012).
49
A tira Uriquest plus possui reação baseada na descoloração do reagente
de Tillman, que em presença do ácido ascórbico muda da cor cinza azulada
para alaranjada (FIG. 18). (LABTEST, 2009).
Figura 18 – Tabela de cores para Ácido ascórbico Tira reativa Uriquest
plus, Labtest
Fonte: Criado pelo autor com dados extraídos de LABTEST, 2009
2.5.3 Sedimentoscopia urinária
De fato a etapa mais complexa envolvendo o exame de EAS, a
sedimentoscopia urinária permite avaliar e identificar distúrbios dos tratos renal
e urinário, bem como de outras doenças sistêmicas por meio da análise dos
elementos formados na urina, identificando e quantificando os elementos
presentes. Estes incluem hemácias, leucócitos, células epiteliais, muco,
bactérias, leveduras, espermatozoides, cristais, parasitas, artefatos, dentre
outros. Seu valor depende de dois fatores principais: processamento adequado
da amostra e o conhecimento e experiência do microscopista. (COSTAVAL et
al., 2001; MUNDT; SHANAHAN, 2012; STRASINGER; DI LORENZO, 2009).
O sedimento urinário fornece informações através dos elementos
celulares e não celulares em detrimento de sua atividade nos rins e os
principais serão abordados a seguir. (GOLDMAN; AUSIELLO, 2009).
2.5.3.1 Hemácias
Na urina normal podem-se encontrar pequenos números de hemácias
ao se realizar a análise do sedimento. (WEIDE; LARA, 2005). “Na urina, as
hemácias aparecem como discos bicôncavos, lisos, não-nucleados, e medem
cerca de 7 mm de diâmetro.” (STRASINGER; DI LORENZO, 2009).
O aumento de hemácias no sangue pode indicar uma variedade de
condições sistêmicas e do trato urinário. A hematúria está associada a danos à
membrana glomerular ou lesão vascular e pode ser originária de qualquer
50
região do trato urinário, seja pelos vasos intrarrenais, dos glomérulos, dos
túbulos ou de qualquer parte do trato urogenital. (GOLDMAN; AUSIELLO,
2009; MUNDT; SHANAHAN, 2012).
2.5.3.2 Leucócitos
Em média, até cinco leucócitos por campo de grande aumento são
considerados em uma urina normal, embora esses valores variem na literatura.
Com cerca de 12 mm de diâmetro, o leucócito predominantemente encontrado
no sedimento urinário é o neutrófilo, e podem apresentar-se isoladamente ou
em aglomerados. (MUNDT; SHANAHAN, 2012; STRASINGER; DI LORENZO,
2009).
O aumento de leucócitos na urina são observados mais comumente nas
ITUs, mas também podem ser vistos na nefrite intersticial aguda, nas infecções
causadas por Legionella e Leptospira, em infecções crônicas e em doenças
granulomatosas, como a sarcoidose e a nefrite tubulointersticial. (GOLDMAN;
AUSIELLO, 2009).
2.5.3.3 Outros elementos
Outros elementos que podem aparecer com maior frequência no
sedimento urinário são as células epiteliais, bactérias, muco, cilindros e cristais.
(GOLDMAN; AUSIELLO, 2009; FULLER; THREATTE; HENRY, 2008).
As células epiteliais presentes na urina podem ser originárias de
qualquer ponto do trato urinário e são classificadas em três tipos principais:
tubulares renais, de transição e escamosas. As células tubulares renais são
clinicamente as mais significativas das células epiteliais, devido a sua
importância para manter a função renal. (STRASINGER; DI LORENZO, 2009).
A presença de bactérias na urina pode ou não ser significante conforme
o método de coleta de urina e o tempo entre a coleta e a realização do exame.
Geralmente são observadas bactérias em conjunto a leucócitos, caracterizando
um processo inflamatório de uma ITU, principalmente de bactérias em forma de
bastonete uma vez que os organismos entéricos são os principais agentes
causais das ITUs. (FULLER; THREATTE; HENRY, 2008).
51
Muco são filamentos longos, delgados e ondulantes. Estão presentes em
pequeno número na urina normal, mas podem estar aumentados em processos
infecciosos ou inflamatórios. (MUNDT; SHANAHAN, 2012).
Os cilindros se formam nos túbulos pela proteína de Tamm-Horsfall e
são os únicos elementos formados na urina que tem o rim como o seu único
local de origem. Em indivíduos normais, poucos cilindros são encontrados no
sedimento urinário, embora nas doenças renais, eles podem aparecer em
grandes números e em formas diferentes. Os cilindros apresentam grandes
variações em aspecto, tamanho, morfologia e estabilidade e são classificados
com base no aspecto e composição celular que possui. Dentre os diferentes
tipos de cilindros, podem-se destacar os cilindros hialinos, hemáticos,
leucocitários, de células epiteliais, granulosos finos e grosseiros, céreos e
graxos. (FULLER; THREATTE; HENRY, 2008; MUNDT; SHANAHAN, 2012).
Os cilindros hemáticos indicam hematúria, de caráter sempre patológico,
com o diagnóstico voltado para doença glomerular, particularmente nas
glomerulonefrites, endocardite bacteriana subaguda e infarto renal. A presença
de cilindros hemáticos deve ser acompanhada de hemácias livres e de um
resultado positivo para hemoglobina na tira de urina. Já os cilindros
leucocitários são encontrados em situações de infecção e inflamação não
infecciosa renal. A grande maioria dos cilindros leucocitários reflete doença
tubulointersticial com exsudatos neutrofílicos e inflamação intersticial, comum
na pielonefrite, no entanto, também pode estar presente em inflamações
agudas não bacterianas, como nefrite intersticial e podem vir acompanhadas
dos cilindros hemáticos na glomerulonefrite. (RAVEL, 2009, MUNDT;
SHANAHAN, 2012; STRASINGER; DI LORENZO, 2009; WALLACH, 2011).
Os cristais são formados pela precipitação dos sais urinários frente a
alterações na solubilidade, seja pela influência no pH, temperatura e
concentração. Raramente possuem significado clínico, contudo a presença de
alguns poucos tipos anormais podem representar doença hepática, erros inatos
do metabolismo, insuficiência renal ou danos causados pela cristalização nos
túbulos de compostos iatrogênicos. (FULLER; THREATTE; HENRY, 2008;
STRASINGER; DI LORENZO, 2009). “A avaliação microscópica da urina é
importante para a detecção de cristais, uma vez que nenhum teste químico
detecta a presença deles.” (MUNDT; SHANAHAN, 2012).
52
3 METODOLOGIA
Traz um comparativo metodológico entre as tiras reagentes de urina das
marcas Biocolor e Uriquest plus em comparação a sedimentoscopia urinária
avaliando-se a hematúria e a leucocitúria.
A pesquisa utilizou como grupo de estudo os pacientes que procuraram
atendimento no Laboratório Paulo Netto do município de João Pinheiro/Minas
Gerais (MG) para realizar o EAS no período de 10 a 18 de maio de 2012. Os
pacientes que tinham em seu pedido médico o exame de EAS foram
abordados na recepção do laboratório Paulo Netto e apresentados os objetivos
do estudo, o termo de consentimento livre esclarecido e a garantia de
anonimato dos pacientes, segundo a resolução 196/96. Os que se
voluntariaram assinaram o termo de consentimento livre esclarecido em duas
vias, uma entregue ao paciente e a outra anexada ao trabalho. Uma entrevista
estruturada também foi aplicada visando identificar possíveis interferentes.
O modelo do termo de consentimento livre esclarecido e a entrevista
estruturada encontram-se em apêndice.
Dentre os critérios de inclusão da amostra de urina no estudo:
a) Amostras em frascos plásticos transparentes, estéreis, de 50 ml,
empregados pelo laboratório Paulo Netto;
b) Primeira urina da manhã;
c) Sem conservantes;
d) Amostras recém colhida;
e) Ultra filtrado plasmático humano (urina).
Dos critérios de exclusão da amostra de urina no estudo:
a) Amostras de pacientes menores de dezoito anos;
b) Amostras com volume inferior a 10 ml.
O projeto foi realizado no Laboratório Paulo Netto no município de João
Pinheiro/Minas Gerais na segunda e terceira semana de maio de 2012 com as
53
amostras de urina (urina humana) recolhidas no período de sete às dez da
manhã, obedecendo-se os critérios de inclusão e exclusão das amostras.
Os resultados da análise física, química e da sedimentoscopia urinária
foram comparados observando-se o indício, presença ou ausência de
hematúria, hemoglobinúria e leucocitúria, avaliando-se em caráter estatístico a
sensibilidade, especificidade, concordância e valores preditivos positivos e
negativos de cada etapa para com o comparativo das tiras reativas.
As tiras foram avaliadas quanto à reação química adotada para cada kit,
largura da tira e das almofadas reagentes, tempo para ocorrer à reação,
visibilidade e estabilidade da reação. O procedimento técnico adotado para as
amostras seguiram o modelo exame – EAS compreendido em três etapas:
análise física da urina, análise química da urina e sedimentoscopia urinária.
3.1 Análise física da urina
Realizada a coleta da amostra de urina em frasco fornecido pelo
Laboratório Paulo Netto e identificação própria da instituição, por numeração
sequenciada e as iniciais do participante procede-se com a realização do
exame de EAS.
Inicialmente, homogeneíza-se a amostra suavemente em movimentos
circulares e verte-se 10 ml de urina em tubo cônico plástico transparente,
graduado em 10 ml. Na primeira etapa, a urina foi avaliada quanto à cor e
aspecto apresentado.
A determinação da coloração da amostra foi feita em ambiente com
exposição indireta a iluminação artificial, olhando para baixo através do
recipiente contra um fundo branco. A classificação obedeceu às seguintes
variações de cor existentes na urina: incolor, amarelo claro, amarelo citrino,
amarelo escuro, âmbar, laranja, verde, rosa, vermelha, marrom e preta.
O aspecto foi determinado através do exame visual da amostra
homogeneizada, mantendo-a exposta indiretamente à iluminação artificial. A
descrição do aspecto da urina inclui desde límpido, opalescente, ligeiramente
turvo, turvo e leitoso.
54
3.2 Análise química da urina
Realizada a análise física, procede-se para a análise química da urina. O
método seguiu as recomendações do fabricante do kit das marcas Biocolor e
Uriquest plus para a tira reativa de urina, considerando hematúria, resultados
positivos para a tira reativa de urina, diferenciando a hematúria de
hemoglobinúria, assim como reação positiva para a esterase de leucócitos, foi
considerado leucocitúria.
Para o controle de qualidade, amostras controle foram enviadas para
análise interlaboratorial e os resultados comparados entre si em todos os
parâmetros analisados na tira reativa de urina.
3.2.1 Tira Biocolor
A tira Biocolor determina semi-quantitativamente dez parâmetros na
urina: urobilinogênio, glicose, corpos cetônicos, bilirrubina, proteína, nitrito, pH,
sangue, densidade e leucócitos. Os procedimentos do kit Biocolor estão
descritos abaixo:
Retirar uma fita do kit da marca Biocolor e fechá-lo imediatamente.
Inspecionar a tira. Mergulhar a tira no tubo cônico contendo 10 ml de urina por
cerca de um segundo. Certificar de que todas as almofadas estejam
umedecidas. Evitar que a tira encoste nas laterais do tubo. Retirar o excesso
de urina apoiando as laterais da tira em um papel toalha. Comparar os
resultados da tira com o gráfico presente no rótulo do Kit Biocolor em um
ambiente iluminado artificialmente.
Respeitar o tempo de leitura para cada elemento da tira. Mudanças na
coloração nas extremidades da tira ou depois de decorridos 2 minutos não
apresentam significado clínico. Os resultados são obtidos por comparação
direta da tira teste com o gráfico de cores presente no rótulo do Kit Biocolor.
3.2.2 Tira Uriquest plus
A tira Uriquest plus é um sistema de tira reagente para determinação
semi-quantitativa de bilirrubina, urobilinogênio, cetonas, ácido ascórbico,
55
glicose, proteína, sangue, pH, nitrito, leucócitos e densidade na urina. Abaixo
estão os procedimentos para realizar o teste:
Retirar do frasco de Uriquest plus somente a quantidade de tiras
necessárias para o uso imediato e tampar em seguida. Inspecionar a tira.
Imergir a tira no tubo cônico contendo 10 ml de urina por aproximadamente
dois segundos de forma que todas as áreas sejam imersas quase que
simultaneamente. Retirar a tira, deslizando pela borda do tubo para remover o
excesso de urina. Manter a tira na posição horizontal para prevenir mistura de
produtos químicos de áreas adjacentes. Realizar a leitura das reações em 60
segundos e entre 60 e 120 segundos para leucócitos, comparando as cores
desenvolvidas nas áreas reagentes com a escala de cores do rótulo do kit
Uriquest plus. Não realizar a leitura após 120 segundos.
3.3 Sedimentoscopia urinária
As amostras foram centrifugadas na centrifuga Excelsa baby com
capacidade para 6 tubos, a uma velocidade de 1500 rotações por minuto (rpm)
durante 5 minutos, assegurando sedimentações iguais em todas as amostras.
A sedimentoscopia urinária foi realizada por bioquímico responsável do setor
de urinálise no laboratório Paulo Netto do município de João Pinheiro/Minas
Gerais, ao qual emprega o método de observação com lâmina em microscopia
de luz, com contagem de dez campos, observados na objetiva de 10X para
muco e células epiteliais, e 40X para leucócitos, hemácias, microbiota e outros
elementos anormais. A presença de bactérias, cilindros, muco, células epiteliais
e cristais foram expressos de maneira semiquantitativa (TAB. 1), e a presença
de hemácias e leucócitos expressos em número médio por campos contados.
Tabela 01 – Classificação dos resultados semiquantitativos: bactérias,
cilindros, muco, células epiteliais e cristais
Nº médio por campo
0
<1
1a3
3a5
>5
Classificação
Ausente
Raros
Moderados
Ligeiramente Aumentado
Aumentado
Fonte: Criado pelo autor com dados extraídos de Bottini; Garlipp, 2006, p. 159
56
Foi considerado hematúria valores superiores a duas hemácias por
campos contados, assim como valores superiores a cinco leucócitos por
campos contados foi considerado como leucocitúria.
O laudo emitido foi repassado para o modelo exame – EAS, e em
seguida comparado aos resultados da análise física e química da urina. O
modelo exame – EAS encontra-se em apêndice.
Foi adotado o sistema do Microsoft Office Word 2007 e Microsoft Office
Excel 2007 para a aplicação dos dados da pesquisa em gráficos e tabelas.
Utilizou-se gráficos e tabelas dos seguintes modelos: colunas agrupadas e
Tabela com subtítulo 1.
57
4 RESULTADOS
Foram obtidas amostras de 71 pacientes, no entanto, 4 foram excluídos
do estudo por entrarem em desacordo aos critérios de inclusão e exclusão da
amostra, restando 67 pacientes, sendo que 42 (64%) são do sexo feminino e
25 (36%) são do sexo masculino, como pode ser observado no gráfico 1.
Gráfico 1 – Distribuição do total de amostras em relação ao sexo
Fonte: Dados da pesquisa
Considerando-se a idade dos pacientes, 47 (70%) se encontravam na
faixa etária de 18 a 40 anos enquanto 20 (30%) tinham idade superior a 40
anos, em uma média de idade de 35,5 anos. Da faixa etária de 18 a 40 anos,
se encontram 27 (64%) pacientes do sexo feminino (média de idade de 39,03)
e 20 (80%) pacientes do sexo masculino (média de idade de 33,56), e acima
dos 40 anos, 15 (36%) pacientes do sexo feminino e 5 (20%) pacientes do sexo
masculino.
Dos 67 pacientes selecionados, 4 (6%) apresentaram positividade para
hematúria na tira reativa de urina, 4 (6%) apresentaram reação positiva para
hemoglobinúria na tira reativa de urina, 2 (3%) apresentaram resultados
positivos para leucocitúria na tira reativa de urina e 1 (1,5%) apresentou
positividade para hematúria e leucocitúria na tira reativa de urina. Na análise do
sedimento, 7 (10,5%) apresentaram hematúria microscópica, 3 (4,5%)
58
pacientes com leucocitúria, 1 (1,5%) apresentou cristais de oxalato e 1 (1,5%) a
presença de Trichomonas spp.
Dos
pacientes
que
apresentaram
resultados
positivos
para
hematúria/hemoglobinúria e leucocitúria na tira reativa de urina, 9 (82%) são do
sexo feminino e 2 (18%) do sexo masculino (GRAF. 2). As 3 (27%) amostras
positivas para leucocitúria foram de pacientes do sexo feminino.
Gráfico 2 – Distribuição de amostras positivas para
hematúria/hemoglobinúria e leucocitúria em relação ao sexo
Fonte: Dados da pesquisa
Dentre os medicamentos utilizados pelos pacientes relatados durante a
entrevista estruturada, estão repositores hormonais, reguladores de pressão
arterial sistêmica, glicemia e colesterol, uso de contraceptivos orais, dentre
outros, aos quais, segundo Labtest (2009), não interferem nas reações da tira
reativa de urina. Todos os pacientes relataram estar esclarecidos sobre os
procedimentos da coleta de urina e de não estarem utilizando de nenhum
complexo vitamínico específico. Dois pacientes relataram ter realizado
atividade física intensa no dia anterior a coleta para o EAS.
Pela análise física, houve 3 (4,5%) pacientes com a urina de aspecto
turvo, correlacionando aos resultados da análise química e do sedimento
urinário, foram confirmados pela reação positiva para esterase de leucócitos e
o aumento na concentração da microbiota, leucócitos e de muco na amostra.
59
Avaliando-se as tiras reativas de urina segundo a reação química
adotada para cada kit, largura da tira e das almofadas reagentes, tempo para
ocorrer à reação, visibilidade e estabilidade da reação foi possível verificar que
a tira Uriquest plus e Biocolor obtiveram resultados satisfatórios e semelhantes
nas amostras analisadas, como pode ser observado no quadro 3.
Quadro 3 – Avaliação das tiras reativas de urina Biocolor e Uriquest plus
Parâmetros
Reação química
adotada
Largura das tiras e
almofadas reagentes
Estabilidade e
duração da reação
Reações positivas
Hemácias/sangue
Biocolor
Pseudo
peroxidase da
hemoglobina
Uriquest
Pseudo
plus
peroxidase da
hemoglobina*
Biocolor
5 mm
Uriquest
4 mm
plus
Biocolor
60 segundos
Uriquest 60 segundos
plus
Biocolor
H1
H2
Uriquest
plus
5
4
5
4
Esterase de leucócitos
Biocolor
Hidrólise de
carboxilato
heterocíclico
Uriquest pelas esterases
dos neutrófilos
plus
Biocolor
Uriquest
plus
Biocolor
Uriquest
plus
Biocolor
Uriquest
plus
5 mm
4 mm
120 segundos
120 segundos
3
3
* Protegido da ação antioxidante do ácido ascórbico.
1
H – Hematúria
2
H - Hemoglobinúria
Fonte: Dados da pesquisa
Ambos os kits adotam a reação química baseada na hidrólise de
carboxilato heterocíclico pelas esterases dos neutrófilos, para a presença de
leucócitos enquanto que para a presença de hematúria e/ou hemoglobinúria
tem-se a reação da atividade da pseudoperoxidase da hemoglobina, porém a
tira Uriquest plus apresenta vantagens, devido à diminuição da interferência do
ácido ascórbico na reação para hematúria/hemoglobinúria e possibilidade de
detectar o aumento de ácido ascórbico na amostra pelo acréscimo da reação
de Tillman.
A tira de urina Biocolor por ser mais larga facilita a visibilidade da
reação, no entanto a tira Uriquest plus apresenta reações com cores mais
60
definidas. A estabilidade e tempo para as reações foram semelhantes entre as
tiras de urina dos kits analisados.
Correlacionando os dados obtidos para a análise física, a tira reativa de
urina e a sedimentoscopia urinária, é possível verificar que não houve
discrepância entre os métodos realizados. 3 (27%) pacientes tiveram reações
positivas para esterase de leucócitos, confirmadas na sedimentoscopia da
urina, com o aumento do número de leucócitos por campos contados e
turvação da amostra. Resultados positivos para hematúria na tira reativa de
urina, confirmados pela sedimentoscopia urinária, foi verificado em 5 (45%)
pacientes, no entanto devido a pequena concentração de hemácias, não houve
alteração na coloração e no aspecto das amostras analisadas, caracterizando
uma hematúria microscópica.
Os resultados dos 4 (36%) pacientes para
hemoglobinúria não apresentaram forte correlação com a hematúria na
realização da sedimentoscopia do sedimento urinário, notado pela menor
quantidade de hemácias por campos contados, permitindo diferenciar a
hemoglobinúria da hematúria, porém 2 (18%) pacientes com resultados
positivos para hemoglobinúria na tira reativa de urina, foram considerados
como hematúria microscópica na análise do sedimento ao microscópio,
correspondendo a 7 (63%) pacientes.
Os dados da comparação dos métodos da tira reativa de urina com a
sedimentoscopia urinária estão esquematizados na tabela 2.
Tabela 2 – Comparação entre as tiras reativas de urina e a
sedimentoscopia para hematúria/hemoglobinúria e leucocitúria
Método
Tira reativa de urina
Uriquest plus
Tira reativa de urina
Biocolor
Sedimentoscopia
urinária
Hematúria
5
Hemoglobinúria
4
Leucocitúria
3
5
4
3
7
–
3
Fonte: Dados da pesquisa
A concentração de hemácias e leucócitos mostraram concordância entre
os métodos selecionados de 97% e 100%, respectivamente. (TAB. 3 e 4).
61
Tabela 3 – Concordância entre a contagem de hemácias e reações
positivas para sangue na tira reativa de urina
Reação positiva
Reação negativa
Total
> 2/ campo
7
0
7
Até 2/campo
2
58
60
Total
9
58
67
Sensibilidade = 78%; Especificidade = 97%; VP positivo = 46%; VP negativo= 54%,
Concordância = 97%.
Fonte: Dados da pesquisa
Tabela 4 – Concordância entre a contagem de leucócitos e reações
positivas para esterase de leucócitos na tira reativa de urina
Reação positiva
Reação negativa
Total
> 5/ campo
3
0
3
Até 5/campo
0
64
64
Total
3
64
67
Sensibilidade = 99,9%; Especificidade = 99,9%; VP positivo = 53%; VP negativo= 47%,
Concordância = 100%.
Fonte: Dados da pesquisa
62
5 DISCUSSÃO
A hematúria microscópica assintomática é uma anormalidade urinária
frequente independente de gênero e faixa etária, e embora existam poucos
estudos populacionais sobre a prevalência de hematúrias e de seus
interferentes em fitas de urinálise (BASTOS; MARTINS; DE PAULA, 1998;
COLOMBELI, 2006), alguns estudos como o de Coelho e colaboradores (1997)
em Recife corroboram para esta afirmação. Em seu estudo, ele rastreou urinas
por meio da tira reativa, encontrando hematúria em 19% da população
estudada (PROCHNOW; GONÇALVES, 2000), resultado semelhante ao obtido
neste estudo de 13%. O estudo de Mohr e colaboradores citado por Bastos,
Martins e de Paula (1998), realizado em 15.401 indivíduos na cidade de
Rochester, Estados unidos, alcançou 13% de prevalência de hematúria
microscópica assintomática.
Wallach (2011) cita que episódios isolados de hematúria microscópica
geralmente não necessitam de investigação, podendo ser decorrentes de
infecções virais, traumatismos leves, dentre outros.
Dentre os pacientes com resultados positivos para leucocitúria, todos
foram mulheres na faixa etária de 30 – 40 anos. A leucocitúria está associada a
casos de ITUs, e segundo Silveira e colaboradores (2010), o diagnóstico
dessas infecções, geralmente é feito pela urocultura, embora o método com a
tira reativa de urina e do sedimento urinário auxiliem no diagnóstico. Maldaner
e colaboradores (2011) destaca que as mulheres são mais susceptíveis a ITUs,
devido a questões anatômicas e a contaminação bacteriana da uretra feminina
no ato sexual, confirmando os achados deste estudo em relação a prevalência.
Importante ressaltar que o número de amostras estudadas deveria ser
maior para se ter um resultado mais claro da porcentagem de positividade de
hematúria/hemoglobinúria e leucocitúria em relação aos resultados da
sedimentoscopia urinária, no entanto, frente aos dados obtidos, devem ser
considerados por estarem de acordo com a literatura.
63
6 CONCLUSÃO
A utilização de tiras reagentes de urina contribui para a liberação de
resultados mais rápidos e confiáveis, diminuindo a necessidade de se realizar a
microscopia do sedimento em urinas com características físico-químicas
normais, entretanto deve-se manter atento aos fatores que podem levar a
falsos negativos e falsos positivos, que podem influenciar nos resultados dos
dois métodos e na necessidade de se realizar as três etapas do exame de
urina.
Este estudo demonstrou que a tira reativa de urina apresentou boa
precisão e concordância com a análise física e a sedimentoscopia urinária na
análise da hematúria e leucocitúria, mas devido ao pequeno número de
amostras e escassez de dados sobre o assunto não foi possível traçar um perfil
seguro em relação aos dados obtidos. Sugere-se que novos estudos sejam
realizados a fim de confirmar a aplicabilidade dos métodos no exame de EAS.
64
REFERÊNCIAS
AMORIM, Anne Elisa; PACHECO, Jaqueline Bento Pereira; FERNANDES,
Thaís Teixeira. Exame de urina tipo I: frequência percentual de amostras que
sugerem infecção urinária. Anuário da Produção de Iniciação Científica
Discente. v. 11. n. 12., 2008. p. 57 – 68. Disponível em: <www.scielo.br>.
Acesso em: 21 set. 2011.
ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS. PROJETO 36:000.02003: laboratório clínico – requisitos e recomendações para o exame de urina.
Rio de Janeiro, 2005.
BASTOS, Marcus G.; MARTINS, Geraldo Antunes; DE PAULA, Rogério
Baumgratz. Diagnóstico diferencial nas hematúrias. Jornal Brasileiro de
Nefrologia. v. 20. n. 4., 1998. p. 425 – 440. Disponível em: <www.jbn.org.br>.
Acesso em: 19 set. 2011.
BAYNES, Jhon W; DOMINICZAK, Marek H. Bioquímica médica. 20 ed. Rio de
Janeiro: Editoria Elsevier, 2007.
BIOEASY. Biocolor. Ref. U031.T100. Belo Horizonte. Bioeasy Diagnóstica
Ltda, 2010.
BONINI, P. et al. Erros em laboratório médico. Química clínica. v. 48. n. 5.,
2002. p. 691 – 698. Disponível em: <www.scielo.br>. Acesso em: 16 set. 2011.
BOTTINI, P. V. GARLIPP, C. R. Urinálise: comparação entre microscopia
óptica e citometria de fluxo. Jornal Brasileiro de Patologia Médica
Laboratorial. v. 42. n. 3., 2006. p. 157 – 162. Disponível em: <www.scielo.br>.
Acesso em: 12 set. 2011.
CONSELHO NACIONAL DE SAÚDE. Resolução 196/96: diretrizes e normas
regulamentadoras de pesquisas envolvendo seres humanos. Disponível em:
<www.bioetica.ufrgs.br>. Acesso em: 17 out. 2011.
CARMO, Pryscilla Aparecida Vieira do et al. Avaliação comparativa da
sedimentoscopia urinária realizada pelo nefrologista e pelo profissional de
análises clínicas em pacientes com glomerulopatias. Jornal Brasieliro de
Nefrologia. v. 29. n. 2., 2007. p. 90 – 94. Disponível em: <www.scielo.br>.
Acesso em: 20 set. 2011.
CIRIADES, Pierre G. J. Sedimento urinário: correlação dos resultados pela
gravidade específica, peso específico (ou densidade). Especial – curso de
urinálise 5° parte. News Lab. n. 99., 2010. p. 174 – 178.
COELHO, S. N. et al. Epidemiology of hypertension (HPT) and Kidney disease
(KD) in Recife, Brazil: evidence for a serious health problem. Nephrology,
1997. p. 224 – 232. Disponível em: <www.jbn.org.br>. Acesso em: 19 set.
2011.
65
COLOMBELI, Adriana Scott da Silva. Avaliação do potencial de interferência
analítica de fármacos na análise química do exame de urina. Programa de
pós-graduação em farmácia, 2006.
COLOMBELI, Adriana Scott da Silva. FALKENBERG, Miriam. Comparação de
bula de duas marcas de tiras reagentes utilizadas no exame químico de urina.
Jornal Brasileiro de Patologia Médica Laboratorial. v. 42. n. 2., 2006. p. 85
– 96. Disponível em: <www.scielo.br>. Acesso em: 23 set. 2011.
COMPRI-NARDY, Mariane; STELLA, Mércia Breda; OLIVEIRA, Carolina de.
Práticas de laboratório de bioquímica e biofísica: uma visão integrada. Rio
de Janeiro: Editora Guanabara Koogan, 2011.
COSTA, Marco Antônio et al. Comparação dos resultados obtidos pelos
métodos de contagem por campo e contagem de Addis modificada utilizados
para a análise do sedimento urinário. Revista Brasileira de Análises clínicas.
v. 38. n. 4., 2006. p. 225 – 229. Disponível em: <www.scielo.br>. Acesso em:
23 set. 2011.
COSTAVAL, José Aloysio da, et al. Qual o valor da sedimentoscopia em urinas
com características físico-químicas normais? Jornal Brasileiro de Patologia.
v. 37. n. 4., 2001. p. 261 – 265. Disponível em: <www.scielo.br>. Acesso em:
23 set. 2011.
ENZIPHARMA. Produtos de laboratórios. Disponível em:
<www.enzipharma.com.br/data/index.php?page=shop.product_details&flypage
=shop.flypage&product_id=208&category_id=4&manufacturer_id=0&option=co
m_virtuemart&Itemid=5>. Acesso em: 04 mai. 2012.
FERREIRA, Bárbara C. et al. Estudo dos medicamentos utilizados pelos
pacientes atendidos em laboratório de análises clínicas e suas interferências
em testes laboratoriais: uma revisão da literatura. Revista Eletrônica de
Farmácia. . v. 6. n. 1, 2009. p. 33 – 43. Disponível em: <www.scielo.br>.
Acesso em: 23 set. 2011.
FULLER, Christine E.; THREATTE, Gregory A.; HENRY, John Bernard. Exame
básico de urina. In: HENRY, John Bernard. Diagnósticos clínicos e
tratamento por métodos laboratoriais. 20 ed. São Paulo: Editora Manole,
2008. Cap. 18, p. 427 – 470.
FUNCHAL, Cláudia; MASCARENHAS, Marcello; GUEDES, Renata.
Correlação clínica e técnicas de uroanálise: teoria e prática. Porto Alegre:
Editora Sulina, 2008.
GOLDMAN, Lee; AUSIELLO, Dennis. Cecil: medicina. 23 ed. v. I. Rio de
Janeiro: Editora Elsevier, 2009.
GUYTON, Arthur C.; HALL, John E. Tratado de fisiologia médica. Rio de
Janeiro: Editora Elsevier, 2006.
66
LABTEST. Uriquest plus. 150 – 150. Lagoa Santa: Labtest diagnóstica S. A.,
2009. p. 1 – 6.
LIESENFELD, Cláudia, et al. Avaliação de hematúria em praticantes e nãopraticantes de exercícios físicos variados. Revista Brasileira de Análises
Clínicas. v. 41. n. 2., 2009. p. 143 – 146.
MACHADO, M. H. T et al. Automação do exame de urina: comparação do
Urisys 2400 com a rotina manual (Microscopia do sedimento urinário). Revista
Brasileira de Análises Clínicas. v. 35. n. 4, 2003. p. 165 – 167.
MALDANER, Nádia Ione et al. Perfil antimicrobiano de cepas de Escherichia
coli isolados de pessoas com suspeita de infecção do trato urinário. Revista
Brasileira de Análises Clínicas. v. 43. n. 2., 2011. P. 145 – 147.
MENEZES, Ana M. B.; DOS SANTOS, Iná da S. Curso de epidemiologia básica
para pneumologistas: 4º parte – epidemiologia clínica. Jornal de
Pneumologia. v. 25. n. 6., 1999. p. 321 – 326. Disponível em:
<www.scielo.br>. Acesso em: 1 jun. 2012.
MUNDT, Lillian A., SHANAHAN, Kristy. Exame de urina e de fluidos
corporais de Graff. 2 ed. Porto Alegre: Editora Artmed, 2012.
PEREIRA; Anna Caroline; BORDIGNON, Jardel C. Infecção urinária em
gestantes: perfil de sensibilidade dos agentes etiológicos de gestantes
atendidas pelo SUS na cidade de Palmas – PR. Revista Brasileira de
Análises Clínicas. v. 43. n. 2., 2011. P. 096 – 099.
PROCHNOW, André A.; GONÇALVES, Luis Felipe S. Hematúria. Revista
HCPA. v. 20. n. 3., 2000. p. 247 – 254. Disponível em: <www.hcpa.ufgrs.br>.
Acesso em: 04 out. 2012.
RAVEL, Richard. Laboratório clínico: aplicações clínicas dos dados
laboratoriais. 6 ed. Rio de Janeiro: Guanabara Koogan, 2009.
SILVEIRA, Solange Aparecida et al. Prevalência e suscetibilidade bacteriana
em infecções do trato urinário de pacientes atendidos no Hospital Universitário
de Uberaba. Revista Brasileira de Análises Clínicas. v. 42. n. 3., 2010. P.
157 – 160.
STRASINGER, Susan K.; DI LORENZO, Marjorie S. Urinálise e fluídos
corporais. 5 ed. São Paulo: Editora LMP – Livraria Médica Paulista, 2009.
SUPRALAB. Produtos disponíveis. Disponível em:
<www.supralab.com.br/loja_lancamentos_anteriores.asp>. Acesso em: 04 mai.
2012.
VIEIRA, Múcio. Proteína urinária. 74 ed. Revista News Lab, 2006. p. 150 –
154.
67
WALLACH, Jacques. Interpretação de exames laboratoriais. 8 ed. Rio de
Janeiro: Editora Guanabara Koogan, 2011.
WEIDE, M; LARA G. M. Avaliação da presença de microhematúria antes e
após exercício físico em militares masculinos. 70 ed. Revista NewsLab, 2005.
p. 124 – 134.
68
APÊNDICE A – ENTREVISTA ESTRUTURADA
ENTREVISTA ESTRUTURADA
ID: _________________________________________________________
Sexo: ____ Data de nascimento: ___/___/___
1 – Faz uso de algum medicamento, ou o fez recentemente?
Sim
Não
2 – Em caso afirmativo, qual ou quais?
_______________________________________________________________
3 – Você foi esclarecido sobre os procedimentos da coleta?
Sim
Não
4 – Fez uso de algum complexo vitamínico no período em que precedeu o
exame?
Sim
Não
5 – Em caso afirmativo, qual ou quais?
_______________________________________________________________
6 – Realizou atividade física intensa no dia anterior a coleta?
Sim
Não
69
APÊNDICE B – MODELO EXAME – EAS
Modelo exame – EAS
Análise física
Cor:
Aspecto:
Volume:
pH
Densidade
Urobilinogênio
Corpos cetônicos
Glicose
Proteínas
Bilirrubina
Nitrito
Sangue
Leucócitos
Ácido Ascórbico
Análise química
R1.
V. R.1
5,0
1010 – 1030
Normal
Ausente
Ausente
Ausente
Ausente
Ausente
Ausente
Ausente
–
Sedimentoscopia
R2.
V. R.2
5,0
1010 – 1030
Normal
Ausente
Ausente
Ausente
Ausente
Ausente
Ausente
Ausente
Ausente
Células epiteliais
Microbiota
Muco
Leucócitos
Hemácias
Observações:____________________________________________________
_______________________________________________________________
Resultado paciente – R1 Resultado tira reagente Uriquest plus
R1 Resultado tira reagente Biocolor
Valor de Referência – V.R1 Kit tira reagente Uriquest plus
V.R.2 Kit tira reagente Biocolor
70
APÊNDICE C – TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
Tema: COMPARAÇÃO METODOLÓGICA PARA ANÁLISE DA TIRA REATIVA DE
URINA E SEDIMENTOSCOPIA URINÁRIA: leucocitúria e hematúria.
Pesquisador Responsável: Marco Antônio Silvério Ribeiro
Instituição a que pertence o responsável pelo estudo: Faculdade TECSOMA,
Paracatu – MG
Este projeto tem o objetivo de avaliar os resultados para a leucocitúria e hematúria
entre as marcas de tiras reagentes, Biocolor e Uriquest plus utilizados no exame químico da
urina.
Para tanto serão realizadas coletas de urina em frascos próprios, com prévia
higienização e desprezo do primeiro jato da amostra. As amostras passarão por análise física e
química da urina e pela sedimentoscopia urinária. Os resultados serão comparados e avaliados
segundo o indício, a presença ou ausência de hematúria e/ou leucocitúria.
Durante a execução do projeto não haverá nenhum risco e você estará garantindo com
isso a qualidade de exames laboratoriais. Se você tiver alguma dúvida em relação ao estudo
ou não quiser mais fazer parte do mesmo, pode entrar em contato com o telefone (38) 9158 6591. Se você estiver de acordo em participar, posso garantir que as informações fornecidas
serão confidenciais (ou material coletado), de uso exclusivo para o estudo.
Após ler e receber explicações sobre a pesquisa, e ter meus direitos de:
1.
Receber resposta a qualquer pergunta e esclarecimento sobre os procedimentos,
riscos, benefícios e outros relacionados à pesquisa;
2.
Retirar o consentimento a qualquer momento e deixar de participar do estudo;
3.
Não ser identificado e ser mantido o caráter confidencial das informações
relacionadas à privacidade.
_______________________________________________ declaro estar ciente do
exposto e desejar participar do projeto.
João Pinheiro, _____ de ___________ de ______
Nome do voluntário: ____________________________________________________
Assinatura: ____________________________________________________________
Eu, Marco Antônio Silvério Ribeiro declaro que forneci todas as informações referentes
ao projeto ao participante.
__________________________________________________
Marco Antônio Silvério Ribeiro
Data:___/____/____.




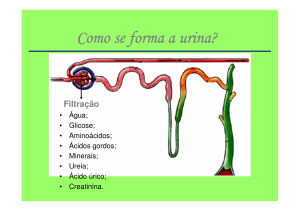


![Exame 2744 LSD[dietilamina do ácido lisérgico], urina](http://s1.studylibpt.com/store/data/005349342_1-d4a910d388af9a7ae060b6a6ee594864-300x300.png)


