Física 3 | aulas 11 e 12 www.fisicanaveia.com.br
www.fisicanaveia.com.br/CEI
Física 3 | aulas 11 e 12
Mudança de Estado
Processos
Q>0
Q<0
Física 3 | aulas 11 e 12
Curva de Aquecimento
Calor e Mudança de Estado
Física 3 | aulas 11 e 12
Calor e Mudança de Estado
A vaporização (passagem do estado líquido para o estado gasoso) pode ocorrer por:
•1) EVAPORAÇÃO: processo que ocorre em qualquer temperatura;
nesse caso, moléculas mais agitadas do que a média se
desprendem do líquido, passando para o estado gasoso.
Exemplo: a água num copo evapora gradativamente à temperatura
ambiente, abaixo do ponto de ebulição.
•2) EBULIÇÃO: processo que ocorre para valores específicos de pressão (P) e temperatura (T) sobre a curva de vaporização no diagrama
de fases. O líquido literalmente ferve e se mantém na temperatura
de ebulição enquanto o processo de mudança de estado acontece.
Exemplo: a água numa panela sobre a chama do fogão atinge o ponto de
ebulição e passa do estado líquido para o estado gasoso.
Física 3 | aulas 11 e 12
Calor e Mudança de Estado
Exercício
1
(Enem) Ainda hoje, é muito comum as pessoas utilizarem vasilhames de barro (moringas
ou potes de cerâmica não esmaltada) para conservar água a uma temperatura menor do
que a do ambiente. Isso ocorre porque:
a) o barro isola a água do ambiente, mantendo-a sempre a uma temperatura menor que a
dele, como se fosse isopor.
b) o barro tem poder de “gelar” a água pela sua composição química. Na reação, a água
perde calor.
c) o barro é poroso, permitindo que a água passe através dele. Parte dessa água evapora,
tomando calor da moringa e do restante da água, que são assim resfriadas.
d) o barro é poroso, permitindo que a água se deposite na parte de fora da moringa. A
água de fora sempre está a uma temperatura maior que a de dentro.
e) a moringa é uma espécie de geladeira natural, liberando substâncias higroscópicas que
diminuem naturalmente a temperatura da água.
Resolução
A água líquida evapora em qualquer temperatura, roubando calor do meio para
isso. A porosidade do barro permite saída de água líquida que, para evaporar, retira calor
da moringa e do restante de água dentro do recipiente. Esse fenômeno abaixa um pouco a
temperatura da água no interior da moringa de cerâmica. Como ela fica mais fria que o
ambiente, ao bebê-la, temos uma sensação agradável por ela estar mais fresca.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
1
(UFF 2011) Quando se retira uma garrafa de vidro com água de uma geladeira, depois de
ela ter ficado lá por algum tempo, veem-se gotas d’água se formando na superfície externa
da garrafa. Isso acontece graças, principalmente, à:
a) condensação do vapor de água dissolvido no ar ao encontrar uma superfície à
temperatura mais baixa.
b) diferença de pressão, que é maior no interior da garrafa e que empurra a água para seu
exterior.
c) porosidade do vidro, que permite a passagem de água do interior da garrafa para sua
superfície externa.
d) diferença de densidade entre a água no interior da garrafa e a água dissolvida no ar, que
é provocada pela diferença de temperaturas.
e) condução de calor através do vidro, facilitada por sua porosidade.
Resolução
A garrafa rouba calor do ar mais próximo à sua superfície. Logo, a temperatura do ar em
volta da garrafa diminui. Para a mesma pressão externa (do ar), pressão atmosférica local,
ocorre a condensação do vapor d’água na forma de gotículas.
Física 3 | aulas 11 e 12
Exercício
Calor e Mudança de Estado
2
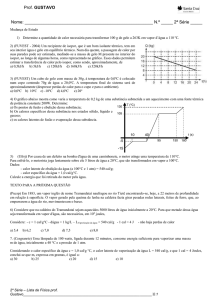
Um calorímetro ideal possui em seu interior 1 kg de gelo a –50 °C. Por meio de um
aparelho elétrico, esse gelo recebe energia até que se transforme em vapor, a 100 °C.
Considere: cgelo = 0,5 cal/g °C; cágua = 1 cal/g °C; Lfusão = 80 cal/g; Lvaporização = 540 cal/g.
Construa a curva de aquecimento tendo, no eixo horizontal, as quantidades de calor para
cada etapa do aquecimento e, no eixo vertical, as temperaturas em °C.
Resolução
QI 25 kcal
QII 80 kcal
QIII 100 kcal
QIV 540 kcal
I) Primeira etapa: aquecimento do gelo de – 50 °C até 0 °C:
QI m c T 1000 0,5 [0 (50)] 25000 cal 25 kcal
II) Segunda etapa: fusão do gelo a 0 °C:
QII m L 1000 80 80000 cal 80 kcal
III) Terceira etapa: aquecimento da água de 0 °C a 100 °C :
QIII m c T 1000 1 (100 0) 100000 cal 100 kcal
IV) Quarta etapa: vaporização da água a 100 °C :
QIV m L 1000 540 540000 cal 540 kcal
Quantidade de
CALOR SENSÍVEL
Quantidade de
CALOR LATENTE
Quantidade de
CALOR SENSÍVEL
Quantidade de
CALOR LATENTE
Física 3 | aulas 11 e 12
Calor e Mudança de Estado
Exercício
3
(PUC-RJ 2015) Um recipiente isolado contém uma massa de gelo, M = 5,0 kg à temperatura T = 0
oC. Por dentro desse recipiente, passa uma serpentina pela qual circula um líquido que se quer
resfriar. Suponha que o líquido entre na serpentina a 28 oC e saia dela a 8 oC. O calor específico
do líquido é CL = 1,0 cal/(g⋅oC), o calor latente de fusão do gelo é LF = 80 cal/g e o calor específico
da água é CA = 1,0 cal/(g⋅oC).
a) Qual é a quantidade total de líquido (em kg) que deve passar pela serpentina de modo a
derreter todo o gelo?
b) Quanto de calor (em kcal) a água (formada pelo gelo derretido) ainda pode retirar − do
líquido que passa pela serpentina − até que a temperatura de saída se iguale à de entrada (28
oC)?
Resolução
a) Qgelo Qlíquido 0 mgelo Lfusão mlíquido clíquido Tlíquido 0
5 kg 80
cal
cal
cal
cal
mlíquido 1 o (8 28)o C 0 400 kg
20 mlíquido o o C
g
g C
g
g C
400
kg mlíquido mlíquido 20 kg
20
Física 3 | aulas 11 e 12
Calor e Mudança de Estado
Exercício
3
(PUC-RJ 2015) Um recipiente isolado contém uma massa de gelo, M = 5,0 kg à temperatura T = 0
oC. Por dentro desse recipiente, passa uma serpentina pela qual circula um líquido que se quer
resfriar. Suponha que o líquido entre na serpentina a 28 oC e saia dela a 8 oC. O calor específico
do líquido é CL = 1,0 cal/(g⋅oC), o calor latente de fusão do gelo é LF = 80 cal/g e o calor específico
da água é CA = 1,0 cal/(g⋅oC).
a) Qual é a quantidade total de líquido (em kg) que deve passar pela serpentina de modo a
derreter todo o gelo?
b) Quanto de calor (em kcal) a água (formada pelo gelo derretido) ainda pode retirar − do
líquido que passa pela serpentina − até que a temperatura de saída se iguale à de entrada (28
oC)?
Resolução
b) Qágua mágua cágua Tágua 5000 g 1
cal
o
(
28
0
)
C 5000 28 cal
o
g C
Qágua 140000 cal 140 kcal
Física 3 | aulas 11 e 12
Calor e Mudança de Estado
Exercício
4
(Unifesp 2016) Considere um copo de vidro de 100 g contendo 200 g de água líquida, ambos
inicialmente em equilíbrio térmico a 20 oC. O copo e a água líquida foram aquecidos até o
equilíbrio térmico a 50 oC, em um ambiente fechado por paredes adiabáticas, com vapor de
água inicialmente a 120 oC. A tabela apresenta valores de calores específicos e latentes das
substâncias envolvidas nesse processo.
Considerando os dados da tabela, que
todo o calor perdido pelo vapor tenha sido
absorvido pelo copo com água líquida e
que o processo tenha ocorrido ao nível do
mar, calcule:
a) a quantidade de calor, em cal, necessária para elevar a temperatura do copo com água líquida
de 20 oC para 50 oC.
b) a massa de vapor de água, em gramas, necessária para elevar a temperatura do copo com
água líquida até atingir o equilíbrio térmico a 50 oC.
Resolução
a) QTotal Qcopo Qágua QTotal mcopo ccopo Tcopo mágua cágua Tágua
QTotal 100 g 0, 2
cal
cal
o
o
(
50
20
)
C
200
g
1
,
0
(
50
20
)
C
o
o
g C
g C
QTotal 20 30 200 30 600 6000 6600 cal
Física 3 | aulas 11 e 12
Exercício
Calor e Mudança de Estado
4
(Unifesp 2016) Considere um copo de vidro de 100 g contendo 200 g de água líquida, ambos
inicialmente em equilíbrio térmico a 20 oC. O copo e a água líquida foram aquecidos até o
equilíbrio térmico a 50 oC, em um ambiente fechado por paredes adiabáticas, com vapor de
água inicialmente a 120 oC. A tabela apresenta valores de calores específicos e latentes das
substâncias envolvidas nesse processo.
Considerando os dados da tabela, que
todo o calor perdido pelo vapor tenha sido
absorvido pelo copo com água líquida e
que o processo tenha ocorrido ao nível do
mar, calcule:
a) a quantidade de calor, em cal, necessária para elevar a temperatura do copo com água líquida
de 20 oC para 50 oC.
b) a massa de vapor de água, em gramas, necessária para elevar a temperatura do copo com
água líquida até atingir o equilíbrio térmico a 50 oC.
Resolução
b)
Q 0 (Q
copo
Qágua ) Qvapor 0 (6600) Qvapor 0
.
cond.
resfr.
(6600) Qresfr
Q
Q
0
vapor
vapor
água / vapor
6600 mvapor 0, 5 (20) mvapor (540) mvapor 1 (50) 0
6600 mvapor (600) 0 6600 mvapor 600 0 m vapor
6600
11 g
600
Física 3 | aulas 11 e 12
Diagrama de Fases
Pressão e Mudança de Estado
Substâncias que aumentam de volume na solidificação.
p (mm Hg)
PC
Líquido
Curva de
SUBLIMAÇÃO
Sólido
Curva de
FUSÃO
Curva de
VAPORIZAÇÃO
Gás
PT
Vapor
T (oC)
PT = Ponto Triplo (os 3 estados coexistem)
PC = Ponto Crítico (Limite G/V)
Física 3 | aulas 11 e 12
Diagrama de Fases
Pressão e Mudança de Estado
Substâncias que aumentam de volume na solidificação.
Exemplo: H2O
p (mm Hg)
PC (374 oC; 1,59.105 mm Hg)
Líquido
Curva de
SUBLIMAÇÃO
Sólido
Curva de
FUSÃO
Curva de
VAPORIZAÇÃO
Gás
PT (0,01oC; 4,58 mm Hg)
Vapor
T (oC)
PT = Ponto Triplo (os 3 estados coexistem)
PC = Ponto Crítico (Limite G/V)
Física 3 | aulas 11 e 12
Diagrama de Fases
p (mm Hg)
Pressão e Mudança de Estado
Analisando o diagrama para a H2O.
Experimento
do regelo
Novo ponto
de fusão!
Panela
de pressão
Ponto de
ebulição
“normal”!
PC
Ponto de fusão
“normal”!
> 760
760
Novo ponto
de ebulição!
água
líquida
gelo
Mantendo P,
Variando T,
a água muda
de estado
PT
<0 0
gás
vapor
d’água
100 > 100
760 mm Hg = 1,013.105 Pa = 101,3 kPa = 1 atm = 10,3 m.c.a.
T (oC)
Física 3 | aulas 11 e 12
Diagrama de Fases
Pressão e Mudança de Estado
Analisando o diagrama para a H2O.
PC
p (mm Hg)
760
< 760
Mantendo P,
Variando T,
a água muda
de estado
Ponto de fusão
“normal”!
água
líquida
gelo
Novo ponto
de fusão!
Ponto de
ebulição
“normal”!
gás
vapor
d’água
PT
Novo ponto
de ebulição!
0>0
< 100 100
760 mm Hg = 1,013.105 Pa = 101,3 kPa = 1 atm = 10,3 m.c.a.
T (oC)
Física 3 | aulas 11 e 12
Diagrama de Fases
p (mm Hg)
Pressão e Mudança de Estado
Analisando o diagrama para a H2O.
PC
água
líquida água
líquida
gelo
Mantendo T,
Variando P,
a água também
muda de estado
PT
vapor
d’água
A partir do PC
não tem como
liquefazer
a água apenas
aumentando
a pressão!
(gás)
T (oC)
760 mm Hg = 1,013.105 Pa = 101,3 kPa = 1 atm = 10,3 m.c.a.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
2
(UNIFESP 2009 – CG) A sonda Phoenix, lançada pela
NASA, detectou em 2008 uma camada de gelo no fundo
de uma cratera na superfície de Marte. Nesse planeta, o
gelo desaparece nas estações quentes e reaparece nas
estações frias, mas a água nunca foi observada na fase
líquida. Com auxílio do diagrama de fase da água,
analise as três afirmações seguintes.
I. O desaparecimento e o reaparecimento do gelo, sem a
presença da fase líquida, sugerem a ocorrência de
sublimação.
II. Se o gelo sofre sublimação, a pressão atmosférica local
deve ser muito pequena, inferior à pressão do ponto triplo
da água.
III. O gelo não sofre fusão porque a temperatura no interior da
cratera não ultrapassa a temperatura do ponto triplo da água.
De acordo com o texto e com o diagrama de fases, pode-se afirmar que
está correto o contido em
a) I, II e III.
b) II e III, apenas.
c) I e III, apenas.
d) I e II, apenas.
e) I, apenas.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
t
Experimento do regelo [1871] - John Tyndall (1820 - 1893)
início
Um arame flexível, com dois
corpos pesados presos em
seus extremos, é apoiado
sobre um bloco de gelo,
exercendo uma pressão
extra sobre a superfície.
fim
A pressão extra sobre a superfície
faz baixar a temperatura de fusão
do gelo que, então, derrete. O
arame atravessa a camada de água
líquida que se formou que, sem a
pressão, volta a solidificar-se.
O arame atravessa todo o
bloco de gelo até que os corpos
caem no chão. O bloco de gelo,
mesmo
atravessado
pelo
arame, permanece sólido por
conta do fenômeno do regelo.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Exercício
5
Um barman observa que se apertar dois cubos de gelo um contra o outro eles tendem a
ficar “grudados”. Explique esse fenômeno do ponto de vista da pressão e da temperatura
de fusão do gelo.
Resolução
O diagrama de fases (ou diagrama de
estado), gráfico P X T da água, nos revela
que um aumento na pressão sobre a fase
sólida reduz a temperatura de fusão de
gelo.
Logo, ao pressionar um cubo contra o
outro, há um aumento superficial da
pressão sobre a camada de gelo que gera
liquefação da camada de contato entre
eles. Assim que cessa a pressão, a água
liquefeita volta a solidifica-se, soldando
um cubo no outro.
Física 3 | aulas 11 e 12
Diagrama de Fases
Pressão e Mudança de Estado
Substâncias que diminuem de volume na solidificação.
p (mm Hg)
Líquido
PC
Curva de
SUBLIMAÇÃO
Sólido
Curva de
FUSÃO
Curva de
PT
Gás
Vapor
VAPORIZAÇÃO
T (oC)
PT = Ponto Triplo (os 3 estados coexistem)
PC = Ponto Crítico (Limite G/V)
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
(Enem) Os seres humanos podem
tolerar apenas certos intervalos de
temperatura e umidade relativa (UR), e,
nessas condições, outras variáveis, como
os efeitos do sol e do vento, são
necessárias para produzir condições
confortáveis, nas quais as pessoas
podem viver e trabalhar. O gráfico
mostra esses intervalos.
A tabela mostra temperaturas e
umidades relativas do ar de duas
cidades, registradas em três meses do
ano.
Extra
3
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Com base nessas informações, pode-se
afirmar que condições ideais são
observadas em:
a) Curitiba, com vento em março, e
Campo Grande, em outubro.
b) Campo Grande, com vento em março,
e Curitiba, com sol em maio.
c) Curitiba, em outubro, e Campo
Grande, com sol em março.
d) Campo Grande, com vento em março,
e Curitiba, com sol em outubro.
e) Curitiba, em maio, e Campo Grande,
em outubro.
Extra
3
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
4
(Enem) A tabela a seguir registra a
pressão atmosférica em diferentes
altitudes, e o gráfico relaciona a
pressão de vapor da água em função
da temperatura. Um líquido, num
frasco aberto, entra em ebulição a
partir do momento em que sua
pressão de vapor se iguala à pressão
atmosférica. Assinale a opção
correta, considerando a tabela, o
gráfico e os dados apresentados,
sobre as seguintes cidades:
A temperatura de ebulição será:
a) maior em Campos do Jordão.
b) menor em Natal.
c) menor no Pico da Neblina.
d) igual em Campos do Jordão e Natal.
e) não dependerá da altitude.
Resolução
Quanto menor a pressão atmosférica, menor a
temperatura de ebulição. E a pressão atmosférica é tão
menor quanto maior é a altitude. Logo, quanto maior a
altitude, menor a temperatura de ebulição da água.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
5
(UNICAMP) No Rio de Janeiro (ao nível do mar), certa quantidade de feijão, em água fervente, demora
40 minutos para ficar pronta. A tabela a seguir fornece o valor da temperatura da fervura da água em
função da pressão atmosférica, enquanto o gráfico fornece o tempo de cozimento dessa quantidade
de feijão em função da temperatura. A pressão atmosférica – que, ao nível do mar, vale 760 mm de
mercúrio – diminui 10 mm de mercúrio para cada 100 m de altitude.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
5
(UNICAMP – continuação)
a) Se o feijão for colocado em uma panela cuja pressão interna seja 880 mm de mercúrio, em quanto
tempo ele fica pronto?
b) Em uma panela aberta, em quanto tempo o feijão fica pronto na cidade de Gramado (RS),
localizada a uma altitude de 800 m?
c) Em qual altitude o tempo de cozimento do feijão (em uma panela aberta) será o dobro do tempo
de cozimento ao nível do mar?
d) Suponha que, em Gramado, foram empregados 2 litros de água e que, ao final do cozimento do
feijão, restaram 0,5 litro de água. Determine a potência térmica absorvida pela água, em watts,
considerando que o intervalo de tempo que aparece no gráfico seja medido a partir do instante em
que a água atinge o ponto de fervura.
Dados:
Calor latente de vaporização da água: 540 cal/g
Densidade da água: 1g/cm³
1 cal = 4J
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
5
a) Se o feijão for colocado em uma panela cuja pressão interna seja 880 mm de mercúrio, em quanto
tempo ele fica pronto?
Resolução
Pela tabela: p = 880 mmHg implica em T = 105 oC.
Pelo gráfico: T = 105 oC implica em t = 20 min.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
5
b) Em uma panela aberta, em quanto tempo o feijão fica pronto na cidade de Gramado (RS),
localizada a uma altitude de 800 m?
Resolução
A cada 100 m de altitude, a pressão cai 10 mmHg. Logo, para 800 m a pressão cai 8 x 10, ou
seja, 80 mmHg. Logo, p = 760 – 80 = 680 mmHg. Pela tabela, p = 680 mmHg implica T = 97 oC.
Pelo gráfico: T = 97 oC implica em t = 60 min.
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
5
c) Em qual altitude o tempo de cozimento do feijão (em uma panela aberta) será o dobro do tempo
de cozimento ao nível do mar?
Ao nível do mar (p = 760 mmHg) a água ferve a T = 100 oC. Pelo gráfico, t = 40 min. Logo, o
dobro do tempo de cozimento ao nível do mar vale t = 80 min que, pelo gráfico, implica em T = 95 oC.
Pela tabela, T = 95 oC implica em p = 640 mmHg = (760 – 120) mmHg. Logo, a queda de 120 equivale a
H = 1200 m.
Resolução
Física 3 | aulas 11 e 12
Pressão e Mudança de Estado
Extra
5
d) Suponha que, em Gramado, foram empregados 2 litros de água e que, ao final do cozimento do
feijão, restaram 0,5 litro de água. Determine a potência térmica absorvida pela água, em watts,
considerando que o intervalo de tempo que aparece no gráfico seja medido a partir do instante em
que a água atinge o ponto de fervura.
Resolução
Dos dois litros de água iniciais sobrou apenas 0,5 litro. Logo, foram vaporizados 1,5 litros de água que, com
densidade de 1 g/cm³ (1 kg/L) equivalem a 1500 g de água. Logo, a quantidade de calor latente absorvida
pela água foi de:
Q m L 1500 540 810000 8,1 105 cal 8,1 105 4 J 32, 4 105 J
A potência térmica para a energia Q = 32,4.105 J e t = 60 min = 3600 s (Gramado, ver item “b”) vale:
Q 32, 4 105 J
2 J
P
9
10
900 W
t
3, 6 103 s
s