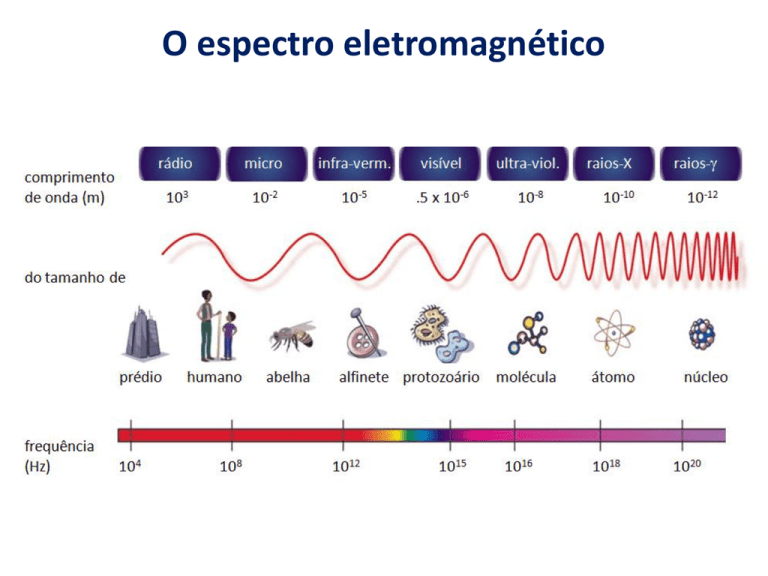
O espectro eletromagnético
Adaptado de http://blogs.edf.org/climate411/wp-content/files/2007/07/ElectromagneticSpectrum.png
Nossa Fonte de Luz: o Sol
http://osoleasaude.blogspot.com/2007/05/radiao-solar.html
História da Espectroscopia
~330 a.C. Aristóteles
Luz existe independentemente do olho humano
~295 a.C. Euclides de Alexandria
1º tratado de Ótica: engloba tudo relacionado à visão
direta (não refração nem reflexão)
“Raios de Visão”: para que um objeto possa ser visto
devemos (a) iluminá-lo e (b) olhar para ele
~250 a.C. Archimedes
refração do raio de luz
estuda o fenômeno do “arco-íris”
~55 a.C.
Tito Lucrécio
átomos são incolores; cores provém da incidência da luz
~ 145
Ptolomeu
Ótica: inclui refração e reflexão
~ 1280
Alhazen (ibn al-Haitam)
cores surgem devido a diferentes condições da luz
pedra de leitura (lentes de cristais de rocha)
1289
Qutbaddin as-sIrazi
explicação para o arco-íris por analogia entre gotas de
chuva e esfera de vidro contendo água
1608
Hans Lipperhey
descoberta da luneta (telescópio)
1609
Galileo Galilei
constrói telescópio e o aponta para o céu: atronomia
1626
Rene Descartes
Lei da Refração
1666
Isaac Newton
decomposição da luz solar em um prisma: 6 ou 7 (!)
cores
recomposição em um segundo prisma
Adaptado de http://sirius.bu.edu/withers/teaching/as101_summer1_2006/mychapter05.ppt
1777
Carl Wilhelm Scheele
luz violeta é a mais energética do espectro
1800
Friedrich Herschel
descobre a radiação infravermelha na luz solar
1802
Johann Ritter
descobre a radiação ultravioleta na luz solar
William Wollaston
5 ou 7 (!) linhas pretas no espectro solar
Thomas Young
fenômeno da interferência, cálculo de
1814
Joseph Fraunhofer
desenvolvimento do espectroscópio: análise espectral
centenas de linhas pretas no espectro solar
1848
Armand Fizeau
objetos se afastando em alta velocidade causam o
deslocamento das linhas espectrais para o vermelho
1859
Robert Bunsen; Gustav Kirchhoff
espectroscopia: cada elemento químico possui seu
espectro único (“impressão digital”)
descobrem novos elementos químicos (Césio, Rubídio)
espectro de elementos químicos dentro do espectro
solar: análise espectral de objetos cósmicos
AR
GÁS
1 – válvula fechada
2 – válvula semi-aberta
3 – válvula quase totalmente aberta
4 – válvula aberta
1864
James Maxwell
luz é radiação eletromagnética
1868
Joseph Lockyer
descoberta do gas solar Hélio (na Terra somente 27
anos depois)
1874
Hermann Vogel
vapor d’água presente nos espectros das atmosferas de
Marte e Saturno: habitáveis!!
1885
Johann Balmer
linhas do espectro do Hidrogênio: Linhas de Balmer
1924
Edwin Hubble
comprova a expansão do Universo
Espectro Solar
Newton: luz branca é uma mistura de
diferentes tipos de “raios luminosos”,
refratados em ângulos ligeiramente
diferentes, cada um produzindo uma
cor espectral diferente.
Fraunhofer: espectro solar possui centenas de linhas negras sobre as
cores.
Fraunhofer: espectro de cada
estrela poderia fornecer sua
composição química (“impressão
digital“)?
Espectro luminoso e composição química da atmosfera de um gigante
exoplaneta, que gira em torno de uma estrela normal, comparável ao
Sol.
Janeiro de 2010
http://www.apolo11.com/spacenews.php?posic=dat_20100115-192511.inc
Descoberta do Infravermelho (IR)
Herschell: região espectral
acima da cor vermelha fornece
uma grande potência
calorífica – região infravermelha.
Descoberta do Ultravioleta (UV)
Ritter: região espectral abaixo da
cor violeta é capaz de reduzir melhor
a prata – região ultravioleta.
http://coolcosmos.ipac.caltech.edu/cosmic_classroom/classroom_activities/ritter_example.html
Deslocamento para o Vermelho (redshift)
Fizeau: movimento de uma estrela
afeta a posição das linhas no
seu espectro.
Hubble: universo está em expansão.
O Espectroscópio
Análise Espectral
Lâmpada
incandescente
gás quente
gás frio
rede de
difração
espectro contínuo
espectro de emissão
espectro de absorção
Adaptado de http://www.apolo11.com/espectro.php
Novo Método Científico: Espectroscopia
Bunsen e Kirchhoff: análise
espectral dos elementos químicos;
análise química; descobrimento
de novos elementos.
Espectro de Elementos Químicos
H
N
O
C
Ar
Fe
Modelo Atômico
6 prótons
+ 6 nêutrons
Bohr: elétrons orbitam
em torno do núcleo
(constituído de prótons
e nêutrons), em órbitas
estáveis e de energias
bem definidas.
elétron
próton
nêutron
átomo de carbono
Transições Eletrônicas
O elétron estando no
estado excitado (n=2)
retorna ao seu estado
fundamental (n=1),
e emite “algo” com
energia E.
n=inteiro
E aumenta
O que é esse “algo”?
O que leva o elétron ao
estado excitado?
emite energia
E = E2-E1
Interação da luz com a matéria
fóton
Fóton: velocidade c (m/s)
frequência (Hz ou s-1)
comprimento de onda (m)
energia E (J)
e se relacionam: c
A energia do fóton será: E h h
estado fundamental
fóton
estado excitado
c
estado fundamental
O fóton será absorvido caso sua energia E for idêntica à diferença
de energia E entre o estado fundamental e o estado excitado
c = 3 x 108 m/s (veloc. da luz); h = 6.624 x 10-34 J/s (const. de Planck)
Átomo de Hidrogênio – Espectro Visível
Algumas Séries do Átomo de Hidrogênio
série de Balmer
limite de ionização
estado fundamental
Adaptado de http://www.astrogeo.va.it/astronom/spettri/teoria/idrogeno.jpg
Átomos mais Complexos
Hg
Moléculas
Energias: translacional, rotacional, vibracional
Os diversos estados
(fundamental,
excitado) apresentam
uma grande
quantidade de níveis
de energia permitidos.
Adaptado de http://www.forbrf.lth.se/fileadmin/forbrf/images/Utbildning/Molekylfysik_eng.jpg
Níveis de Energia em Moléculas
Transições e suas Regiões Espectrais