1. (Fuvest 92) Adote: calor específico da água = 1 cal/g.°C
Um recipiente contendo 3600g de água à temperatura inicial de 80°C é posto num local onde a
temperatura ambiente permanece sempre igual a 20°C. Após 5 horas o recipiente e a água
entram em equilíbrio térmico com o meio ambiente. Durante esse período, ao final de cada
hora, as seguintes temperaturas foram registradas para a água: 55°C, 40°C, 30°C, 24°C, e
20°C. Pede-se:
a) um esboço indicando valores nos eixos, do gráfico da temperatura da água em função do
tempo;
b) em média, quantas calorias por segundo, a água transferiu para o ambiente.
2. (Fuvest 93) Um recipiente de vidro de 500g e calor específico 0,20cal/g°C contém 500g de
água cujo calor específico é 1,0cal/g°C. O sistema encontra-se isolado e em equilíbrio térmico.
Quando recebe uma certa quantidade de calor, o sistema tem sua temperatura elevada.
Determine:
a) a razão entre a quantidade de calor absorvida pela água e a recebida pelo vidro.
b) a quantidade de calor absorvida pelo sistema para uma elevação de 1,0°C em sua
temperatura.
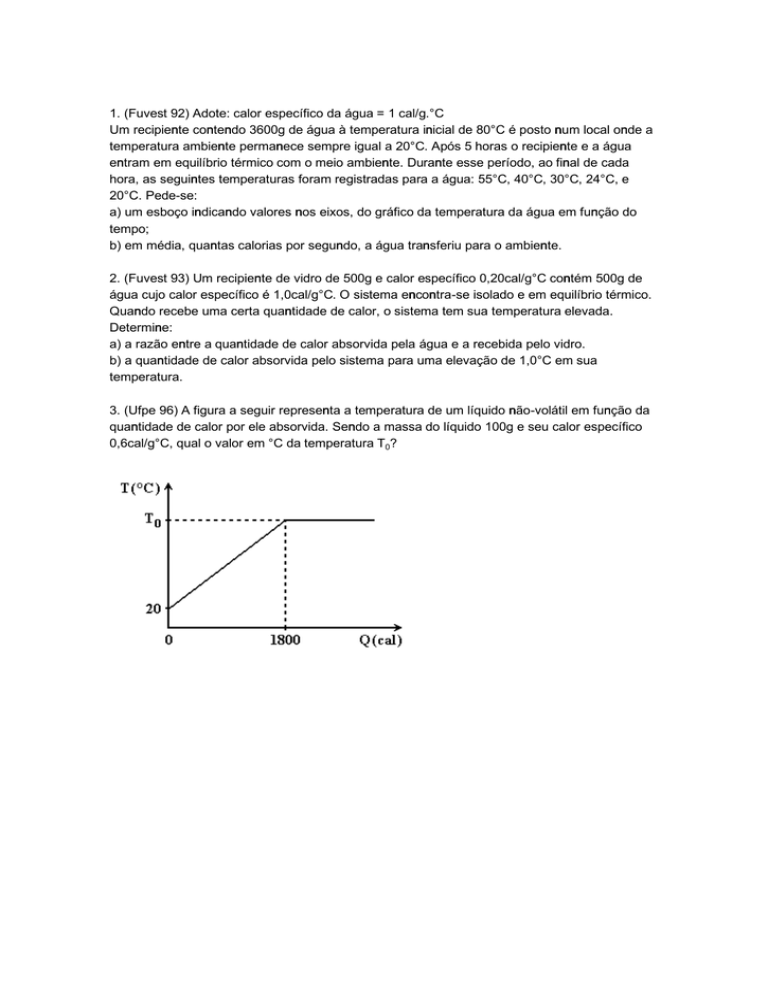
3. (Ufpe 96) A figura a seguir representa a temperatura de um líquido não-volátil em função da
quantidade de calor por ele absorvida. Sendo a massa do líquido 100g e seu calor específico
0,6cal/g°C, qual o valor em °C da temperatura T³?
4. (Ufpe 96) O gráfico a seguir representa a temperatura em função do tempo para 1,0kg de um
líquido não volátil, inicialmente a 20°C. A taxa de aquecimento foi constante e igual a
4600J/min. Qual o calor específico desse líquido, em unidades de 10£J/(kg°C)?
5. (Ufpe 2006) Considere que uma pequena boca de fogão a gás fornece tipicamente a
potência de 250 cal/s. Supondo que toda a energia térmica fornecida é transmitida a 200 g de
água, inicialmente a 30°C, calcule o tempo, em segundos, necessário para que a água comece
a ferver. Considere a pressão atmosférica de 1 atm.
6. (Ufpe 96) Qual o valor (em unidades de 10£ calorias) do calor liberado quando 10g de vapor
d'água a 100°C condensam para formar água líquida a 10°C?
Dados:
- calor latente de vaporização da água: 540cal/g
- calor específico da água: 10cal/g°C
7. (Fatec 95) Um frasco contém 20g de água a 0°C. Em seu interior é colocado um objeto de
50g de alumínio a 80°C. Os calores específicos da água e do alumínio são respectivamente
1,0cal/g°C e 0,10cal/g°C.
Supondo não haver trocas de calor com o frasco e com o meio ambiente, a temperatura de
equilíbrio desta mistura será
a) 60°C
b) 16°C
c) 40°C
d) 32°C
e) 10°C
8. (Fei 94) Um calorímetro contém 200ml de água, e o conjunto está à temperatura de 20°C. Ao
ser juntado ao calorímetro 125g de uma liga a 130°C, verificamos que após o equilíbrio térmico
a temperatura final é de 30°C. Qual é a capacidade térmica do calorímetro?
Dados:
calor específico da liga: 0,20cal/g°C
calor específico da água: 1cal/g°C
densidade da água: 1000kg/m¤
a) 50 cal/°C
b) 40 cal/°C
c) 30 cal/°C
d) 20 cal/°C
e) 10 cal/°C
9. (Fei 96) Para se determinar o calor específico do ferro, um aluno misturou em um calorímetro
ideal 200g de água a 20°C com 50g de ferro a 100°C e obteve a temperatura final da mistura
š=22°C. Qual é o calor específico do ferro?
a) 0,05 cal/g°C
b) 0,08 cal/g°C
c) 0,10 cal/g°C
d) 0,25 cal/g°C
e) 0,40 cal/g°C
10. (Fuvest) Um atleta envolve sua perna com uma bolsa de água quente, contendo 600g de
água à temperatura inicial de 90°C. Após 4 horas ele observa que a temperatura da água é de
42°C. A perda média de energia da água por unidade de tempo é:
Dado: c = 1,0 cal/g. °C
a) 2,0 cal/s
b) 18 cal/s
c) 120 cal/s
d) 8,4 cal/s
e) 1,0 cal/s
11. (Fuvest 92) Adote: calor específico da água: 1,0 cal/g.°C
Um bloco de massa 2,0kg, ao receber toda energia térmica liberada por 1000 gramas de água
que diminuem a sua temperatura de 1°C, sofre um acréscimo de temperatura de 10°C. O calor
específico do bloco, em cal/g.°C, é:
a) 0,2
b) 0,1
c) 0,15
d) 0,05
e) 0,01
12. (Mackenzie 96) O carvão, ao queimar, libera 6.000cal por grama. Queimando 70g desse
carvão, 20% do calor liberado é usado para aquecer de 15°C, 8kg de um líquido. Não havendo
mudança do estado de agregação, podemos afirmar que o calor específico desse líquido é:
a) 0,8 cal/g .°C
b) 0,7 cal/g.°C
c) 0,6 cal/g.°C
d) 0,4 cal/g.°C
e) 0,2 cal/g.°C
13. (Pucsp 97) É preciso abaixar de 3°C a temperatura da água do caldeirão, para que o nosso
amigo possa tomar banho confortavelmente. Para que isso aconteça, quanto calor deve ser
retirado da água?
O caldeirão contém 10¥g de água e o calor específico da água é 1cal/g°C.
a) 20 kcal
b) 10 kcal
c) 50 kcal
d) 30 kcal
e) Precisa-se da temperatura inicial da água para determinar a resposta.
14. (Uel 96) O gráfico a seguir representa o calor absorvido por dois corpos sólidos M e N em
função da temperatura.
A capacidade térmica do corpo M, em relação do corpo N, vale
a) 1,4
b) 5,0
c) 5,5
d) 6,0
e) 7,0
15. (Ufg 2006) O cérebro de um homem típico, saudável e em repouso, consome uma potência
de aproximadamente 16W. Supondo que a energia gasta pelo cérebro em 1 min fosse
completamente usada para aquecer 10 ml de água, a variação de temperatura seria de,
aproximadamente,
Densidade da água:
1,0.10¤ kg/m¤
Calor específico da água:
4,2.10¤ J/kg.°C
a) 0,5 °C
b) 2 °C
c) 11 °C
d) 23 °C
e) 48 °C
16. (Ufpr 2006) Numa garrafa térmica há 100 g de leite à temperatura de 90°C. Nessa garrafa
são adicionados 20 g de café solúvel à temperatura de 20°C. O calor específico do café vale
0,5 cal/(g°C) e o do leite vale 0,6 cal/(g°C). A temperatura final do café com leite é de:
a) 80°C.
b) 42°C.
c) 50°C.
d) 60°C.
e) 67°C.
17. (Unesp 94) Massas iguais de cinco líquidos distintos, cujos calores específicos estão dados
na tabela adiante, encontram-se armazenadas, separadamente e à mesma temperatura, dentro
de cinco recipientes com boa isolação e capacidade térmica desprezível. Se cada líquido
receber a mesma quantidade de calor, suficiente apenas para aquecê-lo, mas sem alcançar
seu ponto de ebulição, aquele que apresentará temperatura mais alta, após o aquecimento,
será:
a) a água.
b) o petróleo.
c) a glicerina.
d) o leite.
e) o mercúrio.
18. (Fuvest-gv 92) Coloca-se 900g de gelo a 0°C, no interior de um forno de microondas de
1200W para ser transformado em água também a 0°C. Admitindo-se que toda a energia
fornecida pelo forno será absorvida pelo gelo, devemos programá-lo para funcionar durante:
a) 3 min
b) 4 min
c) 6 min
d) 12 min
e) 0,5 min
19. (Mackenzie 96) Quando um corpo recebe calor:
a) sua temperatura necessariamente se eleva.
b) sua capacidade térmica diminui.
c) o calor específico da substância que o constitui aumenta.
d) pode eventualmente mudar seu estado de agregação.
e) seu volume obrigatoriamente aumenta.
20. (Mackenzie 96) Num copo com 200 ml de água a 20°C, são introduzidos 20g de gelo a 20°C; desprezadas as perdas e a capacidade térmica do copo, após o equilíbrio térmico, a
temperatura da água será de:
Dados:
calor específico da água = 1,0 cal/g°C
calor específico do gelo = 0,5 cal/g°C
calor latente de fusão do gelo = 80 cal/g
massa específica da água = 1,0 g.cm-¤
a) 0°C.
b) 10°C.
c) 10,9°C.
d) 11°C.
e) 12°C.
21. (Puccamp 95) Um calorímetro de capacidade térmica 50cal/°C contém 520g de gelo a 0°C.
Injeta-se no calorímetro vapor de água a 120°C, na quantidade necessária e suficiente para
fundir totalmente o gelo. A massa de água, em gramas, que se forma no interior do calorímetro
vale
Dados:
calor específico da água = 1,0cal/g°C
calor específico do vapor = 0,50cal/g°C
calor latente de fusão do gelo = 80cal/g
calor latente de vaporização da água = 540cal/g
a) 520
b) 584
c) 589
d) 620
e) 700
22. (Uece 96) Um pedaço de gelo a 0°C é colocado em 200g de água a 30°C, num recipiente
de capacidade térmica desprezível e isolado termicamente. O equilíbrio térmico se estabelece
em 20°C. O calor latente de fusão do gelo é 80cal/g e o calor específico da água é 1,0cal/g.°C.
A massa do pedaço de gelo, usado no experimento, é:
a) 10g
b) 20g
c) 30g
d) 40g
23. (Uel 95) Um recipiente de capacidade térmica 50 cal/°C contém 200g de água a 40°C.
Introduz-se no recipiente 50g de gelo a 0°C. Admitindo que não há trocas de calor com o
ambiente, a temperatura final de equilíbrio, em °C, é
Dados:
calor específico da água = 1 cal/g°C
calor latente de fusão de gelo = 80 cal/g
a) 24
b) 20
c) 15
d) 12
e) zero
24. (Ufes 96) Quantas calorias são necessárias para vaporizar 1,00 litro de água, se a sua
temperatura é, inicialmente, igual a 10,0°C?
Dados:
- calor específico da água: 1,00 cal/g°C;
- densidade da água: 1,00 g/cm¤;
- calor latente de vaporização da água: 540 cal/g.
a) 5,40 × 10¥ cal
b) 6,30 × 10¥ cal
c) 9,54 × 10¥ cal
d) 5,40 × 10¦ cal
e) 6,30 × 10¦ cal










