Curso de Pós-Graduação em Bioquímica e Imunologia
Instituto de Ciências Biológicas
Universidade Federal de Minas Gerais
Projeto de dissertação de Mestrado
Modelo Murino de Imunização com Células Dendríticas Transformadas ex vivo
com cDNA de Antígenos Recombinantes de Verme Adulto de Schistosoma
mansoni
Aluno: Vinícius de Souza Góes
Orientador: Alfredo Miranda de Góes
Co-orientador: Maria de Fátima Leite
Maio de 2002
Justificativa
Células dendríticas (DC, do inglês Dendritic Cell) são células derivadas da medula
óssea que possuem função de células apresentadoras de antígenos (1). Estas são encontradas na
maioria dos tecidos como células imaturas caracterizadas pela eficiência na captação de
partículas e microrganismos por fagocitose, macropinocitose e pinocitose mediada por
receptores. Após ativação por agentes pró-inflamatórios, produtos bacterianos (LPS) ou
infecção intracelular por vírus ou bactérias, as DCs sofrem maturação (2). Nesse estágio, as
DCs migram para os tecidos linfóides secundários e sofrem grandes mudanças em suas
propriedades: perdem a capacidade de captar antígenos, expressam altos níveis de MHC e
moléculas acessórias (CD80, CD86, CD40), adquirindo a função de ativar linfócitos T
antígeno-específicos (3).
Frente a várias evidências que apontam as DCs como iniciadoras da resposta imune
primária, tem-se criado um grande interesse na investigação de seu uso terapêutico como
indutores específicos da resposta imune contra patógenos, incluindo viroses, bactérias, fungos e
parasitas (2-5). Recentemente demonstrou-se a participação de DC como mediador celular
crítico na produção de resposta imune protetora contra tumores em vacina de DNA (6, 7).
Modelos murinos experimentais têm convincentemente demonstrado que DC carregada com
antígenos tumor-associado é capaz de produzir imunidade protetora e curativa anti-tumor (8).
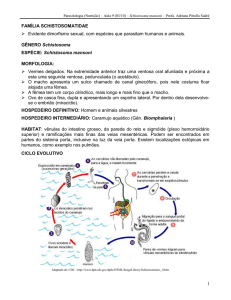
Na esquistossomose, parasitose endêmica de ocorrência bastante ampla causada pelo
trematódeo Schistosoma mansoni (9, 10), o desenvolvimento de uma vacina anti-schistosômica
tem sido uma área de pesquisa particularmente ativa. A demonstração da habilidade de
humanos na aquisição de resistência à infecção por S. mansoni (11) junto com o avanço em
pesquisas com infecções experimentais utilizando cercarias atenuadas ou antígenos definidos,
sugerem que é possível o desenvolvimento de uma vacina (12, 13). A tecnologia de vacina de
DNA vêm sendo empregado com sucesso em modelos experimentais de infecção, resultados
como proteção efetiva em camundongos imunizados (14) e efeitos anti-fecundidade com
redução da patologia da doença (15) foram recentemente descritos. Apesar disso, pouco se sabe
sobre o mecanismo preciso associado com a aquisição de resistência, particularmente, sobre as
variáveis que governam a participação de DCs no desencadeamento de uma resposta imune
primária que levaria a suscetibilidade ou resistência à infecção por S. mansoni (16-18). A
elucidação desses processos seria de grande valor no desenvolvimento de uma vacina antischistosômica.
Sato & Kamiya (1995) relataram a necessidade da presença de DCs, como células
imuno-estimulatórias, no desencadear de uma resposta eficiente de célula T, em linfonodos
periféricos, frente à exposição percutânea de larvas normais ou atenuadas de S. mansoni em
cobaias. Tendo em vista a importância destas células na produção de uma resposta imune
primária, resolvemos investigar se células dendríticas transformadas com cDNA de antígenos
recombinantes de S. mansoni são capazes de desenvolver uma resposta imune contra uma
infecção experimental.
1
Objetivo Geral
Avaliação in vivo da resposta imune de camundongos BALB/c imunizados com células
dendríticas transformadas com cDNA de antígenos de verme adulto de Schistosoma mansoni.
Objetivos Específicos
1. Seleção de clones que expressam antígenos recombinantes através da triagem de biblioteca
de cDNA de verme adulto de S. mansoni por ELISA de captura.
2. Estabelecimento e fenotipagem de cultura primária de células dendríticas derivadas de
medula óssea de camundongos BALB/c.
3. Transformação e ativação de células dendríticas com vetor de expressão para células de
mamíferos contendo cDNA codificando antígenos previamente selecionados.
4. Avaliação da resposta imune de camundongos BALB/c imunizados com células dendríticas
transformadas frente a infecção desafio com S. mansoni.
2
Estratégia experimental
1. Seleção de antígenos recombinantes.
Para a seleção de antígenos recombinantes, clones positivos para fagemídio pBluescript
contendo inserto serão selecionados de uma biblioteca de cDNA de verme adulto de S.
mansoni clonado no vetor lambda ZapII (Stratagene). Esses clones serão cultivados com IPTG,
para expressão da proteína recombinante, e células rompidas por sonicação. Após
centrifugação, sobrenadantes serão recolhidos e testados por ELISA de captura utilizando
anticorpos contra antígenos de verme adulto de S. mansoni.
Clones que apresentaram reatividade expressiva no teste de ELISA, terão DNA
plasmidial purificado e sequenciado. As sequências de DNA obtidas serão editadas e
comparadas com outras sequências de DNA e de aminoácidos, depositadas em bancos de dados
não redundantes, utilizando os programas Blastn e Blastx (http://www.ncbi.nlm.nih.gov/Blast).
Dessas sequências, quatro serão selecionadas e terão incerto amplificados e
subclonados em vetor de expressão em mamíferos.
2. Obtenção de célula dendrítica.
DCs serão preparados segundo protocolo de Inaba et al. Brevemente, suspensão de
medula óssea será extraída de fêmurs e tíbias de camundongos BALB/c, tratados com tampão
0.17 M Tris-NH4Cl para lise de eritrócitos e 5 x 106 células serão semeados em frascos de
teflon em 10 ml meio RPMI 1640 contendo 5% de FCS, gentamicina (50 g/ml) e 10% de
meio condicionado contendo GM-CSF. A cada dois dias, 50% do meio de cultura é trocado.
3. Transformação ativação de célula dendrítica
Transfecção de células dendríticas será realizado com EffectineTM Transfection Reagent
(Quiagen) segundo protocolo recomendado pelo fabricante. Após transfecção, as células serão
ativadas pela adição de 0,1g/ml de LPS no meio de cultura.
4. Imunização de camundongos
Imunização intradérmica com 1-5 x 105 células dendríticas transformadas ou não será
realizado em grupo de oito camundongos BALB/c. Após 28 dias, seguidos a imunização, será
realizado um reforço e, após 56 dias, uma infecção desafio com S. mansoni. A cada
manipulação dos camundongos será realizado coleta de sangue e soro recolhido para testes em
ELISA e Western Blot.
5. Citometria de fluxo
Os ensaios de imunofluorescência para avaliar a expressão e modulação de marcadores
de superfície de células dendríticas serão realizados, em placas de microtitulação de 96 poços,
segundo Falcão (2000). Assim, analisaremos os seguintes marcadores de superfície celular:
MHC II (I-A), CD 11c, DEC 205, CD80, CD86, CD40.
3
Viabilidade do Projeto
O laboratório de Imunologia Celular e Molecular, sob a orientação do Prof. Alfredo
Miranda de Góes, possui os reagentes e os equipamentos necessários para o desenvolvimento
deste projeto. As técnicas empregadas na metodologia (técnicas de biologia molecular, cultivo
celular, ELISA, transformação celular e outras técnicas imunológicas e bioquímicas) são
amplamente utilizadas nesse laboratório. Os experimentos de transformação celular serão
realizados com a colaboração da professora Maria de Fátima Leite.
Cronograma
1o Semestre
a. Seleção de clones codificadores de antígenos recombinantes de S. mansoni.
b. Subclonagem, em vetor de expressão em mamíferos, do cDNA de antígenos selecionados.
2o Semestre
a.
b.
c.
d.
Estabelecimento e fenotipagem de cultura primária de células dendríticas.
Transformação e ativação das células dendríticas cultivadas.
Imunização de camundongos BALB/c e posterior desafio com S. mansoni.
Avaliação da ação imunogênica de células dendríticas transformadas.
3o Semestre
a. Análise dos resultados e redação final da dissertação do mestrado.
4
Bibliografia
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
Steinman, R.M. (1991). The dendritic cell system and its role in immunogenicity. Annual Review of
Immunology 9: 271-296.
Lopez, C.B., Fernandez-Sesma, A., Czelusniak, S. M., Schulman, J.L., and Moran, T.M. (2000). A mouse
model for imunization with ex vivo virus-infected dendritic cells. Cellular Immunology 206: 107-115.
Banchereau, J., Steinman, R.M. (1998). Dendritic cells and the control of immunity. Nature 392: 245-252.
Cella, M., Sallusto, F., and Lanzavecchia, A. (1997). Origin, maturation and antigen presenting function of
dendritic cells. Current Opinion in Immunology 9: 10-16.
Reyes-Sandoval, A. and Ertl, H.C. (2001). DNA vaccines. Current Molecular Medicine 1(2): 217-243.
Coombes, B.K. and Mahony, J.B. (2001). Dendritic cell discoveries provide new insight into the cellular
immunobiology of DNA vaccines. Immunology Letters 78: 103-111.
Cochlovius, B., Stassar. M.J.J.G., Schreurs, M.W., Benner, A., and Adema, A. (2002). Oral DNA
vaccination: antigen uptake and presentation by dendritic cells elicits protective immunity. Immunology
Letters 80: 89-96.
Fields, R.C., Shimizu, K. and Mule, J.J. (1998). Murine dendritic cells pulsed with whole tumor lysates
mediate potent antitumor immune response in vitro and in vivo. Proceedings of the National Academy of
Science, USA 95: 9482-9487.
Mott, K.E. (1987). Epidemiological considerations of a schistosome vaccine. Acta Tropica 44(12): 13-20.
Von Lichtenberger, F. (1987). Consequences of infections with schistosomes. In: Ollinson, D. & Simpson,
A.J.G. (EDS) The biology of schistosomes: from genes to latrines. Academic Press, p. 185.
De Jesus, A.R., Araujo, I., Becelar, O., Magalhães, A., Pearce, E., Harn, D., Strand, M., and Carvalho, E.M.
(2000). Human immune responses to Schistosoma mansoni vaccine candidate antigens. Infection and
Immunity. 68: 2797-2803.
Hirsch, C., Almeida, C.A., Doughty, B.L., and Goes, A.M. (1997). Characterization of Schistosoma mansoni
44.7/56.8 Kda egg antigens recognized by human monoclonal antibodies, wich induce protection against
experimental infection and proliferation of peripheral blood mononuclear cells from schistosomiasis patients.
Vaccine 15: 948-954.
Wilson, R.A., Coulson, P.S., and Mountford, A.P. (1999). Immune response to the radiation-attenuated
schistosome vaccine: what can we learn from knockout mice? Immunology Letters 65: 117-123.
Da’dara A.A., Skelly P.J., Wang M., and Harn D.A. (2002). Immunization with plasmid DNA encoding the
integral membrande protein, Sm23, elicits a protective immune response against schistosome infection in
mice. Vaccine 20: 359-369.
Ghlichlia, K., Bahgat, M., Ruppel, A., and Schirrmacher, V. (2002). DNA vaccination with asparaginyl
endopeptidase (Sm32) from the parasite Schistosoma mansoni: anti-fecundity effect induced in mice. Vaccine
20: 439-447.
Sato, H. and Kamiya, H. (1995). Role of epidermal Langerhans’ cells in the induction of protective immunity
to Schistosoma mansoni in guinea-pigs. Immunology 84(2): 233-40.
Sato H. and Kamiya, H. (1998). Accelerated influx of dendritic cells into the lymph nodes draining skin sites
exposed to attenuated cercariae of Schistosoma mansoni in guinea-pigs. Parasite Immunology 20(7): 337-43.
Gustavson, S., Zouain, C.S., Alves, J.B., Leite, M.F., and Goes, A.M. (2002) Modulation of granulomatous
hypersensitivity against Schistosoma mansoni eggs in mice vaccinated with culture-derived macrophages
loaded with PIII. in press.
Inaba, K., Inaba, M., Romani, M., et al. (1992). Generation of large numbers of dendritic cells from mouse
bone marrow cultures supplemented with granulocyte-macrophage colony-stimulating factor. Journal of
Experimental Medicine 176: 1693-702.
Vinícius de Souza Góes
Alfredo Miranda de Góes
5