Aula 00
Química p/ Perito Criminal - Polícia Científica-GO (com videoaulas)
Professor: Wagner Bertolini
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
AULA 00: Apresentação do curso
SUMÁRIO
PÁGINA
1.
Saudação e Apresentação do professor
01
2.
Breve apresentação do curso
02
3.
Cronograma das Aulas
04
4.
Ácidos
05
5.
Questões Propostas
27
1.
Saudação e apresentação do professor
Olá meus novos amigos(as),
É com grande satisfação que apresento a vocês este curso de QUÍMICA,
projetado especialmente para atender às necessidades daqueles que se preparam
para o concurso de PERITO CRIMINAL DA POLÍCIA CIENTÍFICA DE GOIÁS,
organizado pela UNIVERSA.
Permitam-me fazer uma breve apresentação de minha trajetória acadêmica e
profissional:
- Professor de Química em algumas editoras para concursos públicos, com
cursos em pdf e vídeo-aulas.
- Aprovado no concurso da PCSP para o cargo de PERITO CRIMINAL.
-graduado pela Faculdade de Ciências Farmacêuticas pela USP-RP, em 1990;
00000000000
- Mestre em síntese de complexos bioinorgânicos de Rutênio, com liberação de
óxido nítrico, pela Faculdade de Ciências Farmacêuticas USP-RP;
- Doutor em farmacotécnica, estudando o efeito de promotores de absorção
cutânea visando a terapia fotodinâmica para o câncer de pele, Faculdade de Ciências
Farmacêuticas pela USP-RP;
- Especialista em espectrometria de massas, pela Faculdade de Química, USP-RP;
- professor de Química em ensino Médio e pré-vestibulares (Anglo, Objetivo, COC)
desde 1992.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 1 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
- professor de Química (Orgânica, Geral, Analítica, Físico-Química e Inorgânica) em
cursos de graduação;
- Professor de Química Farmacêutica, em curso de graduação em Farmácia;
- Professor de Pós-Graduação em Biotecnologia (controle de produtos e processos
biotecnológicos);
- Analista Químico em indústria farmacêutica, AKZO do Brasil, em São Paulo-SP.
- Consultor de pesquisa entre empresa-Universidade, em Ribeirão Preto, onde
resido atualmente.
2.
- Breve apresentação do curso
Seguem abaixo comentários acerca do conteúdo e da metodologia do nosso
curso:
A proposta do curso é facilitar o seu trabalho e reunir toda a teoria e inúmeros
exercícios, no que tange aos assuntos do Edital, em um só material.
Nosso curso será completo: teoria detalhada e mais de 400 questões
comentadas e resolvidas.
Portanto, se você está iniciando seus estudos em QUÍMICA para concursos
fique tranquilo, pois, nosso curso atenderá aos seus anseios perfeitamente.
Se você já estudou os temas, e apenas quer revisá-los, o curso também será
bastante útil, pela quantidade de exercícios que teremos e pelo rigor no tratamento
da matéria, o que lhe permitirá uma excelente revisão do conteúdo.
A Aula Demonstrativa visa apresentar a didática e a metodologia do
professor. Em suma: este curso trará toda matéria completa durante o seu
00000000000
transcorrer.
As aulas do curso terão entre 40 (quarenta) e 100 (cem) páginas,
aproximadamente. O número de questões em cada aula será variável, pois alguns
assuntos são rotineiramente exigidos nos concursos e outros aparecem com menor
frequência.
Serão oferecidas várias vídeo-aulas que serão disponibilizadas conforme a
programação.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 2 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Você encontrará vários comentários sobre o que é importante ou o que
não cai nas provas. Não se assuste. É só para direcionar seu tempo sobre os
tópicos que realmente são importantes e não perder tempo com “fagulhas”.
Serão disponibilizadas muitas questões de diversas bancas dos concursos
mais recentes, para que você se familiarize com o estilo das perguntas. Isto é muito
importante, pois, permite a você uma maior segurança e tranquilidade no momento
da prova.
Buscarei fazer uma lista de questões só com questões da banca. Isto é muito
importante, pois, pode-se avaliar o estilo e linguagem usada pela banca.
Provavelmente esta será disponibilizada como um simulado. E este simulado consta
como última aula, mas, tendo um número de questões razoável, anteciparei a
postagem. Depois, buscarei comentar todas as questões, se possível.
Alguns tópicos são de abordagem compatível com ensino médio, apesar do
concurso se referir a nível superior. As aulas finais são mais difíceis, pois,
estes tópicos requerem conhecimento de várias técnicas analíticas, que
fazem parte da graduação).
O edital não é muito específico. Pelo contrário: é bem geral, muito vago. Mas,
partindo-se da análise global dos tópicos pode-se concluir, em função de
experiências no assunto, que seria uma abrangência bem ampla em vários
assuntos e mais pontuais em outros.
PRESTE SEMPRE MUITA ATENÇÃO QUANDO APARECER A CORUJINHA.
AO LADO APARECE UMA DELAS. Estas corujinhas serão empregadas para
chamar a sua atenção para vários aspectos
00000000000
dentro do nosso curso.
OLHO NELAS!!!!!
Esperamos contribuir muito para que você consiga alcançar seu objetivo (e por
sinal o objetivo de milhares de brasileiros) que á a aprovação em um concurso
público.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 3 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
3. PROGRAMAÇÃO DO CURSO
AULA
Aula 00
Aula 01
Aula 02
CONTEÚDO
Vídeos
- Apresentação do curso. Química
Vídeo apresentação
inorgânica: ácidos (parte 1).
e 2.1 (só parte 2)
- funções inorgânicas: ácidos (parte 2);
bases; sais e óxidos.
2.1 vídeo parte 1
2.2.; 2.3; 2.4
- Classificação periódica
DATA
28/11
05/12
4.1 e 4.2
12/12
3 (2 vídeos)
19/12
Vídeo 5
29/12
-Ligações químicas; Noções de
química de coordenação (Teoria dos
Aula 03
Elétrons de Valência, Teoria do
Campo Cristalino e Teoria dos Orbitais
Moleculares)
Aula 04
- Estequiometria; Preparo de soluções.
Aula 05
Titulometria. 3.3. Complexometria.
04/01
- Espectroscopia de absorção na
Aula 06
região do ultravioleta, visível e
09/01
infravermelho
Aula 07
Aula 08
- Espectroscopia de absorção atômica.
- Espectrometria de massa.
- Técnicas cromatográficas.
14/01
20/01
- Processos de extração (LíquidoAula 09
Líquido, Extração em Fase Sólida,
24/01
Extração de Voláteis por Headspace )
00000000000
Aula 10
QUIMICA ORGÂNICA. Teoria
estrutural. Estereoquímica.Funções
orgânicas. Propriedades físicas dos
compostos orgânicos. Reatividade de
28/01
compostos orgânicos.
Obs: a aula sobre química orgânica poderá (e provavelmente será) antecipada.
No cronograma inicial havia esquecido de colocar orgânica. Então, farei isto para
não atrasar seus estudos.
Observação importante:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 4 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Este curso é protegido por direitos autorais (copyright), nos
termos da Lei 9.610/98, que altera, atualiza e consolida a legislação
sobre direitos autorais e dá outras providências.
Grupos de rateio e pirataria são clandestinos, violam a lei e
prejudicam os professores que elaboram os cursos. Valorize o
trabalho de nossa equipe adquirindo os cursos honestamente
através do site Estratégia Concursos ;-)
Conte comigo para sanar suas dúvidas. Sempre busco atende-lo de uma forma
bem tempestiva.
Sempre que você tiver alguma dúvida, ao recorrer ao fórum
indique a aula, página e número da questão, se for o caso.
4. Ácidos
Hoje estudaremos as funções inorgânicas. Mais precisamente, uma parte do
estudo dos ácidos. Recomendo que guarde as características de cada função e
treine, treine muito.
Observe e memorize as dicas dadas sobre as características de cada função.
Caso você queira tirar alguma dúvida no fórum peço que indique a aula, a página
e o exercício, bem como sua dúvida sobre este. Ou sobre a teoria ou outras
dúvidas.
Isto agiliza a minha resposta para você, sem demorar muito, sem correr o risco
de responder a questão errada, etc.
00000000000
Propriedades funcionais são propriedades comuns a determinados grupos de
matérias, identificados pela função que desempenham, e são tais grupos
denominados de funções químicas.
As funções químicas são um conjunto de substâncias com propriedades
químicas semelhantes, que podem ser divididas em orgânicas e inorgânicas.
Funções orgânicas: são aquelas constituídas pelo elemento carbono, estudada
pela química orgânica. A química orgânica estuda os compostos que contêm
carbono e a propriedade típica do carbono é a formação de cadeias. É chamada de
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 5 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
orgânica porque inicialmente os cientistas pensavam que eles só podiam ser
encontrados nos seres vivos ou fósseis. Hoje um grande número de compostos de
carbono pode ser produzido em laboratório para utilização na indústria. Certos
medicamentos, plásticos e pesticidas, por exemplo, são substâncias orgânicas
sintéticas.
Existem algumas substâncias que possuem átomo de carbono, mas que fogem a
este critério de classificação, por possuírem propriedades de compostos
inorgânicos, dentre as quais se destacam: CO (monóxido de carbono), CO 2 (dióxido
de carbono), KCN (cianeto de potássio), CaCO3 (carbonato de cálcio), Na2CO3
(carbonato de sódio), H2CO3 (ácido carbônico), entre outros.
Funções inorgânicas: são aquelas constituídas por todos os demais elementos
químicos que constituem os ácidos, bases, sais e óxidos, estudados pela Química
Inorgânica. Atualmente o conceito de substâncias inorgânicas e orgânicas pode
seguir a seguinte definição:
Com isso, por questões didáticas puramente, estudaremos estes dois ramos
importantes de estudo da Química, a Química Inorgânica e a Química Orgânica, que
também são subdivididas em outros grupos. As principais funções químicas
inorgânicas – ácidos, bases, sais e óxidos – são encontradas em nosso cotidiano e
também em nosso organismo. Por exemplo: o ácido clorídrico é um dos
00000000000
constituintes do suco gástrico, encontrado no estômago; a soda cáustica é
constituinte de produto de uso doméstico para desentupir pias; utilizada para
fabricar o sabão; o sal de cozinha é constituído pelo cloreto de sódio e a cal viva,
utilizado na construção civil e também na culinária, é constituída pelo óxido de
cálcio.
Para definir estas substâncias existem vários critérios de classificação. Nós
utilizaremos os critérios da condutividade elétrica, segundo Arrhenius, e o teste com
indicadores ácido-base para caracterizar semelhança nas propriedades químicas
dessas substâncias.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 6 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
ÁCIDOS
Ácidos no cotidiano: ácido acético (vinagre) e ácido cítrico (frutas cítricas).
Introdução
Desde os tempos dos alquimistas, observou-se que certas substâncias
apresentavam comportamentos peculiares quando dissolvidos na água. Entre tais
propriedades destacavam-se:
- o sabor azedo facilmente identificado em frutas cítricas, como limão, laranja,
etc (a palavra ácido é proveniente do latim acidus - azedo, picante);
- formar soluções aquosas condutoras de eletricidade;
- provocar efervescência, quando em contato com o calcário;
- produzir mudança de cor nos indicadores ácido-base.
Essas substâncias foram denominadas ácidos.
Os ácidos estão presentes em nosso dia-a-dia, como por exemplo: a laranja, o
limão e as demais frutas cítricas contém ácido cítrico; a bateria de um automóvel
00000000000
contém ácido sulfúrico; o vinagre contém ácido acético; o ácido clorídrico é
constituinte do suco gástrico no estômago; o ácido nítrico é utilizado para produzir
explosivos como o TNT (dinamite).
De um modo geral os ácidos são tóxicos e corrosivos, portanto, deve-se evitar o
contato com a pele, ingeri-los ou inalá-los.
O estudo da função ácido é a parte mais complexa das funções inorgânicas. Por
isto é de extrema importância que você domine os principais tópicos como:
formulação e nomenclatura. As demais funções são bem mais simples, se
comparadas a ácidos.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 7 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
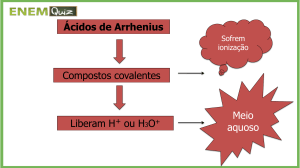
Definição Segundo Arrhenius
Ácido é todo composto molecular que, em solução aquosa, se ioniza,
produzindo exclusivamente como cátion o H3O+ (hidroxônio).
HCl + H2O
HCN + H2O
H3O+ + Cl–
H3O+ + CN–
Simplificadamente, o cátion hidroxônio (H3O+) pode ser representado por H+ e a
presença da água está representada pelo (aq) ao lado direito da fórmula do
composto (ou mesmo nem aparecer, subentendendo-se a presença de meio
aquoso, por definição):
H+ + Cl–
HCl(aq)
HCN
H+ + CN–
Resumindo:
Classificação dos Ácidos
- Quanto à natureza do ácido
Orgânicos - são compostos que contém em sua estrutura o grupamento
carboxila, composto por um átomo de carbono ligado a um átomo de oxigênio por
00000000000
ligação dupla ( C= O) e a um grupo hidroxila (-OH), por ligação simples:
carboxila
O grupo carboxila também pode ser representado apenas por: -COOH
O hidrogênio ligado ao átomo de oxigênio do grupo carboxila é considerado o
hidrogênio ionizável do ácido. Desta forma na sua ionização, teremos:
R-COOH
Prof. Wagner Luiz
H+ + R-COO-
www.estrategiaconcursos.com.br Página 8 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Entre os milhares de ácidos orgânicos conhecidos, alguns são de enorme
importância para o homem, como por exemplo:
- HCOOH é o ácido fórmico (fórmico, pois foi descoberto nas formigas, mas
sintético atualmente)
- CH3COOH = ácido acético (presente no vinagre, acetum – azedo)
Inorgânicos ou minerais - são de origem mineral e dividem-se em hidrácidos e
oxiácidos.
Ex.: HCl, HF, HCN, H2SO4, H3PO4, etc
- Quanto à presença de oxigênio na molécula
a) Hidrácidos – não possuem oxigênio em suas moléculas
Exemplos: HCl, HCN, HF, HI, HBr, H2S, etc.
b) Oxiácidos – possuem oxigênio em suas moléculas
Exemplos: HNO3 , HClO3 , H2SO4, H3PO4, etc.
- Quanto ao número de hidrogênios ionizáveis
Monoácidos (ou monopróticos) – apresentam um hidrogênio ionizável.
Exemplos: HCl, HBr, HNO3 , H3PO2 (exceção).
Diácidos (ou dipróticos) – apresentam dois hidrogênios ionizáveis.
Exemplos: H2S, H2SO4 , H3PO3 (exceção).
Triácidos – apresentam três hidrogênios ionizáveis.
00000000000
Exemplos: H3PO4 , H3BO3.
Tetrácidos – apresentam quatro hidrogênios ionizáveis.
Exemplos: H4SiO4 , H4P2O7.
- Quanto ao número de elementos químicos
Binário: dois elementos químicos diferentes.
Exemplos: HCl, H2S, HBr.
Ternário – três elementos químicos diferentes.
Exemplos: HCN, HNO3 , H2SO4
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 9 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Quaternário – quatro elementos químicos diferentes.
Exemplos: HCNO, HSCN
- Quanto à volatilidade (baixo ponto de ebulição, facilidade em formar
vapores)
Observação: Por que se deixarmos um recipiente aberto contendo éter em pouco
tempo, observa-se que o éter desaparecerá?
O éter é um líquido que possui baixo ponto de ebulição e evapora com facilidade
à temperatura ambiente. Dizemos neste caso que o éter é uma substância volátil.
Outro exemplo comum ocorre com o vinagre, o qual possui um odor bastante
pronunciado devido à volatilidade do ácido acético, seu principal constituinte.
Ácidos voláteis - ácidos com baixo ponto de ebulição (PE).
Ex.: todos os hidrácidos (HCl, HF, HI, HBr, HCN, H2S), HNO3, HCOOH e
CH3COOH.
Ácidos fixos - ácidos com elevado ponto de ebulição (PE).
Ex.: H2SO4 (PE = 340ºC), H3PO4 (PE = 213ºC) e H3BO3 (PE = 185ºC).
- Quanto ao grau de ionização (força de um ácido)
OBS.: tal cálculo não exige que você conheça a fórmula do ácido e nem a sua
estrutura química.
Ácidos fortes: possuem
Ácidos moderados: 5%
Ácidos fracos:
> 50%
00000000000
50%
< 5%
Como se calcula o valor de
(alfa)?
quantidade de moléculas que ionizaram
X
quantidade de moléculas dissolvidas
Regra Prática para Determinação da Força de um Ácido (conhecendo-se a
fórmula molecular do ácido e, se necessário, sua estrutura molecular):
- Hidrácidos:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 10 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Ácidos fortes: HI > HBr > HCl.
Ácido moderado: HF.
Ácidos fracos: demais.
- Oxiácidos
Sendo HxEzOy a fórmula de um ácido de um elemento E qualquer, temos
M=y-x
em que:
y = número de átomos de oxigênio
x = número de átomos de hidrogênios
se:
m=3
ácido muito forte
Exemplos: HClO4 , HMnO4...
m=2
ácido forte
Exemplos: HNO3 , H2SO4...
m=1
ácido moderado
Exemplos: H3PO4 , H2SO3 , H3PO3 (2 H+), H3PO2 (1 H+)
m=0
ácido fraco
Exemplos: HClO, H3BO3
Observação:
1º) O ácido carbônico (H2CO3) é uma exceção, pois, é um ácido fraco ( =0,18%),
embora o valor de m = 1
2º) Todos os ácidos carboxílicos são fracos.
00000000000
Fórmula Estrutural
I. Hidrácidos ( HxE)
Cada hidrogênio está ligado ao elemento por um traço (–) que representa a
ligação covalente simples.
Exemplos
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 11 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Oxiácidos (HxEzOy)
Para escrever a fórmula estrutural dos oxiácidos, devemos proceder da seguinte
maneira:
1) escrever o símbolo do elemento central;
2) distribuir ao redor deste elemento todos os oxigênios da fórmula mencionada.
3) distribuir ao redor dos oxigênios os átomos de hidrogênio que sejam ionizáveis.
Se tiver H não ionizável (o que ocorre com ácidos do elemento fósforo), os
hidrogênios não ionizáveis devem ser colocados ao lado do elemento central.
4) Ligar os hidrogênios ionizáveis aos átomos de oxigênio vizinhos, formando
grupinhos H-O) e ligar o elemento central a tantos grupos – OH quantos forem os
hidrogênios ionizáveis. Caso haja H sem ligar, fazer uma ligação simples deste(s) H
com o átomo central.
5) (passo circunstancial, pois, depende de ter ou não oxigênio sem ligar): ligar o
elemento central ao(s) oxigênio(s) restante(s) através de ligação dativa (geralmente)
ou de uma dupla ligação (ocorre tal dupla com os elementos carbono e nitrogênio).
SABER fazer a fórmula estrutural é um conhecimento de grande valia.
Através dela você poderá entender melhor quais são os hidrogênios que se
ionizam (somente os ligados DIRETAMENTE ao átomo de oxigênio) e também,
00000000000
perceber a estrutura de um ânion com ionização parcial ou total.
Portanto, veja que são passos bem simples e de fácil compreensão.
Capriche e faça alguns ácidos que você conheça as fórmulas, para treinar.
Exemplos
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 12 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Cuidado com os ácidos oxigenados do elemento fósforo (P). Vejam os H
não ionizáveis:
00000000000
Observação
Duas exceções importantes, por apresentarem hidrogênios não-ionizáveis, são:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 13 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
(observe nas estruturas acima que os hidrogênios que não ionizam se ligam
diretamente ao átomo central e não há ionização devido à pequena diferença
de eletronegatividade entre os elementos H e P).
Formulação e Nomenclatura
Formulação
O ácido é formado pelo cátion H+ e um ânion qualquer (Ax-). Portanto, podemos
representar sua fórmula da seguinte maneira:
H+Ax-
HxA
Nomenclatura
Hidrácidos (HxE)
O nome de um ácido é feito basicamente da seguinte forma:
1o) escreve-se a palavra ácido;
2o) nome do elemento, com origem em latim;
3o) terminação ídrico
Exemplos
HCl
ácido clorídrico
HBr
ácido bromídrico
HCN
ácido cianídrico
H2S
HI
00000000000
ácido sulfídrico
ácido iodídrico
Oxiácidos (HxEzOy)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 14 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Neste caso, como o mesmo elemento pode formar vários oxiácidos,
estabelecemos um oxiácido padrão a partir do qual daremos nomes aos demais.•
Oxiácido padrão
ácido nome de E ico
Regra geral para elementos que formam 2 ou mais oxiácidos:
Como vemos na tabela acima, todo oxiácido padrão tem terminação ico. Se
tivermos um ácido com:
a) um oxigênio a mais que o padrão, acrescentamos o prefixo per;
b) um oxigênio a menos que o padrão, a terminação muda para oso;
c) dois oxigênios a menos que o padrão, a terminação continua oso e
00000000000
acrescentamos o prefixo hipo.
Resumindo temos:
Aplicando esta regra, ficamos com:
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 15 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Caem pouco em provas os casos abaixo
OBS.: Quando varia o grau de hidratação (ocorre retirada de uma molécula de
água de uma ou duas moléculas de dado ácido). Não são ácidos muito comuns de
aparecerem em provas de concursos, mas, existem. Portanto:
00000000000
Resumindo temos:
Observação: quando um ácido resulta de um oxiácido pela substituição de um
átomo de oxigênio por um átomo de enxofre seu nome é formado acrescentando-se
o prefixo tio ao nome do ácido de origem.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 16 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Exemplos
Ionização dos Ácidos
A ionização de um ácido, como já vimos anteriormente na própria definição de
ácido de Arrhenius, é a reação do ácido com a molécula de água, produzindo o
cátion H3O+.
Se um ácido possui dois ou mais hidrogênios ionizáveis (poliácido), a ionização
ocorre em etapas.
Exemplos
a)
b)
c)
00000000000
d)
e)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 17 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Nomenclatura dos Ânions
Podemos considerar que os ânions são provenientes dos ácidos.
Assim, temos as seguintes terminações (sufixos) a serem empregados:
HF = ácido fluorídrico
F- = fluoreto
HCl = ácido clorídrico
Cl- = ânion cloreto
Br- = ânion brometo
HBr = ácido bromídrico
HI = ácido iodídrico
I- = ânion iodeto
CN- = ânion cianeto
HCN = ácido cianídrico
HNO3 = ácido nítrico
NO3- = ânion nitrato
HNO2 = ácido nitroso
NO2- = ânion nitrito
HClO3 = ácido clórico
ClO3- = ânion clorato
ClO4- = ânion perclorato
HClO4 = ácido perclórico
HClO2 = ácido cloroso
ClO2- = ânion clorito
HClO = ácido hipocloroso
CH3COOH = ácido acético
ClO- = ânion hipoclorito
00000000000
CH3COO- = ânion acetato
OBS: Caem pouco em provas os casos abaixo
HIDROGENO ÂNIONS
São ânions que possuem um ou mais hidrogênios ionizáveis em sua fórmula. Sua
nomenclatura segue a seguinte regra:
Mono, di ou tri (nº de H ionizáveis) + hidrogeno + nome do ânion normal
Ou ainda:
Nome do ânion normal + mono, di ou tri (nº de H ionizáveis) + ácido
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 18 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Observações:
1º) A colocação do prefixo mono é opcional;
2º) Os hidrogeno ânions provenientes de diácidos, o nome pode ser formado
acrescentando-se o prefixo BI.
Exemplo 1:
H2S
H+ + HS-
HS-
H+ + S2-
Desta forma, teremos:
H2S
HS-
S2-
Ácido
(Mono)Hidrogeno sulfeto ou
Sulfeto
sulfídrico
Sulfeto (mono)ácido ou
Bissulfeto
Exemplo 2:
H2SO4
H+ + HSO4-
HSO4-
H+ + SO42-
Desta forma, teremos:
H2SO4
HSO4-
SO42-
Ácido
(Mono)Hidrogeno sulfato ou
Sulfato
sulfúrico
Sulfato (mono)ácido ou
Bissulfato
Exemplo 3:
H3PO4
H+ + H2PO4-
H2PO4-
+
H +
HPO42-
H+ + PO43-
00000000000
HPO42-
Desta forma, teremos:
H3PO4
H2PO4-
HPO42- (*)
PO43-
Ácido
Di-hidrogeno
(Mono)Hidrogeno
Fosfato
Fosfórico
fosfato ou
fosfato ou
Fosfato diácido
Fosfato (mono)ácido
(*) Observe que para o hidrogeno fosfato não foi utilizado o prefixo BI, pois o
ânion é proveniente de um triácido.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 19 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Exemplo 4:
H2CO3
H+ + HCO3-
HCO3-
H+ + CO32-
Desta forma, teremos:
H2CO3
HCO3-
CO32-
Ácido
(Mono)Hidrogeno carbonato
Carbonato
carbônico
ou
Carbonato (mono)ácido ou
Bicarbonato
Apesar de esses ânions apresentarem hidrogênios, estes não são ionizáveis
APLICAÇÕES DOS PRINCIPAIS ÁCIDOS DO COTIDIANO
Ácido clorídrico (HCl)
O ácido impuro (técnico) é vendido no comércio com o nome de ácido muriático;
00000000000
Recipiente contendo ácido muriático
É encontrado no suco gástrico, produzido pelas células parietais, responsável
pela acidez estomacal;
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 20 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Esquema representativo do estômago contendo suco gástrico (HCl)
- É um reagente muito usado na indústria e no laboratório;
- É usado na limpeza de pisos após a caiação das paredes (cal hidratada
Ca(OH)2), para remover os respingos de cal;
HCl(aq) + Ca(OH)2(s)
CaCl2(aq) + 2 H2O
- É usado na limpeza de superfícies metálicas antes da soldagem dos respectivos
metais.
Ácido fluorídrico (HF)
Tem a particularidade de corroer o vidro, devendo ser guardado em frascos de
plástico, por esta razão é usado para fazer gravações sobre o vidro.
Ácido cianídrico (HCN)
O HCN é o gás de ação venenosa mais rápida que se conhece: uma
concentração de 0,3 mg por litro de ar é imediatamente mortal;
É o gás usado nos estados americanos do norte que adotam a pena de morte por
00000000000
câmara de gás;
A primeira vítima do HCN foi seu descobridor, Carl Wihelm Scheele, que morreu
ao deixar cair um vidro contendo solução de HCN.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 21 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Câmara de gás utilizado em execuções.
Ácido sulfídrico (H2S)
O H2S é um gás incolor, mais pesado do que o ar e inflamável com um forte odor
desagradável de ovos podres. Esse gás é algumas vezes referido como "gás de
cano de esgoto". Em pequenas concentrações ele pode irritar os olhos e atuar como
depressivo; em elevadas concentrações ele pode provocar irritação do sistema
respiratório superior e, durante longas exposições, edema pulmonar. Sendo mais
denso que o ar, o H2S pode acumular-se em depressões e cavernas.
Aquecendo as mãos no gêiser (deserto chileno nos Andes) que elimina H 2S com
00000000000
odor de ovo podre.
Ácido sulfúrico (H2SO4)
É o ácido mais utilizado e importante nas indústrias e nos laboratórios, conhecido
como “burro de carga”. O poder econômico de um país pode ser avaliado pela
quantidade de ácido sulfúrico que ele fabrica e consome;
O maior consumo de ácido sulfúrico é na fabricação de fertilizantes, como os
superfosfatos e o sulfato de amônio;
É o ácido dos acumuladores de chumbo (baterias) usados nos automóveis;
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 22 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
É consumido em enormes quantidades em inúmeros processos industriais, como
processos da indústria petroquímica, fabricação de papel, corantes, etc;
O ácido sulfúrico concentrado é um dos desidratantes mais enérgicos. Assim, ele
carboniza os hidratos de carbono como os açúcares, amido e celulose; a
carbonização é devido à desidratação desses materiais;
Adição de ácido. sulfúrico ao açúcar com desidratação e formação de carvão com
expansão de massa.
O ácido sulfúrico "destrói" o papel, o tecido de algodão, a madeira, o açúcar e
outros materiais devido à sua enérgica ação desidratante;
O ácido sulfúrico concentrado tem ação corrosiva sobre os tecidos dos
organismos vivos também devido à sua ação desidratante. Produz sérias
queimaduras na pele. Por isso, é necessário extremo cuidado ao manusear esse
ácido;
As chuvas ácidas em ambiente poluídos com dióxido de enxofre contêm H 2SO4 e
causam grande impacto ambiental.
S + O2(g)
Prof. Wagner Luiz
SO2(g) + 1/2 O2(g)
00000000000
SO3(g) + H2O(l)
H2SO4(aq)
www.estrategiaconcursos.com.br Página 23 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Efeitos da chuva ácida: estátua antes e depois da exposição à chuva ácida,
floresta negra na Alemanha em 1970 e 1983 depois da exposição à chuva ácida.
Ácido nítrico (HNO3)
Depois do sulfúrico, é o ácido mais fabricado e mais consumido na indústria. Seu
maior consumo é na fabricação de explosivos, como nitroglicerina (dinamite),
trinitrotolueno (TNT), tri nitrocelulose (algodão pólvora) e ácido pícrico e picrato de
amônio;
00000000000
É usado na fabricação do salitre (NaNO3, KNO3) e da pólvora negra (salitre +
carvão + enxofre);
Pólvora negra: (Salitre - KNO3 + Carvão - C + Enxofre - S)
As chuvas ácidas em ambientes poluídos com óxidos do nitrogênio contém HNO 3
e causam sério impacto ambiental. Em ambientes não poluídos, mas na presença
de raios e relâmpagos, a chuva também contém HNO3, mas em proporção mínima;
N2(g) + O2(g)
Prof. Wagner Luiz
2 NO(g) + O2(g)
2 NO2(g) + H2O(l)
HNO2 + HNO3
www.estrategiaconcursos.com.br Página 24 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
O ácido nítrico concentrado é um líquido muito volátil; seus vapores são muito
tóxicos. É um ácido muito corrosivo e, assim como o ácido sulfúrico, é necessário
muito cuidado ao manuseá-lo.
Explosão realizada através do uso do TNT obtido a partir do HNO3
Ácido fosfórico (H3PO4)
Os seus sais (fosfatos) têm grande aplicação como fertilizantes na agricultura;
É usado como aditivo (acidulante) em refrigerantes como a Coca-Cola.
00000000000
Refrigerante contendo H3PO4 como acidulante
Ácido carbônico (H2CO3)
É o ácido das águas minerais gaseificadas e dos refrigerantes. Forma-se na
reação do gás carbônico com a água: CO2 + H2O à H2CO3
Responsável pelo processo de formação da chuva ácida em ambientes não
poluídos na ausência de descargas elétricas.
CO2(g) + H2O(l) Û H2CO3(aq) Û H+(aq) + HCO31-(aq)
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 25 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Bebidas contendo ácido carbônico (H2CO3)
Ácido acético (H3C-COOH)
É o ácido constituinte do vinagre, utilizado com condimento na culinária;
O vinagre é uma solução aquosa contendo de 3 a 7% de ácido acético.
Vinagre contendo 3% a 7% de ácido acético
OBS: é ácido orgânico.
Achou complicado? Então vou dar uma força:
Professor: tem algum esquema pra ajudar a fazer mais fácil?
Para você fazer a maior parte dos ácidos (fórmula ou nome) basta que você
memorize o esquema abaixo e treine algumas vezes como usar o esquema.
Vou passar o esquema e dar algumas explicações:
3B3
2C3
1N3
00000000000
3P4
2S4
1Cl3
Percebeu que os números da esquerda do símbolo estão decrescentes em
todos os casos (3,2,1) ?
Percebeu que os números da direita do símbolo estão repetidos em cima (3)
e quase todos estão repetidos embaixo (4)?
O que significam estes números? Os da esquerda representam os
hidrogênios e os da direita os oxigênios presentes na molécula.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 26 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Informações a serem seguidas:
1) todos desta tabela e com estes valores os nomes terminam em ico
2) se diminuir 1 átomo de oxigênio então os nomes terminam em oso
3) se diminuírem 2 átomos de oxigênio então os nomes terminam em oso,
mas deve-se colocar o prefixo hipo antes do nome.
4) se aumentar 1 átomo de oxigênio então os nomes terminam em ico, mas
deve-se colocar o prefixo per antes do nome.
Memorizem assim: o que difere um ácido oxigenado do outro, tendo o
mesmo elemento central é a quantidade de átomos de oxigênio. Pense, então,
que seria uma “escadinha” de oxigênio. E descer uma escada é gostOSO,
mas, subir é um PERICO.
Exemplos:
Procure na tabelinha que passei onde está o cloro. Veja o numero que está
à direita dele, Você deve ter achado o número 3. Portanto, o cloro com 3
átomos de oxigênio ao lado terá terminação ICO.
HClO
ácido hipoCLORoso
HClO2
ácido CLORoso
HClO3
ácido CLÓRICO
HClO4
valores da tabelinha dada
ácido PERCLÓRICO
Exemplo 2: qual a fórmula do ácido fosfórico?
Você observa que o nome está terminando em ico. Então, consulte na
00000000000
tabela os valores que estão à direita e à esquerda da letra P (símbolo do
fósforo) e monte a fórmula H3PO4.
E se fosse ácido fosforoso? Bastaria diminuir um átomo de oxigênio da
fórmula do ácido fosfórico. Ficaria:
H3PO3.
Treine um pouco o suo, porque é muito útil. OBS.: não pode mudar a ordem dos
símbolos. E o iodo e o bromo você pode fazer usando os valores do cloro
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 27 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
QUESTÕES RESOLVIDAS
01. O ácido clórico é um ácido forte, utilizado como catalisador em reações de
polimerização e como agente oxidante. Soluções aquosas desse ácido pode causar
grande irritação na pele e nas mucosas. Represente a fórmula estrutural do ácido
clórico.
GAB
02. Escreva :
a) as fórmulas moleculares do ácido hipoiodoso e do ácido perbrômico.
b) os nomes dos compostos de fórmulas H2SO3 e H3PO4.
Gab:
a) HIO e HBrO4
b) ácido sulfuroso e ácido fosfórico
03. A queima do enxofre presente na gasolina e no óleo diesel gera dois anidridos
que, combinados com a água da chuva, formam seus ácidos correspondentes.
Escreva a fórmula desses ácidos e indique o ácido mais forte. Justifique sua
indicação.
RESOLUÇÃO:
H2SO3 e H2SO4
O ácido mais forte é o H2SO4, pois a diferença entre o número de átomos de
oxigênio e o número de átomos de Hidrogênio ácido é igual a 2, enquanto no
00000000000
H2SO3 essa diferença é igual a 1.
04. Sabe-se que a chuva ácida é formada pela dissolução, na água da chuva, de
óxidos ácidos presentes na atmosfera. Entre os pares de óxidos relacionados, qual
é constituído apenas por óxidos que provocam a chuva ácida?
a) Na2O e NO2
b) CO2 e MgO
c) CO2 e SO3
d) CO e NO2
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 28 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
e) CO e NO
Alternativa ‘C’.
O CO2 reage com a água formando solução ácida e é responsável pela
acidez natural da chuva em ambientes não poluídos. O SO3 reage com a água
formando ácido sulfúrico e é um dos principais responsáveis por diminuir o
pH da chuva a níveis perigosos para o ambiente.
05. Ao se dissolverem 5 mol de um ácido HX, em quantidade suficiente de água,
constatou-se que 4 mol do soluto se ionizaram. Pedem-se:
a) o grau de ionização de HX;
b) o número de íons existentes na solução obtida.
RESOLUÇÃO:
a) 80%
o valor de alfa se calcula através da seguinte relação:
= (numero de mol ionizados/ número de mol dissolvidos) *100
Logo, teremos
=(4/5)*100 = 80%
b) Se o ácido é do tipo HX ele se ioniza da seguinte maneira:
H+
HX
X-
+
Se 4 mol ionizam serão formados 4 mol de cada íon.
Logo, teremos
HX
H+
+
4 mol
X4mol
00000000000
Total de íons= 8 mol
Então, 8x6x1023 íons = 48x1023 íons = 4,8x1024 íons
06. Os ácidos podem ser classificados quanto ao número de hidrogênios ionizáveis.
O ácido hipofosforoso, H3PO2, utilizado na fabricação de medicamentos, apresenta
fórmula estrutural:
H
O P O H
H
a) Quantos hidrogênios são ionizáveis no ácido hipofosforoso? Justifique sua
resposta.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 29 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
b) Escreva a equação de neutralização desse ácido com o hidróxido de sódio.
RESOLUÇÃO:
a) apenas um (01) hidrogênio ionizável.
b) H3PO2 + NaOH NaH2PO2 + H2O
07. O cloro é um gás irritante e sufocante. Misturado à água, reage produzindo os
ácidos clorídrico e hipocloroso – que age como desinfetante, destruindo ou
inativando os microrganismos.
a) Identifique os reagentes e os produtos desta reação e forneça suas fórmulas
químicas.
b) A água de lavadeira é uma solução aquosa de hipoclorito e o ácido muriático
é uma solução concentrada de ácido clorídrico. Ambos podem ser utilizados
separadamente na limpeza de alguns tipos de piso. Explique a inconveniência, para
a pessoa que faz a limpeza, de utilizar uma mistura destes dois produtos.
RESOLUÇÃO:
a) Cl2(g) + H2O
HCl(aq) + HClO(aq)
b) H+(aq) + ClO–(aq) + 2 Cl–(aq)
Cl2(g) + H2O como na reação há produção
de gás cloro, o inconveniente é que a água de lavadeira é irritante aos olhos,
devido à presença do cloro.
08. (TRANSPETRO - TÉCNICO DE OPERAÇÕES JUNIOR - CESGRANRIO/2012).
O ácido carbônico, de fórmula H2CO3, presente nos refrigerantes, é um ácido
muito fraco e, por essa razão,
(A) a sua constante de ionização é muito baixa.
00000000000
(B) se dissocia nos íons H2 e CO3.
(C) reage apenas com bases fracas.
(D) possui ligações iônicas entre os seus átomos.
(E) possui pH maior do que 7 quando em solução aquosa
RESOLUÇÃO:
Os ácidos fracos reagem com qualquer base. Isto não depende de sua força.
Mas, a constante de ionização é reflexo de sua força. Portanto, sendo um ácido
fraco ele terá baixa constante de ionização.
Resposta: “A”.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 30 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
09. (PETROBRÁS - TÉCNICO(A) QUÍMICO(A) DE PETRÓLEO JÚNIOR CESGRANRIO/2012). A fórmula molecular do anidrido acético, derivado do
ácido etanoico, é dada por
(A) C4H6O3
(B) C4H6O4
(C) C6H4O3
(D) C6H4O4
(E) C6H6O3
RESOLUÇÃO:
O anidrido acético é obtido pela condensação de 2 moléculas do ácido acético.
Para que isto ocorra, deve ocorrer a eliminação de água. Teríamos:
2 C2H4O2 - H2O
C4H6O3
Resposta: “A”.
10. (PETROBRÁS - TÉCNICO DE OPERAÇÃO JÚNIOR- CESGRANRIO/2012). De
acordo com o conceito de Ácido-Base de Arrhenius, a propriedade que
caracteriza uma substância ácida é aquela na qual os compostos que, ao
serem dissolvidos em água,
(A) sofrem dissociação iônica, liberando íons OH−.
(B) sofrem dissociação iônica, liberando íons H+ e OH−, simultaneamente.
(C) sofrem dissociação iônica, liberando CO2 para a atmosfera.
(D) sofrem dissociação iônica, liberando H+.
(E) não sofrem dissociação iônica.
00000000000
RESOLUÇÃO:
De acordo com a teoria de Arrhenius uma substância ácida é aquela que ao ser
dissolvida em água libera como único cátion, por ionização (a banca comete um erro
conceitual, pois, ácidos ionizam e bases e sais dissociam), o grupo H 3O+
(simplificado por H+).
A meu ver a Resposta: mais adequada seria a alternativa E, pois, ácidos não
dissociam. Mas a banca trouxe a D.
Resposta: “D”.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 31 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
11.
(DMAE-RS-
QUÍMICO-
CONSULPLAN/2011).
Quantos
átomos
de
hidrogênio possui a estrutura química do composto “ácido cloroso”?
A) 4
B) 3
C) 2
D) 1
E) 0
RESOLUÇÃO:
A fórmula do ácido cloroso é HClO2. Portanto, apresenta um átomo de
hidrogênio.
Resposta: “D”
12. (UNIPAMPA - TÉCNICO DE LABORATÓRIO– CESPE/2013). O ácido acético
pode ser armazenado juntamente com outros ácidos, tal como o ácido nítrico,
não sendo requeridos cuidados especiais para armazenamentos de ácidos.
RESOLUÇÃO:
Os ácidos geralmente são agentes corrosivos, podem ser voláteis e tóxicos.
Devem ser guardados em espaços adequados.
Resposta: “ERRADO”.
13. (MINISTÉRIO DA AGRICULTURA – AUXILIAR DE LABORATÓRIO –
CONSULPLAN/2014). Qual dos seguintes compostos é um ácido?
A) SO2.
B) H2SO4
00000000000
C) Na2SO4.
D) Na2S2O3.
RESOLUÇÃO:
Ácidos, segundo Arrhênius, liberam íons H3O+ quando em solução aquosa.
Portanto, é necessário que a espécie química tenha ao menos átomo de hidrogênio.
Por exclusão, chegamos ao H2SO4. Só uma dica: ácidos começam com H.
Portanto, B.
Resposta: “B”.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 32 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
14. (UFJF-MG - TÉCNICO DE LABORATÓRIO – 2013 – IFSULDEMINAS) O ácido
clorídrico puro (HC ) é um composto que conduz pouca eletricidade, assim
como a água pura (H2O). No entanto, ao dissolvermos esse ácido na água, é
formada uma solução que conduz muito bem a eletricidade, o qual se deve à:
a) dissociação da água em H+ e OH-.
b) ionização do HC , formando H3O+ e C -.
c) transferência de elétrons da água para o HC .
d) transferência de elétrons do HC para a água.
e) reação de neutralização do H+ da água com o C - do HC .
RESOLUÇÃO:
O ácido puro e a água pura são compostos moleculares e, portanto, péssimos
condutores de corrente elétrica. Porém, ao misturá-los, o ácido sofre a reação de
ionização originando íons. A solução iônica formada é boa condutora de corrente
elétrica. HCl + H2O
H+ + Cl-
Resposta: “B”
Abaixo colocarei um trecho da aula sobre espectrometria de massas. Este ano
houve um concurso para o MAPA (Ministério da Agricultura) e no meu material
tive a felicidade de discutir a rota de fragmentação de um composto. Qual a
grande satisfação? Justamente na questão aberta, que valia muitos pontos no
concurso, caiu exatamente a questão discutida no meu material.
Além de eu ter acertado várias dicas do material que acabaram caindo várias
questões exatamente da forma que eu havia discutido e dados as dicas.
Então vamos:
00000000000
Segue trechos da aula do tópico espectrometria de massas:
“Espectrometria de massas
Esta técnica é uma das mais modernamente empregadas, apesar de seu
conhecimento não ser tão recente. Ocorre que, em função das dificuldades iniciais
da técnica esta não foi levada muito a sério, pois, supunha-se ser de pouca
importância.
Porém, a técnica passou a ter grande importancia a partir dos anos 80.
Muitos novos conhecimentos foram aplicados, novos equipamentos foram
desenvolvidos e a técnica é, atualmente, de grande importancia e de extrema
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 33 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
funcionalidade. Permite análises extremamente seletivas (pode-se se determinar em
uma complexa mistura a concentração de um único composto, por exemplo, em
uma centena de outros compostos).
Como existem muitas variáveis da técnica iremos trabalhar com as mais
empregadas para a maioria dos compostos, objetivando apenas dar uma ideia a
quem nunca teve contato com esta brilhante técnica.
O assunto é muito complexo. Para os que o desconhecem ficará uma
dificuldade adicional. Para os que já tiveram alguma disciplina na graduação que
envolvia tal técnica, menores as dificuldades de se conhecer o básico.
Esta técnica tem uma grande desvantagem: o custo. Os espectrômetros
custam de R$ 300.000,00 (os mais simples) a R$ 1.200.000,00. O valor médio para
uso industrial gira por volta de uns R$ 500.000,00. Os valores dependem das
formas de ionização, dos detectores, dos analisadores de massas, entre outros.
A manutenção do aparelho também é um aspecto a ser considerado devido
aos elevados custos. Além do espaço físico necessário para a instalação destes
Nas instituições públicas é comum a presença de espectrômetros de toda
natureza. Porém, em instituições particulares estes são mais raros.”
“Para situar o concursando vou fazer um breve resumo em tópicos:
O que é Espectrometria de Massas?
- Uma poderosa técnica analítica que possibilita:
– Medir massa molecular de compostos
– Identificar compostos desconhecidos
– Quantificar compostos
00000000000
– Revelar a estrutura de moléculas
– Determinar modificações pós traducionais em proteínas
Alguns Usos:
- Monitorar pacientes durante uma cirurgia;
- Determinar a composição de espécies encontradas no....”
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 34 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
“Espectrômetro de massas
O espectrômetro de massas é um instrumento que separa íons, positivos ou
negativos, produzidos a partir de átomos ou moléculas, quer sejam das mais
simples às mais complexas, de acordo com a razão massa/carga (q/m).
Espectrometria de massas - Instrumental
Os espectrômetros de massas constam de quatro partes básicas: um sistema de
manipulação para introduzir a amostra desconhecida no equipamento; uma fonte de
íon, na qual é produzido um feixe de partículas proveniente da....”
“Exemplos de interpretação de espectros de massas
Este tópico requer muitos estudos, pois, para cada função orgânica termos
diferentes perdas lógicas e as análises devem ser personalísticas. Vou dar alguns
exemplos de compostos, fragmentos e espectros dos íons obtidos.
Exemplo 01) No espectro de massas do 2,2-dimetilpentano podemos observar os
dois fragmentos iônicos resultantes de quebras nos pontos de ramificação
representados pelos íons a m/z 85 (M - 15) e 57 (cation t-butil):
00000000000
A discussão das fragmentações nos leva a.....
ENFIM, são exertos do material que será destinado a seus estudos.
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 35 de 36
00000000000 - DEMO
Química para Perito Criminal GO
Teoria e exercícios
Prof. WAGNER LUIZ – Aula 00
Hoje tivemos uma aula mais light, praticamente para apresentar o curso e a
didática do professor. Coloquei todo assunto de ácidos. A vídeo-aula da
segunda parte de ácidos será postada na aula 01. Na aula 01 fecharemos todo
estudo das funções, onde teremos mais aspectos relativos aos ácidos, em
reações com hidróxidos e óxidos.
Espero que você tenha gostado da aula.
Seja muito bem-vindo ao nosso curso.
Aguardo você para as próximas aulas.
Sempre a seu dispor.
Prof. Wagner Bertolini
00000000000
Prof. Wagner Luiz
www.estrategiaconcursos.com.br Página 36 de 36
00000000000 - DEMO