INTRODUÇÃO.
As vias para a síntese de aminoácidos essenciais foram deduzidas de
estudos bioquímicos e genéticos daqueles organismos capazes de
sintetizá-los. As vias que levam à síntese dos aminoácidos essenciais
são geralmente longas (5 a 15 etapas) e mais complexas do que aquelas
que levam aos aminoácidos não essenciais, a maioria dos quais
possuem menos de 5 etapas.
Os animais superiores são incapazes de sintetizar vários aminoácidos
essenciais por falta de uma ou duas enzimas nas suas vias. A mais
complexa das vias de aminoácidos essenciais são aquelas que levam à
fenilalanina, ao triptofano e à histidina, que possuem benzeno ou anéis
heterocíclicos. A síntese destes anéis condensados do triptofano, requer
etapas numerosas e complexas, catalisadas por enzimas.
A maneira mais simples pela qual a síntese de aminoácidos é
controlada é através de inibição alostérica da primeira reação
biossintetizante, pelo seu produto final. A primeira reação da
seqüência, que usualmente é irreversível, é catalisada por uma enzima
alostérica. Um outro mecanismo para a regulação da biossíntese dos
aminoácidos é através do controle da concentração das enzimas
biossintetizantes. Quando as células não necessitam de um certo
aminoácido porque ele já está disponível em altas concentrações, as
enzimas requeridas na sua síntese estão presentes em níveis muito
baixos. Entretanto, se a concentração destes aminoácidos cai a níveis
menores do que os adequados, as células começam a sintetizar mais as
1
enzimas necessárias para a síntese de aminoácidos. Este tipo de
regulação é exercida por alteração nas atividades dos genes que
codificam estas enzimas. Toda vez que o produto de uma via
biossintetizante for disponível em grandes concentrações, os genes que
codificam estas enzimas são inativados ou reprimidos.
A ferroprofina ou grupo heme da hemoglobina liberada das células
vermelhas , é degradada produzindo o ferro (três mais) livre, e no fim
a bilirrubina, um derivado tetrapirrólico linear ou aberto. A bilirrubina
torna-se ligada à albumina sérica do sangue, sendo transportada ao
fígado onde é transformada num derivado hidrossolúvel excretado na
bile. A bilirrubina é o pigmento responsável pela cor amarela da pele e
da conjuntiva da icterícia, que resulta de uma função hepática lesada.
A determinação da concentração da bilirrubina no sangue é útil no seu
diagnóstico e no de outras doenças hepáticas.
Uma outra fonte de energia biológica importante se resume em
transforma energia química em energia luminosa, este processo é
denominado fotossíntese.
Os organismos fotossintetizantes e heterotróficos vivem num estado de
equilíbrio dinâmico, balanceado em nossa biosfera.
As plantas fotossintetizantes captam a energia solar na forma de ATP e
NADPH, que elas usam como fontes de energia para sintetizar os
carboidratos e outros componentes orgânicos celulares a partir do
dióxido de carbono e água, simultaneamente, elas liberam oxigênio na
atmosfera. Os heterotróficos aeróbicos, por outro lado, usam o oxigênio
formado para a degradar os produtos orgânicos ricos de energia da
2
fotossíntese em CO2 e H2O, a fim de gerar ATP para as suas próprias
atividades. O dióxido de carbono formado pela respiração nos
heterotróficos retorna à atmosfera para ser usado novamente pelos
organismos fotossintetizantes. A energia solar desta forma fornece a
força motora para o ciclo contínuo de dióxido de carbono e oxigênio
atmosféricos na nossa biosfera.
Quantidades enormes de energia são armazenadas como produtos da
fotossíntese. Cada ano, pelo menos 10 (elevado a 17) Kcal de energia
livre são gerados pelo mundo vegetal às expensas da energia solar. Isto
é 10 vezes maior que toda a energia combustível fóssil usada por ano
pela humanidade. Mesmos os combustíveis fósseis (carvão, petróleo e
gás natural) são produtos da fotossíntese que se realizou há milhões de
anos atrás. Por causa da nossa dependência global de energia solar,
passada e presente, tanto para energia como para a alimentação, o
mecanismo da fotossíntese propõe os problemas bioquímicos mais
fundamentais.
Um processo metabólico muito ativo nos animais é a biossíntese de
triacilgliceróis, eles têm capacidade de armazenar este composto em
grandes quantidades. Já os seres humanos armazenam apenas centenas
de gramas de glicogênio no fígado e nos músculos, para suprir as
necessidades energéticas do organismo por cerca de 12 horas.
Diversamente, a quantidade total de triacilgliceróis armazenadas em
um adulto de 70 Kg, de constituição média, é cerca de 12 Kg, suficiente
para suprir as necessidades energéticas basais por até oito semanas.
Todo o carboidrato consumido em excesso à capacidade de
3
armazenamento do glicogênio é convertido em triacilgliceróis, que
podem ser armazenados em grandes quantidades nas células adiposas
em diferentes partes do organismo, especialmente debaixo da pele e na
cavidade abdominal.
As plantas também sintetizam triacilgliceróis como forma de
armazenamento de combustível rico em energia, especialmente nas
frutas, nozes e sementes.
Os lipídeos polares das membranas, como os vários fosfolipídeos e
esfingolipídeos, que são armazenados, são também constantemente
sintetizados pelos animais como membranas, que sofrem degradação
metabólica contínua.
Os ácidos graxos também transferem aos triacilgliceróis e fosfolipídeos
o seu caráter hidrofóbico.
4
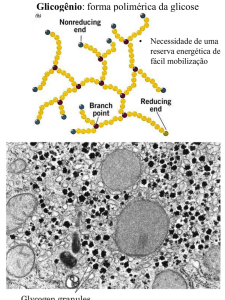
METABOLISMO DO GLICOGÊNIO.
O glicogênio, é uma reserva energética facilmente mobilizada, é um
polímero ramificado de radicais de glicose. A maioria das unidades de
glicose no glicogênio é unida por ligações glicosídicas 1,4. O
glicogênio está presente em grandes quantidades nos músculos e no
fígado, onde é armazenado no citoplasma na forma de grânulos
hidratados.
A maior parte da molécula de glicogênio é degradada a glicose 1fosfato pela ação da fosforilase. A ligação glicosídica entre o C1 de uma
ose terminal e o C4 da adjacente é rompida por ortofosfato, dando
glicose 1-fosfato, que pode ser reversivelmente convertida a glicose 6fosfato. O piridoxal fosfato, um derivado da vitamina B6, participa da
clivagem fosforolítica do glicogênio. Os pontos de ramificação são
degradados pela ação conjugada de um oligo-hosídio transferase e
uma -1,6-glicosidase. Esta última(enzima disramificadora) catalisa a
hidrólise de ligações 1,6, o que produz glicose.
5
6
O glicogênio é sintetizado por uma via diferente. UDP-glicose(uridina
di fosfato), o intermediário ativado na síntese do glicogênio, forma-se a
partir da glicose 1-fosfato e UTP. O glicogênio sintetase catalisa a
transferência de glicose de UDP-glicose para a hidroxila C4 de uma ose
terminal na cadeia de glicogênio em crescimento. A síntese é iniciada
pela glicogenina, uma proteína anti-glicosilante, que contém uma
unidade oligo-holisídica covalente, unida a uma tirosina específica.
A glicogênio sintetase só é ativada quando associada com a
glicogenina, que serve para limitar o tamanho dos grânulos de
glicogênio. Uma enzima ramificada converte algumas das ligações
1,4, a ligações -1,6, aumentando o número de extremidades, de
modo que o glicogênio possa a ser degradado e sintetizado mais
rapidamente.
A fosforilase, uma enzima dimérica é regulada por efetores alostéricos
e modificações covalentes reversíveis. A fosforilase “b” no músculo,
pode também ser ativada pela ligação do AMP, um efeito
antagonizado pelo ATP e glicose 6-fosfato. A forma “a” no fígado é
inibida pela glicose. Os locais de ligações do AMP e os locais de
fosforilação estão localizados na interface das subunidades. Alterações
conformacionais induzidas pelas ligações do AMP e pela fosforilação,
7
são transmitidas a distâncias maiores do que a 30Å para os centros
catalíticos e outros locais de ligações. No músculo, a fosforilase é
ativada a fim de gerar ose para uso interno das células como fonte
energética para atividades musculares. Ao contrário, a fosforilase
hepática é ativada para liberar glicose, que é exportada a outros órgãos
como músculos esqueléticos e cérebro.
A síntese e degradação do glicogênio são coordenados do por uma
cascata de reações amplificadoras. O glicogênio sintetase é inativo
quando a fosforilase é ativa, e vice-versa. Epinifrina e glucagon
estimulam a degradação do glicogênio e inibem sua síntese por
aumentarem o nível intracelular de AMP cíclico, que ativa uma
proteína cinase A(PKA). A fosforilase cinase torna-se mais ativa,
enquanto o glicogênio sintetase torna-se menos ativa quando
fosforilada pela PKA. Níveis citossólicos elevados de cálcio ativam
diretamente a fosforilase cinase, que contém calmodulina como uma
de suas subunidades. Portanto, a concentração muscular e os
hormônios mobilizadores de cálcio promovem a degradação do
glicogênio.
As ações mobilizadoras de glicogênio PKA são revertidas pela proteína
fosfatose 1, que é regulada por vários hormônio. A epinefrina
8
(adrenalina) inibe essa fosfatose por bloquear sua ligação aos grânulos
de glicogênios e por ativar um inibidor; ambos os efeitos são feitos por
fosforilação catalisada pelo PKA. Ao contrário, a insulina ativa a
fosforilase por disparar uma cascata que fosforila a subunidade
destinada ao glicogênio dessa enzima. Portanto, a síntese do glicogênio
é
diminuída
pela
epinefrina
e
aumentada
pela
insulina(hipoglicemiante). A glicogênio sintetase e a glicogênio
fosforilase são também reguladas por interações alostéricas não
covalentes. De fato, a fosforilase é uma peça importante do sistema
sensor de glicose das células hepáticas. O metabolismo de glicogênio
exemplifica o poder de precisão da fosforilação reversível na regulação
de processos biológicos.
9
METABOLISMO DE ÁCIDOS GRAXOS.
Os ácidos graxos são fisiologicamente importantes como:
- componentes de fosfolipídeos e glicolipídeos;
- modificadores lipólifos de proteínas;
- moléculas fornecedoras de energia;
- hormônios e mensageiros intracelulares.
Estes
compostos
são
armazenados
no
tecido
adiposo
como
trigicerídeos(gorduras neutras), que podem ser mobilizadas pela ação
hidrolítica de lipases sob o controle hormonal. Os ácidos graxos são
ativadores da acetil coenzima A, que são transportadas através da
membrana mitocondrial interna, e pela carnitina, e degradadas na
matriz mitocondrial por uma seqüência repetida de quatro reações:
1. Oxidação ligada ao FAD;
2. Hidratação;
3. Oxidação ligada a NAD+;
4. Tiólise por coenzima A
O FADH2 e o NADH formados nas etapas de oxidação transferem seus
elétrons ao O2 por meio da cadeia respiratória, quando a acetil CoA
formada na etapa de tiólise entra normalmente no ciclo de ácido nítrico
por condensação com oxaloacetato. Quando a concentração deste
composto é insuficiente, a acetil CoA dá origem a acetoacetato e 3hidroxibutírato, que são moléculas energéticas normais. No jejum em
diabéticos, formam-se grandes quantidades de acetoacetato, 3hidroxibutírato e acetona(conhecidos juntos como “corpos cetônicos”)
10
no fígado, acumulando-se no sangue. Os mamíferos são incapazes de
transformar ácidos graxos em glicose, porquê não tem a via para a
produção global de oxaloacetato, piruvato, ou outros intermediários de
glicogênese a partir de acetil Co A.
Os ácidos graxos são sintetizados no citosol por uma via diferente da
de -oxidação. Um ciclo de reações, baseado em formação e clivagem
de citrato, transporta as células de mitocôndrias para o citosol.
O NADPH necessário para a síntese é gerado pela via das pentosesfosfato e na transferência de equivalentes reduzidos da mitocôndria
pela lançadeiras malato-piruvato. A síntese começa com a carboxilação
de acetil-CoA a malonil-CoA, a etapa limitante. Essa reação
impulsionada pelo ATP é catalisada pela acetil-CoA carboxilase, uma
enzima com biotina. Os intermediários nessa síntese de ácidos graxos
são ligados a uma proteína carregadora de acilas(ACP-acyl carrier
protein), especificamente à sulfidrila terminal em seu grupamento
prostético de fosfopanteteína. Forma-se acetil-ACP de acetil-CoA e
malonil-ACP de malonil-CoA condensam-se, formando acetoacetilACP, uma reação impulsionada pela liberação de CO2 da unidade
malonila ativada. Isso é seguido de uma redução, uma desidratação e
11
uma segunda redução. O NADPH é o redutor nessas etapas. À butirilACP formada desse modo esta pronta para uma segunda volta de
alongamento, que começa com a adição de uma unidade de 2 carbonos
vinda da malonil-ACP. Sete voltas de alongamento produzem palmitilACP, que é hidrolisada a palmitato. A síntese de palmitato requer 8
moléculas de acetil-CoA , 14 de NADPH e 7 de ATP; 7 HCO3 exercem
um papel catalítico. Em organismos superiores, as enzimas que fazem
a síntese de ácidos graxos são ligadas por covalência em um complexo
enzimático multifuncional. A unidade flexível de fosfopanteína da
ACP leva o substrato de um centro ativo para outro nesse complexo.
A síntese e a degradação dos ácidos graxos são reguladas de maneira
recíproca, de modo que ambas não estejam simultaneamente ativas. A
acetil-CoA carboxilase, o local principal de controle, é estimulada pela
insulina e inibida pelo glucagon e adrenalina. Esses efeitos hormonais
são
feitos
por
alterações
nas
quantidades
das
formas
ativas(desfosforilada) e inativa(fosforilada) da carboxilase. O citrato,
que sinaliza uma abundância em blocos de construção e energia,
estimula alostericamente a carboxilase. O glucagon e a adrenalina
12
estimulam a degradação dos triacilgliceróis por ativarem a lipase. A
insulina, ao contrário inibe a lipólise. Em épocas de saciedade, as acetilCoA de ácidos graxos não penetram na matriz mitocondrial, porquê a
malonil CoA inibe a carnitina acetil-transferase I.
Os ácidos graxos são alongados e dessaturados por sistemas
enzimáticos na membrana do retículo endoplasmático. A dessaturação
requer NADH e O2 e é feita por um complexo constituído de uma
flavoproteína, um citocromo e uma ferroproteína não héminica. Os
mamíferos não tem enzimas para introduzir duplas ligações além do
C9 e, portanto, precisam de linoleato e linolenato em suas dietas.
O araquidonato, um importante precursor das prostaglandinas e
outras moléculas sinalizadoras, é derivado do linoleato. Este ácido
graxo polinsaturado é o precursor de diversas classes de moléculas
sinalizadoras(prostaglandinas,
prostaciclinas,
tromboxanos
e
leucotrienos), que atuam como mensageiros e hormônio locais por
causa de sua brevidade. Eles são chamados de icosanóides, pois
contém 20 átomos de carbono.
13
A prostaglandina sintetase, a enzima que catalisa a primeira etapa da
síntese de todos os icosanóides, exceto leucotrienos, é constituída de
um ciclo-oxigenase e de uma hidrixoperoxidase. A aspirina(acetilsalicilato), uma droga anti-inflamatória e anti-trombótica, bloqueia, de
modo irreversível a síntese desse icosanóides por acetilar uma serina
na ciclo-oxigenase da síntese.
14
FOTOSSÍNTESE.
A fotossíntese em vegetais verdes é feita por dois fotossistemas
localizados nas membranas tilocóides dos cloroplastos. A iluminação
leva à geração de um gradiente de prótons transmembrana para a
criação de ATP e à criação de um poder redutor para a produção de
NADPH. A luz absorvida por moléculas de clorofila no complexo de
captação de luz do fotossistema é encaminhada para o centro de
reação do P680, um par especial de clorofilas localizado na interface
de duas subunidades semelhantes que forman o núcleo do centro de
reação. Sem elétron é transferido do P680 excitado para a feofitina e,
daí, para plastoquinonas ligadas a Qa e Qb, formando plastoquinona
reduzida da (QH2). O centro de reação recupera elétrons da água
pela ação de uma proteína que contém manganês, o que causa o
desprendimento de O2. Assim, a reação global catalisada pelo
fotossistema é a transferência de elétrons, induzida pela luz da água
para a plastoquinona. Sem gradiente de prótons transmembrana é
concomitantemente gerado, o centro de reação fotossintética de uma
bactéria púrpura, que é homólogo ao fotossistema de vegetais, foi
visualizada por resolução atômica. O evento crítico em todos os
centros de reação de fotossíntese é a transferência induzida pela luz
de um elétrons para um aceptor contra um gradiente de potencial
eletroquímico.
15
Elétrons do fotossistema II fluem para o fotossistema I, através do
complexo de citocromo “bf”. Esse complexo transmembrânico
bombeia prótons para dentro do espaço tilocóide quando os elétrons
são transferidos de QH2 para a plastocianina, uma proteína
hidrossolúvel. O fotossistema I participa na transferência movida à
luz de elétrons da plastocianina para P700 e, daí, para ferrodoxina,
um redutor poderoso. A ferrodoxina: NADP+
redutase, uma
flavoproteína localizada no lado do estroma da membrana catalisa
então a formação de NADPH. Deste modo, a interação dos
fotossistemas I e II leva à transferência de elétrons da água (H2O)
para o NADPH e à concomitante geração de um gradiente de
prótons para a síntese de ATP.
16
Como alternativa, os elétrons da feredoxina podem fluir de volta
para o fotossistema I pelo complexo citocromo “bf”; esse modo de
ação do fotossistema I chamado de fosforilação cíclica, leva a geração
de um gradiente de prótons, sem a formação de NADPH. O ATP
sintetase de cloroplastos (também chamada CF0 - CF1) assemelha-se
muitos à ATP sintetase de bactérias e de mitocôndrias (F0 - F1). A
síntese de ATP é impulsionada pelo fluxo de prótons do espaço
tilocóide, através do canal transmembrana de CF0 para CF1 no lado
do estroma da membrana.
O ATP e o NADPH formados à luz da fotossíntese são usados para
converter CO2 em hexoses e outros compostos orgânicos. A fase “no
escuro” da fotssíntese, chamada de ciclo de Calvin, começa com a
reação do CO2 com ribulose 1,5-bifosfato para formar duas
moléculas de 3-fosfoglicerato a frutose 6-fosfato e glicose 6-fosfato
são semelhantes a gliceralgêneses, exceto quanto ao fato da
gliceraldeído-3-fosfato desidrogenase em cloroplasto ser específica
para o NADPH e não para NADH. A ribulose 1,5-bisfosfato é
17
regenerada da frutose 6 - fosfato, gliceraldeído - 3 - fosfato e
dihidroxiacetona fosfato por uma série complexa de reações.
Diversas etapas nessa regeneração da ribulose 1,5-bifosfato são
semelhantes às da via pentose-fosfato. A tiorredoxina formada pela
transferência de elétrons da ferrodoxina ativa enzimas do ciclo de
Calvin, ao reduzir pontes dissulfetos. O aumento induzido pela luz,
de PH e do nível de Mg+ do estroma também é importante ao
estímulo da carboxilação da ribulose 1,5-bisfosfato. Três ATP e dois
NADPH são consumidos para cada CO2 convertidos em hexoses.
Quatro prótons são absorvidos pelo fotossistema I e, outros quatros
pelo fotossistema II, para gerar dois NADPH e um gradiente de
prótons suficientes para impulsionar a síntese de 3ATP. Amido nos
cloroplastos e sacarose no citosol são os principais glicídeos
armazenados pelos vegetais.
18
A
ribulose
competitiva
1,5-bifosfato
carboxilase
deoxigenase,
que
também
produz
catalisa
fosfoglicolato
reação
e
3-
fosfoglicerato. A reciclagem do fosfoglicolato leva à liberação de CO2
e maior consumo de O2, em um processo chamado fotorrespiração.
Essa improdutiva reação colateral é tornada mínima em vegetais
tropicais, que tem uma via acessória para a concentração de CO2 no
local do ciclo de Calvin. Essa via em C4 permite que os vegetais
tropicais tirem vantagem dos altos níveis de luz e minimizem a
oxidação da ribulose 1,5-bifosfato.
Reação global da fotossíntese:
6CO2 + 30ATP + 12NADPH + 12H2O C6H12O6 + 30ATP + 30P2 +
12NADPH + 18H+
Mais simplificadamente temos:
12H2O + 6CO2 C6H12O6 + 6H2O + 6O2.
19
BIOSSÍNTESE DOS AMINOÁCIDOS E DO HEMO
Microorganismos utilizam ATP e ferredoxina reduzida(redutor
potente), para reduzir N2 a NH3. Sem aglomerado de ferro e
molibdênio na nitrogênase catalisa com eficiência a fixação de NH2,
uma molécula bem inerte. Organismos superiores consomem NH4+
para sintetizar aminoácidos, nucleotídeos e outras biomoléculas
nitrogenadas. Os principais pontos de entrada de NH4+ no
metabolismo são glutamina, glutamato e carbanil fosfato. Os seres
humanos podem sintetizar 11 do compostos básicos de 20
aminoácidos. Esses são chamados não essências, em contraste com os
essências, que são fornecidos pela alimentação. As vias de síntese dos
aminoácidos
não essências
são bem simples. A glutumato
desidrogenase catalisa a aminação redutora da -cetoglutarato.
Alanina
e
aspartato
são
sintetizados
por
transaminação,
respectivamente, de piruvato e oxaloacetato. A gluttamina é
sintetizada a partir de NH4 e glutamato e a asparagina é sintetizada
de modo semelhante. Prolina e arginina são derivadas do glutamato.
A serina, formada a partir de 3-fosfoglicerato, é precursora da glicina
e cisteína. A tirosina é sintetizada por hidroxilação de fenilalanina,
um aminoácido essencial.
20
As vias de biossíntese se aminoácidos são mais complexas. A maioria
dessas vias é regulada por retroinibição (feedback), na qual a etapa
comprometida sofre inibição alostérica sobre o produto final. O
controle retroativo seqüencial, multiplicidade de enzimas, controle
retroativo configurado e cumulatório são sistemas regulatórios
amplamente usados na metabolismo. A regulação da glutamina
sintetase de E. coli fornece uma demonstração marcante de retroinibição cumulativa e de controle por uma cascata de modificação
covalentes reversível.
21
O tetra-hidrofalato, um transportador de unidades ativadas com
carbono,
exerce
um
papel
importante
no
metabolismo
de
aminoácidos e nucleotídeos. Esta coenzima transporta unidades de 1
carbono em 3 estados de oxidação, que são interconversíveis: mais
reduzido-metila;
intermediário-metileno;
mais
oxidado-formila,
forminino e metila. O principal doador de metilas ativadas é a Sadenosil meticoninas, que é sintetizada pela transferência de uma
adenosila do ATP para o átomo de metionina. Forma se S-adenosil
homocisteína quando a metila ativada é transferida para um aceptor.
Ela é hidrolisada à adenosina e homocisteína, que é então metilada a
metionina para completar o ciclo de metila ativada. A S-adenosil
metionina também serve como doador de propilamina na síntese de
poliaminas e como percursor de etileno, um hormônio vegetal que
induz o amadurecimento.
22
Os aminoácidos são precursores de várias biomoléculas. O glutatião
(-glu-cis-gli) serve como tampão de sulfidras e como agente em
destoxidação. A glutatião peroxidase, uma seleno-enzima, catalisa a
redução de peróxido hidrogênio e de peróxidos orgânicos pelo
glutatião. O óxido nítrico (NO), um mensageiro de curta duração, é
formado a partir da arginina. As porfirinas são sintetizadas a partir
de glicina e suxinil-CoA, que se condensam para dar aminolevolinato. Duas moléculas desse intermediário se ligam,
formando porfolinogênio. Quatro porfobilinogênios se combinam
para formar um tetrapirol linear que se ciclisa à uroporfirinogênios 3.
Oxidação e modificações de cadeias laterais levam a síntese de
protoporfirina IX, que adquiri um átomo de ferro para formar o
hemo. A tradução do mRNA para g-minolevulinato sintetase, a
enzima que catalisa a etapa comprometida nesta via é inibida pelo
hemo.
Este
grupamento
prostético
é
degradado
por
uma
monoxigenase, um tetrapirrol linear. A redução da biliverdina por
NADPH gera bilirubina, um potente destruidor de peróxidos. A
bilirubina é tornada solúvel para excreção para a formação do
derivado diglucuronídico.
23
24
“Parte de um artigo publicado na revista Scientific American, julho
de 1996, sob o título LUZ SOLAR E O CÂNCER DE PELE, onde os
pesquisadores explicam as dificuldades que enfrentam para
compreender como as mutações processam-se na cadeia do DNA,
alterando completamente a seqüência de aminoácidos, e as
conseqüências que causam no metabolismo celular”.
UMA MUTAÇÃO COM ASSINATURA.
A pesquisa estava desanimada. O DNA na célula humana continha
mais do que 100.000 genes, e cada gen inclue milhares de
nucleotídeo, os construtores dos blocos de DNA, porém somente
alguns poderiam conter traços de danos induzidos pelo sol. Ainda
que pudéssemos identificar mutações em câncer de pele simples,
como poderíamos estar seguros de que o sol os tivesse causado?
Felizmente outras investigações deram pistas úteis para achar que a
luz ultravioleta, radiação beta, de longe era a suspeita de ser o fator
carcinogênico, tendo uma assinatura característica.
Após estudar tudo sobre vírus nas células humanas, pesquisadores
da Suíça, França, Canadae EUA, mostraram que a luz ultravioleta
causava mutações em pontos da cadeia do DNA, que continham
bases de nucleotídeos específicos.
25
Bases são partes variáveis dos nucleotídeos, e levam nomes como
Adenina(A), Guanina(G), Citosina(C) e Timina(T). A luz ultravioleta
cria mutações onde, as bases piramídicas, como a citosina e timina,
permanecem ao lado de outra piramidina.
Cerca de 2 terços dessas mutações são substituições de ( C ) por (T) , e
cerca de 10% destas mudanças ocorrem em duas ( C ) adjacentes, com
ambas bases mudando para duas (T). Estas características de
mutações por ultravioleta constitue a impressão digital de tipos ,
porquê elas não são feitas por outros agentes.
Nós então tivemos a idéia de que tipos de mutações distintas,
poderiam ser resultantes de exposição solar. Mas nós necessitaríamos
de um exato ponto, o qual, no vasto número de genes humanos que
sofreram mutação produzissem um efeito carcinogênico.
Nossa suposição era de que a solução estaria nos genes humanos, já
conhecidos, envolvidos com câncer.
Dos oncogenes conhecidos e genes supressores de tumores, nós
escolhemos examinar um gene supressor de tumor chamado de p53,
o qual é agora conhecido, por estar mutado em mais da metade das
pessoas com câncer. Neste ponto, nós suspeitamos que o p53,
poderia estar envolvido em muitos casos de câncer de pele, devido a
uma intrigante conecção entre um câncer de pele sem melanoma, e
uma
rara
afecção(epidermodisplasia
verruciforme)
que
causava
crescimentos de verrugas na pele.
26
Pesquisas anteriores revelaram que tal crescimento continha DNA do
papiloma vírus humano, e que quando cresciam estavam localizados
em áreas do corpo que sofriam ação da luz solar. Peter M. Howley e
seus colegas no Instituto Nacional do Câncer mostraram que uma
das proteínas produzidas pelo papiloma vírus inativava a proteína
p53, (genes geram as proteínas, e a proteína p53, como era esperado é
produto do gene p53). Então indicações eram de que , o p53 poderia
ter um papel importante no câncer de pele, sem melanoma; mas
necessitávamos de confirmação.
Para encontrarmos uma prova, estudamos outros tipos de câncer de
pele, carcinomas, tumores inquestionavelmente ligados a exposição
solar(que ocorre na face, ou nas mãos, especialmente em pessoas
brancas, residentes nos trópicos). Em colaboração com Jan Potten do
Hospital da Universidade de Uppsala, Suécia, nós descobrimos que
mais de 90% das células cancerosas dos carcinomas, de uma coleção
de amostras coletadas nos EUA, tinham uma mutação em algum
lugar do gene supressor de tumor p53, estas mutações ocorriam em
lugares com bases pirimidicas adjacentes, e elas tinham a
característica de substituição de( C) por (T), padrão associado a
exposição da luz ultravioleta. Nosso grupo de pesquisa, junto com
diversos outros, mais tarde apontou a luz do sol associada as
mutações do p53, em células basais, nos carcinomas(melanoma não
aparece associado com as alterações p53). Pesquisadores ainda estão
estudando melanócitos cancerosos para genes afetados pela luz solar.
27
Após examinar amostras em nosso laboratório, Annemarie Ziegler
achou que pele pré-cancerosa também possuía p53, indicando que a
mudança genética ocorria bem antes do tumor aparecer. Mas estaria
esta
mutação
realmente
causando
o
câncer
de
pele
não
melanomatoso, ou ele era apenas um simples indicador de tempo
vida da exposição solar?
Nós poderíamos excluir esta última possibilidade pelo modo
particular de como o código foi alterado. O nucleotídeo no gene está
arrumado em codons bem definidos - grupos de três bases que
especificam diferentes aminoácidos. A seqüência de codons em um
gen, determina a seqüência de aminoácidos que estão enfileirados
juntos para construir uma proteína. Mas diferentes codons podem
especificar o mesmo aminoácido, como se o nome do aminoácido
pudesse ser soletrado de várias maneiras. Tipicamente um
aminoácido não muda, o primeiro par de bases do codon é constante,
e o terceiro aminoácido varia. Consequentemente, se a mutação p53,
encontrada no câncer de pele for justamente um mero efeito da
exposição solar, nós esperaríamos encontrar mudanças na terceira
posição, em lugar da primeira ou segunda que na verdade ocorre.
Isto é, existiria uma quantidade de exemplos onde o codon
mutado(onde houvesse uma substituição de base), sem alteração do
correspondente aminoácido. Ainda, estudos neste gene em câncer de
pele, por todo o planeta tem consistentemente revelado mutações
que modificam um ou mais aminoácidos na proteína p53. Essas
28
mudanças genéticas para p53, não eram então um simples efeito da
exposição a ultravioleta. Elas eram de fato a causa do câncer de pele.
Para melhor entender como o gen p53 era afetado no câncer de pele
não melanomatoso, nós investigamos se certos segmentos do gen
p53, eram particularmente propensos para a mutação pela luz solar
de bases adjacentes pirimidicas(isto é, Cs por Ts). Biólogos
encontraram os chamados “pontos quente” de mutação(lugares na
cadeia de DNA onde as mutações tendem a ocorrer), a qualquer
momento elas expõe as células vivas para carginogênicas. Após
analisar muitos tumores, nós determinamos que o gen p53 em câncer
de pele não melenomatoso, contém cerca de 9 pontos quentes. Em
casos de câncer não relacionados a exposição solar(como câncer de
cólon ou de bexiga) 5 codons do p53 são na maioria mutados, três dos
quais, estão entre os pontos quentes, no câncer de pele.
Em dois pontos quentes, encontrados somente em, outros tipos de
câncer, o mutante(C ) é flanqueado pelo outro lado, pelo ( G) ou (A),
jamais por (T) ou por outro ( C). Um par de bases pirimidicas
faltantes, eqüivale ao lugar no DNA das células da pele, que estão
protegidas da mutação pela luz ultravioleta.
Há centenas de lugares onde o gen p53 atua com bases pirimidicas
adjacentes. Por que ter apenas alguns lugares atuando como pontos
quentes, quando as células estão expostas a sol? Várias pesquisas têm
recentemente ajudado a responder esta questão, pela construção de
29
uma descoberta feita a mais de três décadas atrás em Oak Ridge
National Lab, por Richard B. Setlow e Willian L. Carrier, que
determinaram que a célula pode reverter os danos causados pelo
ultravioleta no DNA, através de um processo enzimático chamado
excisão
reparadora(amputação
reparadora).
Onde
as
células
simplesmente cortam a parte danificada , extirpando as bases e
repondo-as com bases intactas. Eles mostraram que as células
reparam danos vagarosamente em pares de pirimidinas. Na
seqüência deste trabalho, outros pesquisadores, encontraram as que
células reparadas de p53 em câncer da pele não melanomatoso são
mais lentas, têm metabolismo mais vagaroso, do que outros lugares
no gene. O que parece mostrar que os pontos quentes nascem da
inabilidade da célula em consertar os danos eficientemente.
30
ESTUDO DIRIGIDO
BIOSSÍNTESE DOS AMINOÁCIDOS E DO HEMO.
1-O que se entende por aminoácidos essenciais e não essenciais
nutricionalmente?
R: Os aminoácidos que o homem pode sintetizar são aminoácidos
não essenciais, e os que são fornecidos através da dieta são essenciais.
Os aminoácidos não essenciais são sintetizados a partir dos
intermediários do ciclo do ácido cítrico e outra intermediários
metabólicos comuns, por reações simples. Os aminoácidos essenciais
são sintetizados por caminhos mais complexos.
2-Como pode ser resumido o metabolismo dos aminoácidos?
R: O metabolismo doa aminoácidos não essenciais, efetuado pelo
homem, pode ser feito através do glutamato desidrogenase que
catalisa a aminação redutora do -cetoglutarato para glutamato entre
outros. Já os aminoácidos essenciais apresentam uma via mais
complexa.
3- Como se dá a síntese de alanina a partir do piruvato?
R: Piruvato + glutamato alanina + -cetoglutarato.
31
4- Quais as reações envolvidas pelo glutamato desidrogenase e pelo
glutamato sintetase?
R: O glutamato é percursor de vários aminoácidos não essenciais. A
maioria dos aminoácidos não essenciais derivam de seus -amino,
grupos de glutamato. Para ser sintetizado, o glutamato depende do
-cetoglutarato e NH4+. Esta aminação redutora é catalisada pelo
glutamato desidrogenase, que também pode usar NADH como
redutor. A glutamina é sintetizada por glutamato e NH4+ numa
reação catalisada por glutamina sintetase
5- Como podem ser sintetizados os seguintes -aminoácidos:
R:
a)
Aspartato:
é
sintetizado
a
partir
dos
-cetoácidos
correspondentes por reações de transaminação nas quais o glutamato
é o doador de -amino grupos.
b) Glutamina: é sintetizada a partir do glutamato e NH4+ em reação
catalisada pela glutamina sintetase.
c) Aspargina: é sintetizada da mesma forma que a glutamina.
d) Glicina: é derivada da serina por uma complexa reação catalisada
pela serina transidrometilase.
e) Serina: é sintetizada a partir do 3-fosfoglicerato, onde a primeira
etapa é uma oxidação para 3-fosfohidroxipiruvato; este cetoácido
32
transaminado para 3-fosfoserina, que é então hidrolisada para dar
origem a serina.
6- Quais aminoácidos não essenciais que podem ser obtidas de outros
também não essenciais?
R: São a alanina, aspargina, glutamina, prolina, serina e glicina.
7- Quais aminoácidos não essenciais que podem ser obtidos de outros
essenciais?
R: A tirosina.
8- Quais os aminoácidos essenciais nutricionalmente?
R: São a arginina, histidina, isoleucina, leucina, lisina, fenilalanina,
tronina, triptofano e valina.
9- Como se dá a biossíntese de aminoácidos nutricionalmente essenciais a
partir do aspartato?
R: Oxalacetato + glutamato aspartato + cetoglutarato.
Aspartato + NH4 + ATP asparagina + ADP + Pi + H
10- Como se dá a biossíntese de aminoácidos nutricionalmente essenciais a
partir de intermediário anfibólicos?
R: Os aminoácidos são percursores de uma variedade de
biomoléculas. Porfinas são sintetizadas a partir da glicina e sucinil
CoA,
que
se
condensam
para
dar
-aminolevulinato.
Este
33
intermediário se condensa molécula a molécula para formar
porfobilinogênio. Quatro porfobilinogênio combinam-se para formar
uma tetrapirrola linear que cicliza para formar uroporfirinogênioIII.
Oxidação e modificações da cadeias lateral levam a síntese da
protoporfirinaIX que adquire um átomo de ferro para formar hemo.
-aminolevulinato sintetase, a
enzima que catalisa
a etapa
comprometida da via , é retro-inibida pelo hemo.
34
FOTOSSÍNTESE.
1-Qual é a reação de obtenção da glicose a partir de CO2 e H2O?
R:
luz
H2O + CO2 (CH2O) + O2.
2- Quais as reações que envolvem a fase clara e escura da fotossíntese?
R: As reações na luz geram NADPH e ATP, enquanto as reações no
escuro destas moléculas ricas em energia geram CO2.
3- Explique o aparelho fotossintetizante.
R: Este aparelho recebe o nome de cloroplasto. Eles são constituídos
por um sistema de membrana externa e um complexo de sistemas
intermembranosas. A membrana interna é pregueada para formar os
tilacóides, que contém o pigmento clorofila. Uma pilha destes sacos
constitui um granum. Granas diferentes são unidas por regiões na
membrana chamadas de lamelas, que permitem uma maior absorção
de energia. O estroma é responsável pela fixação de gás carbônico,
produzindo carboidratos.
4-Como se dá a absorção de luz pela clorofila e qual é o processo de conversão
de energia?
R: A primeira etapa da fotossíntese é a absorção de luz por uma
molécula de clorofila. A energia é transferida de uma clorofila para a
outra até que alcance uma clorofila com propriedades especiais em
35
um sítio chamado de centro de reação. A luz é convertida em energia
útil, a cooperação de duas reações luminosas é necessária para a
fotossíntese - fotossistemaI (gerando potencial redutor na forma de
NADPH) - fotossistemaII (rompe a água para produzir O2 e gera um
redutor).
O ATP é produzido quando elétrons fluem através de uma cadeia de
transferência de elétrons que une os dois fotossistemas. O NADPH e
o ATP gerados pela luz são então empregados para reduzir CO2 a
glícidio por uma série de reações no escuro chamada ciclo de Calvin.
A primeira etapa da reação de CO2 com ribulose difosfato para
formar duas moléculas de 3-fosfoglicerato. Hexose é formada a partir
do 3-fosfoglicerato pela via glicogênica, e ribulose difosfato é
regenerada pela ação de transcetolase, aldose e diversas outras
enzimas. Em uma volta do ciclo, 3 ATP e 2 NADPH levam o CO2 ao
nível de hexose fosfato.
5- Quais as características da fosforilação não cíclica e acíclica?
R: O ATP é gerado no retorno de elétrons para o centro de reações
via citocromo b6. Daí este processo ser chamado fosforilação cíclica.
Deste modo o ATP é gerado sem a formação concomitante de
NADPH. O fotossistemaII não participa na fosforilação cíclica, e
portanto o O2 não é formado de H2O durante o processo. A
fosforilação cíclica é operativa. Quando há insuficiência de NADP+
para aceptar elétrons do FRS reduzido ou da ferredoxina reduzida.
36
Essa condição existe quando a relação de NADPH para NADP+ é
alta. A não cíclica é aquela que não envolve todos esses processos e a
redução de NADPH para NADP+ não é alta.
6- Como ocorre a regulação da fotossíntese?
R: Ela é regulada pela intensidade da luz, porém quando intensa com
baixa temperatura, apresenta a taxa fotossintética limitada pela fase
não luminosa.
7-O que se entende por fotorespiração?
R: É a liberação dos carbonos na forma de CO2, que ocorre
metabolicamente e funcionalmente relacionado com a fotossíntese,
sendo que é regulada de acordo com a intensidade luminosa além da
taxa de oxigênio encontrada no ar.
37
BIOSSÍNTESE E METABOLISMO DE ÁCIDOS GRAXOS.
1- Como são armazenados os lipídeos?
R: Os lipídeos são armazenados na forma de triacilglicerol(ésteres de
glicerol sem carga). Nos mamíferos, a maior quantidade de
triacilglicerídeos é encontrada nas células do tecido adiposo. Essas
células são especializadas para a síntese e armazenamento de
triacilglicerídeos, e também para a mobilização em ATP.
2- Quais as etapas de degradação dos trigliceróis?
R: Os ácidos graxos são degradados por oxidação no carbono .
3- Qual é o destino do glicerol obtido a partir do s trigliceróis?
R: O glicerol penetra na célula adiposa, recombinando-se para formar
novas moléculas de gordura neutra. Os lipídeos levam a liberação do
glicerol, que passa para o sangue, e devido a sua grande solubilidade
no plasma, é captado pelo fígado e reaproveitado.
4- Mostre o destino dos lipídeos na dieta. Qual é a rota de um ácido graxo no
metabolismo?
R: O início da utilização das gorduras como fonte de energia é a
hidrólise dos triglicerídeos pela lipase. A sua atividade é regulada
por hormônios. A adrenalina, noradrenalina, glucagon e ACTH
estimulam a adenilciclase das células adiposas. O nível aumentado
do AMP-cíclico estimula uma proteína cinase que ativa a lipase,
38
fosforilando-a. Assim esses hormônios causam a lipólise. Em
contraste, a insulina inibe a adenil ciclase e assim causa a lipólise.
Sendo assim o AMP-cíclico é um segundo mensageiro na regulação
da lipólise.
5- Como se dá a ativação dos ácidos graxos livres, e qual o papel da
carnitina, na oxidação do mesmo?
R: Os ácidos graxos são oxidados nas mitocôndrias e são
previamente ativas antes de suas entradas na matriz mitocondrial. O
ATP dirige a formação de uma ligação tioéster entre o grupo
carboxila de um ácido graxo e o grupo sulfidrila da CoA . Esta
ativação ocorre na membrana externa da mitocôndria.
A carnitina funciona como carreador de moléculas de acetil CoA de
cadeia longa que não atravessam rapidamente a membrana da
mitocôndria, sendo necessário um mecanismo de transporte especial.
6- Onde ocorre a Beta oxidação? Quem faz o transporte dos ácidos graxos
até esse sítio?
R: A Beta oxidação ocorre na matriz mitocondrial. e os ácidos graxos
São carregados através da membrana mitocondrial interna pela
carnitina. O grupo acila é transferido do átomo de enxofre da CoA
para o grupo hidroxila da carnitina para formar a acil carnitina, que
se difunde através da membrana mitocondrial.
7- Como ocorre o metabolismo dos ácidos graxos insaturados?
39
R: O metabolismo ocorre a partir de duas enzimas adicionais
(isomerase e epimerase) , que são necessárias para a degradação.
8- Mostre através de reações como ocorre a oxidação completa do palmitato.
R: Cn acil CoA + FAD + NAD + H2O + CoA Cn-2acil CoA +
FADH2 + NADH + acetil CoA + H+.
Palmitol CoA + 7FAD + 7NAD + 7CoA + 7H2O 8 acetil CoA +
7FADH2 + 7NADPH + 7H+.
9- Como ocorre a biossíntese dos ácidos graxos? O caminho para a
biossíntese é o mesmo para a degradação?
R: A síntese ocorre no citosol; os intermediários da síntese dos ácidos
graxos são convalentemente ligados aos grupos sulfidrilas de uma
proteína carregadora de acila(ACP). Muitas enzimas da síntese dos
ácidos graxos nos organismos superiores são estruturadas em um
complexo multienzimático; o crescimento da cadeia se faz por
alongamento pela adição seqüencial de unidades de dois carbonos
derivados da acetil CoA, e o redutor na síntese é o NADH. A síntese
dos ácidos graxos ocorre por vias diferentes da degradação.
10- Qual é a etapa comprometida na síntese dos ácidos graxos?
R: A etapa comprometida é a de formação de manolil coenzima.
11- Como se dá o prolongamento da cadeia de um ácido graxo?
40
R: A fase de alongamento de síntese de ácidos graxos inicia-se com a
formação de acetil ACP e manolil ACP. A acetil transacilase e melonil
transacilase catalisam essas reações. A acetil ACP e manolil ACP
reagem para formar acetoacil ACP. Esta condensação é catalisada
pela acetil ACP. Na reação de condensação forma-se unidades com
quatro átomos de carbonos, a partir de uma unidade de 2 e outra de
3 carbonos, liberando CO2. As próximas três etapas na síntese de
ácidos graxos reduzem o ceto grupo da posição C3 para metileno
grupo. Essas três últimas reações convertem a auto acetil ACP em
buritil ACP, que completa o primeiro ciclo de crescimento. Na
segunda volta da síntese do ácido graxo, a buritil ACP condensa-se
com a manolil ACP para formar C-6-Beta-cetoacil-ACP na C6 acilACP, que está pronta para a terceira volta de crescimento. Os ciclos
de crescimento continuam até que a C-16-acil-ACP seja formada.
Então é hidrolizada para produzir palmitato e ACP.
41
METABOLISMO DO GLICOGÊNIO.
1- Como ocorre a regulação do metabolismo do glicogênio?
R: O equilíbrio das quatros reações abaixo favorece grandemente a
síntese do glicogênio:
ATP + D-glicose D-glicose 6-fosfato + ADP.
glicose 6-fosfato glicose 1-fosfato.
UDP + glicose 1-fosfato UDP-glicose + PP.
UDP-glicose + glicose UDP + glicose.
A glicose 6-fosfato é isomerizada a glicose 1-fosfato e daí forma
glicogênio e fosfato inorgânico.
A fosforilase, a forma ativa que contém resíduos de serina essenciais
fosforilados é desfosforilada pela fosforilase fosfatase, produzindo a
fosforilase b, a forma relativamente inativa, que pode ser estimulada
pelo AMP, seu modulador alostérico. A glicogênio sintetase também
ocorre em formas fosforiladas e desfosforiladas, mas é regulada de
maneira recíproca com a fosforilase. Em sua forma ativa, a glicogênio
sintetase a é convertida em sua forma menos ativa , a glicogênio
sintetase b.
42
A glicogênio fosforilase e a glicogênio sintetase são portanto,
reciprocamente reguladas; quando uma é estimulada a outra é
inibida.
2- Quais são as enzimas chaves no metabolismo do glicogênio?
R: Participam do metabolismo do glicogênio a glicoquinase, que
forma a glicose 6-fosfato; a fosfoglicomutase, que forma glicose 1fosfato; a uritil transferase, que transfere a UDP para a glicose 1fosfato, formando UDP-glicose e a transglicosidade, transfere
resíduos de glicose da posição 1-4 para a posição 1-6, ramificando a
cadeia.
3-O que se entende por glicogenólise?
R: É a degradação do glicogênio, pela estimulação da adrenalina,
através de uma cascata de amplificações. Tal cascata é idêntica no
fígado e músculos esqueléticos. Como os músculos não possuem
glicose 6-fosfato, eles não produzem glicose sangüínea. Em vez disso,
a formação aumentada de glicose 6-fosfato no músculo leva a uma
taxa aumentada da glicólise até lactato. Na realidade, a glicogenólise
é a forma de armazenamento do glicogênio.
43