SETOR DE CIÊNCIAS EXAT AS E NATURAIS
DEPART AMENTO DE QUÍMICA
QUÍMICA GERAL e ANALÍTICA
Curso: Farmácia
Professores Responsáveis: Patrícia Los Weinert
Wilson Costa
Ponta Grossa
2014
Instruções Gerais
Manuseio de Sólidos
Para retirar um sólido, na forma de pó ou grânulos, de um frasco é utilizada uma espátula cuidadosamente
limpa, para evitar contaminações. Se o frasco tiver uma boca estreita, impossibilitando a introdução de uma espátula,
deve ser feita em primeiro lugar, uma transferência do sólido para um pedaço de papel ou para um recipiente de
vidro. Após o uso, feche bem o frasco para evitar a contaminação do reagente através da entrada de poeira ou do
aumento da umidade.
Manuseio de Líquidos
Quando retirar líquidos de um frasco, algumas precauções devem ser tomadas:
- ao transferir um líquido, evite que o mesmo escorra externamente, danificando o rótulo de identificação, impedindo
assim, a leitura do nome da substância;
- antes de derramar um líquido, incline o frasco de modo a molhar o gargalo, o que evitará que o líquido escoe
bruscamente.
- ao verter líquidos em um recipiente utilize um funil ou um bastão de vidro pelo qual o líquido escorrerá;
- em nenhuma circunstância coloque bastões de vidro, pipetas ou quaisquer outros materiais dentro de frascos de
reagentes. Para pipetar, transfira uma porção do líquido para um frasco limpo e seco, e a partir deste efetue a
operação;
- não retorne líquido não utilizado ao frasco de reagente. Retire o mínimo necessário e o excesso coloque em um
frasco separado para futuros usos ou para ser recuperado;
- não coloque líquidos aquecidos dentro de frascos volumétricos, pois o processo de expansão/contração, devido ao
aquecimento seguido de resfriamento, altera a calibração desses frascos.
Aquecimento de Substâncias
Os utensílios mais comuns utilizados no aquecimento de substâncias são: bico de Bunsen, chapa
aquecedora e manta aquecedora. Alguns cuidados gerais devem ser observados quando da realização de
aquecimento de substâncias:
- Não utilize uma chama para aquecer substâncias inflamáveis;
- Não aqueça substâncias em frascos volumétricos;
- Não aqueça substâncias em recipientes totalmente fechados;
- Iniciar sempre o aquecimento de forma branda, intensificando-o depois de alguns segundos;
- Ao aquecer líquidos em tubos de ensaio, não aqueça o fundo do tubo. Posicione a chama na altura do nível do
líquido. Use uma pinça de madeira ou de papel para segurar o tubo. Durante o aquecimento o líquido deve estar em
constante agitação. Não volte a boca do tubo de ensaio em sua direção ou na direção de seus companheiros;
- Terminado o uso do gás, verifique se todos os registros estão devidamente fechados, evitando assim o perigo de
escape.
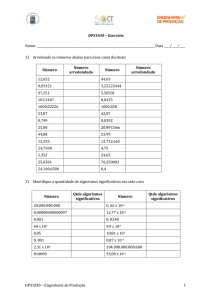
Avaliação dos resultados - Algarismos significativos
Todas as medidas de uma propriedade físico-química estão afetadas por uma incerteza, chamada em geral
erro, desvio ou imprecisão da medida. Por isso, os resultados das medidas devem ser expressos de modo tal que se
possa avaliar a precisão com que elas foram feitas (ou calculadas). Portanto, o número que representa a medida de
uma propriedade não pode ter uma quantidade qualquer de algarismos, ele deve conter apenas algarismos que
representem realmente a precisão com que a medida foi feita, ou seja, todos os algarismos devem ter um significado.
Introduzimos assim o conceito de algarismos significativos, procurando indicar que nem todos os algarismos que
aparecem na representação de uma medida ou no resultado de uma operação matemática tem significado científico.
Quando escrevemos 6,41mL dizemos que a imprecisão (a dúvida da medida de volume) está no último
algarismo "1". É errado escrever que 6,41 mL = 6,410 mL, pois neste último caso a dúvida está no milésimo de
centímetro e não em centésimo como no primeiro caso.
A situação se complica um pouco se aparecem zeros no início ou no fim do número. Os zeros que aparecem
no início não são significativos pois indicam simplesmente a posição da vírgula. Assim, 0,003702 e 0,3702 têm o
mesmo número de algarismos significativos (4): 3, 7, 0 e 2. Às vezes (não é sempre), os zeros que aparecem
como últimas cifras indicam apenas a ordem de grandeza. Por exemplo, 74000 poderia ter apenas dois algarismos
significativos (7 e 4) e os três zeros indicam o milhar. Ou então, temos de fato cinco algarismos significativos:
7, 4, 0, 0 e 0.
3
Para evitar confusões, costuma-se escrever o número em potências de 10: 74x10 significa que temos dois
algarismos significativos. Se os algarismos significativos fossem cinco, dever-se-ia escrever: 74000. O uso de
potência de 10 é indispensável quando tratamos com grandezas muito pequenas ou muito grandes:
23
-34
6,022x10 , 6,63x10 j.s. etc. Portanto, quando se escreve um número em potência de 10, o primeiro fator deve
indicar os algarismos significativos e o segundo nos diz de quantos zeros se deve deslocar a vírgula.
Para se saber quantos algarismos significativos existem em um número que expressa a medida de uma
propriedade, deve-se proceder assim:
i. O algarismo que fica mais à esquerda, diferente de zero, é o mais significativo,
ii. Se não há vírgula, o algarismo que fica mais à direita, diferente de zero, é o algarismo menos significativo,
iii. Se há vírgula, o último algarismo da direita é o menos significativo, mesmo que ele seja zero,
iv. Todos os algarismos entre o mais e o menos significativo são significativos.
Durante os cálculos, pode-se trabalhar com um algarismo a mais, mas ao se apresentar o resultado final,
deve-se usar o número correto de algarismos significativos, obedecendo às seguintes regras:
-se o algarismo a ser cortado for maior que 5, soma-se 1 ao algarismo anterior,
-se o algarismo a ser cortado for menor que 5, o algarismo anterior mantém-se inalterado,
-se o algarismo a ser cortado for igual a 5, soma-se 1 ao anterior se ele for ímpar, mantendo-o inalterado se for par.
Exemplo 1- Medida de volume em proveta
Se ao medir o volume de uma amostra líquida numa proveta de 25 mL, cuja menor divisão é 0,1 mL, encontrou-se o
valor 17,24 mL, este resultado tem quatro algarismos significativos (os dígitos um, sete e dois são conhecidos com
certeza e o quatro é o algarismo duvidoso, aquele que foi estimado). O algarismo duvidoso sempre está na casa
decimal em que está o limite de erro de aparelho de medida utilizado. Como o limite de erro de uma proveta
corresponde à metade de sua menor divisão, no caso da proveta acima mencionada, este limite é de 0,05 mL; por
isso que no valor 17,24 mL o dígito 4 corresponde ao algarismo duvidoso. Portanto:
· Menor divisão da escala da proveta = 0,1 mL
· Limite de erro da proveta = metade de sua menor divisão = 0,1/2 = 0,05
· Representação do valor obtido: (17,24, + 0,05) mL
Exemplo 2- Medida de massa em balança com fundo de escala de 0,001g
Já no caso de um valor de massa igual a 7,241 g, medido numa balança cujo fundo de escala é 0,001 g (para
balanças, o limite de erro é igual à menor divisão), os dígitos sete, dois e quatro são conhecidos com certeza e o um
é o algarismo duvidoso. Portanto:
· Menor divisão da escala dessa balança = 0,001 g
· Limite de erros em balanças = menor divisão de escala = 0,001 g
· Representação do valor obtido = (7,241 + 0,001) g
Exemplo 3- Medida de massa em balança com sensibilidade de 0,01 g
O valor 2,54 g é obtido numa balança cuja sensibilidade é 0,01g, o que significa que a massa medida está
compreendida entre 2,53 g - 2,55 g. Os algarismos 2 e 5 são conhecidos com certeza, enquanto que o 4 é duvidoso;
o número 2,54 tem, portanto, 3 algarismos significativos e o resultado da medida deve ser expresso por (2,54 + 0,01)
g. É errado colocar quaisquer outros algarismos depois do 4, mesmo que sejam zeros.
Exemplo 4- Medida de massa em balança com sensibilidade de 0,0001 g
A obtenção de uma massa no valor de 2,5400 g significa que a massa está compreendida entre 2,5399 2,5401 g. O número 2,5400 tem 5 algarismos significativos sendo que o último zero é o duvidoso. O resultado da
medida deve ser expresso por (2,5400 + 0,0001) g. Quando você exprimir o resultado de uma medida, você deve
preocupar-se, fundamentalmente, com o número de cifras do mesmo; para que o resultado seja correto ele deve
conter todos os algarismos acerca dos quais você tem certeza e o primeiro duvidoso (e, somente ele). Esses
algarismos são denominados algarismos significativos porque são aqueles que possuem valor prático ou
significativo na expressão do resultado. Lembre-se que números matematicamente iguais podem ser diferentes
quando exprimem uma medida; por exemplo, os números 2,54 e 2,5400 são iguais matematicamente, mas são
bastante diferentes quando representam os resultados de uma medida, como, por exemplo, a massa de um corpo:
2,54g ¹ 2,5400g, conforme mostrado nos exemplos 3 e 4.
· Atenção aos zeros finais dos números
Deve-se prestar atenção especial aos zeros dos números.
Regra 1: “Se à esquerda de um número só houver zeros, estes zeros não são algarismos significativos.”
Regra 2: Os zeros colocados à direita dos números deverão ser colocados se forem significativos ou DEVERÃO SER
OMITIDOS se não forem significativos. Para indicar com clareza se o último zero é ou não significativo, o número
deve ser escrito sob a forma:
b
a . 10 onde 1 ≤ a < 10
Frequentemente, é difícil decidir qual o número de algarismos significativos em valores que contêm muitos
zeros, por exemplo, em um volume igual a “500 mL” ou em uma massa igual a “200 g”. Nestes casos a decisão deve
ser tomada levando-se em conta o limite de erro do aparelho utilizado. Assim, um volume de “500 mL” deve ser
expresso como:
2
a) 500,0 mL – 5,000x10 mL, se a menor divisão da proveta utilizada for 1 mL;
2
b) 500 mL=5,00x10 mL, se a menor divisão da proveta utilizada for 10 mL.
Já uma massa de “200 g” deve ser expressa como:
a) 200,00 g, se o fundo de escala da balança for centigrama, isto é, 0,01g;
b) 200,0 g, se o fundo de escala da balança for decigrama, isto é 0,1 g;
c) 200 g, se o fundo de escala for grama.
Nos casos acima, os valores de volume e massa expressos têm os seguintes significados: 500,0 + 0,5 mL,
500 + 5 mL, 200,00 ± 0,01g, 200,0 ± 0,1g e 200 ± 1g, respectivamente. Note-se que, em todos os casos, o algarismo
duvidoso (o último algarismo) está na mesma casa decimal que o limite de erro.
· Operações com Algarismos Significativos
a) Adição e Subtração
O resultado de uma soma ou de uma subtração deve ser relatado com o mesmo número de casas decimais
que o termo com o menor número de casas decimais. Por exemplo, os resultados das seguintes operações de soma
e subtração.
b) Multiplicação e Divisão
O resultado de uma multiplicação ou de uma divisão deve ser arredondado para o mesmo número de
algarismos significativos que o do termo com menor número de algarismos significativos. Por exemplo, os resultados
das seguintes operações de multiplicação e divisão:
c) Várias Operações
Quando um cálculo envolver mais de uma operação, após a realização de cada operação, pode-se ou não
efetuar o arredondamento para o devido número de algarismos significativos. Pode-se optar, também, por efetuar
arredondamento ao final de todas as operações, quando envolver apenas multiplicação e divisão.
13,428 x (6,2/90,14356) = 13,428 x 0,069 = 0,93
ou
13,428 x (6,2/990,14356) = 0,923566... = 0,92
Prática 1. Estudos de hidratos
1. Objetivos
Compreender os conceitos de hidratação; Aprender as técnicas de determinação do número de moléculas de
água de hidratação de um sólido; Compreender a importância da umidade na estabilidade, qualidade e composição
dos compostos; Aprender como armazenar corretamente substâncias químicas higroscópicas.
2. Princípios básicos
Quando soluções aquosas de sais solúveis são evaporadas, o sal separa-se sob a forma de cristais. Tais
cristais podem conter quantidades não estequiométricas de água adsorvida na superfície do cristal ou
mecanicamente ligada a rede cristalina. Entretanto, muitas vezes, esses cristais contêm quantidades
estequiométricas de água que estão quimicamente ligadas. Tais compostos são conhecidos como hidratos e a água
é designada como hidratação.
A formação de hidratos não é específica para sais nem para cristais, é um fenômeno geral. Muitos hidratos
são estáveis à temperatura ambiente e sob condições atmosféricas, outros não. Se o hidrato perde água para a
atmosfera, é chamado de eflorescente. Se a substância remove umidade da atmosfera, é dita higroscópica, e se a
substância se dissolve ao absorver a umidade, é chamada deliquescente. Os sais desidratados são, frequentemente,
higroscópicos e devem ser mantidos isolados da atmosfera depois de secos, a fim de evitar absorção de umidade.
Compostos que não são estáveis ao aquecimento devem ser secos sob vácuo ou expondo-os a uma
atmosfera seca, de um dessecador, contendo um agente dessecante forte, como pentóxido de fósforo ou ácido
sulfúrico concentrado.
Sais hidratados têm pressão de vapor da água ou de líquidos orgânicos. A pressão de vapor dos hidratos
depende da estabilidade do composto em particular e da temperatura. Quando a pressão parcial de vapor de água na
atmosfera for maior que a pressão do CaCl2.4 H2O, o hidrato absorverá água e o composto CaCl2.6 H2O será
formado. Se a pressão real de vapor de água for menor que a pressão de vapor do CaCl 2.4 H2O, este perderá água
para a atmosfera. No ar a 25º.C, com umidade relativa de 30%, a pressão parcial do vapor de água é 7,1 mmHg
(23,8 x 0,30 = 7,1 mm). Desde que a pressão de vapor do CaCl2.4 H2O a 25º.C é 33,5 mmHg, o hidrato absorverá
água.
Formas de água em sólidos
Uma enorme variedade de substâncias sólidas encontradas na natureza contém água ou os elementos que a
formam. A quantidade de água nos sólidos é variável e depende da umidade e temperatura do ambiente e do seu
estado de subdivisão.
A distinção entre os vários modos pêlos quais a água pode ser retida por um sólido é de muita importância,
pois não necessariamente ela será retida por um mesmo tipo de ligação. Por exemplo, o Ca(OH)2 pode possuir água
adsorvida em sua superfície (água de adsorção), como também produzir água ao se decompor sob ação do calor
(água de constituição).
Basicamente, os sólidos podem conter dois tipos de água: a Não-Essencial e a Essencial.
a) Água Não-Essencial
A caracterização química do sólido independe deste tipo de água. Devem ser consideradas, neste grupo, os
seguintes casos:
Água de adsorção
É a água retida sobre a superfície dos sólidos, quando estes estão em contato com um ambiente úmido. A
quantidade de água adsorvida dependerá da temperatura e da superfície específica do sólido. Quanto mais
finamente dividido este se apresentar, maior será a sua área específica exposta ao ambiente e, conseqüentemente,
maior será a quantidade de água adsorvida. Esta, por sua vez, estará em equilíbrio com o ambiente.
A quantidade deste tipo de água no sólido aumenta com o aumento da pressão de vapor da água no
ambiente e diminui com o aumento da temperatura.
Calor + H2O (ads) ↔ H2O (vapor)
A determinação quantitativa da água adsorvida é feita pelo aquecimento do sólido, em estufa, a 105-110°C,
até peso constante. Este é um fenômeno geral observado em todos os sólidos, em maior ou menor proporção.
Água de absorção
Ocorre em várias substâncias coloidais, tais como amido, proteínas, carvão ativo e sílica-gel. Ao contrário do
que ocorre com a água de adsorção, a quantidade de água absorvida é muito grande nestes sólidos, podendo, em
alguns casos, atingir 20% (m/m) ou mais do peso total do sólido.
Ela está retida como uma fase condensada nos interstícios ou capilares do colóide, e por esta razão os
sólidos que a contêm apresentam-se como perfeitamente secos.
Água de oclusão
Apresenta-se retida nas cavidades microscópicas distribuídas irregularmente nos sólidos cristalinos, e não
está em equilíbrio com a atmosfera ambiente. Por este motivo a sua quantidade é insensível às mudanças de
umidade no ambiente.
Quando um sólido que contém água de oclusão é aquecido, ocorre uma difusão lenta das moléculas de água
até a sua superfície, onde se verifica o fenômeno da evaporação. Necessariamente uma temperatura maior que
100°C é requerida para que este processo se dê com uma velocidade apreciável.
Durante o aquecimento, a volatilização da água ocluída provoca a ruptura dos cristais, fenômeno este
chamado de decrepitação. Quando isto ocorre, deve-se precaver contra perdas de material.
b) Água Essencial
É a água existente como parte integral da composição molecular ou da estrutura cristalina de um sólido.
Os subgrupos deste tipo de água são:
Água de constituição
Neste caso, a água não está presente como H2O no sólido, mas é formada quando este se decompõe pela
ação do calor. O importante a se notar é que a relação estequiométrica de 2:1 entre hidrogênio e oxigênio nestes
compostos não precisa ser necessariamente observada.
Algumas vezes necessita-se de temperaturas relativamente-altas para causar a decomposição dos sólidos
que contêm este tipo de água.
Exemplos:
2 NaHCO3(s)
Ca(OH)2(s)
2 Fe(OH)3(s)
300 C
→
800 C
→
1000 C
Na2CO3(s) + H2O(g) + CO2(g)
CaO(s) + H2O
→
Fe2O3(s) + 3 H2O(g)
Água de hidratação
Ocorre em vários sólidos, formando os hidratos cristalinos (compostos que contem água de cristalização).
A água está ligada a estes sólidos mediante ligações de coordenação covalentes, que são normalmente mais
fracas que as eletrostáticas. Por esta razão, a água de cristalização é facilmente eliminada destes compostos pela
ação do calor.
A quantidade de água de hidratação (ou de cristalização) num hidrato cristalino é uma característica do sólido
e sempre se apresenta com estequiometria definida.
Alguns hidratos cristalinos podem perder água de cristalização quando mantidos em ambiente
completamente seco (fenômeno de eflorescência dos cristais), enquanto que, outros podem retirar água de um
ambiente úmido (fenômeno de deliquescência dos cristais).
Como exemplos típicos de cristais hidratados citam-se BaCl2.2H2O, CuSO4.5H2O, Na2SO4.10H2O,
CaSO4.2H2O, CaC2O4.2H2O, etc.
3. Materiais necessários
CuSO4.5 H2O
Na2SO4.n H2O
BaCl2.n H2O
Tubos de ensaio
cadinhos de porcelana balança semi-analítica dessecador
Bico de gás
pinça para tubo de ensaio
sacarose
4. Procedimento experimental
ASPECTOS QUALITATIVOS
1. Colocar cerca de 0,2 g de CuSO4.5 H2O em um tubo de ensaio. Aquecer suavemente em uma chama, mantendo a
extremidade superior do tubo de ensaio relativamente resfriada. Observar a aparência do sólido antes e depois do
aquecimento, bem como a parte superior do tubo de ensaio. Depois de frio, adicionar algumas gotas de água ao
sólido. Anotar as observações.
2. Repetir o procedimento do item anterior com Na2SO4.n H2O e sacarose.
3. Examinar diversos sólidos expostos no laboratório (cores, água absorvida, aspectos em geral, etc...).
ASPECTOS QUANTITATIVOS
1. Pesar um cadinho de porcelana, limpo e seco, em balança semi-analítica, tomando o cuidado de não tocar com as
mãos. Anotar o peso.
2. Pesar cerca de 1 g de BaCl2.n H2O diretamente no cadinho. Anotar o peso.
3. Aquecer o cadinho com BaCl2.n H2O por 15 minutos em chama não-luminosa.
4. Colocar o cadinho com BaCl2 em dessecador por 15 minutos. Pesar novamente.
5. Repetir o procedimento dos itens 3 e 4 até peso constante.
6. Calcular o n° de moléculas de água de hidratação do BaCl2.n H2O.
Responda as seguintes questões:
1. Como um hidrato deve ser guardado após ter sido desidratado?
2. Aspectos qualitativos, discutir:
a) a que se deve a mudança de cor do CuSO4.5 H2O após aquecimento e depois da adição de 1 gota de
água?
b) qual pode ser a razão da mudança de cor e do aspecto da sacarose após aquecimento?
c) qual a razão das substâncias expostas no laboratório mudarem de aspecto físico?
3. Aspectos quantitativos, discutir:
a) por que ocorre variação de massa do cadinho antes e após o aquecimento? Por que é necessário um
cadinho limpo e seco?
b) determinar a massa de água perdida; a % em peso da água no sal hidratado; a fórmula do sal e calcular o
erro em % em função do número de moléculas de água descrito no rótulo do produto.
4. A presença de uma impureza volátil no BaCl2.n H2O poderia afetar os resultados? De que maneira?
5. Por que não devemos pegar o cadinho diretamente com as mãos quando o mesmo será utilizado para a
determinação gravimétrica?
6. Por que devemos aquecer a substância até peso constante?
5. Referências bibliográficas
- SILVA, R.R; BOCCHI, N.; ROCHA FILHO, R.C. Introdução à Química Experimental. São Paulo: McGraw-Hill, 1990,
p. 127-137 e 170-176.
- GIESBRECHT, E. (coord.), Experiências de Química: Técnicas e Conceitos Básicos, PEQ - Projetos de Ensino de
Química,
São Paulo: Ed. Moderna, 1982, p. 43-45.
RUSSEL, J. B. Química geral. São Paulo, Makron Books, 1982.