HISTÓRICO
TEORIA DA FORÇA VITAL
- Bergman - 1777 - 1ª separação da
- Berzelius: os compostos orgânicos
necessitam de uma “força maior”, a
vida, para serem sintetizados.
Química - Química Inorgânica: compostos
extraídos dos minerais.
- Química Orgânica: compostos
extraídos dos organismos vivos.
1
2
QUEDA DA TEORIA DA FORÇA
VITAL
Cianato de Amônio
- Wöhler - 1828: sintetiza em
laboratório a uréia, encontrada no
suor e urina dos animais, pelo
aquecimento de um composto
inorgânico extraído de minerais, o
cianato de amônio.
3
5
NH4CNO
Uréia
∆
Inorgânico
O C
NH2
NH2
Orgâncio
4
Definição Atual
Relembrando:
- Química Orgânica: é a parte da
química que estuda todos os
compostos do Carbono.
Ligação σ: Orbitais atômicos que se
aproximam ao longo de um mesmo eixo
- Química Inorgânica: é a parte da
química que estuda os compostos
dos outros elementos.
H; Z = 1
Exemplo:
Distribuição eletrônica: 1s1
6
1
Relembrando:
H H
Ligação π: Orbitais atômicos que se
aproximam ao longo de eixos paralelos
H—H
H2
Exemplo:
O; Z = 8
Distribuição eletrônica: 1s2 2s2 2p4
1s2
7
px
2s2
O
π
OσO
O=O
py
O2
py
π
π
O
pz
O
σ
pz
σ
9
10
PRINCÍPIOS BÁSICOS
Relembrando:
O CARBONO É TETRAVALENTE
C
Ex:
Metano
Z=6
Distribuição eletrônica:
H
11
pz
2p4
8
O
py
1s2 2s2 2p2
C H
H
H
12
2
Representação em orbitais
1s2
2s2
1s2
2p2
2s2
px
py
pz
2p2
ou
Ex: Monóxido de Carbono
1s2
2s2
px
13
py
2p2
pz
C
O
14
Representação em diagrama de energias
E
Carbono no estado excitado
E
2p
2s
s
px
py
pz
1s
15
Estado Excitado
Estado Excitado
16
Carbono sp3
E
s
Ligação
sp3
sp3
sp3
σ
H
sp3
sp3
sp3
sp3
C
H
H
s
s
sp3
17
Estado Híbrido
18
H s
Carbono sp3
3
H
Metano
4 ligações
simples
C H
H
H
Carbono sp3
19
C
Carbono sp3
20
4 ligações σ.
Ângulo entre
as ligações
Aqui
σ:
σ: s-sp3
s-sp3
σ:
C
s-sp3
109º28’
σ: s-sp3
σ: s-sp3
Carbono sp3
21
Forma espacial
tetraédrica
Carbono sp3
22
Forma espacial
tetraédrica
C
23
C
C
Carbono sp3
24
Carbono sp3
4
Carbono no estado excitado
H
Metano
E
σ: s-sp3
109º28’
C H
H
H
σ: s-sp3
σ: s-sp3
25
s
px
py
pz
σ: s-sp3
Carbono sp3
Estado Excitado
26
Carbono sp2
pz
E
sp2 sp2 sp2
pz
sH
sp2
sp2
sH
29
pz
Estado Híbrido
27
π
sp2
Carbono sp2
28
Eteno ou etileno
H
Hs
sp2
C
σ
sp2
sp2
pz
sp2
C
sp2
C
sp2
H
Hs
Carbono sp2
H
30
C
H
Carbono sp2
5
1 ligação π
3 ligações σ
1 ligação dupla
σ: s-sp2
2 ligações simples
C
C
π: p-p
σ: sp2-sp2
σ: s-sp2
Carbono sp2
31
Ângulo entre
as ligações
Carbono sp2
32
Forma espacial
trigonal planar
120º
120º
C
C
120º
Carbono sp2
33
Carbono no estado excitado
Carbono sp
E
E
s
35
Carbono sp2
34
px
Estado Excitado
py
pz
sp
36
sp
py
pz
Estado Híbrido
6
py
py
pz
sp
π
sp
H
s
Carbono sp
37
π
py
pz
sp
sp
C
sp
sp
σ
C
Hs
Carbono sp
38
1 ligação tripla
Etino ou acetileno
H
pz
C
C
C
H
1 ligação simples
Carbono sp
39
2 ligações π
σ: s-sp
C
Carbono sp
40
Ângulo entre
as ligações
π: p-p
π: p-p
σ: sp-sp
C
180º
2 ligações σ
41
Carbono sp
42
Carbono sp
7
Forma espacial linear
Existe outra possibilidade para o Carbono sp:
Tomemos por exemplo o O: Z = 8
1s2 2s2 2p4
C
1s2
2s2
px
py
pz
2p4
Carbono sp
43
π
py
pz
O
σ
py
π
pz
sp
sp
σ
C
pz
C
O
C
Carbono sp
46
Ângulo entre
as ligações
2 ligações π
π: p-p
σ: p-sp
2 ligações duplas
py
Carbono sp
45
Carbono sp
44
π: p-p
σ: p-sp
C
180º
2 ligações σ
47
Carbono sp
48
Carbono sp
8
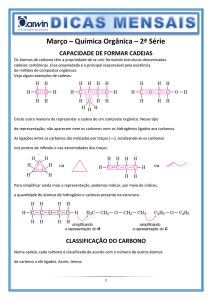
O CARBONO FORMA CADEIAS
Forma espacial linear
Os átomos de carbono são capazes de se
ligarem entre si, através de ligações sucessivas
formando, desde cadeias pequenas e lineares
até cadeias muito longas contendo muitas
ramificações.
C
C
C
C
C
C
C
C
C
C
C
C
Carbono sp
49
CLASSIFICAÇÃO DOS CARBONOS
Os carbonos podem ser classificados de
acordo como o nº de carbonos a que estão
ligados, podendo ser:
50
Está ligado a no máximo 1 outro átomo de C.
H
H
C
P
H
H
metano
P
H2C
P
P
CH2
H3C
eteno ou
etileno
O
P
C
OH
ácido etanóico ou
ácido acétíco
52
Carbono Secundário (S)
Carbono Terciário (T)
Está ligado a 2 outros átomos de C.
P
H3C
S
CH2
P
CH3
propano
P
H3C S
CH OH
H3CP
53
C
Carbono Primário (P)
• Carbono Primário (P);
• Carbono Secundário (S);
• Carbono Terciário (T);
• Carbono Quaternário(Q).
51
C
C
Está ligado a 3 outros átomos de C.
P
S
S
P
H2C
C
CH
CH2
P
CH3
Cl
2-cloro-1,3-butadieno
ou 2-cloro-but-1,3-dieno
ou cloropreno ou neopreno
P CH P
H3C T CH3
2-metilpropano
ou
isobutano
2-propanol ou propan-2-ol
álcool isopropílico
P
T
S
P
H2C
C
CH
CH2
P
CH3
2-metil-1,3-butadieno
ou 2-metil-but-1,3-dieno
ou isopreno
54
9
Simplificação das Fórmulas Estruturais
Carbono Quaternário (Q)
Está ligado a 4 outros átomos de C.
As fórmulas estruturais podem ser escritas
de muitas maneiras, algumas não levam
em consideração a geometria da molécula,
outras, tentam refletir a geometria das
várias ligações entre os átomos que
compõem a molécula.
P
CH3
P
H3C
C
Q
P
CH3
CH3
P
2,2-dimetilpropano
55
56
Butano - C4H10
H
H H H H
H C
C
C
H
C H
H
H H H H
H3C
CH2
CH2
C
H
CH3
C
H
C
H
H
C
H
Ciclobutano - C4H8
H
H
CH3CH2CH2CH3
H3C
CH2 CH2 CH3
CH2
H2C
CH2
Cl
CH2
CH2
Cl
58
Etóxi-etano - C4H10O
CH2
O
CH2
Piridina - C5H5N
Tetraciclina - C22H24N2O8
N
OH
CH3
OH
N
NH2
O
OH
59
CH3
CH3(CH2) 2CH3
57
CH3
H2C
1-cloropropano - C3H7Cl
O
OH
OH
O
O
60
10
CLASSIFICAÇÃO DAS CADEIAS
CARBÔNICAS
- Acíclicas ou Abertas
Acíclicas
Saturadas
ou
Insaturadas
- Cíclicas ou Fechadas
61
Normais
ou
Ramificadas
62
Cíclicas
Heteroátomo: átomo diferente de carbono
Alicíclicas
que está ligado a pelo menos dois átomos de
carbono, ou seja, aquele átomo que está no
meio da cadeia carbônica. Ex.:
Aromáticas
Mononucleares
Saturadas ou
Insaturadas
H3C
Normais ou
Ramificadas
Núcleos
Condensados
Homocíclicas ou
Heterocíclicas
O CH2
CH3
H2C
H2C
S
CH2 CH2
Cl
Cl
Iperita ou
“gás mostarda”
O
H3C C
Núcleos Isolados
63
CH2
etóxi-etano ou
éter etílico
Polinucleares
N CH3
N,N-dimetiletanamida
H3C
64
Núcleo Aromático: o núcleo aromático
Cadeias Saturadas:
mais comum possui uma cadeia cíclica,
contendo 6 C ligados entre si por ligações
duplas e simples alternadas.
Possuem apenas ligações σ (ligações simples)
ENTRE CARBONOS.
C
C
C
C
C
C
C
C
C
C
Exemplos
C
C
pentano
65
Homogêneas
ou
Heterogêneas
ciclopentano
66
11
Cadeias Insaturadas:
Cadeias Normais:
Possuem pelo menos 1 ligação π (ligações
duplas e/ou triplas) ENTRE CARBONOS.
Possuem apenas CARBONOS PRIMÁRIOS E
SECUNDÁRIOS.
Exemplos
Exemplos
2-buteno ou but-2-eno
ciclobuteno
pentano
67
ciclopentano
68
Cadeias Ramificadas:
Cadeias Homogêneas ou Homocíclicas:
Possuem pelo menos 1 CARBONO
TERCIÁRIO OU QUATERNÁRIO .
NÃO há a presença de HETEROÁTOMO.
Exemplos
Exemplos
2-buteno ou but-2-eno
3-metilpentano
ciclobuteno
metilciclopentano
69
70
Cadeias Heterogêneas ou Heterocíclicas:
Cadeias Cíclicas Aromáticas Mononucleares:
EXISTE a presença de HETEROÁTOMO.
APRESENTAM apenas UM NÚCLEO
AROMÁTICO.
Exemplos
Exemplo
O
etóxi-etano
ou
éter etílico
71
NH2
O
tetraidrofurano
ou
THF
aminobenzeno
ou
anilina
72
12
Cadeias Cíclicas Aromáticas Polinucleares:
APRESENTAM MAIS de um NÚCLEO
AROMÁTICO.
Cadeias Cíclicas Aromáticas Polinucleares de
Núcleos Isolados:
NÃO APRESENTAM CARBONOS
COMUNS entre os núcleos aromáticos.
Exemplos
O
Exemplo
O
difenilcetona
ou benzofenona
difenilcetona
ou benzofenona
naftaleno
73
74
Cadeias Cíclicas Aromáticas Polinucleares de
Núcleos Condensados:
APRESENTAM pelo menos 2 CARBONOS
COMUNS entre os núcleos aromáticos.
Exemplos:
pentano
Cadeia acíclica, saturada, normal e homogênea
Exemplo
ciclobuteno
naftaleno
Cadeia cíclica, alicíclica, insaturada, normal e
homocíclica
75
76
NH2
CLASSIFICAÇÃO DOS
COMPOSTOS ORGÂNICOS
aminobenzeno
ou anilina
Compostos Aromáticos
possuem cadeia aromática
Cadeia cíclica, aromática, mononuclear
Compostos Heterocíclicos
possuem cadeia heterocíclicas
naftaleno
Compostos Alifáticos
Os demais compostos, que não se encaixam nas
categorias anteriores
Cadeia cíclica, aromática, polinuclear de
núcleos condensados
77
78
13
NOMENCLATURA OFICIAL DOS
COMPOSTOS ORGÂNICOS
IUPAC
(International Union of Pure and Applied
Chemistry)
79
Os nomes eram arbitrários, levavam em
consideração a origem ou característica do
composto. Ex: HCOOH foi chamado ácido fórmico,
pois era encontrado em certas formigas;
O número de compostos orgânicos aumentou
consideravelmente;
A sistematização da nomenclatura tornou-se
inevitável;
80
Em 1892 no Congresso Internacional de
Genebra, os químicos deram início à nomenclatura
oficial IUPAC;
Tais regras atingem um número limitado de
compostos orgânicos (aproximadamente 1 milhão
de compostos), por isso, ainda persistem até hoje
outros tipos de nomenclatura;
81
Dois aspectos foram levados em consideração
1 - Cada composto deve ter um nome diferente;
2 - O nome deve indicar a fórmula estrutural do
composto.
Começaremos pelos compostos de cadeias
normais, em seguida passaremos aos de
cadeias ramificadas.
82
Compostos Orgânicos de Cadeia Normal
O nome do composto é dividido
em três partes:
PREFIXO
83
INFIXO
SUFIXO
PREFIXO
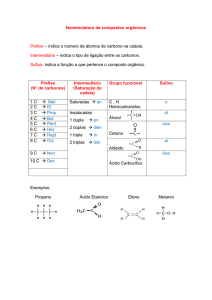
Indica o NÚMERO DE ÁTOMOS
DE CARBONO presentes na cadeia
principal.
84
14
Nº de átomos de
Carbono
Prefixo
*1
MET
*2
ET
* 10
DEC
*3
PROP
* 11
UNDEC
*4
BUT
* 12
DODEC
*5
PENT
13
TRIDEC
*6
HEX
14
TETRADEC
85
HEPT
*8
OCT
*9
NON
86
15
PENTADEC
16
HEXADEC
17
HEPTADEC
18
OCTADEC
19
NONADEC
20
EICOS
21
HENEICOS
22
DOEICOS
INFIXO
Indica o TIPO DE LIGAÇÃO entre
os carbonos.
87
89
*7
88
Cadeia carbônica
Infixo
Só ligações simples entre carbonos
an
Uma ligação dupla entre carbonos
en
Duas ligações duplas entre carbonos
dien
Três ligações duplas entre carbonos
trien
Uma ligação tripla entre carbonos
in
Duas ligações triplas entre carbonos
diin
Três ligações triplas entre carbonos
triin
Uma dupla e uma tripla entre carbonos
enin
SUFIXO
Indica o GRUPO FUNCIONAL a
que pertence o composto orgânico.
90
15
GRUPOS FUNCIONAIS
Grupo Funcional
Hidrocarbonetos:
É um grupamento de átomos, ligados de
forma determinada, cuja presença fará
com que compostos orgânicos diferentes
possuam
comportamento
químico
semelhante.
91
Alcanos; Alcenos; Dienos;
Alcinos; Cicloalcanos;
Cicloalcenos; Aromáticos.
92
Fenóis; Enóis; Álcoois; Éteres;
Aldeídos; Cetonas;
Ácidos Carboxílicos;
Sais de Ácidos Carboxílicos;
Ésteres; Haletos de Ácidos;
Anidridos; Haletos Orgânicos;
Compostos de Grignard;
Ácidos Sulfônicos; Funções Tio;
Aminas; Amidas; Nitrilas; etc.
ALCANOS
Cadeia aberta e somente LIGAÇÕES SIMPLES
entre carbonos. Fórmula geral: CnH2n + 2
C
prefixo + an + o
93
94
Exemplos:
H
ALCENOS
butano
C H
H
H
Cadeia aberta e 1 ÚNICA LIGAÇÃO DUPLA
entre carbonos. Fórmula geral: CnH2n
C
C
metano
hexano
95
prefixo + en + o
96
16
Exemplos:
ALCINOS
H
Cadeia aberta e 1 ÚNICA LIGAÇÃO TRIPLA
entre carbonos. Fórmula geral: CnH2n - 2
H
C
C
H
C
H
eteno
“etileno”
propeno
“propileno”
C
prefixo + in + o
97
98
Exemplos:
H
DIENOS
C
C
Cadeia aberta e 2 LIGAÇÕES DUPLAS entre
carbonos. Fórmula geral: CnH2n - 2
H
etino
“acetileno”
prefixo + dien + o
propino
Os dienos podem se subdividir em dienos
acumulados, dienos isolados e dienos
conjugados.
99
100
C
C
C
C
C
dieno conjugado
C
101
C
C
C
C
C
Exemplos:
C
propadieno
dieno isolado
1,3-butadieno ou
but-1,3-dieno
dieno acumulado
1,4-pentadieno ou
pent-1,4-dieno
102
17
CICLO ALCANOS
Exemplos:
Cadeia fechada e somente LIGAÇÕES
SIMPLES entre carbonos. Fórmula geral: CnH2n
ciclobutano
ciclopropano
C
C
C
103
ciclo-hexano
ciclopentano
ciclo + prefixo + an + o
104
CICLO ALCENOS
Exemplos:
Cadeia fechada e 1 ÚNICA LIGAÇÃO DUPLA
entre carbonos. Fórmula geral: CnH2n - 2
ciclobuteno
ciclopropeno
C
C
C
105
ciclo-hexeno
ciclopenteno
ciclo + prefixo + en + o
106
AROMÁTICOS
Possuem pelo menos um NÚCLEO
AROMÁTICO.
Exemplos:
benzeno
107
antraceno
naftaleno
naftaceno
pentaceno
108
18
fenantreno
Benzo[a]pireno
109
coroneno
110
OH
FENOL
Possui pelo menos um grupo hidroxila
(-OH) ligado diretamente a um C
aromático.
OH
OH
hidroxibenzeno
“fenol”
α-hidroxinaftaleno
α-naftol
OH
hidróxi + nome do aromático
111
β-hidroxinaftaleno
β-naftol
112
ÁLCOOL
OH
Possui pelo menos um grupo hidroxila
(-OH) ligado a um C alifático.
Etanol
“álcool etílico”
OH
Etenol
“álcool vinílico”
OH
OH
C
prefixo + infixo + ol
113
ciclobutanol
“álcool ciclobutílico”
OH
ciclopentanol
“álcool ciclopentílico”
114
19
ÉTER
O
Possui o oxigênio como heteroátomo, ou
seja, entre dois carbonos
C
115
O
metoxi-etano
“éter metil-etílico”
C
Cadeia menor
Cadeia maior
prefixo + oxi - prefixo + infixo + sufixo
116
O
metóxi-benzeno
“éter metil-fenílico ou anisol”
ALDEÍDO
O
Possui o grupo carbonila (C=O) na
extremidade da cadeia carbônica, ligado
a hidrogênio.
propanal
O
O
C
butanal
H
prefixo + infixo + al
117
118
CETONA
O
Possui o grupo carbonila (C=O) no
interior da cadeia, ou seja, entre dois
carbonos.
O
propanona
“acetona ou dimetil-cetona”
C
C
O
C
butanona
“metil-etil-cetona
prefixo + infixo + ona
119
120
20
O
ÁCIDO CARBOXÍLICO
C
H
OH
ácido metanóico
“ácido fórmico”
Possui o grupo carboxila (-COOH) que é
constituído de um grupo carbonila ligado
a uma hidroxila.
O
C
O
OH
Ácido prefixo + infixo + óico
121
122
OH
ácido etanóico
“ácido acético”
O
SAL DE ÁCIDO CARBOXÍLICO
H
Derivado do ácido carboxílico, onde o H
do grupo -OH, foi substituído por um
cátion.
O
C
+
O
-
O
- +
OK
123
124
etanoato de potássio
“acetato de potássio”
O
ÉSTER
O
Derivado de ácido carboxílico, onde o
grupo -OH foi substituído por um grupo
-O-C.
O
O
-
O Na
metanoato de sódio
“formiato de sódio”
prefixo + infixo + oato de (nome do cátion)
C
C
etanoato de etila
“acetato de etila”
O
C
O
prefixo + infixo + oato
125
de prefixo + ila
126
butanoato de etila
“butirato de etila”
21
HALETO DE ÁCIDO
O
Derivado de ácido carboxílico, onde o
grupo -OH foi substituído por um
halogênio.
O
H
Cl
cloreto de metanoíla
“cloreto de formila”
C
X
O
X = Cl ou Br
Br
Haleto de prefixo + infixo + oíla
127
Brometo de propanoíla
128
O
ANIDRIDO
O
anidrido etanóico
“anidrido acético”
Obtido pela desidratação de duas
moléculas de ácido carboxílico, e
conseqüente união entre eles.
O
O
O
O
anidrido
Nome do primeiro ácido
prefixo + infixo + óico
O
O
anidrido etanóico propanóico
Nome do segundo ácido
prefixo + infixo + óico
129
130
Cl
HALETO ORGÂNICO
Derivado de hidrocarboneto pela
substituição de um ou mais H por
halogênios.
X
Cloro-etano
C
Br
Br
X = F, Cl, Br, I
Nome do halogênio + nome da cadeia carbônica
Nome do halogênio prefixo + infixo + o
131
O
1,1-dibromo-etano
F
Flúor-ciclopentano
I
Iodo-benzeno
132
22
Aminas
Derivados teoricamente do NH3, pela
substituição dos hidrogênios por cadeias
carbônicas.
C
C
H
N
N
C
H
Amina primária
prefixo + il (para tantos quantos forem os
radicais ligados ao N) + amina
H
Amina secundária
N
C
N
H
etilamina
C
H
N
C
Amina terciária
133
H
etilmetilamina
N
N
etilmetilpropilamina
H
dimetilamina
134
N-prefixo + il (para todos os radicais
ligados ao N) prefixo + infixo + amida
Amidas
Derivados dos ácidos carboxílicos pela
substituição do grupo OH por um grupo
N-.
O
O
C
C
NH2
N
C
C
N
NH2
Amida N,N-dissubstituída
135
N
H
O
C
N-etil-etanamida
N
C
Amida
N-monossubstituída
O
etanamida
O
H
Amida simples
O
O
N-etil-N-metil-etanamida
136
N
N,N-dimetil-etanamida
Nitrila
H3C
Derivado do HCN pela substituição do H
por uma cadeia carbônica.
C
C N
ou
C
CN
etanonitrila
CN
propanonitrila
CN
CN
prefixo + infixo + o + nitrila
137
butanonitrila
138
23
Nitrocomposto
H3C
Apresenta o grupo nitro (-NO2) ligado a
uma cadeia carbônica.
nitrometano
139
NO2
nitroetano
NO2
C NO2
Nitro + nome da cadeia carbônica
Nitro + prefixo + infixo + o
NO2
NO2
nitrociclopentano
nitrobenzeno
140
Ácido sulfônico
Apresenta o grupo sulfônico (-SO3H)
ligado a uma cadeia carbônica.
H3C
SO3H
SO3H
ácido metano-sulfônico
ácido etano-sulfônico
SO3H
C
SO3H
SO3H
ácido
ciclopentano-sulfônico
ácido
benzeno-sulfônico
Ácido + prefixo + infixo + o + sulfônico
141
142
Composto de Grignard
MgBr
Derivado do MgX2 pela substituição de
um halogênio por uma cadeia carbônica.
Brometo de butil magnésio
C MgX
MgCl
nome do haleto de + prefixo + il + magnésio
143
Cloreto de ciclopentil magnésio
144
24
Tio álcool
Derivado de álcool pela substituição do
O pelo S.
C
SH
SH
metanotiol
etanotiol
H3C
SH
SH
ciclo-hexanotiol
prefixo + infixo + o + tiol
145
146
Tio éter
S
Derivado de éter pela substituição do O
pelo S.
C
S
metil - tio - metano
C
Cadeia menor
Cadeia maior
prefixo + il - tio - prefixo + infixo + o
147
S
metil - tio - etano
148
Localização do grupo funcional e das
insaturações
Sempre que houver mais de uma
possibilidade para a localização do grupo
funcional e/ou insaturações, será
necessário numerar os carbonos da
cadeia para indicar a posição exata do
grupo funcional e/ou insaturações.
As seguintes regras básicas são
recomendadas pela IUPAC:
149
A) Devemos numerar a partir da
extremidade mais próxima da
“característica” do composto
150
25
B) Devemos entender por
“característica”
um
grupo
funcional ou uma insaturação,
nessa ordem de importância.
151
C) A numeração deve seguir a
regra dos menores números.
152
D) A IUPAC recomenda a
seguinte padronização na maneira
de escrever esses números:
• escrever o
preferencialmente
antes daquilo que ele indica;
• separar nos entre si por vírgulas
e nos de palavras por hífens.
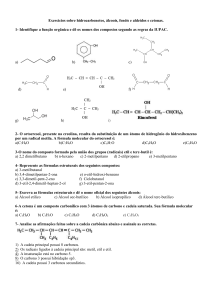
Exercícios:
1) Dê o nome para os seguintes compostos;
a)
b)
c)
OH
no
153
d)
e)
f)
OH
OH
OH
154
g)
h)
i)
O
m)
O
OH
n)
O
O
OH
j)
k)
O
155
o)
l)
O
O
p)
O
OH
HO
O
OH
O
-
OK
+
O
156
26
O
q)
r)
O
O
t)
s)
O
Cl
O
Cl
O
Br
F
SO 3H
I
z)
w)
aa)
S
Br
SO 3H
157
SH
158
ab)
ac)
ah)
ad)
ae)
N
N
af)
O
ag)
O
NO2
aj)
NO2
NO2
ak)
NO2
O
O
NH2
ai)
N
H
NH2
N
al)
CN
N
H
159
NO 2
160
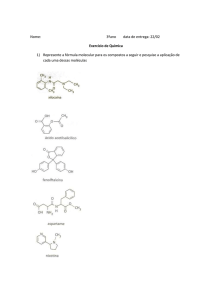
Compostos de Cadeia Ramificada
CADEIA PRINCIPAL
Em compostos de cadeia ramificada, as
ramificações são consideradas como
RADICAIS, e deve-se escolher uma
CADEIA PRINCIPAL de acordo com os
seguintes critérios:
161
y)
MgCl
O
u)
O
x)
O
Cl
O
v)
1) A cadeia principal deve possuir:
a) o grupo funcional;
b) o maior no de insaturações;
c) a sequência mais longa de átomos de
carbono;
d) se houver duas ou mais possibilidades na
escolha da cadeia principal com o mesmo
no de C, deve-se escolher aquela com o
maior número de radicais (ramificações);
162
27
e) quando a cadeia é mista, consideramos
PREFERENCIALMENTE, como principal
a alicíclica ou aromática.
Classificação e Nomenclatura dos Radicais
Radicais derivados de hidrocarbonetos
2) Radicais:
a) da presença ou não de insaturação;
b) do tipo de carbono por onde o radical se
liga à cadeia principal.
Para radicais saturados:
Uma vez escolhida a cadeia principal, as
demais cadeias secundárias (ramificações)
serão consideradas radicais. O nome da
cadeia principal é dado de modo idêntico ao
dos compostos de cadeia normal e deve ser
precedido pelo nome dos radicais.
O nome do radical vai depender:
PREFIXO + IL (ou ILA)
163
164
Radicais alquila: são radicais monovalentes e
saturados, derivados dos alcanos.
Algumas variações para o 2-metilbutano
1 carbono
3
2
1
2
3
4
4
3
1
2
1
4
CH3
4
metil ou metila
Ex..: 2-metilbutano
165
166
Radicais alquila
Ex.: 3-etilpentano
CH3
CH2
etil ou etila
3
2
1
2
1
Radicais alquila
3 carbonos
2 carbonos
167
4
3
1 2 3 4
5
1 2 3 4 5
n-propil
isopropil
i-propil
168
28
Radicais alquila
4 carbonos
Ex.: isopropilbenzeno Ex.: n-propilbenzeno
n-butil
sec-butil ou s-butil
isobutil ou i-butil
169
terc-butil ou t-butil
170
Radicais alquila
5 carbonos
Radicais alquenila: são radicais monovalentes
derivados dos alcenos.
2 carbonos
n-pentil
isoamil
etenil ou vinil
neo-pentil
sec-amil
171
t-pentil
172
Radicais alquenila
Radicais alquinila: são radicais monovalentes
derivados dos alcinos.
3 carbonos
alil
propenil
2 carbonos
isopropenil
etinil
173
174
29
Radicais alquinila
Radicais cíclicos: são radicais monovalentes,
derivados de cadeias cíclicas.
3 carbonos
ciclopropil
propinil
ciclobutil
propargil
175
176
fenil
benzil
α
ciclopentil
Ciclo-hexil
β
β
α
177
178
Radicais derivados
funcionais
de
outros
α
grupos
β
β
β
β
α
α-naftil
HO
carboxil(a)
179
O
OH
hidroxil
ou
hidróxi
H
formil(a)
ou
metanoil(a)
α
α
α
β
β
β-naftil
O
O
O
α
acetil(a)
ou
etanoil(a)
metóxi
O
etóxi
180
30
NO2
nitro
Os prefixos ORTO, META e PARA são
usados para indicar posições relativas de dois
ou mais substituintes ligados ao núcleo
aromático:
CN
ciano
R
R'
O
NH2
R
R
R'
R'
amino
fenóxi
181
posição 1,2
orto ou
o182
posição 1,3
meta ou
m-
posição 1,4
para ou
p-
No caso de funções mistas, é necessário
considerar uma das funções como principal e
as demais como radicais. A IUPAC
recomenda a seguinte ordem de importância
na escolha da função principal:
Localização dos Radicais na Cadeia
Principal: é dada pela numeração dos
carbonos da cadeia principal segundo as
regras já mencionadas:
ácido carboxílico > aldeído (aldo) >
a) iniciar pela extremidade mais próxima da
característica mais importante do composto:
cetona (ceto ou oxo) > álcool (hidróxi) >
amina (amino) > haletos (nome do halogênio)
183
grupo funcional > insaturação > radical
b) a numeração deve seguir a regra dos
menores números possíveis;
184
c) se ainda restar mais de uma possibilidade,
iniciar a numeração pela extremidade mais
próxima do radical mais simples.
f) os radicais podem ser mencionados em
ordem de complexidade, ou ainda em ordem
alfabética (preferível).
d) em caso de dois ou mais radicais iguais na
mesma cadeia, usar os prefixos di (dois), tri
(três), tetra (quatro), penta (cinco), etc.
Resumindo, temos:
e) o nome do último radical deve vir ligado
ao nome da cadeia principal, exceto nos casos
em que o nome da cadeia principal começar
pela letra h que deve vir precedido de hífen.
1) determinar a cadeia principal e seu nome;
185
Para dar o nome a um composto com cadeia
ramificada seguimos os seguintes passos:
2) numerar os carbonos da cadeia principal;
3) identificar os radicais e sua localização.
186
31