LISTA COM QUESTÕES DE QUÍMICA DO ENEM:
2010 Á 2014
Prof. Luiz Eduardo Gomes – Químico
Mestrando em Química – UFMS
Laboratório de Nanomateriais e Nanotecnologia aplicada –
LNNA
Instituto de Física INFI-UFMS
e-mail: [email protected]
Questões do ano de 2014
1. (Enem 2014) A aplicação excessiva de fertilizantes
nitrogenados na agricultura pode acarretar alterações no
solo e na água pelo acúmulo de compostos nitrogenados,
principalmente a forma mais oxidada, favorecendo a
proliferação de algas e plantas aquáticas e alterando o
ciclo do nitrogênio, representado no esquema. A espécie
nitrogenada mais oxidada tem sua quantidade controlada
por ação de microrganismos que promovem a reação de
redução dessa espécie, no processo denominado
desnitrificação.
O processo citado está representado na etapa
a) I.
b) II.
c) III.
d) IV.
e) V.
2. (Enem 2014) O potencial brasileiro para transformar
lixo em energia permanece subutilizado — apenas
pequena parte dos resíduos brasileiros é utilizada para
gerar energia. Contudo, bons exemplos são os aterros
sanitários, que utilizam a principal fonte de energia ali
produzida. Alguns aterros vendem créditos de carbono
com base no Mecanismo de Desenvolvimento Limpo
(MDL), do Protocolo de Kyoto.
Essa fonte de energia subutilizada, citada no texto, é o
a) etanol, obtido a partir da decomposição da matéria
orgânica por bactérias.
b)
gás natural, formado pela ação de fungos
decompositores da matéria orgânica.
c) óleo de xisto, obtido pela decomposição da matéria
orgânica pelas bactérias anaeróbias.
d) gás metano, obtido pela atividade de bactérias
anaeróbias na decomposição da matéria orgânica.
e) gás liquefeito de petróleo, obtido pela decomposição
de vegetais presentes nos restos de comida.
3. (Enem 2014) A talidomida é um sedativo leve e foi
muito utilizado no tratamento de náuseas, comuns no
início da gravidez. Quando foi lançada, era considerada
segura para o uso de grávidas, sendo administrada como
uma mistura racêmica composta pelos seus dois
enantiômeros (R e S). Entretanto, não se sabia, na época,
que o enantiômero S leva à malformação congênita,
afetando principalmente o desenvolvimento normal dos
braços e pernas do bebê.
COELHO, F. A. S. ―Fármacos e quiralídade‖. Cadernos
Temáticos de Química Nova na Escola, São Paulo, n. 3,
maio 2001 (adaptado).
Essa malformação congênita ocorre porque esses
enantiômeros
a) reagem entre si.
b) não podem ser separados.
c) não estão presentes em partes iguais.
d) interagem de maneira distinta com o organismo.
e) são estruturas com diferentes grupos funcionais.
4. (Enem 2014) O biodiesel não é classificado como uma
substância pura, mas como uma mistura de ésteres
derivados dos ácidos graxos presentes em sua matériaprima. As propriedades do biodiesel variam com a
composição do óleo vegetal ou gordura animal que lhe
deu origem, por exemplo, o teor de ésteres saturados é
responsável pela maior estabilidade do biodiesel frente à
oxidação, o que resulta em aumento da vida útil do
biocombustível. O quadro ilustra o teor médio de ácidos
graxos de algumas fontes oleaginosas.
Fonte
Oleagi
nosa
Milho
Palma
Canola
Algodã
o
Amend
oim
Teor médio do ácido graxo (% em massa)
Mirís Palmí Esteá Olei Linol Linol
tico
tico
rico
co
eico
ênico
(C14: (C16: (C18: (C1
(C18: (C18:
0)
0)
0)
8:1) 2)
3)
< 0,1 11,7
1,9
25,2 60,6
0,5
1,0
42,8
4,5
40,5 10,1
0,2
< 0,2 3,5
0,9
64,4 22,3
8,2
0,7
20,1
2,6
19,2
55,2
0,6
< 0,6
11,4
2,4
48,3
32,0
0,9
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
1
MA, F.; HANNA, M. A. ―Biodiesel Production: a review‖.
Bioresource Technology, Londres, v. 70, n. 1 jan. 1999
(adaptado).
Qual das fontes oleaginosas apresentadas produziria um
biodiesel de maior resistência à oxidação?
a) Milho.
b) Palma.
c) Canola.
d) Algodão.
e) Amendoim.
5. (Enem 2014) O estudo de compostos orgânicos
permite aos analistas definir propriedades físicas e
químicas responsáveis pelas características de cada
substância descoberta. Um laboratório investiga
moléculas quirais cuja cadeia carbônica seja insaturada,
heterogênea e ramificada.
A fórmula que se enquadra nas características da
molécula investigada é
a) CH3 (CH)2 CH(OH) CO NH CH3.
b) CH3 (CH)2 CH(CH3 ) CO NH CH3.
c) CH3 (CH)2 CH(CH3 ) CO NH2.
d) CH3 CH2 CH(CH3 ) CO NH CH3.
e) C6H5 CH2 CO NH CH3 .
6. (Enem 2014) A capacidade de limpeza e a eficiência
de um sabão dependem de sua propriedade de formar
micelas estáveis, que arrastam com facilidade as
moléculas impregnadas no material a ser limpo. Tais
micelas têm em sua estrutura partes capazes de interagir
com substâncias polares, como a água, e partes que
podem interagir com substâncias apolares, como as
gorduras e os óleos.
SANTOS, W. L. P; MÕL, G. S. (Coords.). Química e
sociedade. São Paulo: Nova Geração, 2005 (adaptado).
A substância capaz de formar as estruturas mencionadas
é
a) C18H36 .
SILVA, V. A.; BENITE, A. M. C.; SOARES, M. H. F. B.
―Algo aqui não cheira bem… A química do mau cheiro‖.
Química Nova na Escola, v. 33, n. 1, fev. 2011
(adaptado).
A eficiência do uso do vinagre nesse caso se explica pela
a) sobreposição de odor, propiciada pelo cheiro
característico do vinagre.
b) solubilidade da piridina, de caráter ácido, na solução
ácida empregada.
c) inibição da proliferação das bactérias presentes, devido
à ação do ácido acético.
d) degradação enzimática da molécula de piridina,
acelerada pela presença de ácido acético.
e) reação de neutralização entre o ácido acético e a
piridina, que resulta em compostos sem mau odor.
8. (Enem 2014) Com o objetivo de substituir as sacolas
de polietileno, alguns supermercados têm utilizado um
novo tipo de plástico ecológico, que apresenta em sua
composição amido de milho e uma resina polimérica
termoplástica, obtida a partir de uma fonte petroquímica.
ERENO, D. ―Plásticos de vegetais‖. Pesquisa Fapesp, n.
179, jan. 2011 (adaptado).
Nesses plásticos, a fragmentação da resina polimérica é
facilitada porque os carboidratos presentes
a) dissolvem-se na água.
b) absorvem água com facilidade.
c) caramelizam por aquecimento e quebram.
d) são digeridos por organismos decompositores.
e) decompõem-se espontaneamente em contato com
água e gás carbônico.
9. (Enem 2014)
A forma das moléculas, como
representadas no papel, nem sempre é planar. Em um
determinado fármaco, a molécula contendo um grupo não
planar é biologicamente ativa, enquanto moléculas
contendo substituintes planares são inativas.
O grupo responsável pela bioatividade desse fármaco é
b) C17H33COONa.
c) CH3CH2COONa.
d) CH3CH2CH2COOH.
a)
e) CH3CH2CH2CH2OCH2CH2CH2CH3 .
7. (Enem 2014) Grande quantidade dos maus odores do
nosso dia a dia está relacionada a compostos alcalinos.
Assim, em vários desses casos, pode-se utilizar o
vinagre, que contém entre 3,5% e 5% de ácido acético,
para diminuir ou eliminar o mau cheiro. Por exemplo,
lavar as mãos com vinagre e depois enxaguá-las com
água elimina o odor de peixe, já que a molécula de
piridina (C5 H5 N) é uma das substâncias responsáveis
pelo odor característico de peixe podre.
b)
c)
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
2
Visando eliminar da água o clorofórmio e outras
moléculas orgânicas, o tratamento adequado é a
a) filtração, com o uso de filtros de carvão ativo.
b) fluoretacão, pela adição de fluoreto de sódio.
c) coagulação, pela adição de sulfato de alumínio.
d) correção do pH, pela adição de carbonato de sódio.
e) floculação, em tanques de concreto com a água em
movimento.
d)
e)
10. (Enem 2014) O principal processo industrial utilizado
na produção de fenol é a oxidação do cumeno
(isopropilbenzeno). A equação mostra que esse processo
envolve a formação do hidroperóxido de cumila, que em
seguida é decomposto em fenol e acetona, ambos
usados na indústria química como precursores de
moléculas mais complexas. Após o processo de síntese,
esses dois insumos devem ser separados para
comercialização individual.
12. (Enem 2014) Grandes fontes de emissão do gás
dióxido de enxofre são as indústrias de extração de cobre
e níquel, em decorrência da oxidação dos minérios
sulfurados. Para evitar a liberação desses óxidos na
atmosfera e a consequente formação da chuva ácida, o
gás pode ser lavado, em um processo conhecido como
dessulfurização, conforme mostrado na equação (1).
CaCO3(s) SO2(g) CaSO3(s) CO2(g)
(1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado,
com o auxílio do ar atmosférico, para a obtenção do
sulfato de cálcio, como mostrado na equação (2). Essa
etapa é de grande interesse porque o produto da reação,
popularmente conhecido como gesso, é utilizado para fins
agrícolas.
2 CaSO3(s) O2(g) 2 CaSO4(s)
(2)
As massas molares dos elementos carbono, oxigênio,
enxofre e cálcio são iguais a 12g / mol, 16g / mol,
Considerando as características físico-químicas dos dois
insumos formados, o método utilizado para a separação
da mistura, em escala industrial, é a
a) filtração.
b) ventilação.
c) decantação.
d) evaporação.
e) destilação fracionada.
11. (Enem 2014)
Para impedir a contaminação
microbiana do suprimento de água, deve-se eliminar as
emissões de efluentes e, quando necessário, tratá-lo com
desinfetante. O ácido hipocloroso (HC O), produzido pela
reação entre cloro e água, é um dos compostos mais
empregados como desinfetante. Contudo, ele não atua
somente como oxidante, mas também como um ativo
agente de cloração. A presença de matéria orgânica
dissolvida no suprimento de água clorada pode levar à
formação de clorofórmio (CHC 3 ) e outras espécies
orgânicas cloradas tóxicas.
SPIRO, T. G.; STIGLIANI, W. M. Química ambiental. São
Paulo: Pearson. 2009 (adaptado).
32g / mol e 40g / mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman.
2002 (adaptado).
Considerando um rendimento de 90% no processo, a
massa de gesso obtida, em gramas, por mol de gás retido
é mais próxima de
a) 64.
b) 108.
c) 122.
d) 136.
e) 245.
13. (Enem 2014)
Diesel é uma mistura de
hidrocarbonetos que também apresenta enxofre em sua
composição. Esse enxofre é um componente indesejável,
pois o trióxido de enxofre gerado é um dos grandes
causadores da chuva ácida. Nos anos 1980, não havia
regulamentação e era utilizado óleo diesel com 13 000
ppm de enxofre. Em 2009, o diesel passou a ter 1 800
ppm de enxofre (S1800) e, em seguida, foi inserido no
mercado o diesel S500 (500 ppm). Em 2012, foi difundido
o diesel S50, com 50 ppm de enxofre em sua
composição. Atualmente, é produzido um diesel com
teores de enxofre ainda menores.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
3
Os Impactos da má qualidade do óleo diesel brasileiro.
Disponível em: www.cnt.org.br.
Acesso em: 20 dez. 2012 (adaptado).
A substituição do diesel usado nos anos 1980 por aquele
difundido em 2012 permitiu uma redução percentual de
emissão de SO3 de
a) 86,2%.
b) 96,2%.
c) 97,2%.
d) 99,6%.
e) 99,9%.
14. (Enem 2014)
A liberação dos gases
clorofluorcarbonos (CFCs) na atmosfera pode provocar
depleção de ozônio (O3 ) na estratosfera. O ozônio
estratosférico é responsável por absorver parte da
radiação ultravioleta emitida pelo Sol, a qual é nociva aos
seres vivos. Esse processo, na camada de ozônio, é
ilustrado simplificadamente na figura.
ambientes, utilizando-se amostras de 500g de solo e
100mL de água, conforme apresentado no quadro.
Ambiente
Resíduo de naftaleno (g)
Solo l
1,0 102
Solo lI
2,0 102
Água I
7,0 106
Água II
8,0 106
Água III
9,0 106
O ambiente que necessita de biorremediação é o(a)
a) solo I.
b) solo II.
c) água I.
d) água II.
e) água III.
16. (Enem 2014) A revelação das chapas de raios X gera
uma solução que contém íons prata na forma de
Ag(S2O3 )23 . Para evitar a descarga desse metal no
ambiente, a recuperação de prata metálica pode ser feita
tratando eletroquimicamente essa solução com uma
espécie adequada. O quadro apresenta semirreações de
redução de alguns íons metálicos.
E0 (V)
Semirreação de redução
Ag(S2O3 )23 (aq) e
Cu2 (aq) 2e
Quimicamente, a destruição do ozônio na atmosfera por
gases CFCs é decorrência da
a) clivagem da molécula de ozônio pelos CFCs para
produzir espécies radicalares.
b) produção de oxigênio molecular a partir de ozônio,
catalisada por átomos de cloro.
c) oxidação do monóxido de cloro por átomos de oxigênio
para produzir átomos de cloro.
d) reação direta entre os CFCs e o ozônio para produzir
oxigênio molecular e monóxido de cloro.
e) reação de substituição de um dos átomos de oxigênio
na molécula de ozônio por átomos de cloro.
15. (Enem 2014)
A utilização de processos de
biorremediação de resíduos gerados pela combustão
incompleta de compostos orgânicos tem se tornado
crescente, visando minimizar a poluição ambiental. Para a
ocorrência de resíduos de naftaleno, algumas legislações
limitam sua concentração em até 30mg kg para solo
agrícola e 0,14mg L para água subterrânea. A
quantificação desse resíduo foi realizada em diferentes
Pt 2 (aq) 2e
Ag(s) 2S2O32 (aq)
Cu(s)
0,02
0,34
Pt(s)
1,20
(aq) 3e
A (s)
1,66
Sn2 (aq) 2e
Sn(s)
0,14
Zn2 (aq) 2e
Zn(s)
0,76
A
3
BENDASSOLLI, J. A. et al. ―Procedimentos para a
recuperação de Ag de resíduos líquidos e sólidos‖.
Química Nova, v. 26, n. 4, 2003 (adaptado).
Das espécies apresentadas, a adequada para essa
recuperação é
a) Cu(s).
b) Pt(s).
c) A 3 (aq).
d) Sn(s).
e) Zn2 (aq).
17. (Enem 2014) Visando minimizar impactos ambientais,
a legislação brasileira determina que resíduos químicos
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
4
lançados diretamente no corpo receptor tenham pH entre
5,0 e 9,0. Um resíduo líquido aquoso gerado em um
processo industrial tem concentração de íons hidroxila
igual a 1,0 1010 mol / L. Para atender a legislação, um
químico
separou
as
seguintes
substâncias,
disponibilizadas
no
almoxarifado
da
empresa:
CH3COOH, Na2SO4 , CH3OH, K 2CO3 e NH4C .
Para que o resíduo possa ser lançado diretamente no
corpo receptor, qual substância poderia ser empregada
no ajuste do pH?
a) CH3COOH
b) Na2SO4
c) CH3OH
d) K 2CO3
e) NH4C
Questões do ano de 2013
1. (Enem 2013) Sabe-se que o aumento da concentração
de gases como CO2, CH4 e N2O na atmosfera é um dos
fatores responsáveis pelo agravamento do efeito estufa. A
agricultura é uma das atividades humanas que pode
contribuir tanto para a emissão quanto para o sequestro
desses gases, dependendo do manejo da matéria
orgânica do solo.
ROSA, A. H.; COELHO, J. C. R. Cadernos Temáticos de
Química Nova na Escola. São Paulo, n. 5, nov. 2003
(adaptado).
De que maneira as práticas agrícolas podem ajudar a
minimizar o agravamento do efeito estufa?
a) Evitando a rotação de culturas.
b) Liberando o CO2 presente no solo.
c) Aumentando a quantidade de matéria orgânica do solo.
d) Queimando a matéria orgânica que se deposita no
solo.
e) Atenuando a concentração de resíduos vegetais do
solo.
2. (Enem 2013) As moléculas de nanoputians lembram
figuras humanas e foram criadas para estimular o
interesse de jovens na compreensão da linguagem
expressa em fórmulas estruturais, muito usadas em
química orgânica. Um exemplo é o NanoKid,
representado na figura:
Em que parte do corpo do NanoKid existe carbono
quaternário?
a) Mãos.
b) Cabeça.
c) Tórax.
d) Abdômen.
e) Pés.
3. (Enem 2013) O glifosato (C3H8NO5P) é um herbicida
pertencente ao grupo químico das glicinas, classificado
como não seletivo. Esse composto possui os grupos
funcionais carboxilato, amino e fosfonato. A degradação
do glifosato no solo é muito rápida e realizada por grande
variedade de microrganismos, que usam o produto como
fonte de energia e fósforo. Os produtos da degradação
são o ácido aminometilfosfônico (AMPA) e o Nmetilglicina (sarcosina):
A partir do texto e dos produtos de degradação
apresentados, a estrutura química que representa o
glifosato é:
a)
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
5
5. (Enem 2013) Músculos artificiais são dispositivos feitos
com plásticos inteligentes que respondem a uma corrente
elétrica com um movimento mecânico. A oxidação e
redução de um polímero condutor criam cargas positivas
e/ou negativas no material, que são compensadas com a
inserção ou expulsão de cátions ou ânions. Por exemplo,
na figura os filmes escuros são de polipirrol e o filme
branco é de um eletrólito polimérico contendo um sal
inorgânico. Quando o polipirrol sofre oxidação, há a
inserção de ânions para compensar a carga positiva no
polímero e o filme se expande. Na outra face do
dispositivo o filme de polipirrol sofre redução, expulsando
ânions, e o filme se contrai. Pela montagem, em
sanduíche, o sistema todo se movimenta de forma
harmônica, conforme mostrado na figura.
b)
c)
d)
e)
4. (Enem 2013) O citral, substância de odor fortemente
cítrico, é obtido a partir de algumas plantas como o
capim-limão, cujo óleo essencial possui aproximadamente
80%, em massa, da substância. Uma de suas aplicações
é na fabricação de produtos que atraem abelhas,
especialmente do gênero Apis, pois seu cheiro é
semelhante a um dos feromônios liberados por elas. Sua
fórmula molecular é C10H16O, com uma cadeia alifática de
oito carbonos, duas insaturações, nos carbonos 2 e 6; e
dois grupos substituintes metila, nos carbonos 3 e 7. O
citral possui dois isômeros geométricos, sendo o trans o
que mais contribui para o forte odor.
Para que se consiga atrair um maior número de abelhas
para uma determinada região, a molécula que deve estar
presente em alta concentração no produto a ser utilizado
é:
a)
b)
c)
d)
A camada central de eletrólito polimérico é importante
porque
a) absorve a irradiação de partículas carregadas, emitidas
pelo aquecimento elétrico dos filmes de polipirrol.
b) permite a difusão dos íons promovida pela aplicação
de diferença de potencial, fechando o circuito elétrico.
c) mantém um gradiente térmico no material para
promover a dilatação/contração térmica de cada filme
de polipirrol.
d) permite a condução de elétrons livres, promovida pela
aplicação de diferença de potencial, gerando corrente
elétrica.
e) promove a polarização das moléculas poliméricas, o
que resulta no movimento gerado pela aplicação de
diferença de potencial.
6. (Enem 2013)
descartáveis vem
O uso de embalagens plásticas
crescendo em todo o mundo,
e)
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
6
juntamente com o problema ambiental gerado por seu
descarte inapropriado. O politereftalato de etileno (PET),
cuja estrutura é mostrada, tem sido muito utilizado na
indústria de refrigerantes e pode ser reciclado e
reutilizado. Uma das opções possíveis envolve a
produção de matérias-primas, como o etilenoglicol (1,2etanodiol), a partir de objetos compostos de PET pósconsumo.
induzido-dipolo induzido entre a celulose e as
moléculas de água.
e) interações íon-dipolo mais fortes entre o poliacrilato e
as moléculas de água, em relação às ligações de
hidrogênio entre a celulose e as moléculas de água.
8. (Enem 2013) Entre as substâncias usadas para o
tratamento de água está o sulfato de alumínio que, em
meio alcalino, forma partículas em suspensão na água, às
quais as impurezas presentes no meio aderem.
Disponível em: www.abipet.org.br. Acesso em: 27 fev.
2012 (adaptado).
O método de separação comumente usado para retirar o
sulfato de alumínio com as impurezas aderidas é a
a) flotação.
b) levigação.
c) ventilação.
d) peneiração.
e) centrifugação.
Com base nas informações do texto, uma alternativa para
a obtenção de etilenoglicol a partir do PET é a
a) solubilização dos objetos.
b) combustão dos objetos.
c) trituração dos objetos.
d) hidrólise dos objetos.
e) fusão dos objetos.
9. (Enem 2013) O brasileiro consome em média 500
miligramas de cálcio por dia, quando a quantidade
recomendada é o dobro. Uma alimentação balanceada é
a melhor decisão pra evitar problemas no futuro, como a
osteoporose, uma doença que atinge os ossos. Ela se
caracteriza pela diminuição substancial de massa óssea,
tornando os ossos frágeis e mais suscetíveis a fraturas.
7. (Enem 2013) As fraldas descartáveis que contêm o
polímero poliacrilato de sódio (1) são mais eficientes na
retenção de água que as fraldas de pano convencionais,
constituídas de fibras de celulose (2).
Disponível em: www.anvisa.gov.br. Acesso em: 1 ago.
2012 (adaptado).
Considerando-se o valor de 6 1023 mol1 para a
constante de Avogadro e a massa molar do cálcio igual a
40 g/mol, qual a quantidade mínima diária de átomos de
cálcio a ser ingerida para que uma pessoa supra suas
necessidades?
a) 7,5 1021
b) 1,5 1022
c) 7,5 1023
d) 1,5 1025
CURI, D. Química Nova na Escola, São Paulo, n. 23,
maio 2006 (adaptado).
A maior eficiência dessas fraldas descartáveis, em
relação às de pano, deve-se às
a) interações dipolo-dipolo mais fortes entre o poliacrilato
e a água, em relação às ligações de hidrogênio entre a
celulose e as moléculas de água.
b) interações íon-íon mais fortes entre o poliacrilato e as
moléculas de água, em relação às ligações de
hidrogênio entre a celulose e as moléculas de água.
c) ligações de hidrogênio mais fortes entre o poliacrilato e
a água, em relação às interações íon-dipolo entre a
celulose e as moléculas de água.
d) ligações de hidrogênio mais fortes entre o poliacrilato e
as moléculas de água, em relação às interações dipolo
e) 4,8 1025
10. (Enem 2013) A formação frequente de grandes
volumes de pirita (FeS2) em uma variedade de depósitos
minerais favorece a formação de soluções ácidas
ferruginosas, conhecidas como ―drenagem ácida de
minas‖. Esse fenômeno tem sido bastante pesquisado
pelos cientistas e representa uma grande preocupação
entre os impactos da mineração no ambiente. Em contato
com oxigênio, a 25°C, a pirita sofre reação, de acordo
com a equação química:
4FeS2 (s) 15O2 (g) 2H2O( ) 2Fe2 (SO4 )3 (aq) 2H2SO4 (aq)
FIGUEIREDO, B. R. Minérios e ambiente. Campinas:
Unicamp, 2000.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
7
Para corrigir os problemas ambientais causados por essa
drenagem, a substância mais recomendada a ser
adicionada ao meio é o
a) sulfeto de sódio.
b) cloreto de amônio.
c) dióxido de enxofre.
d) dióxido de carbono.
e) carbonato de cálcio.
11. (Enem 2013)
A produção de aço envolve o
aquecimento do minério de ferro, junto com carvão
(carbono) e ar atmosférico em uma série de reações de
oxirredução. O produto é chamado de ferro-gusa e
contém cerca de 3,3% de carbono. Uma forma de
eliminar o excesso de carbono é a oxidação a partir do
aquecimento do ferro-gusa com gás oxigênio puro. Os
dois principais produtos formados são aço doce (liga de
ferro com teor de 0,3% de carbono restante) e gás
carbônico. As massas molares aproximadas dos
elementos carbono e oxigênio são, respectivamente, 12
g/mol e 16 g/mol.
LEE, J. D. Química Inorgânica não tão concisa. São
Paulo: Edgard Blücher, 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5
toneladas de ferro-gusa, a massa de gás carbônico
formada, em quilogramas, na produção de aço doce, é
mais próxima de
a) 28.
b) 75.
c) 175.
d) 275.
e) 303.
12. (Enem 2013) Uma das etapas do tratamento da água
é a desinfecção, sendo a cloração o método mais
empregado. Esse método consiste na dissolução do gás
cloro numa solução sob pressão e sua aplicação na água
a ser desinfectada. As equações das reações químicas
envolvidas são:
C 2 (g) 2H2O( )
HC O(aq) H2O( )
HC O(aq) H3O (aq) C (aq)
H3O (aq) C (aq)
pK a logK a 7,53
A ação desinfetante é controlada pelo ácido hipocloroso,
que possui um potencial de desinfecção cerca de 80
vezes superior ao ânion hipoclorito. O pH do meio é
importante, porque influencia na extensão com que o
ácido hipocloroso se ioniza.
Para que a desinfecção seja mais efetiva, o pH da água a
ser tratada deve estar mais próximo de
a) 0.
b) 5.
c) 7.
d) 9.
e) 14.
13. (Enem 2013) A varfarina é um fármaco que diminui a
agregação plaquetária, e por isso é utilizada como
anticoagulante, desde que esteja presente no plasma,
com uma concentração superior a 1,0 mg/L. Entretanto,
concentrações plasmáticas superiores a 4,0 mg/L podem
desencadear hemorragias. As moléculas desse fármaco
ficam retidas no espaço intravascular e dissolvidas
exclusivamente
no
plasma,
que
representa
aproximadamente 60% do sangue em volume. Em um
medicamento, a varfarina é administrada por via
intravenosa na forma de solução aquosa, com
concentração de 3,0 mg/mL. Um indivíduo adulto, com
volume sanguíneo total de 5,0 L, será submetido a um
tratamento com solução injetável desse medicamento.
Qual é o máximo volume da solução do medicamento que
pode ser administrado a esse indivíduo, pela via
intravenosa, de maneira que não ocorram hemorragias
causadas pelo anticoagulente?
a) 1,0 mL
b) 1,7 mL
c) 2,7 mL
d) 4,0 mL
e) 6,7 mL
14. (Enem 2013) Eu também podia decompor a água, se
fosse salgada ou acidulada, usando a pilha de Daniell
como fonte de força. Lembro o prazer extraordinário que
sentia ao decompor um pouco de água em uma taça para
ovos quentes, vendo-a separar-se em seus elementos, o
oxigênio em um eletrodo, o hidrogênio no outro. A
eletricidade de uma pilha de 1 volt parecia tão fraca, e, no
entanto podia ser suficiente para desfazer um composto
químico, a água…
SACKS, O. Tio Tungstênio: memórias de uma infância
química. São Paulo: Cia. das Letras, 2002.
O fragmento do romance de Oliver Sacks relata a
separação dos elementos que compõem a água. O
princípio
do
método
apresentado
é
utilizado
industrialmente na
a) obtenção de ouro a partir de pepitas.
b) obtenção de calcário a partir de rochas.
c) obtenção de alumínio a partir da bauxita.
d) obtenção de ferro a partir de seus óxidos.
e) obtenção de amônia a partir de hidrogênio e nitrogênio.
15. (Enem 2013) Glicose marcada com nuclídeos de
carbono-11 é utilizada na medicina para se obter imagens
tridimensionais do cérebro, por meio de tomografia de
emissão de pósitrons. A desintegração do carbono-11
gera um pósitron, com tempo de meia-vida de 20,4 min,
de acordo com a equação da reação nuclear:
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
8
UV
11
6C
11
5B
I. CF2C 2
CF2C • C •
0
1e
(pósitron)
A partir da injeção de glicose marcada com esse
nuclídeo, o tempo de aquisição de uma imagem de
tomografia é cinco meias-vidas.
Considerando que o medicamento contém 1,00 g do
carbono-11, a massa, em miligramas, do nuclídeo
restante, após a aquisição da imagem, é mais próxima de
a) 0,200.
b) 0,969.
c) 9,80.
d) 31,3.
e) 200.
Questões do ano de 2012
1. (Enem 2012)
A própolis é um produto natural
conhecido por suas propriedades anti-inflamatórias e
cicatrizantes. Esse material contém mais de 200
compostos identificados até o momento. Dentre eles,
alguns são de estrutura simples, como é o caso do
C6H5CO2CH2CH3, cuja estrutura está mostrada a seguir.
O ácido carboxílico e o álcool capazes de produzir o éster
em apreço por meio da reação de esterificação são,
respectivamente,
a) ácido benzoico e etanol.
b) ácido propanoico e hexanol.
c) ácido fenilacético e metanol.
d) ácido propiônico e cicloexanol.
e) ácido acético e álcool benzílico.
II. C • O3 O2 C O •
A preocupação com as possíveis ameaças à camada de
ozônio (O3) baseia-se na sua principal função: proteger a
matéria viva na Terra dos efeitos prejudiciais dos raios
solares ultravioleta. A absorção da radiação ultravioleta
pelo ozônio estratosférico é intensa o suficiente para
eliminar boa parte da fração de ultravioleta que é
prejudicial à vida.
A finalidade da utilização dos gases isobutano, butano e
propano neste aerossol é
a) substituir o CFC, pois não reagem com o ozônio,
servindo como gases propelentes em aerossóis.
b) servir como propelentes, pois, como são muito
reativos, capturam o Freon existente livre na atmosfera,
impedindo a destruição do ozônio.
c) reagir com o ar, pois se decompõem espontaneamente
em dióxido de carbono (CO2) e água (H2O), que não
atacam o ozônio.
d) impedir a destruição do ozônio pelo CFC, pois os
hidrocarbonetos gasosos reagem com a radiação UV,
liberando hidrogênio (H2), que reage com o oxigênio do
ar (O2), formando água (H2O).
e) destruir o CFC, pois reagem com a radiação UV,
liberando carbono (C), que reage com o oxigênio do ar
(O2), formando dióxido de carbono (CO2), que é
inofensivo para a camada de ozônio.
3. (Enem 2012) A produção mundial de alimentos
poderia se reduzir a 40% da atual sem a aplicação de
controle sobre as pragas agrícolas. Por outro lado, o uso
frequente dos agrotóxicos pode causar contaminação em
solos, águas superficiais e subterrâneas, atmosfera e
alimentos. Os biopesticidas, tais como a piretrina e
coronopilina, têm sido uma alternativa na diminuição dos
prejuízos econômicos, sociais e ambientais gerados pelos
agrotóxicos.
2. (Enem 2012) O rótulo de um desodorante aerossol
informa ao consumidor que o produto possui em sua
composição os gases isobutano, butano e propano,
dentre outras substâncias. Além dessa informação, o
rótulo traz, ainda, a inscrição ―Não tem CFC‖. As reações
a seguir, que ocorrem na estratosfera, justificam a não
utilização de CFC (clorofluorcarbono ou Freon) nesse
desodorante:
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
9
exemplo, são usados fungos unicelulares, chamados de
leveduras, que são comercializados como fermento
biológico. Eles são usados para promover o crescimento
da massa, deixando-a leve e macia.
O crescimento da massa do pão pelo processo citado é
resultante da
a) liberação de gás carbônico.
b) formação de ácido lático.
c) formação de água.
d) produção de ATP.
e) liberação de calor.
6. (Enem 2012) Uma dona de casa acidentalmente
deixou cair na geladeira a água proveniente do degelo de
um peixe, o que deixou um cheiro forte e desagradável
dentro do eletrodoméstico. Sabe-se que o odor
característico de peixe se deve às aminas e que esses
compostos se comportam como bases.
Na tabela são listadas as concentrações hidrogeniônicas
de alguns materiais encontrados na cozinha, que a dona
de casa pensa em utilizar na limpeza da geladeira.
Concentração
(mol/L)
–2
10
–6
10
–3
10
–8
10
–12
10
Material
Identifique
as
funções
orgânicas
presentes
simultaneamente nas estruturas dos dois biopesticidas
apresentados:
a) Éter e éster.
b) Cetona e éster.
c) Álcool e cetona.
d) Aldeído e cetona.
e) Éter e ácido carboxílico.
4. (Enem 2012) Em uma planície, ocorreu um acidente
ambiental em decorrência do derramamento de grande
quantidade de um hidrocarboneto que se apresenta na
forma pastosa à temperatura ambiente. Um químico
ambiental utilizou uma quantidade apropriada de uma
solução de para-dodecil-benzenossulfonato de sódio, um
agente tensoativo sintético, para diminuir os impactos
desse acidente.
Essa intervenção produz resultados positivos para o
ambiente porque
a) promove uma reação de substituição no
hidrocarboneto, tornando-o menos letal ao ambiente.
b) a hidrólise do para-dodecil-benzenossulfonato de sódio
produz energia térmica suficiente para vaporizar o
hidrocarboneto.
c) a mistura desses reagentes provoca a combustão do
hidrocarboneto, o que diminui a quantidade dessa
substância na natureza.
d) a solução de para-dodecil-benzenossulfonato
possibilita a solubilização do hidrocarboneto.
e) o reagente adicionado provoca uma solidificação do
hidrocarboneto, o que facilita sua retirada do ambiente.
Suco de limão
Leite
Vinagre
Álcool
Sabão
Carbonato
sódio/barrilha
de
de
H3O
+
–12
10
Dentre os materiais listados, quais são apropriados para
amenizar esse odor?
a) Álcool ou sabão.
b) Suco de limão ou álcool.
c) Suco de limão ou vinagre.
d) Suco de limão, leite ou sabão.
e) Sabão ou carbonato de sódio/barrilha.
7. (Enem 2012)
O benzeno é um hidrocarboneto
aromático presente no petróleo, no carvão e em
condensados de gás natural. Seus metabólitos são
altamente tóxicos e se depositam na medula óssea e nos
tecidos gordurosos. O limite de exposição pode causar
anemia,
câncer
(leucemia)
e
distúrbios
do
comportamento. Em termos de reatividade química,
quando um eletrófilo se liga ao benzeno, ocorre a
formação de um intermediário, o carbocátion. Por fim,
ocorre a adição ou substituição eletrofílica.
Disponível em: www.sindipetro.org.br. Acesso em: 1 mar.
2012 (adaptado).
5. (Enem 2012) Há milhares de anos o homem faz uso
da biotecnologia para a produção de alimentos como
pães, cervejas e vinhos. Na fabricação de pães, por
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
10
Com base no texto e no gráfico do progresso da reação
apresentada, as estruturas químicas encontradas em I, II
e III são, respectivamente:
Dentre as vitaminas apresentadas na figura, aquela que
necessita de maior suplementação diária é
a) I.
b) II.
c) III.
d) IV.
e) V.
a)
9. (Enem 2012)
Quando colocamos em água, os
fosfolipídeos tendem a formar lipossomos, estruturas
formadas por uma bicamada lipídica, conforme mostrado
na figura. Quando rompida, essa estrutura tende a se
reorganizar em um novo lipossomo.
b)
c)
d)
e)
8. (Enem 2012) O armazenamento de certas vitaminas
no organismo apresenta grande dependência de sua
solubilidade. Por exemplo, vitaminas hidrossolúveis
devem ser incluídas na dieta diária, enquanto vitaminas
lipossolúveis são armazenadas em quantidades
suficientes para evitar doenças causadas pela sua
carência. A seguir são apresentadas as estruturas
químicas de cinco vitaminas necessárias ao organismo.
Esse arranjo característico se deve ao fato de os
fosfolipídeos apresentarem uma natureza
a) polar, ou seja, serem inteiramente solúveis em água.
b) apolar, ou seja, não serem solúveis em solução
aquosa.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
11
c) anfotérica, ou seja, podem comportar-se como ácidos e
bases.
d) insaturada, ou seja, possuírem duplas ligações em sua
estrutura.
e) anfifílica, ou seja, possuírem uma parte hidrofílica e
outra hidrofóbica.
IDA (índice diário aceitável) desse adoçante é 40 mg/kg
de massa corpórea.
10. (Enem 2012)
Os tubos de PVC, material
organoclorado sintético, são normalmente utilizados como
encanamento na construção civil. Ao final da sua vida útil,
uma das formas de descarte desses tubos pode ser a
incineração. Nesse processo libera-se HC g , cloreto de
Com base nas informações do texto, a quantidade
máxima recomendada de aspartame, em mol, que uma
pessoa de 70 kg de massa corporal pode ingerir por dia é
mais próxima de
hidrogênio, dentre outras substâncias. Assim, é
necessário um tratamento para evitar o problema da
emissão desse poluente.
Entre as alternativas possíveis para o tratamento, é
apropriado canalizar e borbulhar os gases provenientes
da incineração em
a) água dura.
b) água de cal.
c) água salobra.
d) água destilada.
e) água desmineralizada.
11. (Enem 2012) No Japão, um movimento nacional para
a promoção da luta contra o aquecimento global leva o
slogan: 1 pessoa, 1 dia, 1 kg de CO2 a menos! A ideia é
cada pessoa reduzir em 1 kg a quantidade de CO 2
emitida todo dia, por meio de pequenos gestos
ecológicos, como diminuir a queima de gás de cozinha.
Um hambúrguer ecológico? É pra já! Disponível em:
http://lqes.iqm.unicamp.br. Acesso em: 24 fev. 2012
(adaptado).
Considerando um processo de combustão completa de
um gás de cozinha composto exclusivamente por butano
(C4H10), a mínima quantidade desse gás que um japonês
deve deixar de queimar para atender à meta diária,
apenas com esse gesto, é de
Dados: CO2 (44 g/mol); C4H10 (58 g/mol)
a) 0,25 kg.
b) 0,33 kg.
c) 1,0 kg.
d) 1,3 kg.
e) 3,0 kg.
Disponível
http://boaspraticasfarmaceuticas.blogspot.com.
em: 27 fev. 2012.
em:
Acesso
Dado: massa molar do aspartame = 294g/mol
–4
a) 1,3 10 .
–3
b) 9,5 10 .
–2
c) 4 10 .
d) 2,6.
e) 823.
13. (Enem 2012) Osmose é um processo espontâneo
que ocorre em todos os organismos vivos e é essencial à
manutenção da vida. Uma solução 0,15 mol/L de NaC
(cloreto de sódio) possui a mesma pressão osmótica das
soluções presentes nas células humanas.
A imersão de uma célula humana em uma solução 0,20
mol/L de NaC tem, como consequência, a
+
a) absorção de íons Na sobre a superfície da célula.
+
b) difusão rápida de íons Na para o interior da célula.
c) diminuição da concentração das soluções presentes na
célula.
+
d) transferência de íons Na da célula para a solução.
e) transferência de moléculas de água do interior da
célula para a solução.
14. (Enem 2012) O boato de que os lacres das latas de
alumínio teriam um alto valor comercial levou muitas
pessoas a juntarem esse material na expectativa de
ganhar dinheiro com sua venda. As empresas fabricantes
de alumínio esclarecem que isso não passa de uma
―lenda urbana‖, pois ao retirar o anel da lata, dificulta-se a
reciclagem do alumínio. Como a liga do qual é feito o anel
contém alto teor de magnésio, se ele não estiver junto
com a lata, fica mais fácil ocorrer a oxidação do alumínio
no forno. A tabela apresenta as semirreações e os
valores de potencial padrão de redução de alguns metais:
12. (Enem 2012) Aspartame é um edulcorante artificial
(adoçante dietético) que apresenta potencial adoçante
200 vezes maior que o açúcar comum, permitindo seu
uso em pequenas quantidades. Muito usado pela
indústria alimentícia, principalmente nos refrigerantes diet,
tem valor energético que corresponde a 4 calorias/grama.
É contraindicado a portadores de fenilcetonúria, uma
doença genética rara que provoca o acúmulo da
fenilalanina no organismo, causando retardo mental. O
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
12
Semirreação
Li e– Li
Potencial Padrão de Redução (V)
–3,05
K e– K
–2,93
2
–
2 e Mg
–2,36
3
3 e– A
–1,66
Mg
A
Zn2 2 e– Zn
–0,76
Cu2 2 e– Cu
+0,34
Disponível em: www.sucatas.com. Acesso em: 28 fev.
2012 (adaptado).
Com base no texto e na tabela, que metais poderiam
entrar na composição do anel das latas com a mesma
função do magnésio, ou seja, proteger o alumínio da
oxidação nos fornos e não deixar diminuir o rendimento
da sua reciclagem?
a) Somente o lítio, pois ele possui o menor potencial de
redução.
b) Somente o cobre, pois ele possui o maior potencial de
redução.
c) Somente o potássio, pois ele possui potencial de
redução mais próximo do magnésio.
d) Somente o cobre e o zinco, pois eles sofrem oxidação
mais facilmente que o alumínio.
e) Somente o lítio e o potássio, pois seus potenciais de
redução são menores do que o do alumínio.
1. (Enem 2011) Para evitar o desmatamento da Mata
Atlântica nos arredores da cidade de Amargosa, no
Recôncavo da Bahia, o Ibama tem atuado no sentido de
fiscalizar, entre outras, as pequenas propriedades rurais
que dependem da lenha proveniente das matas para a
produção da farinha de mandioca, produto típico da
região. Com isso, pequenos produtores procuram
alternativas como o gás de cozinha, o que encarece a
farinha. Uma alternativa viável, em curto prazo, para os
produtores de farinha em Amargosa, que não cause
danos à Mata Atlântica nem encareça o produto é a
a) construção, nas pequenas propriedades, de grandes
fornos elétricos para torrar a mandioca.
b) plantação, em suas propriedades, de árvores para
serem utilizadas na produção de lenha.
c) permissão, por parte do Ibama, da exploração da Mata
Atlântica apenas pelos pequenos produtores.
d) construção de biodigestores, para a produção de gás
combustível a partir de resíduos orgânicos da região.
e) coleta de carvão de regiões mais distantes, onde existe
menor intensidade de fiscalização do Ibama.
2. (Enem 2011)
A bile é produzida pelo fígado,
armazenada na vesícula biliar e tem papel fundamental
na digestão de lipídeos. Os sais biliares são esteroides
sintetizados no fígado a partir do colesterol, e sua rota de
síntese envolve várias etapas. Partindo do ácido cólico
representado na figura, ocorre a formação dos ácidos
glicólico e taurocólico; o prefixo glico- significa a presença
de um resíduo do aminoácido glicina e o prefixo tauro-, do
ácido taurina
15. (Enem 2012) A falta de conhecimento em relação ao
que vem a ser um material radioativo e quais os efeitos,
consequências e usos da irradiação pode gerar o medo e
a tomada de decisões equivocadas, como a apresentada
no exemplo a seguir.
―Uma companhia aérea negou-se a transportar material
médico por este portar um certificado de esterilização por
irradiação‖.
Física na Escola, v. 8, n. 2, 2007 (adaptado).
A decisão tomada pela companhia é equivocada, pois
a) o material é incapaz de acumular radiação, não se
tornando radioativo por ter sido irradiado.
b) a utilização de uma embalagem é suficiente para
bloquear a radiação emitida pelo material.
c) a contaminação radioativa do material não se prolifera
da mesma forma que as infecções por microrganismos.
d) o material irradiado emite radiação de intensidade
abaixo daquela que ofereceria risco à saúde.
e) o intervalo de tempo após a esterilização é suficiente
para que o material não emita mais radiação.
Questões do ano de 2011
A combinação entre o ácido cólico e a glicina ou taurina
origina a função amida, formada pela reação entre o
grupo amina desses aminoácidos e o grupo
a) carboxila do ácido cólico.
b) aldeído do ácido cólico.
c) hidroxila do ácido cólico.
d) cetona do ácido cólico.
e) éster do ácido cólico.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
13
3. (Enem 2011) A pele humana, quando está bem
hidratada, adquire boa elasticidade e aspecto macio e
suave. Em contrapartida, quando está ressecada, perde
sua elasticidade e se apresenta opaca e áspera. Para
evitar o ressecamento da pele é necessário, sempre que
possível,
utilizar
hidratantes
umectantes,
feitos
geralmente à base de glicerina e polietilenoglicol:
do rio, principal fonte de sobrevivência dos ribeirinhos. A
diarreia é frequente nas crianças e ocorre como
consequência da falta de saneamento básico, já que a
população não tem acesso à água de boa qualidade.
Como não há água potável, a alternativa é consumir a do
rio.
O
Liberal.
8
jul.
http://www.oliberal.com.br.
HO CH2 CH2 O CH2 CH2 n O CH2 CH2 OH
polietilenoglicol
Disponível em: http://www.brasilescola.com. Acesso em:
23 abr. 2010 (adaptado).
A retenção de água na superfície da pele promovida
pelos hidratantes é consequência da interação dos
grupos hidroxila dos agentes umectantes com a umidade
contida no ambiente por meio de
a) ligações iônicas.
b) forças de London.
c) ligações covalentes.
d) forças dipolo-dipolo.
e) ligações de hidrogênio.
2008.
Disponível
em:
O procedimento adequado para tratar a água dos rios, a
fim de atenuar os problemas de saúde causados por
microrganismos a essas populações ribeirinhas é a
a) filtração.
b) cloração.
c) coagulação.
d) fluoretação.
e) decantação.
6. (Enem 2011) A eutrofização é um processo em que
rios, lagos e mares adquirem níveis altos de nutrientes,
especialmente fosfatos e nitratos, provocando posterior
acúmulo de matéria orgânica em decomposição. Os
nutrientes são assimilados pelos produtores primários e o
crescimento desses é controlado pelo nutriente limítrofe,
que é o elemento menos disponível em relação à
abundância necessária à sobrevivência dos organismos
vivos. O ciclo representado na figura seguinte reflete a
dinâmica dos nutrientes em um lago.
4. (Enem 2011) No processo de industrialização da
mamona, além do óleo que contém vários ácidos graxos,
é obtida uma massa orgânica, conhecida como torta de
mamona. Esta massa tem potencial para ser utilizada
como fertilizante para o solo e como complemento em
rações animais devido a seu elevado valor proteico. No
entanto, a torta apresenta compostos tóxicos e
alergênicos diferentemente do óleo da mamona. Para que
a torta possa ser utilizada na alimentação animal, é
necessário um processo de descontaminação.
Revista Química Nova na Escola. V. 32, no 1, 2010
(adaptado).
A característica presente nas substâncias tóxicas e
alergênicas, que inviabiliza sua solubilização no óleo de
mamona, é a
a) lipofilia.
b) hidrofilia.
c) hipocromia.
d) cromatofilia.
e) hiperpolarização.
5. (Enem 2011) Belém é cercada por 39 ilhas, e suas
populações convivem com ameaças de doenças. O
motivo, apontado por especialistas, é a poluição da água
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
14
A análise da água de um lago que recebe a descarga de
águas residuais provenientes de lavouras adubadas
revelou as concentrações dos elementos carbono (21,2
mol/L), nitrogênio (1,2 mol/L) e fósforo (0,2 mol/L).
Nessas condições, o nutriente limítrofe é o
a) C.
b) N.
c) P.
d) CO2 .
e) PO4 .
7. (Enem 2011) O peróxido de hidrogênio é comumente
utilizado como antisséptico e alvejante. Também pode ser
empregado em trabalhos de restauração de quadros
enegrecidos e no clareamento de dentes. Na presença de
soluções ácidas de oxidantes, como o permanganato de
potássio, este óxido decompõe-se, conforme a equação a
seguir:
5 H2O2 (aq) 2 KMnO4 (aq) 3 H2SO4 (aq) 5 O2 (g) 2 MnSO4 (aq) K2SO4 (aq) 8 H2O ( )
c) oxidação, pois a luz solar que incide sobre o tronco
ativa fotoquimicamente a cal, que elimina os seres
vivos do microambiente.
d) aquecimento, pois a luz do Sol incide sobre o tronco e
aquece a cal, que mata os seres vivos do
microambiente.
e) vaporização, pois a cal facilita a volatilização da água
para a atmosfera, eliminando os seres vivos do
microambiente.
9. (Enem 2011) Um dos problemas dos combustíveis que
contêm carbono é que sua queima produz dióxido de
carbono. Portanto, uma característica importante, ao se
escolher um combustível, é analisar seu calor de
combustão ( hc o ) , definido como a energia liberada na
queima completa de um mol de combustível no estado
padrão. O quadro seguinte relaciona algumas substâncias
que contêm carbono e seu Hc o .
Substância
Fórmula
Hc o (kJ/mol)
benzeno
C6H6 ( )
- 3 268
ROCHA-FILHO, R. C. R.; SILVA, R. R. Introdução aos
Cálculos da Química. São Paulo: McGraw-Hill, 1992.
etanol
C2H5OH ( )
- 1 368
glicose
C6H12O6 (s)
- 2 808
De acordo com a estequiometria da reação descrita, a
quantidade de permanganato de potássio necessária para
reagir completamente com 20,0 mL de uma solução 0,1
mol/L de peróxido de hidrogênio é igual a
metano
CH4 (g)
- 890
octano
C8H18 ( )
- 5 471
a) 2,0 100 mol
3
b) 2,0 10 mol
c) 8,0 101mol
d) 8,0 104 mol
e) 5,0 103 mol
8. (Enem 2011) A cal (óxido de cálcio, CaO), cuja
suspensão em água é muito usada como uma tinta de
baixo custo, dá uma tonalidade branca aos troncos de
árvores. Essa é uma prática muito comum em praças
públicas e locais privados, geralmente usada para
combater a proliferação de parasitas. Essa aplicação,
também chamada de caiação, gera um problema: elimina
microrganismos benéficos para a árvore.
Disponível em: http://super.abril.com.br. Acesso em: 1
abr. 2010 (adaptado).
A destruição do microambiente, no tronco de árvores
pintadas com cal, é devida ao processo de
a) difusão, pois a cal se difunde nos corpos dos seres do
microambiente e os intoxica.
b) osmose, pois a cal retira água do microambiente,
tornando-o
inviável
ao
desenvolvimento
de
microrganismos.
Neste contexto, qual dos combustíveis, quando queimado
completamente, libera mais dióxido de carbono no
ambiente pela mesma quantidade de energia produzida?
a) Benzeno.
b) Metano.
c) Glicose.
d) Octano.
e) Etanol.
10. (Enem 2011) Os refrigerantes têm-se tornado cada
vez mais o alvo de políticas públicas de saúde. Os de
cola apresentam ácido fosfórico, substância prejudicial à
fixação de cálcio, o mineral que é o principal componente
da matriz dos dentes. A cárie é um processo dinâmico de
desequilíbrio do processo de desmineralização dentária,
perda de minerais em razão da acidez. Sabe-se que o
principal componente do esmalte do dente é um sal
denominado hidroxiapatita. O refrigerante, pela presença
da sacarose, faz decrescer o pH do biofilme (placa
bacteriana), provocando a desmineralização do esmalte
dentário. Os mecanismos de defesa salivar levam de 20 a
30 minutos para normalizar o nível do pH,
remineralizando o dente. A equação química seguinte
representa esse processo:
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
15
b) I e III.
c) II e IV.
d) III e V.
e) IV e V.
GROISMAN, S. Impacto do refrigerante nos dentes é
avaliado sem tirá-lo da dieta. Disponível em:
http://www.isaude.net. Acesso em: 1 maio 2010
(adaptado).
Considerando que uma pessoa consuma refrigerantes
diariamente,
poderá
ocorrer
um
processo de
desmineralização dentária, devido ao aumento da
concentração de
a) OH , que reage com os íons Ca2 , deslocando o
equilíbrio para a direita.
b) H , que reage com as hidroxilas OH , deslocando o
equilíbrio para a direita.
c) OH , que reage com os íons Ca2 , deslocando o
equilíbrio para a esquerda.
d) H , que reage com as hidroxilas OH , deslocando o
equilíbrio para a esquerda.
12. (Enem 2011)
Um dos processos usados no
tratamento do lixo é a incineração, que apresenta
vantagens e desvantagens. Em São Paulo, por exemplo,
o lixo é queimado a altas temperaturas e parte da energia
liberada é transformada em energia elétrica. No entanto,
a incineração provoca a emissão de poluentes na
atmosfera. Uma forma de minimizar a desvantagem da
incineração, destacada no texto, é
a) aumentar o volume do lixo incinerado para aumentar a
produção de energia elétrica.
b) fomentar o uso de filtros nas chaminés dos
incineradores para diminuir a poluição do ar.
c) aumentar o volume do lixo para baratear os custos
operacionais relacionados ao processo.
d) fomentar a coleta seletiva de lixo nas cidades para
aumentar o volume de lixo incinerado.
e) diminuir a temperatura de incineração do lixo para
produzir maior quantidade de energia elétrica.
e) Ca2 , que reage com as hidroxilas OH , deslocando
o equilíbrio para a esquerda.
11. (Enem 2011) Certas ligas estanho-chumbo com
composição específica formam um eutético simples, o
que significa que uma liga com essas características se
comporta como uma substância pura, com um ponto de
fusão definido, no caso 183°C. Essa é uma temperatura
inferior mesmo ao ponto de fusão dos metais que
compõem esta liga (o estanho puro funde a 232°C e o
chumbo puro a 320°C) o que justifica sua ampla utilização
na soldagem de componentes eletrônicos, em que o
excesso de aquecimento deve sempre ser evitado. De
acordo com as normas internacionais, os valores mínimo
e máximo das densidades para essas ligas são de 8,74
g/mL e 8,82 g/mL, respectivamente. As densidades do
estanho e do chumbo são 7,3 g/mL e 11,3 g/mL,
respectivamente. Um lote contendo 5 amostras de solda
estanho-chumbo foi analisado por um técnico, por meio
da determinação de sua composição percentual em
massa, cujos resultados estão mostrados no quadro a
seguir.
Amostra
I
II
III
IV
V
Porcentagem de
Sn (%)
60
62
65
63
59
Porcentagem de
Pb (%)
40
38
35
37
41
Com base no texto e na análise realizada pelo técnico, as
amostras que atendem às normas internacionais são
a) I e II.
Questões do ano de 2010
1. (Enem 2010) Os pesticidas modernos são divididos
em várias classes, entre as quais se destacam os
organofosforados, materiais que apresentam efeito tóxico
agudo para os seres humanos. Esses pesticidas contêm
um átomo central de fósforo ao qual estão ligados outros
átomos ou grupo de átomos como oxigênio, enxofre,
grupos metoxi ou etoxi, ou um radical orgânico de cadeia
longa. Os organofosforados são divididos em três
subclasses: Tipo A, na qual o enxofre não se incorpora
na molécula; Tipo B, na qual o oxigênio, que faz dupla
ligação com fósforo, é substituído pelo enxofre; e Tipo C,
no qual dois oxigênios são substituídos por enxofre.
BAIRD, C. Química Ambiental. Bookman, 2005.
Um exemplo de pesticida organofosforado Tipo B, que
apresenta grupo etoxi em sua fórmula estrutural, está
representado em:
a)
b)
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
16
ficam paradas em silêncio.
Assim se forma o ngaura. O ngaura cobre o chão da
floresta, enriquece a terra e alimenta as árvores.]
As folhas velhas morrem para ajudar o crescimento das
folhas novas.]
Dentro do ngaura vivem aranhas, formigas, escorpiões,
centopeias, minhocas, cogumelos e vários tipos de outros
seres muito pequenos.]
As folhas também caem nos lagos, nos igarapés e
igapós,
c)
d)
A natureza segundo os Ticunas/Livro das Árvores.
Organização Geral dos Professores Bilíngues Ticunas,
2000.
e)
2. (Enem 2010) No ano de 2004, diversas mortes de
animais por envenenamento no zoológico de São Paulo
foram evidenciadas. Estudos técnicos apontam suspeita
de intoxicação por monofluoracetato de sódio, conhecido
como composto 1080 e ilegalmente comercializado como
raticida. O monofluoracetato de sódio é um derivado do
ácido monofluoracético e age no organismo dos
mamíferos bloqueando o ciclo de Krebs, que pode levar à
parada da respiração celular oxidativa e ao acúmulo de
amônia na circulação.
O monofluoracetato de sódio pode ser obtido pela
a) desidrataçao do ácido monofluoracético, com liberação
de água.
b) hidrólise do ácido monofluoracético, sem formação de
água.
c) perda de íons hidroxila do ácido monofluoracético, com
liberação de hidróxido de sódio.
d) neutralização do ácido monofluoracético usando
hidróxido de sódio, com liberação de água.
e) substituição dos íons hidrogênio por sódio na estrutura
do ácido monofluoracético, sem formação de água.
3. (Enem 2010) O texto ―O voo das Folhas‖ traz uma
visão dos índios Ticunas para um fenômeno usualmente
observado na natureza:
O voo das Folhas
Com o vento
as folhas se movimentam.
E quando caem no chão
Na visão dos índios Ticunas, a descrição sobre o ngaura
permite classificá-lo como um produto diretamente
relacionado ao ciclo
a) da água.
b) do oxigênio.
c) do fósforo.
d) do carbono.
e) do nitrogênio.
4. (Enem 2010) Em nosso cotidiano, utilizamos as
palavras ―calor‖ e ―temperatura‖ de forma diferente de
como elas são usadas no meio científico. Na linguagem
corrente, calor é identificado como ―algo quente‖ e
temperatura mede a ―quantidade de calor de um corpo‖.
Esses significados, no entanto, não conseguem explicar
diversas situações que podem ser verificadas na prática.
Do ponto de vista científico, que situação prática mostra a
limitação dos conceitos corriqueiros de calor e
temperatura?
a) A temperatura da água pode ficar constante durante o
tempo em que estiver fervendo.
b) Uma mãe coloca a mão na água da banheira do bebê
para verificar a temperatura da água.
c) A chama de um fogão pode ser usada para aumentar a
temperatura da água em uma panela.
d) A água quente que está em uma caneca é passada
para outra caneca a fim de diminuir sua temperatura.
e) Um forno pode fornecer calor para uma vasilha de
água que está em seu interior com menor temperatura
do que a dele.
5. (Enem 2010) Em visita a uma usina sucroalcooleira,
um grupo de alunos pôde observar a série de processos
de beneficiamento da cana-de-açúcar, entre os quais se
destacam:
1. A cana chega cortada da lavoura por meio de
caminhões e é despejada em mesas alimentadoras
que a conduzem para as moendas. Antes de ser
esmagada para a retirada do caldo açucarado, toda a
cana é transportada por esteiras e passada por um
eletroímã para a retirada de materiais metálicos.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
17
2. Após se esmagar a cana, o bagaço segue para as
caldeiras, que geram vapor e energia para toda a
usina.
3. O caldo primário, resultante do esmagamento, é
passado por filtros e sofre tratamento para transformarse em açúcar refinado e etanol.
Com base nos destaques da observação dos alunos,
quais operações físicas de separação de materiais
foram realizadas nas etapas de beneficiamento da
cana-de-açúcar?
a) Separação mecânica, extração, decantação.
b) Separação magnética, combustão, filtração.
c) Separação magnética, extração, filtração.
d) Imantação, combustão, peneiração.
e) Imantação, destilação, filtração.
6. (Enem 2010)
A fonte de energia representada na figura, considerada
uma das mais limpas e sustentáveis do mundo, é extraída
do calor gerado
a) pela circulação do magma no subsolo.
b) pelas erupções constantes dos vulcões.
c) pelo sol que aquece as águas com radiação
ultravioleta.
d) pela queima do carvão e combustíveis fósseis.
e) pelos detritos e cinzas vulcânicas.
7. (Enem 2010) O fósforo, geralmente representado pelo
–3
íon de fosfato (PO4 ), é um ingrediente insubstituível da
vida, já que é parte constituinte das membranas celulares
e das moléculas do DNA e do trifosfato de adenosina
(ATP), principal forma de armazenamento de energia das
células.
O fósforo utilizado nos fertilizantes agrícolas é extraído de
minas, cujas reservas estão cada vez mais escassas.
Certas práticas agrícolas aceleram a erosão do solo,
provocando o transporte de fósforo para sistemas
aquáticos, que fica imobilizado nas rochas. Ainda, a
colheita das lavouras e o transporte dos restos
alimentares para os lixões diminuem a disponibilidade dos
íons no solo. Tais fatores têm ameaçado a
sustentabilidade desse íon.
Uma medida que amenizaria esse problema seria:
a) Incentivar a reciclagem de resíduos biológicos,
utilizando dejetos animais e restos de culturas para
produção de adubo.
b) Repor o estoque retirado das minas com um íon
sintético de fósforo para garantir o abastecimento da
indústria de fertilizantes.
c) Aumentar a importação de íons fosfato dos países ricos
para suprir as exigências das indústrias nacionais de
fertilizantes.
d) Substituir o fósforo dos fertilizantes por outro elemento
com a mesma função para suprir as necessidades do
uso de seus íons.
e) Proibir, por meio de lei federal, o uso de fertilizantes
com fósforo pelos agricultores, para diminuir sua
extração das reservas naturais.
8. (Enem 2010) As misturas efervescentes, em pó ou em
comprimidos, são comuns para a administração de
vitamina C ou de medicamentos para azia. Essa forma
farmacêutica sólida foi desenvolvida para facilitar o
transporte, aumentar a estabilidade de substâncias e,
quando em solução, acelerar a absorção do fármaco pelo
organismo.
A matérias-primas que atuam na efervescência são, em
geral, o ácido tartárico ou o ácido cítrico que reagem com
um sal de caráter básico, como o bicarbonato de sódio
(NaHCO3), quando em contato com a água. A partir do
contato da mistura efervescente com a água, ocorre uma
série de reações químicas simultâneas: liberação de íons,
formação de ácido e liberação do gás carbônico- gerando
a efervescência.
As equações a seguir representam as etapas da reação
da mistura efervescente na água, em que foram omitidos
os estados de agregação dos reagentes, e H 3A
representa o ácido cítrico.
I. NaHCO3 → Na + HCO3
II. H2CO3
H2O + CO2
–
+
III. HCO 3 + H
H2CO3
+
–
IV. H3A
3H + A
+
A ionização, a dissociação iônica, a formação do ácido e
a liberação do gás ocorrem, respectivamente, nas
seguintes etapas:
a) IV, I, II e III
b) I, IV, III e II
c) IV, III, I e II
d) I, IV, II e III
e) IV, I, III e II
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
18
9. (Enem 2010) As mobilizações para promover um
planeta melhor para as futuras gerações são cada vez
mais frequentes. A maior parte dos meios de transporte
de massa é atualmente movida pela queima de um
combustível fóssil. A título de exemplificação do ônus
causado por essa prática, basta saber que um carro
produz, em média, cerca de 200g de dióxido de carbono
por km percorrido.
Revista Aquecimento Global. Ano 2, nº 8. Publicação do
Instituto Brasileiro de Cultura Ltda.
Um dos principais constituintes da gasolina é o octano
(C8H18). Por meio da combustão do octano é possível a
liberação de energia, permitindo que o carro entre em
movimento. A equação que representa a reação química
desse processo demonstra que
a) no processo há liberaçao de oxigênio, sob a forma de
O2.
b) o coeficiente estequiométrico para a água é de 8 para
1 do octano.
c) no processo há consumo de água, para que haja
liberação de energia.
d) o coeficiente estequiométrico para o oxigênio é de 12,5
para 1 do octano.
e) o coeficiente estequiométrico para o gás carbônico é
de 9 para 1 do octano.
10. (Enem 2010) A composição média de uma bateria
automotiva esgotada é de aproximadamente 32% Pb, 3%
PbO, 17% PbO2 e 36% PbSO4. A média de massa da
pasta residual de uma bateria usada é de 6kg, onde 19%
é PbO2, 60% PbSO4 e 21% Pb. Entre todos os compostos
de chumbo presentes na pasta, o que mais preocupa é o
sulfato de chumbo (II), pois nos processos
pirometalúrgicos, em que os compostos de chumbo
(placas das baterias) são fundidos, há a conversão de
sulfato em dióxido de enxofre, gás muito poluente.
Para reduzir o problema das emissões de SO2(g), a
indústria pode utilizar uma planta mista, ou seja, utilizar o
processo hidrometalúrgico, para a dessulfuração antes da
fusão do composto de chumbo. Nesse caso, a redução de
sulfato presente no PbSO4 é feita via lixiviação com
solução de carbonato de sódio (Na2CO3) 1M a 45°C, em
que se obtém o carbonato de chumbo (II) com rendimento
de 91%. Após esse processo, o material segue para a
fundição para obter o chumbo metálico.
PbSO4 + Na2CO3 → PbCO3 + Na2SO4
Dados: Massas Molares em g/mol Pb = 207; S = 32; Na =
23; O = 16; C = 12
Segundo as condições do processo apresentado para a
obtenção de carbonato de chumbo (II) por meio da
lixiviaçao por carbonato de sódio e considerando uma
massa de pasta residual de uma bateria de 6 kg, qual
quantidade aproximada, em quilogramas, de PbCO3 é
obtida?
a) 1,7 kg
b) 1,9 kg
c) 2,9 kg
d) 3,3 kg
e) 3,6 kg
11. (Enem 2010) Todos os organismos necessitam de
água e grande parte deles vive em rios, lagos e oceanos.
Os processos biológicos, como respiração e fotossíntese,
exercem profunda influência na química das águas
naturais em todo o planeta. O oxigênio é ator dominante
na química e na bioquímica da hidrosfera. Devido a sua
baixa solubilidade em água (9,0 mg/ℓ a 20°C) a
disponibilidade de oxigênio nos ecossistemas aquáticos
estabelece o limite entre a vida aeróbica e anaeróbica.
Nesse contexto, um parâmetro chamado Demanda
Bioquímica de Oxigênio (DBO) foi definido para medir a
quantidade de matéria orgânica presente em um sistema
hídrico. A DBO corresponde à massa de O2 em
miligramas necessária para realizar a oxidação total do
carbono orgânico em um litro de água.
BAIRD, C. Química Ambiental. Ed. Bookman, 2005
(adaptado).
Dados: Massas molares em g/mol: C = 12; H = 1; O = 16.
Suponha que 10 mg de açúcar (fórmula mínima CH 2O e
massa molar igual a 30 g/mol) são dissolvidos em um litro
de água; em quanto a DBO será aumentada?
a) 0,4mg de O2/litro
b) 1,7mg de O2/litro
c) 2,7mg de O2/litro
d) 9,4mg de O2/litro
e) 10,7mg de O2/litro
12. (Enem 2010) Ao colocar um pouco de açúcar na
água e mexer até a obtenção de uma só fase, prepara-se
uma solução. O mesmo acontece ao se adicionar um
pouquinho de sal à água e misturar bem. Uma substância
capaz de dissolver o soluto é denominada solvente; por
exemplo, a água é um solvente para o açúcar, para o sal
e para várias outras substâncias. A figura a seguir ilustra
essa citação.
ARAÚJO, R.V.V.; TINDADE, R.B.E.; SOARES, P.S.M.
Reciclagem de chumbo de bateria automotiva: estudo de
caso.
Disponível em: http://www.iqsc.usp.br. Acesso em: 17 abr.
2010 (adaptado).
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
19
Suponha que uma pessoa, para adoçar seu cafezinho,
tenha utilizado 3,42g de sacarose (massa molar igual a
342 g/mol) para uma xícara de 50 mℓ do líquido. Qual é a
concentração final, em molℓ, de sacarose nesse
cafezinho?
a) 0,02
b) 0,2
c) 2
d) 200
e) 2000
13. (Enem 2010) A lavoura arrozeira na planície costeira
da região sul do Brasil comumente sofre perdas elevadas
devido à salinização da água de irrigação, que ocasiona
prejuízos diretos, como a redução de produção da
lavoura. Solos com processo de salinização avançado
não são indicados, por exemplo, para o cultivo de arroz.
As plantas retiram a água do solo quando as forças de
embebição dos tecidos das raízes são superiores às
forças com que a água é retida no solo.
WINKEL, H.L.; TSCHIEDEL, M. Cultura do arroz:
salinização de solos em cultivos de arroz.
Disponível em: http//agropage.tripod.com/saliniza.hml.
Acesso em: 25 jun. 2010 (adaptado)
A presença de sais na solução do solo faz com que seja
dificultada a absorção de água pelas plantas, o que
provoca o fenômeno conhecido por seca fisiológica,
caracterizado pelo(a)
a) aumento da salinidade, em que a água do solo atinge
uma concentração de sais maior que a das células das
raízes das plantas, impedindo, assim, que a água seja
absorvida.
b) aumento da salinidade, em que o solo atinge um nível
muito baixo de água, e as plantas não têm força de
sucção para absorver a água.
c) diminuição da salinidade, que atinge um nível em que
as plantas não têm força de sucção, fazendo com que
a água não seja absorvida.
d) aumento da salinidade, que atinge um nível em que as
plantas têm muita sudação, não tendo força de sucção
para superá-la.
e) diminuição da salinidade, que atinge um nível em que
as plantas ficam túrgidas e não têm força de sudação
para superá-la.
14. (Enem 2010) Sob pressão normal (ao nível do mar),
a água entra em ebulição à temperatura de 100 °C.
Tendo por base essa informação, um garoto residente em
uma cidade litorânea fez a seguinte experiência:
• Colocou uma caneca metálica contendo água no
fogareiro do fogão de sua casa.
• Quando a água começou a ferver, encostou
cuidadosamente a extremidade mais estreita de uma
seringa de injeção, desprovida de agulha, na superfície
do líquido e, erguendo o êmbolo da seringa, aspirou
certa quantidade de água para seu interior, tapando-a
em seguida.
• Verificando após alguns instantes que a água da seringa
havia parado de ferver, ele ergueu o êmbolo da seringa,
constatando, intrigado, que a água voltou a ferver após
um pequeno deslocamento do êmbolo.
Considerando o procedimento anterior, a água volta a
ferver porque esse deslocamento
a) permite a entrada de calor do ambiente externo para o
interior da seringa.
b) provoca, por atrito, um aquecimento da água contida
na seringa.
c) produz um aumento de volume que aumenta o ponto
de ebulição da água.
d) proporciona uma queda de pressão no interior da
seringa que diminui o ponto de ebulição da água.
e) possibilita uma diminuição da densidade da água que
facilita sua ebulição.
15. (Enem 2010)
No que tange à tecnologia de
combustíveis alternativos, muitos especialistas em
energia acreditam que os alcoóis vão crescer em
importância em um futuro próximo.
Realmente, alcoóis como metanol e etanol têm
encontrado alguns nichos para uso doméstico como
combustíveis há muitas décadas e, recentemente, vêm
obtendo uma aceitação cada vez maior como aditivos, ou
mesmo como substitutos para gasolina em veículos.
Algumas das propriedades físicas desses combustíveis
são mostradas no quadro seguinte.
Álcool
Metanol
(CH3OH)
Etanol
(CH3CH2OH)
Densidade a
25°C (g/mL)
Calor de
Combustão
(kJ/mol)
0,79
– 726,0
0,79
– 1367,0
Dados: Massas molares em g/mol:
H = 1,0; C = 12,0; O = 16,0.
Considere que, em pequenos volumes, o custo de
produção de ambos os alcoóis seja o mesmo. Dessa
forma, do ponto de vista econômico, é mais vantajoso
utilizar
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
20
a) metanol, pois sua combustão completa
aproximadamente 22,7 kJ de energia por
combustível queimado.
b) etanol, pois sua combustão completa
aproximadamente 29,7 kJ de energia por
combustível queimado.
c) metanol, pois sua combustão completa
aproximadamente 17,9 MJ de energia por
combustível queimado.
d) etanol, pois sua combustão completa
aproximadamente 23,5 MJ de energia por
combustível queimado.
e) etanol, pois sua combustão completa
aproximadamente 33,7 MJ de energia por
combustível queimado.
fornece
litro de
fornece
litro de
fornece
litro de
fornece
litro de
fornece
litro de
16. (Enem 2010)
O abastecimento de nossas
necessidades energéticas futuras dependerá certamente
do desenvolvimento de tecnologias para aproveitar a
energia solar com maior eficiência. A energia solar é a
maior fonte de energia mundial. Num dia ensolarado, por
exemplo, aproximadamente 1 kJ de energia solar atinge
cada metro quadrado da superfície terrestre por segundo.
No entanto, o aproveitamento dessa energia é difícil
porque ela é diluída (distribuída por uma área muito
extensa) e oscila com o horário e as condições climáticas.
O uso efetivo da energia solar depende de formas de
estocar a energia coletada para uso posterior.
BROWN, T. Química, a ciência central. São Paulo:
Pearson Prentice Hall, 2005.
Atualmente, uma das formas de se utilizar a energia solar
tem sido armazená-la por meio de processos químicos
endotérmicos que mais tarde podem ser revertidos para
liberar calor. Considerando a reação:
CH4(g) + H2O(v) + calor
CO(g) + 3H2(g)
e analisando-a como potencial mecanismo para o
aproveitamento posterior da energia solar, conclui-se que
se trata de uma estratégia
a) insatisfatória, pois a reação apresentada não permite
que a energia presente no meio externo seja absorvida
pelo sistema para ser utilizada posteriormente.
b) insatisfatória, uma vez que há formação de gases
poluentes e com potencial poder explosivo, tornando-a
uma reação perigosa e de difícil controle.
c) insatisfatória, uma vez que há formação de gás CO que
não possui conteúdo energético passível de ser
aproveitado posteriormente e é considerado um gás
poluente.
d) satisfatória, uma vez que a reação direta ocorre com
absorção de calor e promove a formação das
substâncias combustíveis que poderão ser utilizadas
posteriormente para obtenção de energia e realização
de trabalho útil.
e) satisfatória, uma vez que a reação direta ocorre com
liberação de calor havendo ainda a formação das
substâncias combustíveis que poderão ser utilizadas
posteriormente para obtenção de energia e realização
de trabalho útil.
17. (Enem 2010) A eletrólise é muito empregada na
indústria com o objetivo de reaproveitar parte dos metais
sucateados. O cobre, por exemplo, é um dos metais com
maior rendimento no processo de eletrólise, com uma
recuperação de aproximadamente 99,9%. Por ser um
metal de alto valor comercial e de múltiplas aplicações,
sua recuperação torna-se viável economicamente.
Suponha que, em um processo de recuperação de cobre
puro, tenha-se eletrolisado uma solução de sulfato de
cobre (II) (CuSO4) durante 3 h, empregando-se uma
corrente elétrica de intensidade igual a 10A. A massa de
cobre puro recuperada é de aproximadamente
Dados: Constante de Faraday F = 96 500 C/mol; Massa
molar em g/mol: Cu = 63,5.
a) 0,02g.
b) 0,04g.
c) 2,40g.
d) 35,5g.
e) 71,0g.
18. (Enem 2010) As baterias de Ni-Cd muito utilizadas no
nosso cotidiano não devem ser descartadas em lixos
comuns uma vez que uma considerável quantidade de
cádmio é volatilizada e emitida para o meio ambiente
quando as baterias gastas são incineradas como
componente do lixo. Com o objetivo de evitar a emissão
de cádmio para a atmosfera durante a combustão é
indicado que seja feita a reciclagem dos materiais dessas
baterias.
Uma maneira de separar o cádmio dos demais
compostos presentes na bateria é realizar o processo de
lixiviação ácida. Nela, tanto os metais (Cd, Ni e
eventualmente Co) como os hidróxidos de íons metálicos
Cd(OH)2(s), Ni(OH)2(s), Co(OH)2(s) presentes na bateria,
reagem com uma mistura ácida e são solubilizados. Em
função da baixa seletividade (todos os íons metálicos são
solubilizados), após a digestão ácida, é realizada uma
etapa de extração dos metais com solventes orgânicos de
acordo com a reação:
2+
+
M (aq) + 2HR(org)
MR2(org) + 2H (aq)
Onde:
2+
2+
2+
2+
M = Cd , Ni ou Co
HR = C16H34 — PO2H: identificado no gráfico por X
HR = C12H12 — PO2H : identificado no gráfico por Y
O gráfico mostra resultado da extração utilizando os
solventes orgânicos X e Y em diferentes pH.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
21
A reação descrita no texto mostra o processo de extração
dos metais por meio da reação com moléculas orgânicas,
X e Y Considerando-se as estruturas de X e Y e o
processo de separação descrito, pode-se afirmar que
a) as moléculas X e Y atuam como extratores catiônicos
+
uma vez que a parte polar da molécula troca o íon H
pelo cátion do metal.
b) as moléculas X e Y atuam como extratores aniônicos
+
uma vez que a parte polar da molécula troca o íon H
pelo cátion do metal.
c) as moléculas X eY atuam como extratores catiônicos
uma vez que a parte apolar da molécula troca o íon
2–
PO2 pelo cátion do metal.
d) as moléculas X e Y atuam como extratores aniônicos
uma vez que a parte polar da molécula troca o íon
2–
PO2 pelo cátion do metal.
e) as moléculas X e Y fazem ligações com os íons
metálicos resultando em compostos com caráter apolar
o que justifica a eficácia da extração.
19. (Enem 2010) O crescimento da produção de energia
elétrica ao longo do tempo tem influenciado
decisivamente o progresso da humanidade, mas também
tem criado uma séria preocupação: o prejuízo ao meio
ambiente. Nos próximos anos, uma nova tecnologia de
geração de energia elétrica deverá ganhar espaço: as
células a combustível hidrogênio/oxigênio.
Com base no texto e na figura, a produção de energia
elétrica
por
meio
da
célula
a
combustível
hidrogênio/oxigênio
diferencia-se
dos
processos
convencionais porque
a) transforma energia química em energia elétrica, sem
causar danos ao meio ambiente, porque o principal
subproduto formado é a água.
b) converte a energia química contida nas moléculas dos
componentes em energia térmica, sem que ocorra a
produção de gases poluentes nocivos ao meio
ambiente.
c) transforma energia química em energia elétrica, porém
emite gases poluentes da mesma forma que a
produção de energia a partir dos combustíveis fósseis.
d) converte energia elétrica proveniente dos combustíveis
fósseis em energia química, retendo os gases
poluentes produzidos no processo sem alterar a
qualidade do meio ambiente.
e) converte a energia potencial acumulada nas moléculas
de água contidas no sistema em energia química, sem
que ocorra a produção de gases poluentes nocivos ao
meio ambiente.
20. (Enem 2010) Decisão de asfaltamento da rodovia
MG-010, acompanhada da introdução de espécies
exóticas, e a prática de incêndios criminosos ameaçam o
sofisticado ecossistema do campo rupestre da reserva da
Serra do Espinhaço. As plantas nativas desta região,
altamente adaptadas a uma alta concentração de
alumínio, que inibe o crescimento das raízes e dificulta a
absorção de nutrientes e água, estão sendo substituídas
por espécies invasoras que não teriam naturalmente
adaptação para este ambiente; no entanto, elas estão
dominando as margens da rodovia, equivocadamente
chamada de ―estrada ecológica‖. Possivelmente, a
entrada de espécies de plantas exóticas neste ambiente
foi provocada pelo uso, neste empreendimento, de um
tipo de asfalto (cimentosolo) que possui uma mistura rica
em cálcio, que causou modificações químicas aos solos
adjacentes à rodovia MG-010.
Scientific American Brasil. Ano 7, n.° 79, 2008 (adaptado).
Essa afirmação baseia-se no uso de cimento-solo,
mistura rica em cálcio que
a) inibe a toxicidade do alumínio, elevando o pH dessas
áreas.
b) inibe a toxicidade do alumínio, reduzindo o pH dessas
áreas.
c) aumenta a toxicidade do alumínio, elevando o pH
dessas áreas.
d) aumenta a toxicidade do alumínio, reduzindo o pH
dessas áreas.
e) neutraliza a toxicidade do alumínio, reduzindo o pH
dessas áreas.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
22
21. (Enem 2010) As cidades industrializadas produzem
grandes proporções de gases como o CO2, o principal
gás causador do efeito estufa. Isso ocorre por causa da
quantidade de combustíveis fósseis queimados,
principalmente no transporte, mas também em caldeiras
industriais. Além disso, nessas cidades concentram-se as
maiores áreas com solos asfaltados e concretados, o que
aumenta a retenção de calor, formando o que se conhece
por ―ilhas de calor‖. Tal fenômeno ocorre porque esses
materiais absorvem o calor e o devolvem para o ar sob a
forma de radiação térmica.
Em áreas urbanas, devido à atuação conjunta do efeito
estufa e das ―ilhas de calor‖, espera-se que o consumo de
energia elétrica
a) diminua devido à utilização de caldeiras por indústrias
metalúrgicas.
b) aumente devido ao bloqueio da luz do sol pelos gases
do efeito estufa.
c) diminua devido à não necessidade de aquecer a água
utilizada em indústrias.
d) aumente devido à necessidade de maior refrigeração
de indústrias e residências.
e) diminua devido à grande quantidade de radiação
térmica reutilizada.
22. (Enem 2010) O lixão que recebia 130 toneladas de
lixo e contaminava a região com o seu chorume (líquido
derivado da decomposição de compostos orgânicos) foi
recuperado, transformando-se em um aterro sanitário
controlado, mudando a qualidade de vida e a paisagem e
propor cionando condições dignas de trabalho para os
que dele subsistiam.
Revista Promoção da Saúde da Secretaria de Políticas de
Saúde Ano 1, n.o 4, dez. 2000 (adaptado)
Quais procedimentos técnicos tornam o aterro sanitário
mais vantajoso que o lixão, em relação às problemáticas
abordadas no texto?
a) O lixo é recolhido e incinerado pela combustão a altas
temperaturas.
b) O lixo hospitalar é separado para ser enterrado e sobre
ele, colocada cal virgem.
c) O lixo orgânico e inorgânico é encoberto, e o chorume
canalizado para ser tratado e neutralizado.
d) O lixo orgânico é completamente separado do lixo
inorgânico, evitando a formação de chorume.
e) O lixo industrial é separado e acondicionado de forma
adequada, formando uma bolsa de resíduos.
Pró-Reitoria de Extensão, Cultura e Assuntos Estudantis
Cidade Universitária, s/n * Caixa Postal 549 * Campo Grande – MS * CEP 79070-900 - Fone:3345-7232/7233 *
www.pro-enem.ufms.br * E-mail: [email protected] * www.preae.ufms.br * E-mail: [email protected]
23







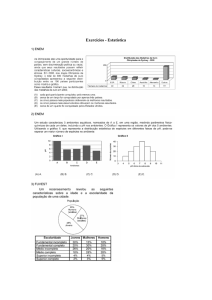

![PK**********!*u*Rw ******[Content_Types].xml](http://s1.studylibpt.com/store/data/000600652_1-a677707083171b8c9acd3b7d39acb751-300x300.png)