UNIVERSIDADE CATÓLICA DE BRASÍLIA
PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA
PROGRAMA DE PÓS-GRADUAÇÃO STRICTU SENSU
MESTRADO EM CIÊNCIAS GENÔMICAS E BIOTECNOLOGIA
EXPRESSÃO DIFERENCIAL DE miRNAs EM LINFÓCITOS T
DE INDIVÍDUOS TRANSPLANTADOS RENAIS
Autor: Laureane Ribeiro Pavanelli
Orientadora: Dr.ª Rosângela Vieira de Andrade
Coorientador: Dr. Marcelo de Macedo Brígido
Brasília - DF
2013
Pró-Reitoria de Pós-Graduação e Pesquisa
Programa de Pós-Graduação Strictu Sensu
Mestrado em Ciências Genômicas e Biotecnologia
EXPRESSÃO DIFERENCIAL DE miRNAs
EM LINFÓCITOS T
DE INDIVÍDUOS TRANSPLANTADOS RENAIS
Autor: Laureane Ribeiro Pavanelli
Orientadora: Dr.ª Rosângela Vieira de Andrade
Coorientador: Dr. Marcelo de Macedo Brígido
Brasília
2013
LAUREANE RIBEIRO PAVANELLI
EXPRESSÃO DIFERENCIAL DE miRNAs EM LINFÓCITOS T
DE INDIVÍDUOS TRANSPLANTADOS RENAIS
Dissertação apresentada ao Programa de
Pós-Graduação
Strictu
Sensu
em
Ciências Genômicas e Biotecnologia da
Universidade Católica de Brasília, como
requisito para obtenção do título de
Mestre em Ciências Genômicas e
Biotecnologia.
Orientador: Dr.ª Rosângela Vieira de
Andrade
Coorientador: Dr. Marcelo de Macedo
Brígido
Brasília
2013
P337e
Pavanelli, Laureane Ribeiro.
Expressão diferencial de miRNAs em linfócitos T de indivíduos
transplantados renais. / Laureane Ribeiro Pavanelli – 2013.
92f. ; il.: 30 cm
Dissertação (mestrado) – Universidade Católica de Brasília, 2013.
Orientação: Dr.ª Rosângela Vieira de Andrade
Coorientação: Dr. Marcelo de Macedo Brígido
1. Rins - transplante. 2. Imunidade celular. 3. Linfócitos. 4.Cirurgia
operatória. I. Andrade, Rosângela Vieira de. orient,.
Marcelo de Macedo. cooriet. III. Título.
Ficha elaborada pela Biblioteca Pós-Graduação da UCB
25/07/2013
II. Brígido,
Dedico, sem hesitar, à minha família, com
amor e gratidão por sua compreensão,
carinho, presença e incansável apoio ao
longo do período de elaboração deste
trabalho.
AGRADECIMENTO
É com muita satisfação que expresso aqui o mais profundo agradecimento a
todas as pessoas que direta ou indiretamente tornaram possível a realização desta
dissertação. Agradeço, portanto:
À minha família, parentes e queridos agregados. Em especial, mãezinha
Therezinha, paizão Altamiro, irmão Rumenigh e cunhada Karine, por terem
proporcionado as condições necessárias para os meus estudos e por serem o meu
lar, e ainda, pelo amor, carinho, afago e aconchego.
À minha amiga Nina Jardim, que além de muito querida e amada, foi o elo
entre o meu desejo de fazer o mestrado e a Universidade Católica de Brasília –
UCB.
À minha orientadora Rosângela Vieira que me recebeu no seu grupo de
braços abertos e me guiou por toda a trajetória de elaboração deste trabalho.
A todos os professores da Pós-Graduação da UCB que foram essenciais para
o meu crescimento intelectual e por despertar em mim o desejo por novos
conhecimentos.
Aos professores da Universidade de Brasília – UnB, Marcelo Brígido, meu
coorientador, e Andrea Maranhão, minha cocoorientadora, por toda a ajuda,
considerações, ideias, bolsa de estudo e colaboração. A todo o pessoal da
bioinformática da UnB que sempre foram solícitos, em especial, Tainá Raiol e
professora Maria Emília.
Especialmente à Isabel Garcia, minha parceira, companheira, amiga, cúpida,
por toda a ajuda e por ter dividido comigo muito mais que amostras, mas muitas
alegrias, todas as angústias, desesperos e quartos de hotéis. Sem você eu não teria
conseguido.
A todos os amigos e amigas de longa data e aos que fiz através do mestrado
por
me
proporcionarem
momentos
maravilhosos
de
alegria,
distração
e
cumplicidade. Não vou citar nomes porque certamente vou me esquecer de alguém,
mas prometo expressar minha gratidão dia-a-dia a cada um.
Por último e não menos importante agradeço ao meu namorado José Carlos
pela paciência, compreensão e apoio na fase final e mais difícil de elaboração deste
trabalho. E ainda por ser o motivo dos meus sorrisos mais bonitos.
“In my view, all that is necessary for faith
is the belief that by doing our best we shall
succeed in our aims: the improvement of
mankind.”
Rosalind Franklin
RESUMO
Pavanelli, L. R. Expressão Diferencial de miRNAs em Linfócitos T de Indivíduos
Transplantados Renais. 93f. 2013. Mestrado em Ciências Genômicas e
Biotecnologia, Universidade Católica de Brasília, Brasília, 2013.
O transplante tornou-se uma terapia para vários casos de falência de órgão a partir
do desenvolvimento de novas técnicas cirúrgicas associadas a potentes terapias
imunossupressoras. No entanto, a rejeição pós-transplantes ou falência do enxerto,
ainda é um fator limitante para esse tipo de intervenção. A rejeição resulta,
basicamente, a partir da interação de linfócitos T com células apresentadoras de
antígenos, do reconhecimento desses antígenos estranhos pelos receptores dos
linfócitos T e pela estimulação de sinalização acessória. Ao longo das últimas
décadas, o conhecimento mais detalhado desses mecanismos moleculares
associados ao reconhecimento do enxerto pelos linfócitos T, possibilitou o
desenvolvimento de várias abordagens e terapias como, por exemplo, o bloqueio de
coestimulação e a depleção de linfócitos T alorreativos. Sabe-se ainda, que uma
parcela dos pacientes transplantados desenvolve espontaneamente um estado de
tolerância operacional que garante a sobrevida do enxerto. Esta é uma condição
rara, observada em indivíduos transplantados renais e de fígado e geralmente
apresentada por indivíduos que suspenderam o uso dos medicamentos
imunossupressores por conta própria devido aos inúmeros efeitos colaterais e
fatores de risco associados ao uso dessas drogas. A indução desse estado de
tolerância, e consequentemente, manutenção dessa tolerância sem o uso de drogas
imunossupressoras e sem rejeição, são os maiores desafios do transplante. Assim, a
busca por potenciais biomarcadores para a rejeição ou para a aceitação do enxerto
faz-se cada vez mais necessária. Neste contexto, o presente estudo tem como
principal objetivo identificar miRNAs diferencialmente expressos em linfócitos T
humanos de pacientes com função estável ao enxerto, com rejeição crônica, com
tolerância operacional e em indivíduos saudáveis, uma vez que mais pesquisas são
necessárias para uma compreensão profunda da função dos miRNAs na
fisiopatologia renal e nos estados de tolerância operacional. Para tal, foram
selecionados 7 miRNAs (miR-1-1, miR-16, miR-31, miR-126, miR-133a, miR-196b,
miR-328) e analisados em 15 indivíduos transplantados renais (em estado de
tolerância operacional n=5, com função do enxerto estável n=5 e com rejeição
crônica ao enxerto n=5) e em 5 indivíduos saudáveis doadores dos órgãos. Apenas
o miR-31 teve expressão diferencial significativa nos linfócitos T de indivíduos
transplantados em relação a indivíduos não transplantados (p< 0,05). Contudo, a
identificação e análise da expressão deste miRNA, pode ser uma ferramenta
importante para a identificação de um biomarcador promissor, além de promover o
melhor entendimento dos mecanismos envolvidos no estado de tolerância
operacional. Esse conhecimento pode futuramente, identificar pacientes, os quais
poderão se beneficiar com a diminuição ou retirada do uso de drogas
imunossupressoras, proporcionar o entendimento das vias imunorregulatórias
envolvidas nesse estado de tolerância ao enxerto e subsidiar o desenvolvimento de
novas terapias e/ou validar moléculas que poderão ser utilizadas como biofármacos.
Palavras-chave: Transplante renal. Tolerância operacional. Linfócitos T. miRNA.
ABSTRACT
Transplantation has become a therapy for multiple organ failure cases from the
development of new surgical techniques associated with potent immunosuppressive
therapies. However, post-transplant rejection or graft failure still a limiting factor for
this type of intervention. The rejection arises primarily from the interaction of T cells
with antigen-presenting cells, the recognition of foreign antigens by T lymphocyte
receptors and signaling by stimulating accessory. Over the last few decades, detailed
knowledge of these molecular mechanisms involved in the recognition of the graft by
T lymphocytes has enabled the development of several approaches and therapies
such as the blocking of costimulation of T cells and alloreactive depletion. It is known
that some transplanted patients spontaneously develop an operational state of
tolerance that ensures survival of the graft. This is a rare condition seen in kidney
and liver transplanted patients and generally made by individuals who discontinued
the use of immunosuppressive drugs on their own due to the numerous side effects
and risk factors associated with the use of these drugs. Induce this operational state
of tolerance, and consequently, maintenance of tolerance without the use of
immunosuppressive drugs and without rejection, are the biggest challenges of the
transplant. Thus, the search for potential biomarkers for rejection or acceptance of
the graft becomes increasingly necessary. In this context, the present study has as
main objective to identify miRNAs differentially expressed in human T lymphocytes
from patients with graft function, with chronic rejection, with operational tolerance and
healthy subjects, whereas more research is needed for a deep understanding of the
role of miRNAs in renal pathophysiology and in the operational tolerance. For this
purpose, 7 miRNAs (miR-1-1, miR-16, miR-31, miR-126, miR-133a, miR-196b, miR328) were selected and analyzed in 15 transplanted kidney patients (with operational
tolerance n = 5, stable graft function n = 5 and chronic graft rejection n = 5) and 5
healthy donor organs. Only miR-31 had significant differential expression in T
lymphocytes in transplanted patients compared to non-transplant (p <0.05). However,
the identification and analysis of the expression of miRNA may be an important tool
for the identification of a promising biomarker, and to promote a better understanding
of the mechanisms involved in the operational state of tolerance. This knowledge
may eventually identify patients who may benefit from the reduction or withdrawal of
immunosuppressive drugs, lead to understanding of the immunoregulatory pathways
involved in this state of tolerance to the graft and subsidize the development of new
therapies and / or validate molecules that may be used as biopharmaceuticals.
Keywords:
Kidney
transplantation.
Operational
tolerance.
T
cells.
miRNA.
LISTA DE FIGURAS
Figura 1. Estrutura gênica do HLA. Classe I (HLA-A, B e C), classe II (HLA-DR, DQ
e DP) e classe III (proteínas do complemento, HSP e TNF). Os genes TAP, LMP e
HLA-DM codificam proteínas que não são expressas nas superfícies celulares. ..... 19
Figura 2. Biogênese e função de miRNA. ................................................................ 35
Figura 3. Caracterização da população de linfócitos T por citometria de fluxo. Os
linfócitos foram colocados em uma região com base no tamanho e granulosidade
(FSC e SSC) (A) e linfócitos T CD3+-PE (B)............................................................. 55
Figura 4. Análise da qualidade do RNA extraído: Gel de agarose 1,2%, com visíveis
subunidades 28S e 18S, indicando a integridade do material. Marcador (M),
Amostras (Ltx 10 – Ltx 43). ....................................................................................... 56
Figura 5. Mapeamento das reads no gene CD28, localizado no cromossomo
humano 21. Em cada isoforma, as linhas mais grossas representam éxons e as mais
finas, regiões de íntrons. A visualização foi feita no UCSC Genome Browser. ......... 71
Figura 6. Mapeamento das reads advindas do banco de dados SRA/NCBI no gene
CD28, localizado no cromossomo humano 21. Em cada isoforma, as linhas mais
grossas representam éxons e as mais finas, regiões de íntrons. A visualização foi
feita no UCSC Genome Browser. .............................................................................. 72
LISTA DE GRÁFICOS
Gráfico 1. Expressão do miR-31 em linfócitos T de indivíduos transplantados renais
e não transplantados. Pacientes com tolerância operacional (TO), pacientes com
rejeição crônica (RC), pacientes estáveis (ES) e indivíduos saudáveis (SA).
*representa a expressão es estatisticamente significativa dos indivíduos saudáveis
em relação aos transplantados renais. ...................................................................... 60
Gráfico 2. Expressão do miR-1-1 em linfócitos T de indivíduos transplantados renais
e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis
(ES) e saudáveis (SA). .............................................................................................. 62
Gráfico 3. Expressão do miR-16 em linfócitos T de indivíduos transplantados renais
e não transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis
(ES) e saudáveis (SA). .............................................................................................. 63
Gráfico 4. Expressão do miR-126 em linfócitos T de indivíduos transplantados
renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC),
estáveis (ES) e saudáveis (SA). ................................................................................ 64
Gráfico 5. Expressão do miR-133a em linfócitos T de indivíduos transplantados
renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC),
estáveis (ES) e saudáveis (SA). ................................................................................ 65
Gráfico 6. Expressão do miR-196b em linfócitos T de indivíduos transplantados
renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC),
estáveis (ES) e saudáveis (SA). ................................................................................ 67
Gráfico 7. Expressão do miR-328 em linfócitos T de indivíduos transplantados
renais e não transplantados. Tolerância operacional (TO), rejeição crônica (RC),
estáveis (ES) e saudáveis (SA). ................................................................................ 68
Gráfico 8. Gráfico boxplot das qualidades das sequências obtidas inicialmente. Eixo
X: posição nas reads em pb. Eixo Y: escala de qualidade PHRED. ......................... 69
Gráfico 9. Gráfico boxplot das qualidades das sequências obtidas depois da retirada
dos adaptadores e das sequências com qualidade <20, segundo a escala PHRED.
Eixo X: posição nas reads em pb. Eixo Y: escala de qualidade PHRED. ................. 70
Gráfico 10. Análise da qualidade das sequências obtidas por novas bibliotecas de
cDNA. Eixo X: tamanho das reads. Eixo Y: escala Phred. ........................................ 73
LISTA DE TABELAS
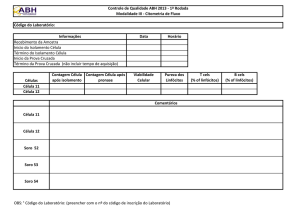
Tabela 1. Dados clínicos dos sujeitos selecionados. ................................................ 52
Tabela 2. Quantidade de células totais, de linfócitos T e de RNA obtido dos linfócitos
T, após separação imuno-magnética de células dos grupos: tolerante operacional
(TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA). ................................... 57
Tabela 3. Valores de fold change dos miR-126 e miR-133a nos indivíduos do
matching 1. Os valores pertencentes ao paciente estável caracteriza um outlier. .... 58
Tabela 4. Número de reads antes e depois da retirada dos adaptadores e das
sequências de baixa qualidade. ................................................................................ 69
Tabela 5. Dados demográficos e clínicos dos indivíduos em estado de tolerância
operaciomal................................................................................................................89
Tabela 6. Dados demográficos e clínicos dos indivíduos em estado de rejeição
crônica........................................................................................................................90
Tabela 7. Dados demográficos e clínicos dos indivíduos com função estável do
enxerto tomando doses habituais de imunossupressores.........................................91
Tabela 8. Dados demográficos e clínicos dos indivíduos saudáveis.........................92
LISTA DE SIGLAS
APCs, antigen-presenting cells
ATG, globulina antitimócita
BCR, B cell receptor
BSA, bovine serum albumin
CD, cluster of differentiation
cDNA, DNA complementar
Cq, Quantification Cicle
CsA, ciclosporina
cTECs, thymic cortical epithelial cells
CTLA, Cytotoxic T lymphocyte antigen
DGCR8, DiGeorge Syndrome critical region 8
DNA, ácido desoxirribonucleico
dNTPS, desoxirribonucleotídeos fosfatados
EDTA, ethylenediamine tetraacetic acid
ES, estáveis
FACS, fluorescence-activated cell sorting
FOXP3, forkhead box protein P3
FSC, Side Scatter
gDNA, DNA genômico
HLA, Human Leukocyte Antigens
HSP, heat shock protein
IL, interleucina
INF, interferon
MALT, mucosa-associated lymphoid tissue
MHC, major histocompatibility complex
MIP-1α, macrophage inflammatory protein
miRNA, microRNA
mRNA, RNA mensageiro
PBMC, peripheral blood mononuclear cells
PBS, phosphate buffered saline
PCR, polymerase chain reaction
pri-miRNA, microRNA primário
qPCR, quantitative polymerase chain reaction
RAG, recombination-activating gene
RANTES, regulated upon activation, normal T cell expressed and secreted
RC, rejeição crônica
RISC, RNA-induced silencing complex
RNA, ácido ribonucleico
rRNA, RNA ribosomal
SA, saudáveis
SFB, soro fetal bovino
SSC, Forward Scatter
STAT, signal transducers and activators of transcription
TCR, T cell receptor
Th, T helper cell
TO, tolerância operacional
TSRI, The Scripps Research Institute
SUMÁRIO
1. INTRODUÇÃO .................................................................................................... 17
1.1 Aspectos gerais do transplante renal .......................................................... 17
1.2 Mecanismos imunológicos ligados à rejeição de transplantes .................... 20
1.3 Mecanismos imunológicos ligados à tolerância ao transplante ................... 23
1.4 Mecanismos de indução de tolerância ao transplante ................................ 26
1.5 Tolerância operacional ................................................................................ 28
1.6 miRNAs ....................................................................................................... 34
1.7 miRNAs COMO BIOMARCADORES da tolerância operacional ................. 37
1.8 Transcritoma, Rna-seq e bioinformática ..................................................... 38
2. OBJETIVOS ........................................................................................................ 42
2.1 Objetivo geral ............................................................................................. 42
2.2 Objetivos específicos .................................................................................. 42
3. DELINEAMENTO EXPERIMENTAL ................................................................... 43
4. MATERIAL E MÉTODOS.................................................................................... 44
4.1 Sujeitos de pesquisa .................................................................................. 44
4.2 Obtenção de células mononucleares de sangue periférico ........................ 45
4.3 Congelamento de células ........................................................................... 45
4.4 Separação das células para obtenção dos linfócitos T ............................... 46
4.5 Citometria de fluxo...................................................................................... 46
4.6 Extração de RNA ........................................................................................ 47
4.7 Quantificação e qualificação do RNA ......................................................... 48
4.8 Tratamento com DNase ............................................................................. 48
4.9 Síntese de cDNA e qPCR........................................................................... 48
4.10 Análise estatística ....................................................................................... 49
4.11 Sequenciamento de alto desempenho ....................................................... 49
4.12 Análise computacional dos dados .............................................................. 50
5. RESULTADOS E DISCUSSÃO .......................................................................... 51
5.1 Sujeitos da pesquisa .................................................................................. 51
5.2 Eficiência e pureza da separação de linfócitos T........................................ 54
5.3 Qualidade e quantidade de RNA ................................................................ 55
5.4 Perfil de expressão de miRNAs em linfócitos T de transplantados renais .. 57
5.4.1 Perfil de expressão do miR-31 .................................................. 59
5.4.2 Perfil de expressão do miR-1-1 ................................................. 61
5.4.3 Perfil de expressão do miR-16 .................................................. 62
5.4.4 Perfil de expressão do miR-126 ................................................ 64
5.4.5 Perfil de expressão do miR-133a .............................................. 65
5.4.6 Perfil de expressão do miR-196b .............................................. 65
5.4.7 Perfil de expressão do miR-328 ................................................ 67
5.5 Sequenciamento de alto desempenho ....................................................... 68
6. CONCLUSÃO E PERSPECTIVAS ..................................................................... 74
REFERÊNCIAS ......................................................................................................... 75
ANEXO A - APROVAÇÃO DO PROJETO PELO COMITÊ DE ÉTICA. .................... 84
ANEXO
B
-
TERMO
DE
CONSENTIMENTO
LIVRE
ESCLARECIDO
E
APROVAÇÃO DO PROJETO PELO COMITÊ DE ÉTICA......................................... 85
ANEXO C - TABELAS COM OS DADOS DEMOGRÁFICOS E CLÍNICOS DOS
SUJEITOS DA PESQUISA........................................................................................ 90
17
1.
INTRODUÇÃO
1.1
ASPECTOS GERAIS DO TRANSPLANTE RENAL
O transplante de órgãos e células hematopoiéticas surgiu como uma solução
para várias patologias. O primeiro transplante de órgão sólido bem sucedido em
humanos foi realizado no ano de 1954, em Boston, por Joseph Edward Murray, que
depois de várias tentativas frustradas transplantou um rim entre gêmeos idênticos e
posteriormente ganhou prêmio Nobel pelo desenvolvimento de técnicas de
transplante de órgãos (GARCIA et al., 2012).
Peter Medawar e Thomas Gibson foram os primeiros a fazer associação entre
o transplante e o sistema imunológico durante a Segunda Guerra Mundial, através
de experimentos que envolviam enxerto de pele em vítimas de queimaduras. Nesses
experimentos, através de biópsias seriadas, eles observaram que enxertos do
próprio indivíduo eram aceitos (auto-enxertos), enxertos de outros indivíduos eram
rejeitados (aloenxertos) e que um segundo aloenxerto igual ao primeiro era rejeitado
de forma acelerada, sugerindo que a destruição do tecido do próprio doador ocorria
por imunização passiva e ainda que esse processo de rejeição é sistêmico e não
local (SIMPSON, 2004).
A
resposta
imunológica
contra
o
enxerto
tem
sido
atribuída
ao
reconhecimento de antígenos do órgão transplantado, apresentados aos linfócitos T
no contexto de antígenos leucocitários humanos HLA (Human Leukocyte Antigens),
as quais, por sua vez, dirigem uma enorme variedade de respostas celulares e
humorais, causando dano tecidual e rejeição do enxerto. Esse tipo de resposta é
mediada pela porção adaptativa do sistema imune (AYALA-GARCÍA et al., 2013).
Corroborando com essa teoria, estudos realizados em camundongos demonstraram
que os animais desprovidos de linfócitos T não rejeitam o enxerto (COELHO;
RAMOS; FILHO, 2007).
O sistema imunológico pode ser dividido em duas porções, a inata e a
adaptativa. A resposta imune inata não é específica e envolve o recrutamento de
diversos componentes do sistema imune, tais como, moléculas solúveis, células
fagocitárias, que liberam mediadores inflamatórios e natural killers. É uma forma de
resposta rápida a agressões, mas não tem habilidade de reconhecimento de certos
antígenos e não se altera quantitativamente ou qualitativamente ao contato prévio
18
com o mesmo agente infectante. Em contrapartida, a resposta imune adquirida
envolve a ativação e proliferação de células especializadas, linfócitos B e T, e das
moléculas solúveis por eles produzidas. É específica, capaz de reconhecer uma
grande diversidade de antígenos, de se tornar mais eficiente após cada encontro
sucessivo com o antígeno, de especialização de resposta, autolimitação e tolerância
a componentes do próprio organismo (DELVES; ROITT, 2000; CRUVINEL et al.,
2010).
Apesar dos linfócitos T serem as principais células envolvidas nos processos
de rejeição ao transplante, as células apresentadoras de antígenos APCs (antigenpresenting cells) desempenham papel fundamental em sua ativação, funcionando
como uma ponte entre o sistema imune inato e o adaptativo. APCs são
especializadas na captura e apresentação de antígenos aos linfócitos por
expressarem em sua membrana plasmática antígenos associados às moléculas do
complexo histocompatibilidade principal MHC (major histocompatibility complex). O
conceito de imunohistocompatibilidade surgiu na década de 30, a partir dos
trabalhos de Peter Gorer. Consequentemente, surgiu um forte estímulo em busca
dos conhecimentos em imunogenética levando à definição do MHC que em
humanos são chamados de antígenos leucocitários humanos (HLA) (AMOS, 1986).
O sistema HLA, descrito por Jean Dausset et al. em 1954 (RAPAPORT et al.,
1965) é um complexo gênico altamente polimórfico que contém mais de 1.000 alelos
diferentes presentes no cromossomo 6 (Figura 1). As moléculas do HLA associadas
a antígenos são exibidas na membrana plasmática de células dendríticas, os
linfócitos T por sua vez reconhecem esses antígenos através de seus receptores de
membrana. Moléculas de HLA-A, B e C correspondem ao MHC de classe I e
apresentam peptídeos endógenos, expressos em todas as moléculas nucleadas do
organismo, aos linfócitos T CD8+. Moléculas de HLA-DP, DQ e DR correspondem ao
MHC de classe II e apresentam peptídeos oriundos de antígenos exógenos aos
linfócitos T CD4+ (DELVES; ROITT, 2000; FENG et al., 2007).
19
Figura 1. Estrutura gênica do HLA. Classe I (HLA-A, B e C), classe II (HLA-DR, DQ e DP) e classe III
(proteínas do complemento, HSP e TNF). Os genes TAP, LMP e HLA-DM codificam proteínas que
não são expressas nas superfícies celulares.
6
Fonte: (SILVA; MORY; DAVINI, 2008).
O processo de apresentação de antígenos aos linfócitos T é extremamente
importante para a sua seleção e maturação no timo. As células pré-T entram no
córtex tímico pelas artérias e durante o processo de seleção e maturação migram
em direção à medula, de onde saem para a circulação. Para que ocorra a maturação
o linfócito T precisa expressar tanto um receptor TCR (T cell receptor) funcional,
quanto co-receptores CD4 e/ou CD8 (ABBAS; LICHTMAN; PILLAI, 2007).
O TCR é expresso na membrana dos linfócitos T em associação com um
complexo denominado CD3, composto por cinco diferentes proteínas da família das
imunoglobulinas, responsável pelo reconhecimento do complexo peptídeo-molécula
de MHC, e o CD3, pela sinalização celular subsequente. A grande diversidade de
repertório dos linfócitos T maduros é gerada pelo processo de recombinação
somática do TCR na qual um dado gene V, entre os diversos possíveis, liga-se a um
dado gene J ou combinação DJ. A recombinação entre os diferentes segmentos é
mediada por enzimas expressas apenas durante a fase de maturação dos linfócitos
(STUTMAN, 1978).
Existem diversos subtipos de linfócitos T efetores e reguladores. Dentre os
efetores destacam-se os auxiliares (Th1, Th2 e Th17) e os citotóxicos (T CD8). Já
dentre
os
reguladores
os
linfócitos
T
são
divididos
em
subpopulações
especializadas. Linfócitos T regulatórios (TREG), subpopulação de linfócitos T CD4+,
foram inicialmente descritos como derivados do timo (SEDDON; MASON, 2000).
Entretanto, outras descobertas apontaram que estas células também podem ser
geradas na periferia (WALDMANN; COBBOLD, 2001). Os linfócitos TREG foram
20
originalmente identificados em camundongos e logo após em seres humanos. Eles
normalmente constituem uma pequena fração dos linfócitos T CD4+ circulantes no
humano adulto e são comumente identificados pela expressão de IL2Rα (CD25)
bem como de FOXP3. Como o próprio nome sugere, são células com papel de
regulação e estão ligadas a manutenção da autotolerância imunológica e no controle
das respostas autoimunes. Existe ainda outra subpopulação de linfócitos (NKT e
LTγδ) que atuam ora como efetoras, ora como reguladoras, representando assim
populações muito heterogêneas do ponto de vista funcional. Desse modo, há grande
interesse no estudo dos subtipos celulares com função regulatórias e de sua
potencial aplicação em tratamentos no âmbito de transplantes e de doenças
autoimunes. (PAPIERNIK et al., 1998; STEPHENS et al., 2001).
1.2
MECANISMOS
IMUNOLÓGICOS
LIGADOS
À
REJEIÇÃO
DE
TRANSPLANTES
No transplante, quanto maiores são as diferenças imunohistoquímicas entre
dois organismos, maior será a reação imunológica contra o transplante. Assim, é
essencial determinar as diferenças entre o HLA de um potencial doador e do
receptor
antes
do
transplante.
Mas
mesmo
depois
de
determinada
a
histocompatibilidade por meio de testes in vitro, quando um indivíduo recebe um
órgão transplantado, seu sistema imunológico é ativado, culminando ou não em
resposta
inflamatória
contra
o
transplante.
Existem
diversas
formas
de
reconhecimento dos transplantes pelo sistema imunológico, as chamadas vias de
alorreconhecimento, do Grego állos que significa reconhecimento do outro, essas
vias se dividem em direta, indireta e semi-direta (CORNELL; SMITH; COLVIN,
2008).
Na via direta de alorreconhecimento, os linfócitos T do indivíduo transplantado
reconhecem diretamente os peptídeos expostos nas células apresentadoras de
antígenos (APCs) do órgão do doador. Isso ocorre devido à frequência elevada de
linfócitos T com especificidade direta ao enxerto, que se deve a um mimetismo
causado por reatividade cruzada entre as moléculas de MHC próprias e as do órgão
transplantado que são reconhecidas pelos linfócitos T do receptor. As APCs do
órgão do doador também podem migrar para os órgãos linfóides secundários,
gerando respostas inflamatórias. Células endoteliais presentes nos vasos do órgão
21
transplantado e células do parênquima do órgão, podem ainda expressar moléculas
de HLA, gerando alorreconhecimento direto (JIANG; HERRERA; LECHLER, 2004).
A via indireta é o modo convencional de apresentação de antígenos pelo
sistema imune e se dá pela mesma forma de apresentação de antígenos derivados
de patógenos. Moléculas do sistema HLA do receptor apresentam peptídeos,
derivados dos antígenos do doador, que foram processados nas APCs, aos linfócitos
T CD4+. As vias diretas e indiretas podem acontecer simultaneamente em um
indivíduo transplantado (CÔTÉ; ROGERS; LECHLER, 2001).
E por último, a via semi-direta, ocorre devida à capacidade das APCs de
transferir moléculas da sua superfície celular para outras células. Estudos mostraram
que células dendríticas apresentadoras de antígenos, adquiriram essas moléculas
de HLA de outras células dendríticas ou de células endoteliais e foram capazes de
apresentá-las de forma eficiente para linfócitos T alorreativos. Essa via cria uma
ligação entre as diretas e indiretas, já que as APCs podem adquirir moléculas de
HLA intactas de células do doador e a mostrá-las aos linfócitos T pela via direta, e
essas mesmas APCs podem apresentar peptídeos, gerados por fagocitose, e
apresentá-los pela via indireta aos linfócitos T CD4+ (JIANG; HERRERA; LECHLER,
2004).
A rejeição imunológica ao transplante é constituída, basicamente, pela fase
de sensibilização e pela fase efetora. Durante a sensibilização ocorre o
reconhecimento do enxerto como estranho ao organismo, através dos mecanismos
de apresentação celular, que conduzem a proliferação de linfócitos T. Na fase
efetora ocorre a infiltração por macrófagos e linfócitos T, no transplante com a
finalidade de destruir o órgão. Os processos de rejeição ao enxerto são classificados
seguindo os critérios Banff. A conferência Banff reúne a cada dois anos uma enorme
equipe de médicos cirurgiões, patologistas, imunologistas, entre outros, para
discutirem novos direcionamentos para transplantes de forma geral. No ano de
2007, levantou várias questões envolvendo o transplante renal (SOLEZ et al., 2008).
De acordo com esses critérios, as rejeições foram classificadas como: aguda ou
crônica, mediadas por anticorpos e/ou por linfócitos T. As agudas geralmente
acontecem poucas semanas após o transplante e as crônicas, ocorrem depois de 3
meses do transplante.
22
Na rejeição aguda mediada por linfócitos T ocorre a infiltração de células
mononucleadas no interstício, seguida por inflamação dos túbulos e por vezes do
endotélio das artérias renais. Dentre as células mononucleares presentes em maior
frequência estão os linfócitos T CD4+ e T CD8+. Além da perforina e granzina,
grânulos dos linfócitos T citotóxicos, e o FasL, um importante efetor do sistema
imune. Outras citocinas e quimiocinas também expressas na rejeição aguda são:
IFN-ϒ, TNF-α e β, RANTES (regulated upon activation, normal Tcell expressed and
secreted) um quimiotático para linfócitos T, eosinófilos e basófilos, MIP-1α
(macrophage
inflammatory
protein)
um
quimiotático
para
leucócitos
polimorfonucleados. Os pacientes com esse quadro clínico desenvolvem uma
elevação abrupta da creatina sérica, retenção de líquidos, febre e até mesmo perda
do enxerto (CORNELL; SMITH; COLVIN, 2008).
A rejeição aguda mediada por anticorpos, geralmente ocorre em pacientes
com exposição prévia a aloantígenos, como aqueles que fizeram transfusões de
sangue, transplantes anteriores, gravidez, entre outros. Os anticorpos são
direcionados principalmente para antígenos do sistema HLA e para moléculas de
MHC expressas nas células endoteliais. Os anticorpos nesse caso atacam regiões
diferentes das atingidas pelos linfócitos T, regiões chamadas de peritubulares e
capilares glomerulares. A rejeição mediada por anticorpos costuma ter um
prognóstico pior do que a rejeição mediada por linfócitos T, necessitando, portanto,
de terapias diferenciadas. É caracterizada por evidência morfológica de agressão
aguda e por presença de fragmentos de C4d que também é utilizado como marcador
diagnóstico na biópsia renal. C4d é um fragmento de C4b, um produto de ativação
da via clássica do complemento. Caracteriza-se também pela ativação das vias da
cascata de coagulação que juntamente com o complemento, recrutam células
inflamatórias (COLVIN, 2007).
A rejeição crônica ocorre por intermédio de mecanismos humorais, celulares
ou ambos, caracterizada por alterações vistas nos glomérulos, túbulos, vasos e
interstícios
renais.
Características
histológicas
da
rejeição
crônica
são
glomerulopatia, capilaropatia peritubular, arteriopatia, e, menos especificamente,
fibrose intersticial e atrofia tubular. Hipertensão arterial e aumento na perda de
proteínas na urina também são características facilmente detectáveis em pacientes
com esse tipo de rejeição ao transplante renal. Os principais fatores imunológicos
23
que estão relacionados à progressão da rejeição crônica são: disparidades de
antígenos HLA entre o doador e o receptor, sensibilização pré-transplante do
receptor dirigido a antígenos HLA, episódios anteriores de rejeição aguda, injúria do
órgão transplantado causada pelo tempo de isquemia e reperfusão pré e/ou durante
a cirurgia e imunossupressão inadequada. A injúria do aloenxerto causada por
isquemia e reperfusão resulta em dano tecidual com consequente resposta
inflamatória e aumento da expressão de moléculas como: HSP (heat shock protein),
moléculas de adesão, citocinas e quimiocinas, que sinalizam a resposta imune
inflamatória (JOOSTEN et al., 2005).
Como
forma
de
prevenir
a
rejeição
ao
enxerto,
vários
agentes
imunossupressores poderosos foram desenvolvidos, tais como a ciclosporina, um
peptídeo cíclico natural que inibe ativação de linfócitos T iniciada por antígenos
específicos, que bloqueia a atividade da calcineurina, uma fosfatase cálciodependente integrante de uma via que induz a expressão de múltiplos genes,
incluindo o fator de crescimento de linfócitos T, a IL2; o tacrolimus, um antibiótico
macrolídeo é outro exemplo de imunossupressor que também inibe a atividade da
calcineurina e é ainda mais potente que a ciclosporina no tratamento da rejeição
aguda a transplantes; o azatioprina e o sirolimus que agem como antiproliferativos
dos leucócitos; o micofenolato mofetil derivado do ácido micofenólico, mais seletivo
que a azatiopina e que inibe proliferação de linfócitos B e T; a rampamicina, outro
antibiótico macrolídeo que tem poderoso efeito inibitório sobre a sinalização dos
receptores da IL2 e sobre o ciclo celular de linfócitos T ativados por antígenos;
anticorpos monoclonais que foram desenvolvidos para alvejar moléculas específicas
em linfócitos T, incluindo moléculas de alta afinidade ao receptor de IL2 que são
expressas em linfócitos T ativados; os glicocorticóides que bloqueiam a transcrição
dos genes de citocinas em linfócitos, células apresentadoras de antígenos e em
outras células imunológicas, entre outros (YU; CARPENTER; ANASETTI, 2001;
MAGEE; PASCUAL, 2004).
1.3
MECANISMOS
IMUNOLÓGICOS
LIGADOS
À
TOLERÂNCIA
AO
TRANSPLANTE
A tolerância imunológica é a maneira pela qual os linfócitos são selecionados
antes de amadurecerem e se tornarem competentes, portanto tolerantes a antígenos
24
próprios, mas capazes de reconhecer antígenos estranhos ao organismo. A
tolerância é classificada em dois tipos, a central quando os linfócitos são
selecionados ainda nos órgãos linfóides primários (timo para linfócitos T e medula
óssea para linfócitos B), e periférica quando selecionados posteriormente nos
órgãos linfóides secundários (baço e linfonodos) e tecidos linfóides secundários
associados a mucosas MALT (mucosa-associated lymphoid tissue) (SAKAGUCHI,
2010).
Durante a maturação dessas células, os receptores dos linfócitos são
produzidos pela geração de uma enorme quantidade de rearranjos gênicos, TCR (T
cell receptor) e BCR (B cell receptor), são receptores de linfócitos T e B,
respectivamente. Os genes que codificam esses receptores são montados a partir
de
fragmentos
variáveis
e
constantes
mediados
pelas
proteínas
RAG
(recombination-activating gene), sendo assim, partindo de um pequeno número de
genes, um grande repertório de receptores é formado, maximizando a diversidade
de receptores através da introdução de sequências variáveis no sítio de
recombinação e regulando o desenvolvimento de linfócitos individuais capazes de
reconhecer um ou um pequeno número de peptídeos (MEDZHITOV, 2007).
Apenas uma minoria de linfócitos T é capaz de reconhecer, tanto moléculas
do MHC próprias do organismo, quanto antígenos estranhos. Muitos linfócitos
imaturos duplamente positivos (T CD4+CD8+), não são capazes de reconhecer
moléculas de MHC próprias, portanto entram em apoptose. Aqueles linfócitos que
expressam TCRs capazes de interagir tanto com antígenos próprios, quanto
estranhos, são selecionados positivamente no cTECs (thymic cortical epithelial
cells), mas se essas células apresentarem alta afinidade por antígenos próprios, elas
serão eliminadas posteriormente pela indução de apoptose ao interagirem com
células dendríticas e macrófagos na medula tímica (seleção negativa). Células
selecionadas podem migrar em direção aos tecidos linfóides periféricos continuando
sua maturação a partir da interação com moléculas MHC de classe I ou II,
determinando assim a maturação em linfócitos T CD8+ ou T CD4+ respectivamente
(ABBAS; JANEWAY, 2000; DELVES; ROITT, 2000).
Acredita-se que esse processo de seleção que ocorre no timo desempenha
um papel importante na autotolerância dos linfócitos T, diminuindo a possibilidade de
maturação e ativação de linfócitos T autorreativos na periferia (COHEN, 2002).
25
Mesmo assim, fisiologicamente existe um grande número de linfócitos T
autorreativos maduros na periferia (COHEN; QUINTANA; MIMRAN, 2004; COHEN,
2007). Estes linfócitos T autorreativos, normalmente não são ativadas e não
induzem autoimunidade, mostrando que existem outros mecanismos de regulação
na periferia que são capazes de manter o estado de tolerância ao próprio, esses
mecanismos envolvem deleção e apoptose, anergia e regulação ou supressão
(AYLA-GARCÍA et al., 2013).
Linfócitos T imunorregulatórios (TREG), como o próprio nome sugere, são
células capazes de suprimir respostas imunes exacerbadas que podem prejudicar o
organismo, além de estabelecer imunidade contra o que não é próprio, tais como os
órgãos transplantados. Para tanto, não é nenhuma surpresa que essas células são
estritamente controladas. Linfócitos T se ligam a qualquer antígeno que entre em
contato com os seus TCRs, mas para que essas células sejam ativadas, gerando
proliferação e diferenciação, é necessário um segundo estímulo que é mediado pelo
sistema imune inato e pelas APCs (ABBAS; JANEWAY, 2000). Uma melhor
definição de TREG se dá pela expressão do principal regulador da transcrição no
+
desenvolvimento de TREG, FOXP3, que confere ao linfócito T CD4 não regulatório
tanto uma função reguladora, quanto um fenótipo regulador. Células que expressam
FOXP3 com atividade regulatória exibem uma variedade de marcadores de
superfície celular incluindo: CD25, CTLA4, CD103, CD134, CD62L, GITR, GARP,
CD39, CD73, TGF-β ligado à superfície, CD127lo e produzem as citocinas antiinflamatórias TGF-β, IFN-γ, IL9, and IL10 (YEH et al., 2013).
Os principais linfócitos T com função imunorregulatória são: linfócitos TREG
(CD4+CD25+), que expressam o fator de transcrição FOXP3 (forkhead box protein
P3) e a cadeia α (alfa) do receptor de IL2 (CD25); linfócitos TR1, que se diferenciam
de linfócitos T CD4+ naive na presença de IL10 e regulam outros linfócitos T; e os
linfócitos Th3 (T helper 3), capazes de impedir reações autoimunes mediante
produção de TGF-β (MESQUITA et al., 2010). Linfócitos TREG, que expressam o fator
de transcrição FOXP3, estão altamente associados à manutenção da homeostase e
da autotolerância. Disfunções ou deficiências nessas células desencadeiam doenças
autoimunes, alergias e imunopatologias. Essas células ainda estabelecem tolerância
a antígenos estranhos ao organismo, por exemplo, a transplantes, portanto esse tipo
26
celular tornou-se o foco central de estudos que envolvem a tentativa da manutenção
desse estado (SAKAGUCHI; WING; YAMAGUCHI, 2009).
Linfócitos TREG podem ser de duas categorias: CD4+CD25+ naturais ou
induzidos. Os naturais se desenvolvem normalmente no processo de maturação de
linfócitos T no timo e no sangue periférico e estão sempre em vigilância normal
contra antígenos próprios evitando respostas autoimunes em potencial. Os induzidos
adquirem atividade supressora a partir de sucessivas ativações e sob condições de
estimulação únicas (SAKAGUCHI; WING; YAMAGUCHI, 2009).
Vários outros mecanismos de regulação, modulação e tolerâncias já foram
descritos. Entre eles, um estudo mostrou que camundongos com deficiência de
CD28, um receptor coestimulatório indispensável para ativação dos linfócitos TREG
CD4+CD25+FOXP3+, desenvolvem severas doenças autoimunes (TAI et al., 2005).
Outro estudo demonstrou que o CTLA-4 (Cytotoxic T lymphocyte antigen), está
associado à supressão de linfócitos T ativados, controlando negativamente os
linfócitos TREG (CHIKUMA; BLUESTONE, 2003). Zheng et al. (2006) reportaram
ainda que a estimulação in vitro de linfócitos T CD4 naive na presença de TGF-β
leva a um aumento na expressão de FOXP3, juntamente com a conversão para o
fenótipo
regulador,
+
a
expressão
do
perfil
de
citocinas
associadas
com
+
TREGCD4 CD25 e aquisição de atividade supressora.
1.4
MECANISMOS DE INDUÇÃO DE TOLERÂNCIA AO TRANSPLANTE
A aceitação de um transplante pelo organismo é um processo longo que
demanda várias combinações de drogas imunossupressoras. Esse tratamento traz
risco a saúde e a qualidade de vida dos transplantados, tais como, infecções
oportunistas e vários efeitos colaterais. Em modelos animais mecanismos são
estudados na tentativa de indução da tolerância, dentre eles destacam-se: indução
do quimerismo linfo-hematopoiético misto, o uso de agentes bloqueadores de
coestimulação e o uso de agentes depletadores de linfócitos T (KEAN et al., 2006).
No quimerismo linfo-hematopoiético misto, células hematopoiéticas são
transferidas do doador para o receptor, com a finalidade de induzir tolerância prévia
ao transplante de órgão, tecidos ou células (ANSARI; SAYEGH, 2004). Para tal,
várias metodologias são empregadas, como por exemplo, a irradiação total do corpo
do receptor para permitir que as células do doador se estabeleçam sem rejeição.
27
Esse modelo mieloablativo implica riscos excessivos de toxicidade. Estudos mais
refinados desenvolveram um protocolo que inclui ciclofosfamida, irradiação tímica e
globulina antitimócita (ATG) com ciclosporina (CsA) e obtiveram sucesso com 2
pacientes que receberam transplante renal de doadores HLA compatíveis e que
foram retirados de todos os regimes imunossupressores. Esses e outros exemplos
que envolvem várias combinações de medicamentos e irradiações pré-transplante
devem ser cuidadosamente estudados, já que o estado de tolerância não depende
apenas de reconhecimento direto pelos linfócitos T, mas também de vários outros
mecanismos supracitados (MATTHEWS; RAMOS; BLUESTONE, 2003).
Linfócitos T necessitam de uma gama de agentes coestimulatórios para sua
ativação completa. O uso de agentes bloqueadores de coestimulação, como o
próprio nome sugere, tem a finalidade de bloquear essas moléculas na superfície
celular para induzir anergia aos linfócitos T, utilizando antagonistas das vias de
sinalização. Técnicas que utilizam esses princípios têm grande potencial, já que
envolvem protocolos que não implicam toxicidade. Mas o grande desafio é bloquear
as diversas vias de sinalização dos linfócitos T, simultaneamente. Os estudos mais
promissores demonstraram efeito sinérgico a partir da combinação de bloqueio de
CD28 e CD154, com ou sem a adição da técnica de quimerismo linfohematopoiético. Outra técnica que obteve sucesso em modelo animal é a
combinação do quimerismo linfo-hematopoiético, com CTLA4lg e com anti-CD154,
isso reduz a necessidade de terapia de radiação, reduzindo portanto, a toxicidade do
quimerismo linfo-hematopoiético originalmente descrito (MATTHEWS; RAMOS;
BLUESTONE, 2003; ANSARI; SAYEGH, 2004).
No estado de tolerância proposto pelo modelo de depleção dos linfócitos T,
uma passageira, mas profunda depleção de linfócitos T redefiniria o sistema imune
para um estado de tolerância a aloantígenos. O uso de anti-CD3, combinado com
imunossupressores obtiveram resultados promissores, podendo ser mais eficaz se
essa terapia for aplicada na fase de reconstituição dos linfócitos T. O uso de
anticorpos monoclonais com essa finalidade já foi aprovado em casos de transplante
renal, mas o uso seguro desses anticorpos ainda é alvo de estudos (MORRIS, 1998;
MATTHEWS; RAMOS; BLUESTONE, 2003). O estudo deste modelo faz parte desse
projeto e está sendo desenvolvido paralelamente a este trabalho com a finalidade de
28
cruzamento final de dados para compreensão das vias imunorregulatórias no
transplante renal, como um todo.
É notório que linfócitos TREG e suas vias estão intimamente ligadas à
manutenção da tolerância, suprimindo a imunidade por vários mecanismos distintos.
O estudo dessas interações é promissor como alvo de terapia clínica, mas um
grande desafio é saber se mecanismos supressivos observados in vitro podem ser
transferidos para situações in vivo, mesmo observando o microambiente em
diferentes órgãos do corpo (WING; FEHÉRVÁRI; SAKAGUCHI, 2006).
1.5
TOLERÂNCIA OPERACIONAL
A tolerância operacional é uma situação clínica definida por estabilização da
função do órgão transplantado sem nenhum indicativo de rejeição crônica e
ausência de qualquer droga imunossupressora, usualmente por mais de 1 ano.
Tolerância operacional “espontânea” já foi descrita em pacientes com transplante
renal e hepático. Tais pacientes oferecem uma oportunidade única de estudo das
condições biológicas e clínicas associadas à tolerância. Um processo de “quase”
tolerância operacional caracterizado por função estável do órgão em pacientes com
baixas doses de drogas imunossupressoras (monoterapia), também é alvo de
estudos (ROUSSEY-KESLER et al., 2006).
Ainda não são conhecidos parâmetros preditivos confiáveis de tolerância, no
contexto clínico. A recomendação clínica usual é de nunca interromper o uso das
drogas imunossupressoras. Portanto, a observação de tolerância operacional ocorre
quando a terapia imunossupressora é interrompida devido aos efeitos colaterais
causados por essas drogas, como nefrotoxicidade e surgimento de neoplasias. E na
maioria dos casos os indivíduos suspendem o uso da imunossupressão por iniciativa
própria. É descrito que após a retirada das drogas imunossupressoras, muitos
indivíduos transplantados renais foram capazes de manter um funcionamento
estável do transplante por um período transitório, mas posteriormente perderam a
função renal. No entanto, outros indivíduos transplantados renais mantiveram uma
função estável do órgão por muitos anos após a retirada das drogas
imunossupressoras, mostrando assim, que o estado de tolerância operacional pode
ser mantido por longo tempo em alguns casos (ASHTON-CHESS; BROUARD;
SOULILLOU, 2006).
29
Como a tolerância operacional parece estar ligada à deleção clonal, à
anergia, ou à uma regulação ativa. Estudos que envolvem seleção e ativação em
sangue periférico de indivíduos que realizaram transplante são os mais realizados. A
partir desses estudos, já foi possível caracterizar que os transplantados
operacionalmente tolerantes têm alterações em linfócitos T clonais no sangue
periférico e que esses linfócitos são principalmente T CD8+ com ausência de
acúmulos de transcrição de citocinas. Esses estudos buscam ainda usar essas
descobertas como marcadores, que poderiam ajudar a identificar indivíduos
tolerantes em potencial (BROUARD et al., 2005; ROUSSEY-KESLER et al., 2006).
Brouard et al. (2007) analisaram células mononucleares do sangue periférico
de 17 pacientes tolerantes operacionais, juntamente com outros grupos clínicos. As
análises por microarranjo identificaram um conjunto de 49 genes que estavam
diferencialmente expressos no grupo de tolerantes operacionais. Em seguida, os 49
genes foram validados por qPCR e 33 deles tiveram acurácia comprovada. Quando
esses 33 genes foram testados em sangue periférico de pacientes com função
estável
ao enxerto, 1 de 12
pacientes estáveis com
terapia tripla de
imunossupressão e 5 de 10 pacientes estáveis com monoterapia de baixa dosagem,
compartilharam o perfil dos tolerantes, sugerindo que é possível selecionar
tolerantes operacionais em potencial dentre os pacientes estáveis ao enxerto.
Foi ainda observado que em pacientes com transplante de fígados os casos
de tolerantes operacionais é mais comum, chegando a 20% dos pacientes.
Martínez-Llordella et al. (2008) analisaram múltiplos parâmetros, incluindo expressão
gênica com microarranjo em sangue periférico de 16 pacientes tolerantes
operacionais. Os genes encontrados incluíam receptores de linfócitos T e células
NK. Curiosamente, o conjunto de genes encontrados em sangue periférico dos
transplantados de fígado, pouco se relacionava com os conjuntos gênicos
encontrados na tolerância operacional de pacientes transplantados renais. Isso pode
ter ocorridos pelas próprias diferenças dos dois tipos de transplante ou pelas
variações técnicas devido ao pequeno número amostral.
Embora ainda não existam marcadores confiáveis para a identificação de
pacientes tolerantes, vários autores já descobriram que tolerantes operacionais
possuem padrões transcricionais únicos no sangue periférico. A diferença nos
padrões de expressão está relacionada com a resposta imune e pode constituir uma
30
base para futuros ensaios que poderão ser usado no diagnóstico de tolerância, a fim
de adaptar melhor a terapia imunossupressora. Mas é importante pensar que outras
variáveis podem desenvolver um papel importante no desenvolvimento do estado de
tolerância. Não se pode contar só com o perfil genético dos indivíduos
transplantados
para
determinar
se
eles
podem
interromper
a
terapia
imunossupressora. Portanto, deve-se associar o transcritoma, com o “imunoma” e
com o “clinicoma” na tentativa de predizer com precisão os possíveis tolerantes
operacionais (BRAZA; SOULILLOU; BROUARD, 2012).
Desde o final dos anos 90, Coelho et al. (1999), pertencentes a este grupo de
estudo, também publicavam artigos com dados importantes que buscavam elucidar
os caminhos de rejeição e aceitação do enxerto pelas células do sistema
imunológico utilizando indivíduos transplantados renais, um dos primeiros trabalhos
mostrou evidências de que a via de alorreconhecimento indireta estava presente no
sangue periférico de transplantados renais com longo tempo de transplante
independentemente de quadros de rejeição ao enxerto.
Em 2001, dando continuidade a esse trabalho, Spadafora-Ferreira et al.
publicaram dois artigos que avaliavam a resposta indireta à alopeptídeos contra
HLA-DR
em
pacientes
renais
transplantados,
pré-transplantados
e
pós-
transplantados em períodos diversos, bem como em indivíduos saudáveis, através
da caracterização do repertório de linfócitos T envolvidos no alorreconhecimento
indireto pela avaliação da proliferação e produção de citocinas por essas células. O
conjunto de dados desses dois estudos demonstrou que os linfócitos T da via de
alorreconhecimento indireta, contradizendo outros estudos, não possuíam papel
inflamatório e sim regulador, surgindo assim à hipótese de que a ativação do
repertório de linfócitos T regulatórios na via indireta de alorreconhecimento pode
induzir um processo ativo de tolerância.
Prosseguindo o estudo, Portugal et al., ainda nesse mesmo ano (2001),
discorreram sobre o repertório de linfócitos T autorreativos em transplantados renais
analisando a resposta proliferativa de células mononucleadas autólogas do sangue
periférico no período pré-transplante e em diferentes períodos pós-transplante, por
técnica de reação de linfócitos autólogos mistos (auto-MLR). E mostraram que foi
encontrada uma intensificada autorreatividade em transplantados renais, sugerindo
que os mecanismos imunológicos pós-transplante podem alterar o repertório de
31
linfócitos T autorreativos. A detecção de resposta proliferativa exclusivamente no
grupo pós-transplantados sugeriu ainda uma alteração significante no repertório de
linfócitos T autorreativos. Mas ainda era preciso esclarecer se essas populações de
linfócitos autorreativos suprimiam a alorreatividade e a inflamação, assim com
descrito para linfócitos T HSP-reativos em artrite reumatoide e artrite experimental
ou se contribuía para a agressão ao enxerto como reportado na autorreatividade
anti-miosina nos pós-transplantados de modelo murino.
Contudo, o grupo decidiu seguir o que sugeria o estudo de artrite reumatoide,
avaliando, portanto, a dinâmica da resposta proliferativa e a produção de citocina
induzida por HSP60 e HSP70 (heat shock protein), com a finalidade de caracterizar
funcionalmente o repertório de linfócitos T anti-HSP no contexto do transplante renal
humano. Para tal, as células mononucleadas do sangue periférico de 36 indivíduos
renais transplantados foram analisadas em vários períodos pós-transplante. E
verificou-se que a produção de interleucina-4 (IL4) induzida por HSP60 estava
associada com a ausência de rejeição imunológica ao enxerto (GRANJA et al.,
2004).
Esse dado foi melhor analisado e no mesmo ano (2004) outro artigo foi
publicado, o objetivo dele era de avaliar a produção de citocinas contra peptídeos
autólogos da HSP60 oriundos de diferentes regiões da proteína em pacientes renais
transplantados em dois momentos pós-transplante, já que dados anteriores
sugeriram que havia predominância de um repertório de linfócitos T autorreativos
pró-inflamatórios no início do pós-transplante (<6 meses) e algum fator regulador em
indivíduos com mais tempo de transplante (>1 ano). O conjunto de resultados
encontrados sugeriu uma predominância de autorreatividade no repertório de
linfócitos T regulatórios anti-HSP, no período mais longo do pós-transplante, que
predominantemente reconhecem peptídeos das regiões intermediárias e C-terminal
da HSP60, esses dados estavam de acordo com o observado no modelo de artrite
reumatoide experimental (CALDAS et al., 2004).
No ano de 2006, o grupo publicou um trabalho ainda maior e com objetivos
mais amplos, foi realizado o estudo do perfil de citocinas da resposta celular
induzida
por
diferentes
estímulos
(peptídeos
e
proteínas)
em
pacientes
transplantados renais. O objetivo era avaliar se a autorreatividade para HSP60
induzia diferentes padrões de citocinas em pós-transplantados (<6 meses e >1 ano)
32
e se esse padrão estava associado com o reconhecimento de diferentes regiões da
molécula de HSP60. Outra pergunta do estudo era se em grupos de pacientes
clinicamente distintos (pacientes estáveis após longo tempo de transplante versus
pacientes com rejeição crônica ao enxerto) havia diferentes populações reativas a
HSP. E por fim, foi investigado se os linfócitos que infiltravam o enxerto eram
capazes de reconhecer a proteína HSP própria e qual era o perfil de citocinas
induzidas por essa proteína. Como conclusão foi observado que, nas células
mononucleadas avaliadas, houve uma predominância da interleucina 10 (IL10)
sendo produzidas por indução da HSP60 durante o período tardio do póstransplante, principalmente em resposta a peptídeos das regiões intermediárias e Cterminal da HSP60, foi relatado ainda que pacientes com rejeição crônica
apresentaram reatividade para HSP60 com maior produção de IL10 em relação aos
pacientes estáveis a longo prazo, sendo assim foi sugerido que apesar de ter
atividade
pró-inflamatória
a
autorreatividade
para
HSP60
no
transplante
provavelmente exercia um papel regulador (CALDAS et al., 2006).
Para um maior respaldo das informações até então descritas, foi avaliada a
proliferação de linfócitos T e a produção de citocinas induzidas por diferentes
regiões de HSP60 recombinante em três linhagens de camundongos, BALB/c(H-2d),
C57BL/6(H-2b) e C3H/HePas(H-2k). A partir disso, foi verificado que resposta
proliferativa foi encontrada predominantemente em camundongos C57BL/6(H-2b), e
na maioria induzida por peptídeos intermediários e N-terminal da proteína HSP60. E
que a produção de interferon-γ (INFG) foi amplamente induzida por diferentes
regiões da HSP60 nas três linhagens de camundongos, embora a resposta tenha
sido focada em diferentes grupos de peptídeos em cada linhagem. Não foi
observado um perfil particular de citocinas de Th1 e Th2 induzidos por alguma
região específica da HSP60. No entanto, foi observada uma hierarquia na produção
de IL10 induzida por peptídeos de diferentes regiões da HSP60 pelas linhagens
C3H/HePas e BALB/c. Em contraste, a produção de IL4 foi induzida somente por
peptídeos das regiões intermediárias e C-terminal das linhagens C3H/HePas e
BALB/c. A hipótese era que a caracterização da reatividade celular para HSP60,
discriminando quais epítopos e sob quais contextos essa proteína induz atividade
funcional diferencial, no transplante humano, poderia ser utilizado como uma
33
alternativa complementar futura ou como uma imunoterapia para controlar a rejeição
(LUNA et al., 2007).
Em seguida foi necessário caracterizar os linfócitos T regulatórios das vias
direta e indireta de alorreconhecimento utilizando células mononucleadas de sangue
periférico
de
indivíduos
transplantados
renais.
Este
trabalho
também
foi
desenvolvido por Spadafora-Ferreira et al. (2007) e visava definir se os linfócitos
TREG participavam ou não da via indireta de alorreconhecimento, a partir da
expressão de FOXP3, além de avaliar o repertório de linfócitos T na via de
alorreconhecimento direta, dado que havia sido descrito por vários autores. Em
resumo, foi encontrado um conjunto funcional de linfócitos T dessa via reativos para
antígenos HLA-DR de doadores, dependentes de IL10 e IL4, sugerindo atividade
regulatória. Foi realizada ainda, a caracterização de linfócitos T CD4+CD25+FOXP3+
que suprimiam a proliferação de outra população de linfócitos T do mesmo paciente
tanto
na
via
direta
como
indireta,
mostrando
que
a
via
indireta
do
alorreconhecimento também está envolvida nos mecanismos regulatórios inerentes
a manutenção do enxerto.
O grupo ainda descreveu a manutenção de linfócitos T CD4+CD25+FOXP3+
no sangue periférico pode ser relevante para o processo de tolerância operacional,
além de outras vias, como a STAT6 (STAT, signal transducers and activators of
transcription) que foi descrita como um inibidor do FOXP3 e que em tolerante
operacional teve um perfil de sinalização alterado com a fosforilação reduzida de
STAT6 em monócitos, sugerindo que a via IL4/STAT6 pode participar do processo
de tolerância imunológica. Esse estudo foi realizado a partir da análise diferencial de
sangue periférico de indivíduos transplantados renais com rejeição crônica, estáveis
e no estado de tolerância operacional e ainda no controle saudável. (VIEIRA et al.,
2010). Utilizando o mesmo grupo de pacientes, outro estudo quantificou o perfil de
expressão gênica de um conjunto de moléculas predominantemente inflamatórias e
imunorregulatórias (FOXP3, GATA3, IL10, TGFB1, TGFBR1/TBX21, TNF e IFNG) e
verificou que foi possível discriminar os tolerantes operacionais dos demais
indivíduos pela expressão significativa do gene GATA3 (VIEIRA et al., 2011).
Por fim, os colaboradores deste trabalho realizaram outro estudo, mas dessa
vez para avaliar o repertório de linfócitos B nos diferentes grupos de indivíduos
transplantados renais (tolerante operacional, rejeição crônica e estável) em
34
comparação com indivíduos saudáveis. Seguindo a hipótese de que o repertório de
linfócitos B, inclusive linfócitos B regulatórios também participam dos processos de
tolerância ao enxerto. Foi descoberto com esse estudo que nos indivíduos tolerantes
operacionais o repertório de linfócitos B se assemelhava com o repertório do grupo
de indivíduos saudáveis, mostrando uma preservação quantitativa, números normais
de linfócitos B totais, naive, de memória e regulatório. Com capacidade conservada
para ativar CD40/STAT3 (via de sinalização dos linfócitos B regulatórios). Enquanto,
os indivíduos com rejeição crônica apresentaram redução do número de linfócitos B
e diminuição significativa na ativação de linfócitos B regulatórios (SILVA et al., 2011).
A descoberta de biomarcadores para a tolerância operacional busca contribuir
para a seleção de agentes imunossupressores, ajustes de dosagens e pode ainda
contribuir para a seleção de pacientes que possam ser tolerantes operacionais em
potencial e que se beneficiariam com a retirada da terapia imunossupressora.
Um biomarcador ideal tem que possuir sensibilidade e especificidade
próximas de 100%, ser de baixo custo e de simples execução e acessibilidade, e
deve, em última análise, impactar na mortalidade associada à doença. Os
biomarcadores detectados em sangue, urina ou fezes são especialmente
interessantes pela facilidade de obtenção dos espécimes, facilidade de repetição
das amostras e mínimo desconforto para os pacientes o garante sua aderência no
caso destes biomarcadores serem utilizados em rastreamento. Neste contexto, os
pequenos RNAs (miRNAs) constituem hoje ferramentas valiosas para o diagnóstico
e prognóstico de várias doenças renais.
1.6
miRNAs
miRNAs são moléculas de RNA endógenas não codificantes de fita única com
cerca de 20-22 nucleotídeos de comprimento. Foram encontrados inicialmente no
nematoide Caenorhabditis elegans em 1993 (LEE; FEINBAUM; AMBROS, 1993).
Desde que foi descrito, também foi encontrado em plantas e mamíferos (BARTEL,
2004). A descoberta e caracterização de miRNA na última década está
revolucionando o entendimento sobre regulação gênica, diferenciação celular,
proliferação, apoptose, metabolismo e fisiopatologia de diversas doenças e
condições imunológicas, incluindo doenças renais e transplante renal (LI et al.,
2010).
35
Os conhecimentos a respeito da biogênese e regulação dos miRNAs foram
expandidos nos último anos. Atualmente sabe-se que a biogênese é realizada em
um
processo complexo
que envolve várias proteínas, dentre elas duas
endonucleases RNase III, Dicer and Drosha. MiRNAs são codificados por DNA
genômico e comumente transcrito pela RNA polimerase II, que gera um transcrito
primário (pri-miRNA) que formam estruturas em grampo, contendo o miRNA maduro
como parte de uma haste com pareamento de dupla fita imperfeito conectado por
um pequeno loop terminal. Os pri-miRNAs são processados pelas proteínas
nucleares DROSHA e seu cofator DGCR8 (DiGeorge Syndrome critical region 8),
resultando na formação de uma molécula em forma de grampo com 70-100pb
chamada de miRNA precursor ou pré-miRNA, que é exportado para o citoplasma
pela exportina-5. No citoplasma a estrutura em forma de grampo é clivada pela
endonuclease DICER, formando duas moléculas de fita dupla de 21-23
nucleotídeos. Depois da separação das duas fitas, uma delas (miRNA maduro) é
transferida para uma proteína ARGONAUTA (Ago) localizada no complexo de
silenciamento induzido por RNA (RISC, RNA-induced silencing complex), que está
envolvido na supressão da expressão gênica por conduzir miRNAs a determinados
mRNAs alvos, enquanto geralmente a outra fita é degradada (Figura 2) (CARTHEW;
SONTHEIMER, 2009).
Figura 2. Biogênese e função de miRNA.
Fonte: (CHANDRASEKARAN, et al. 2012).
36
Sabe-se que os miRNAs geralmente são sintetizados a partir de genes
específicos de miRNA ou de determinadas regiões gênicas que não estão
associadas à produção de proteínas (RODRIGUEZ et al., 2004). DNA que codifica
para miRNAs pode ser encontrado em regiões de íntrons, bem como em regiões
intergênicas (INUI; MARTELLO; PICCOLO, 2010). O processo de maturação dos
miRNAs envolve uma complexa via metabólica que se inicia no núcleo e se estende
até o citoplasma celular (AMBROS, 2004) Os miRNAs exercem suas funções
regulatórias da expressão gênica ligando-se à região 3’ não traduzida (UTR),
sequência codificadora ou 5’UTR de RNAs mensageiros (mRNA) alvos levando à
degradação ou inibição da sua tradução, sendo assim miRNAs são usualmente
reguladores negativos da expressão gênica. Cada miRNA é capaz de regular
centenas de mRNAs de um tipo celular e um mRNA pode ser regulados por
múltiplos miRNAs (VOLINIA et al., 2010), e ainda estima-se que metade do
transcritoma humano está sob regulação de miRNA, incorporando essa via de
regulação pós-transcricional dentro de quase todos os processos biológicos
(CHANDRASEKARAN, et al. 2012; RAISCH, 2013). Os miRNAs são responsáveis
por regular a expressão de cerca de 5.300 genes, ou seja, cerca de 30% de todos os
genes humanos (LEWIS; BURGE; BARTEL, 2005).
Progressos recentes na pesquisa de miRNAs mostraram boas oportunidades
para o entendimento de doenças renais e para a identificação de novos
biomarcadores diagnósticos. O potencial de utilização de miRNAs já foi demonstrado
para câncer em humanos, além de prover melhor acurácia, na classificação de
tumor, quando comparada com a análise de mRNAs (LU et al., 2005). Existem
algumas vantagens para análise de miRNAs sobre mRNAs tais como, maior
estabilidade em tecidos e fluidos biológicos, incluindo soro; e natural proteção contra
RNases endógenas por serem pequenos e talvez por ficarem internalizados dentro
dos exossomos (MITCHELL et al., 2008).
Existem atualmente bases de dados com informações sobre cada miRNAs
descoberto, sobre os quais se armazenam as informações como sequência gênica e
sequência do miRNA, e se fazem ligações por bioinformática sobre as possíveis
conexões de cada miRNA com patologias e processos celulares. De acordo com o
principal banco de dados, miRBase, foram descritos até o presente momento 2237
miRNAs na espécie humana (MIRBASE, 2013a).
37
Avanços na tecnologia hoje permitem detecção de miRNAs com grande
sensibilidade e especificidade. Originalmente, análise de RNA por blot fornecia
informações quantitativas e qualitativas sobre as várias formas de um miRNA a partir
de uma amostra de RNA total. Mas assim como houve aumento nos números de
miRNAs registrados no miRBase, a tecnologia de microarranjo foi adaptada para
buscar milhares de miRNAs de uma mesma amostra. A técnica de PCR em Tempo
Real também foi adaptada para prover análises quantitativas sobre os níveis de
miRNAs. Através dessa técnica é possível gerar grandes quantidades de
informações utilizando uma pequena quantidade de amostra, permitindo análise de
pequenas biópsias, volume limitado de fluido biológico e até de material fixado em
parafina (LI et al., 2010).
1.7
miRNAs COMO BIOMARCADORES DA TOLERÂNCIA OPERACIONAL
O transplante renal surgiu como um ótimo tratamento para pacientes com
doenças renais em estágio terminal. No entanto, para o aumento na sobrevida de
transplantados e a diminuição na morbidade e mortalidade causadas pelos efeitos
colaterais associados ao uso de drogas imunossupressoras, alguns desafios devem
ser transpostos. Ultrapassar esses obstáculos requer a descoberta e validação de
biomarcadores que permitam o reconhecimento precoce de qualquer reposta
imunológica contra o órgão transplantado e melhor entendimento dos processos de
rejeição para o desenvolvimento de terapias mais diretas e a identificação de
pacientes que podem ter suas terapias imunossupressoras diminuídas ou até
retiradas. Como os eventos moleculares precedem o desenvolvimento da resposta
imunológica contra o órgão transplantado, eles fornecem uma oportunidade ideal
para detectar essa resposta antes que um dano significativo ocorra. É possível
detectar algumas alterações por biópsia, mas a habilidade de detectar um sinal em
uma amostra não invasiva tais como, sangue periférico e urina, traz benefícios e
permite um monitoramento prático dos pacientes (CHOWDHURY; HERNANDEZFUENTES, 2013).
Vários estudos já mostraram a diferença de expressão de miRNAs em
desordens
fisiológicas
ou
doenças
(O’CONNELL
et
al.,
2010;
SCHOTT;
STOECKLIN, 2010), inclusive em amostras provenientes de biópsias de pacientes
38
transplantados renais (SUI et al., 2008; ANGLICHEAU et al., 2009; SCIAN et al.,
2011).
No contexto de biomarcadores não invasivos, Danger e et al. (2012)
investigaram a modulação de miRNAs em células mononucleadas de sangue
periférico de 9 pacientes com tolerância operacional comparada a 10 pacientes com
função estável do enxerto sob terapia imunossupressora clássica. A expressão de
381 miRNAs foi mensurada e um total de 266 desses miRNAs estavam expressos
com ciclo de quantificação (Cq) menor que 35 em pelo menos metade das amostras
de cada grupo. Baseado no teste estatístico de Mann-Whitney entre os dois grupos
foram escolhidos oito miRNAs que mostravam claramente a diferença de expressão
entre o grupo de tolerantes operacionais e o grupo de estáveis, sendo 4 miRNAs
muito expressos (miR-450b-5p, miR-142-3p, miR-876-3p, e miR-106b) e 4 miRNAs
pouco expressos (miR-508-3p, miR-148b, miR-324-5p, e miR-98). Outras análises
comparativas com indivíduos saudáveis foram realizadas até que o miR-142-3p
fosse escolhido como o mais específico dentre os oito miRNAs. Foi verificado, então,
sua expressão em subpopulações de leucócitos e foram encontradas as maiores
expressões desse miRNA comparadas com os estáveis nos linfócitos B totais,
purificados a partir de sangue periférico de tolerantes operacionais. Por fim, os
prováveis alvos desse miRNA foram avaliados e foi encontrado que em linfócitos B
provenientes de tolerantes operacionais a expressão de TGF-β1, que tem papel
fundamental na resposta inflamatória, estava aumentada em comparação com
estáveis. Utilizando ferramentas de bioinformática foi possível inclusive predizer a
implicação do miR-142-3p na via do TGF-β. Este estudo atualmente é o único que
mostrou um provável biomarcador da tolerância operacional utilizando indivíduos
com o mesmo contexto clínico que os pacientes deste estudo.
1.8
TRANSCRITOMA, RNA-SEQ E BIOINFORMÁTICA
O transcritoma consiste no conjunto completo de transcritos de uma célula e a
sua quantidade para um determinado estágio especifico do desenvolvimento ou
condição fisiológica, pois avalia o conjunto dos RNAs transcritos, em uma
determinada célula e situação, refletindo a atividade gênica momentânea.
Compreender o transcritoma é essencial para interpretação dos elementos
funcionais do genoma, para revelar constituintes moleculares de células e tecidos e
39
também para a compreensão de doenças e do desenvolvimento. Os principais focos
da análise de transcritomas são: catalogar todos os tipos de transcrição, incluindo
mRNAs, RNAs não-codificadores e miRNAs; determinar a estrutura transcricional de
genes, como os seus sítios de início 5’ e fim 3’, padrões de splicing e outros
modificadores pós-transcricionais; e quantificar os níveis de expressão da mudança
de cada transcrição durante o desenvolvimento e sob condições diferentes (WANG;
GERSTEIN; SNYDER, 2009).
A análise do transcritoma constitui uma excelente ferramenta para estudar a
expressão diferencial dos genes. Geralmente essa análise é feita de forma grosseira
resultando em sequências curtas que são utilizadas como marcadores ou etiquetas
e demonstram a atividade transcricional daquela dada região do genoma. Essa
limitação estava ligada ao método de sequenciamento de Sanger, que demandava
bibliotecas de cDNA e um grande número de sequenciamentos para acumular dados
representativos de EST, porém com advento de técnicas de sequenciamento de
última geração como o pirosequenciamento e o PCR em ponte, criou-se um novo
paradigma operacional. Com essas novas técnicas, múltiplos sequenciamentos são
feitos em paralelo a um custo que representa uma fração daquele realizado com a
tecnologia de Sanger (TORRES et al., 2008; WANG; GERSTEIN; SNYDER, 2009).
Para se realizar um RNA-Seq, em geral, uma população de RNA (total ou
fracionada) é convertida em uma biblioteca de fragmentos de cDNA com
adaptadores ligados a uma ou as duas pontas dessa pequena sequência. Cada
molécula, com ou sem amplificação, é sequênciada em uma plataforma de alto
rendimento para obter sequências curtas de uma extremidade (single-end
sequencing) ou de ambas extremidades (pair-end sequencing). As reads são
tipicamente de 30-400 pb, dependendo da plataforma de sequenciamento utilizada.
Ao final do sequenciamento todas as reads são alinhadas a um genoma referência
ou transcritos de referência ou montado sem um genoma de referência, podendo
assim indicar tanto a estrutura transcricional, quanto o nível de expressão de cada
gene (WANG; GERSTEIN; SNYDER, 2009).
Para comprovar a eficiência do método de sequenciamento de alto
desempenho,
um
estudo
que
consistia
em
demonstrar
o
potencial
do
sequenciamento Illumina para detecção de níveis de expressão de mRNA, foi
proposto, para tal, os dados foram comparados com os resultados obtidos pela
40
técnica de arranjo Affymetrix, utilizando uma mesma amostra de RNA de rim e de
fígado. O estudo mostrou que o sequenciamento Illumina tem alta reprodutibilidade,
com pouca variação técnica, além de ser possível realizar o sequenciamento de
cada amostra de RNA uma única vez utilizando uma única canaleta para isso. O
sequenciamento Illumina também permite análises adicionais, tais como, detecção
de baixos níveis de expressão gênica, variantes de splicing alternativo e novos
transcritos (MARIONI et al., 2008).
Com o aprimoramento das técnicas de sequenciamento, surgiram novos
desafios para a bioinformártica, tais como, o desenvolvimento de métodos eficientes
para armazenar, recuperar e processar grandes quantidades de dados, que devem
ser suficientes para reduzir erros e para remover sequências de baixa qualidade. De
forma geral, uma vez que reads de alta qualidade foram obtidas, a primeira tarefa é
mapear as reads a partir de um genoma de referência ou montá-las em contigs
alinhando a sequência genômica para revelar as estruturas de transcrição. A partir
disso são utilizados softwares que permitem a visualização desse alinhamento e a
confecção de gráficos gerados a partir do tipo de elemento transcricional que se
deseja. Um desafio para o futuro é desenvolver métodos computacionalmente
simples para identificar novos eventos de splicing que ocorrem entre duas
sequências distantes ou entre éxons de dois genes (WANG; GERSTEIN; SNYDER,
2009).
Nesse contexto, análise do perfil de miRNAs nas amostras de linfócitos T,
associado aos dados obtidos por transcritoma e bioinformática, objetivo e
perspectiva deste trabalho, servirão para a descoberta de biomarcadores preditivos
da tolerância operacional. Esse conhecimento busca contribuir para a seleção de
agentes imunossupressores, ajustes de dosagens e pode ainda contribuir para a
seleção de pacientes tolerantes operacionais em potencial e se beneficiarão com a
possível
retirada
da
terapia
imunossupressora.
Pode
ainda
subsidiar
o
desenvolvimento de novas terapias e/ou validar moléculas que provavelmente serão
utilizadas como biofármacos de última geração. Haja vista que o transplante de
órgãos é uma terapia que vem se difundindo com o avanço da medicina. O
desenvolvimento
de
novas
técnicas
cirúrgicas
associadas
a
drogas
imunossupressoras tornou rotineiro o transplante de órgãos. No entanto, a rejeição
41
pós-transplantes ou falência do enxerto, devido à resposta do receptor, ainda é um
fator limitante para esse tipo de intervenção.
O estudo proposto faz parte de um projeto maior intitulado: “Estudo do perfil
imunológico regulador em pacientes com longo tempo de transplante de órgãos
sólidos, em estado de tolerância operacional: bases para novas estratégias
terapêuticas imunomoduladoras na clínica”, coordenado pela Profª. Drª. Verônica
Coelho (INCOR – USP) e está contido dentro dos projetos do Instituto de
Investigação Imunológica – (iii) INCT/CNPq, coordenado pelo Prof. Dr. Jorge Kalil.
Além disso, esse projeto também faz parte do Núcleo de Excelência em Biofármacos
e Imunogenômica, apoiado pelo Edital FAPDF 03/2009 – Programa de Apoio a
Núcleos de Excelência (PRONEX/FAP-DF/CNPq), sob coordenação do Prof. Dr.
Marcelo de Macedo Brígido.
42
2.
OBJETIVOS
2.1
OBJETIVO GERAL
Identificar miRNAs diferencialmente expressos em linfócitos T humanos de
pacientes estáveis, com rejeição crônica, tolerante operacional e indivíduos
saudáveis.
2.2
OBJETIVOS ESPECÍFICOS
a. Analisar os dados clínicos dos sujeitos da pesquisa;
b. Analisar a expressão de miRNAs por meio de qPCR na busca de potenciais
biomarcadores para a tolerância operacional;
c. Transcritoma dos linfócitos T dos indivíduos transplantados renais e dos
indivíduos saudáveis.
43
3.
DELINEAMENTO EXPERIMENTAL
Sujeitos da pesquisa (n=20):
Tolerantes operacionais (n=5);
Rejeição crônica (n=5);
Estáveis (n=5);
Separação das células para
obtenção dos linfócitos T, após
seleção dos grupos
Saudáveis (n=5).
Citometria de fluxo
Extração de RNA
Quantificação e qualificação do
RNA
Síntese de cDNA de miRNAs
qPCR
Análise estatística dos dados
44
4.
MATERIAL E MÉTODOS
4.1
SUJEITOS DE PESQUISA
Os indivíduos do presente estudo provêm do projeto maior coordenado pela
Dr.ª Verônica Coelho (INCOR) e foi devidamente aprovado pela Comissão de ética
para análise de projetos de pesquisa do HCFMUSP (Hospital das Clínicas da
Faculdade de Medicina da Universidade de São Paulo) e da FMUSP (Faculdade de
Medicina da Universidade de São Paulo) (CAPPesp no 1097/05, vide anexo A). As
informações clínicas dos pacientes transplantados renais foram obtidas no
prontuário eletrônico do Serviço de Transplante Renal do HCFMUSP e no serviço de
transplante renal do Hospital São Lucas da PUC-RS com auxílio dos colaboradores
clínicos do projeto. Os indivíduos saudáveis são doadores de pacientes
transplantados renais no HCFMUSP. Todos os participantes deste projeto assinaram
o termo de consentimento livre e esclarecido, aprovado pela comissão de ética da
instituição (anexo A e B). Foram analisados três grupos de pacientes transplantados
renais e um grupo de indivíduos saudáveis e não transplantados, separadamente.
Cada grupo clínico é composto por 5 indivíduos. Os grupos foram dispostos pelas
seguintes características:
A - Grupo Tolerante Operacional: Indivíduos estáveis com longo tempo de
transplante (> 1 ano de transplante), sem uso de drogas imunossupressoras há pelo
menos 1 ano.
B - Grupo Rejeição Crônica: Indivíduos com longo tempo de transplante (> 1
ano de transplante) com rejeição crônica (diagnóstico por biópsia seguindo os
critérios histopatológicos de classificação do rim transplantado - Banff 1997 e 2005
(SOLEZ et al., 2007).
C - Grupo Estável: Indivíduos estáveis com longo tempo de transplante (> 1
ano de transplante) sem uso de drogas imunossupressoras há pelo menos 6 meses,
ou com baixas doses de imunossupressores, seja monoterapia ou terapia com 2
drogas.
D - Grupo Saudável: Indivíduos sadios doadores de transplante renal com
função renal estável analisada através do limite de clearance de creatinina
>45mL/min, não apresentando variação negativa de clearance >10% nos últimos 6
meses.
45
4.2
OBTENÇÃO DE CÉLULAS MONONUCLEARES DE SANGUE PERIFÉRICO
As células mononucleares foram isoladas a partir do sangue de indivíduos
adultos sadios e indivíduos transplantados, obtido por punção venosa em tubos
contendo anticoagulante, EDTA ou heparina. As amostras de sangue coletadas
foram diluídas 1:2 em solução salina isotônica e separadas em gradiente de FicollHypaque (densidade 1.077g/L, Ficoll: Pharmacia Biotech, Sweden e Hypaque:
Urografina 370, Schering, Brasil). Após a centrifugação a 600xg por 25 min, as
células mononucleares (PBMC, peripheral blood mononuclear cells) foram
coletadas, ressuspensas com salina e centrifugadas a 600xg por 10 min. Após a
centrifugação, o sedimento celular foi lavado duas vezes. Nessas lavagens as
células foram ressuspensas em meio RPMI 1640 (Roswell Park Memorial Institute
Medium, Gibco-BRL, Grand Island, NY, EUA) suplementado com 2mM L-Glutamina
(Gibco BRL, Grand Island, NY, EUA), 10mM Hepes (Gibco BRL, Grand Island, NY,
EUA), 0,1ng/mL de Perflacin (Rhodia, SP-Brasil), 1mM de Piruvato de Sódio (Gibco
BRL, Grand Island, NY, EUA) e centrifugadas novamente a 600xg, por 8 min. As
células foram ressuspendidas em 10mL de meio RPMI 1640 e centrifugadas a
400xg, por 8 min, para a remoção de plaquetas. As células foram ressuspensas em
3mL de meio RPMI 1640 acrescido de 10% de soro fetal bovino inativado (SFB)
(Imunoquímica, RJ, Brasil). A concentração e viabilidade celular foram determinadas
por contagem em câmara de Neubauer utilizando-se o corante vital Azul de Tripan
(MCB Manufacturing Chemists Inc., Cincinnati, OH, EUA).
4.3
CONGELAMENTO DE CÉLULAS
As suspensões de células mononucleares foram centrifugadas a 600xg por 8
min e ressuspensas (5 a 20x106 células/mL) em solução de congelamento contendo
90% de SFB (Imunoquímica, RJ, Brasil), e 10% dimetilsulfóxido (Sigma-Aldrich,
Saint Louis, MO, EUA). Alíquotas de 1mL foram distribuídas em tubos de
congelamento (TPP, Switzerland) previamente resfriados e transferidos para
freezers -80ºC por um dia e, posteriormente, para botijões de nitrogênio líquido.
46
4.4
SEPARAÇÃO DAS CÉLULAS PARA OBTENÇÃO DOS LINFÓCITOS T
Os tubos foram transferidos do nitrogênio líquido para o banho-maria a 37ºC
até que o conteúdo estivesse parcialmente descongelado. Essa suspensão de
células foi transferida para outro tubo contendo 10mL de meio RPMI 1640 acrescido
de 10% de SFB. Após isso, as células foram centrifugas a 600xg por 8 min e
ressuspensas em 10mL de meio RPMI 1640 acrescido de 10% de SFB, a viabilidade
celular foi determinada através do corante vital Azul de Tripan (MCB Manufacturing
Chemists Inc., Cincinnati, OH, EUA) pela contagem em câmara de Neubauer.
Primeiramente foi realizada uma separação positiva dos monócitos pela
marcação magnética com CD14 MicroBeads Kit (Miltenyl Biotec Inc., Auburn, CA,
EUA). As células em suspensão foram purificadas em uma coluna MACS® que em
contato com um suporte metálico gera um campo magnético. As células marcadas
magneticamente com CD14+ ficaram presas à coluna, enquanto os outros tipos
celulares passaram livremente e foram coletados em um tubo contendo 3mL de
meio RPMI 1640 acrescido de 10% de SFB. Depois que a coluna foi removida do
suporte os monócitos foram eluidos em um tubo contendo 3mL de meio RPMI 1640
acrescido de 10% de SFB, contados em câmara de Neubauer utilizando o corante
vital Azul de Tripan. As células que passaram livremente pela coluna foram
submetidas a uma nova separação utilizando o Pan T Cell Isolation Kit (Miltenyl
Biotec Inc., Auburn, CA, EUA) que isola os linfócitos T marcando os outros tipos
celulares (seleção negativa). As células que eram de interesse foram marcadas com
um coquetel de anticorpos monoclonais conjugados a biotina e Pan T Cell
MicroBeads. Ao passar as células pela coluna presa ao suporte metálico magnético,
todas as células, exceto os linfócitos T, ficaram aderidas à coluna, enquanto os
linfócitos T passaram livremente e foram coletados em um tubo contendo 3mL de
meio RPMI 1640 acrescido de 10% de SFB, a viabilidade celular foi determinada
através do corante vital Azul de Tripan pela contagem em câmara de Neubauer.
4.5
CITOMETRIA DE FLUXO
Para avaliar a eficiência e pureza da separação celular após a obtenção dos
linfócitos T, as células foram caracterizadas através de marcações imunogênicas.
Para tal, 2x105 células foram transferidas para uma placa de 96 poços, lavadas em
47
tampão MACS® (PBS, BSA, 0.09% Azida e EDTA, Miltenyi Biotec, Bergisch
Gladbach, Germany), e centrifugadas a 500xg por 5 min a 4°C. O sobrenadante foi
descartado e as células foram ressuspensas por forte agitação (vortex) com o
tampão remanescente nos poços. Adicionou-se 25μL dos anticorpos diluídos em
tampão de lavagem FACS (Fluorescence-activeted cell sorting), anti-CD3-PE, antiCD4-FITC, anti-CD19-APC e anti-CD4-PECy5 (BD bioscience®), e icubou-se no
gelo por 30 min protegidas da luz. Em seguida, foram adicionados 150μL de tampão
de lavagem de FACS e as células foram novamente centrifugadas nas condições já
descritas. As células foram ressuspensas em 400μL de tampão de lavagem de
FACS e transferidas para tubos apropriados para o Citômetro FACSCalibur (BD
bioscience®). A leitura da reação no citômetro de fluxo foi realizada no mesmo dia
da reação para evitar a morte celular. O programa utilizado para aquisição e análise
dos dados foi o BD CellQuest Pro™. As células foram adquiridas e selecionadas de
acordo com seu tamanho e granulosidade de maneira a analisar a população de
linfócitos, e a seguir foram contadas 10.000 células para cada amostra dentro da
região de linfócitos. Os dados foram obtidos a partir da análise dos histogramas ou
gráficos de pontos fornecidos pelo programa. Os resultados foram expressos em
percentagem de células positivas para cada marcação em estudo.
4.6
EXTRAÇÃO DE RNA
O RNA foi extraído de acordo com o método (adaptado) proposto por
Chomczynski em 1987 (CHOMCZYNSKI e SACCHI, 1987), no qual se utiliza
solução de TRIzol® (Life Technologies, Grand Island, NY, EUA) para o isolamento
de RNA total. TRIzol® é uma solução monofásica de fenol e isotiocianato de
guanidina que rompe as células mantendo a integridade do RNA. Para a extração,
1mL de TRIzol® para 1-5x106 células foi adicionado. As amostras foram
homogeneizadas por pipetagens repetidas, após a homogeneização foram
adicionados 200μl de clorofórmio RNAase free (Merck, Darmstadt , Germany) por
mL de TRIzol® e a amostra foi agitada vigorosamente por 15 seg. Após agitação, a
amostra foi incubada por 2 a 3 min à temperatura ambiente e centrifugada a
12000xg por 15 min, a 4ºC. Após a centrifugação, há uma separação de fases e o
RNA encontra-se localizado na fase aquosa. Essa fase foi transferida para um novo
tubo, 1μl de GlycoBlue™ (15mg/mL, Applied Biosystems/Ambion, Austin, Texas,
48
EUA) foi adicionado e o RNA foi precipitado com 500μL de isopropanol. A amostra
foi agitada vigorosamente e congelada a -80ºC. Após essa etapa as amostras foram
descongeladas e centrifugadas por 20 min a 12000xg a 4ºC. O sobrenadante foi
removido e 500μL de etanol 75% foram adicionados, seguido por centrifugação a
12000xg por 10 min a 4ºC. O sobrenadante foi descartado e o sedimento deixado
secar até o precipitado mudar de cor. O precipitado foi, então, ressuspendido em
12μL de água DEPC (água tratada com Diethylpyrocarbonato, Invitrogen, Carlsbad,
CA, EUA). Este material foi mantido a -80ºC até o momento da utilização.
4.7
QUANTIFICAÇÃO E QUALIFICAÇÃO DO RNA
Após
a
extração,
o
RNA
obtido
foi
quantificado
pela
leitura
em
espectrofotômetro (NanoDrop®, Thermo Fisher Scientific Inc., Wilmington, DE, EUA)
nos comprimentos de onda (λ) de 260/280nm e 260/230nm. O grau de pureza da
amostra foi verificado através da análise da relação entre 260/280nm e 260/230nm
sendo considerada uma boa extração aquela que apresentasse valores de razão
~2,0. Uma alíquota de RNA foi submetida à eletroforese em gel de agarose RNase
free 1,2% para visualização da qualidade das amostras, permitindo, assim, a
observação das duas subunidades do RNA ribossômico, 18S e 28S. Como
marcador de massa molecular o High DNA Mass ladder (Invitrogen®, Carlsbad, CA,
EUA) foi utilizado.
4.8
TRATAMENTO COM DNase
Verificada a presença de gDNA nessas amostras de RNA, procedeu-se o
tratamento destas com DNase I. As amostras de RNA foram então incubadas a 37°C
durante 45 minutos com DNAse I. Após o tratamento, essas amostras foram
precipitadas com 10% de sal (Acetato de sódio 3M; pH 5,2) e isopropanol durante
20 horas a -20°C. Em seguida foram centrifugadas a 1.2000 rpm durante 45
minutos a 4°C e posteriormente lavadas com álcool 70%.
4.9
SÍNTESE DE cDNA E qPCR
A expressão individual de miRNA foi avaliada com Taqman miRNA
assays (Applied Biosystems™) usando sondas previamente validadas: miR-1-1
49
(assay ID: 002222), miR-16 (assay ID: 000391), miR-31 (assay ID: 002279), miR125b (assay ID: 000449), miR-126 (assay ID: 002228), miR-133a (assay ID:
002246), miR-196b (assay ID: 002215), miR-328 (assay ID: 000 543), miR-650
(assay ID: 001603), e miR-let7a (assay ID: 000377) e como constitutivo foi utilizado
o miRNA RNU48 (assay ID: 001006). A biblioteca de cDNA foi sintetizada usando
miRNA reverse transcription kit (Applied Biosystems™). Foi utilizado 10ng de RNA
total para preparação da biblioteca. Para cada reação de 10 μL de material foi
realizado um pool com 8 sondas adicionando-se 1 μL de 10mM de dNTPs, 0.8 μL
de MultiScribe Reverse Transcriptase, 1μL de Buffer, 0.2μL de RNase Inhibitor e
Primers RT (0.5 μL de cada sonda). As reações foram incubadas no termociclador
Veriti Cycler (Applied Biosystems™) por 30 minutos a 16 °C, 30 minutos a 42 °C, 5
minutos a 85 °C. As amostras foram diluídas na razão de 1:5 para a análise de
qPCR. Os ensaios de qPCR foram realizados usando TaqMan® Universal Master
Mix II, no UNG (Applied Biosystems™). As reações foram processadas, e incubadas
no sistema Step One Plus® ( Applied Biosystems™) a 95 °C por 10 minutos,
seguido por 40 ciclos de 95 °C por 10 segundos e 60 °C por 10 minutos. Todos os
ensaios foram feitos em triplicata. A expressão relativa entre as amostras foi
calculada de acordo com o método 2-ΔΔCq. O modelo de utilização de 8 sondas foi
validado a partir da sua comparação do método convencional que utiliza apenas
uma sonda por reação de cDNA utilizando um mesmo alvo com eficiência
comprovada.
4.10
ANÁLISE ESTATÍSTICA
O teste de Kolmogorov-Smirnov foi utilizado para verificar a normalidade da
média e desvio padrão dos dados obtidos no programa SPSS 20. Em seguida, foi
aplicado uma análise de variância, ANOVA One Way, com utilização de post hoc de
Bonferroni no programa GraphPad Prism v.6 para Windows que também gerou os
gráficos. O nível de significância adotado foi de p < 0.05, ou seja, 95% de
confiabilidade.
4.11
SEQUENCIAMENTO DE ALTO DESEMPENHO
O sequenciamento de alto desempenho das amostras de cDNA (RNA-seq) foi
realizado em um aparelho Illumina HiSeq, pelo The Scripps Research Institute
50
(TSRI) localizado em La Jolla, CA, EUA. O RNA total extraído das células T (150ng)
foi liofilizado em um tubo RNA stable® (Biomatrica, San Diego, CA, EUA) e enviado
para o centro de sequenciamento. Para a preparação da biblioteca de cDNA utilizouse o Encore Complete DR RNASeq kit (Nugen, San Carlos, CA, EUA) que consiste
no enriquecimento de todos os RNAs não ribossomais, durante a síntese de cDNA,
para geração de bibliotecas compatíveis com o sequenciamento de alto
desempenho. Para tal, primeiramente a síntese de cDNA é realizada utilizando
primers que se ligam a dupla fita de cDNA, não se fazendo necessário nenhum
passo para depleção de rRNA. Depois de pronta, a biblioteca de cDNA foi
fragmentada e adicionou-se a cada fragmento adaptadores correspondente ao
Illumina, a esses fragmentos também adicionou-se uma pequena sequência
identificadora (barcode) para identificar cada RNA. O método utilizado para a leitura
dessas sequências foi o paired-end, gerando então duas sequências (reads) para
cada fragmento de 100pb de RNA.
4.12
ANÁLISE COMPUTACIONAL DOS DADOS
Os dados recebidos do centro de sequenciamento foram processados no
laboratório de Bioinformática da UnB sobre supervisão do professor Marcelo de
Macedo Brígido. Todo o processamento foi feito em servidores dedicados e os
resultados organizados em relatórios via web. Os dados foram processados por
programas livres (open source innitiative) que compararam as sequências obtidas
experimentalmente com o genoma de referência, neste caso o genoma humano
(National Center of Biotechnology Information/genoma-hg19p10). Um pipeline de
análise, armazenamento e visualização desses alinhamentos foi utilizado e
visualizado no UCSC Genome Browser. De posse das reads em formato fastq, o
primeiro passo foi analisar a qualidade dos dados gerados por meio do programa
FASTQC. Após esta etapa foi realizada a filtragem de reads, retirando-se os
adaptadores e as reads que possuíam valor abaixo de 20, segundo a escala
PHRED. Em seguida, cada par de reads foi alinhado utilizando-se o programa
Segemehl ao conjunto de todos os cromossomos humanos simultaneamente. Foi
utilizada a opção split no programa Segemehl, a qual considera os alinhamentos dos
pares de reads parciais e distantes entre si, com o intuito de permitir a detecção de
possíveis processamentos alternativos dos RNAs.
51
5.
RESULTADOS E DISCUSSÃO
5.1
SUJEITOS DA PESQUISA
Os indivíduos que participam deste estudo foram escolhidos e segregados em
grupos de acordo com as suas condições clínicas, e em seguida separados em
Matching a partir de afinidades, tais como idade, sexo e tempo de transplante. No
total foram escolhidos 20 indivíduos, dentre eles 5 indivíduos saudáveis (doadores
de órgãos), 5 pacientes com tolerância operacional, 5 pacientes estáveis e 5
pacientes renais crônicos (Tabela 1). Os demais dados clínicos como, por exemplo:
doença de base, disparidades HLA, tipo de doador (falecido ou vivo), função
retardada ao enxerto, terapia de indução, presença de rejeição aguda ou crônica,
podem ser encontrados no Anexo C.
52
Tabela 1. Dados clínicos dos sujeitos selecionados.
Matching
Tempo de
Indivíduos
Grupo
Sexo
Idade
Ltx 03
TO
M
54
25
Ltx 25
RC
M
51
15
Ltx 28
ES
M
56
36
Ltx 41
SA
M
39
-
Ltx 08
TO
M
41
7
Ltx 04
RC
M
46
6
Ltx 09
ES
M
47
6
Ltx 36
SA
M
42
-
Ltx 10
TO
F
42
9
Ltx 13
RC
F
45
11
Ltx 14
ES
F
45
4
Ltx 40
SA
F
34
-
Ltx 75
TO
ND
ND
ND
Ltx 67
RC
F
41
13
Ltx 27
ES
F
47
24
Ltx 37
SA
F
52
-
Ltx 62
TO
M
31
14
Ltx 05
RC
M
35
9
Ltx 31
ES
M
56
7
Ltx 43
SA
M
30
-
1
2
3
4
5
transplante
Saudável (SA), rejeição crônica (RC), tolerante operacional (TO), estável (ES), ND: não disponível.
Uma limitação importante nos estudos da tolerância operacional, no contexto
do transplante renal humano, é o pequeno número de indivíduos. Tolerância ao
enxerto, sem a necessidade de imunossupressão, é uma condição rara, geralmente
apresentada
por
indivíduos
que
suspenderam
o
uso
dos
medicamentos
imunossupressores por conta própria devido aos inúmeros efeitos colaterais e
fatores de risco associados ao uso dessas drogas (SOULILLOU e GIRAL, 2001;
NANKIVELL et al., 2003; HALLORAN, 2004). Assim os trabalhos envolvendo
transplante renal, apresentam grupos pequenos de indivíduos. Em 2005, Brouard et
al., publicaram seus trabalho com 5 indivíduos tolerantes operacionais provenientes
53
de toda a França. No final de 2012 o mesmo grupo utiliza 27 pacientes tolerantes
operacionais provenientes de toda a Europa (BROUARD, 2012). Atualmente,
colaboradores deste trabalho possuem amostras biológicas de 7 indivíduos em
estado de tolerância operacional provenientes de todo o Brasil, dois não foram
incluídas nesse estudo, um por falta de material e outro por ter sido inserido no
projeto após o início deste trabalho.
Analisando as principais características clínicas e de função renal dos
diferentes
grupos
de
indivíduos
inseridos
no
estudo,
percebe-se
que
a
glomerulonefrite crônica foi a doença de base mais comum (8 dos 15 indivíduos
transplantados renais) e apresentada por todos os indivíduos com rejeição crônica.
Várias outras doenças de bases foram observadas (Anexo C), mas sem que
nenhuma outra se destacasse. Outra observação foi que todos os indivíduos
estáveis apresentaram 3 disparidades HLA e o grupo de indivíduos com rejeição
crônica apresentou o maior número de disparidades HLA em maior parte dos
indivíduos desse grupo (3 indivíduos com 6 disparidades HLA). Não se destacou
nenhuma outra característica, entre os diferentes grupos de estudo, a fatores como
número de transfusões sanguíneas, sexo, idade, número de gestações e tempo de
diálise no que diz respeito à evolução clínica e desfecho para rejeição crônica ou
tolerância operacional (Anexo C).
O grupo de indivíduos com rejeição crônica apresentou uma maior frequência
(3 dos 5 indivíduos) de doadores cadavéricos e função retardada do enxerto (FRE)
(4 de 5 indivíduos) quando comparado com todos os outros grupos de estudo
(Anexo C). Apesar dos enxertos oriundos de doadores falecidos (TERASAKI et al.,
1995a; TERASAKI et al., 1995b) e com FRE (WHITTAKER et al., 1973; HALLORAN
e HUNSICKER, 2001), em geral, apresentarem uma pior evolução clínica após o
transplante, vale ressaltar que há um indivíduo (Ltx08) com enxerto de doador
falecido e com FRE entre os tolerantes operacionais, neste trabalho e outros
descritos na literatura (ROUSSEY-KESLER et al., 2006; NEWELL et al., 2010;
SAGOO et al., 2010). Desta forma, esses fatores não parecem ser os únicos
determinantes para o desenvolvimento de rejeição crônica, visto que o perfil
imunológico diferencial do grupo TO foi, também, observado no indivíduo Ltx08.
Assim, outros fatores desencadeados pelo sistema imune devem atuar na evolução
do enxerto de cada indivíduo.
54
O grupo de indivíduos com rejeição crônica apresentou os maiores níveis de
creatinina sérica (ANEXO C), um importante indicador de lesão renal, corroborando
com dados estabelecidos na literatura nos quais a rejeição crônica é, geralmente,
caracterizada por uma lenta disfunção renal, resultando em um aumento progressivo
da creatinina sérica e, geralmente, também acompanhada de proteinúria e
hipertensão arterial (JOOSTEN et al., 2005). Entretanto, não foi observada diferença
significativa em relação ao grupo de tolerantes operacionais. Apesar disso, o grupo
TO apresentou estabilidade da função renal ao longo do tempo sem uso de
imunossupressores enquanto o grupo RC apresentou uma deterioração da função
renal, mesmo fazendo uso de terapia imunossupressora, com confirmação do seu
estado por biópsia. Além disso, o grupo TO não apresentou diferenças significativas
em relação ao grupo SA. Provavelmente, os resultados encontrados aqui devem
estar refletindo os processos imunológicos desencadeados por condições tão
contrastantes como tolerância operacional e rejeição crônica.
5.2
EFICIÊNCIA E PUREZA DA SEPARAÇÃO DE LINFÓCITOS T
A partir do sangue periférico, as células mononucleadas desses indivíduos
foram coletadas e armazenadas no laboratório de imunologia do INCOR-SP e
posteriormente fracionadas por tipos celulares, conforme descritos em material e
métodos.
O fenótipo e morfologia da população dos linfócitos T enriquecidos foram
analisados por citometria de fluxo e microscopia de luz. Para identificar populações
de linfócitos, primeiramente, utilizando o programa CellQuest foi feito uma seleção
nas
células
com
base
nas
propriedades
de
tamanho
e
granulosidade,
respectivamente, FSC (Side Scatter) e SSC (Forward Scatter). (Figura 3A). A partir
dessa região, os linfócitos T com marcação positiva para CD3 foram selecionados
(Figura 3B).
55
Figura 3. Caracterização da população de linfócitos T por citometria de fluxo. Os linfócitos foram
colocados em uma região com base no tamanho e granulosidade (FSC e SSC) (A) e linfócitos T
CD3+-PE (B).
O enriquecimento imuno-magnético dos linfócitos T utilizados nesse estudo foi
eficiente, resultando em uma população linfócitos T altamente viável e pureza de
98,2% (Figura 3B).
5.3
QUALIDADE E QUANTIDADE DE RNA
Confirmada a pureza dos linfócitos T obtidos, o RNA total de todas as
amostras foi extraído e como pode ser visualizado na Figura 4, as moléculas de
RNA apresentaram-se íntegras e de boa qualidade, com as bandas ribossomais 28S
e 18S evidentes, sem rastro e sem contaminação de DNA genômico. (Tabela 2,
Figura 4).
56
Figura 4. Análise da qualidade do RNA extraído: Gel de agarose 1,2%, com visíveis subunidades
28S e 18S, indicando a integridade do material. Marcador (M), Amostras (Ltx 10 – Ltx 43).
A maior concentração de RNA obtida foi de 1.062,89 ng/µl, a partir de 1,1X107
linfócitos T provenientes de 1,5X107 células de PBMC total. E a menor quantidade
de RNA obtida foi de 346,99 ng/µl, a partir de 2,4X106 linfócitos T provenientes de
6,6X106 células de PBMC total. A média da concentração de RNA foi de 572,93
ng/µl levando em consideração os 20 sujeitos da pesquisa (tabela 2).
57
Tabela 2. Quantidade de células totais, de linfócitos T e de RNA obtido dos linfócitos T, após
separação imuno-magnética de células dos grupos: tolerante operacional (TO), rejeição crônica (RC),
estáveis (ES) e saudáveis (SA).
Matching Indivíduos
1
2
3
4
5
5.4
PERFIL
Grupo
PBMC
Linfócitos T
[ ] RNA ng/µl
Ltx 03
TO
1,0 X 107
3,1 X 106
547,69
Ltx 25
RC
1,6 X 107
1,3 X 107
457,46
Ltx 28
ES
6,6 X 106
2,4 X 106
346,99
Ltx 41
SA
1,3 X 107
1,1 X 107
696,00
Ltx 08
TO
6,6 X 106
1,7 X 106
714,34
Ltx 04
RC
7,2 X 106
3,1 X 106
474,53
Ltx 09
ES
1,6 X 107
6,3 X 106
860,41
Ltx 36
SA
6,0 X 106
3,1 X 106
456,97
Ltx 10
TO
1,0 X 107
3,8 X 106
726,00
Ltx 13
RC
1,5 X 107
3,1 X 106
381,44
Ltx 14
ES
8,7 X 106
3,8 X 106
475,90
Ltx 40
SA
7,0 X 106
3,5 X 106
686,00
Ltx 75
TO
1,5 X 107
1,1 X 107
1.062,89
Ltx 67
RC
1,5 X 107
4,5 X 106
561,71
Ltx 27
ES
1,8 X 107
6,6 X 106
423,72
Ltx 37
SA
2,0 X 107
6,0 X 106
474,55
Ltx 62
TO
2,1 X 107
2,7 X 106
560,64
Ltx 05
RC
1,4 X 107
3,1 X 106
646,45
Ltx 31
ES
7,8 X 106
5,0 X 106
371,05
Ltx 43
SA
9.4 X 106
5,7 X 105
534,00
DE
EXPRESSÃO
DE
MIRNAS
EM
LINFÓCITOS
T
DE
TRANSPLANTADOS RENAIS
Um total de 19 miRNAs (miR-1-1, miR-16, miR-31, miR-126, miR-133a, miR196b, miR-328, miR-146a, miR-let-7a, miR-99a, miR-100, miR-145, miR-378, miR650, miR-1275, miR-570, miR-125b, miR-499 e miR-499b-3p), juntamente com 2
miRNAs constitutivos (RNU48 e RNU6b), foram selecionados para serem testados
58
pela técnica de qPCR nos indivíduos pertencentes ao matching 1 (tolerante
operacional Ltx03, rejeição crônica Ltx25, estável Ltx28 e saudável Ltx41).
Logo nas primeiras análises, percebeu-se que havia um indivíduo estável
(Ltx28) apresentando valores de fold change muito acima dos demais indivíduos,
caracterizando claramente um outlier. Para ilustrar tal situação, dois exemplos se
encontram na tabela 3 abaixo. Este indivíduo permaneceu nas análises posteriores,
mas com a utilização de devidas correções de outliers (COUSINEAU e CHARTIER,
2010).
Tabela 3. Valores de fold change dos miR-126 e miR-133a nos indivíduos do matching 1. Os valores
pertencentes ao paciente estável caracteriza um outlier.
miRNA
miR-126
miR-196b
Grupo clínico
TO
RC
ES
SA
TO
RC
ES
SA
Fold change
2,96
2,38
1127,22
1,05
2,85
8,22
72,93
1,09
Para as análises posteriores excluiu-se os miR-499 e miR-499-3p que não
apresentaram expressão nas amostras analisadas e os miRNAs com média de Cq
(Quantification Cicle) superiores a 35 (dados não mostrados) para a maioria das
amostras testadas (miR-145, miR-378, miR-570, miR-125b, miR-let-7a, miR-99a,
miR-100 e miR-650), incluindo o miRNA constitutivo RNU6b que não se mostrou um
bom controle para o material em questão. Os miR-146a e miR-1275, apesar de
apresentarem média de Cq superiores a 35 mostraram níveis de expressão linear,
sem alterações entre os grupos de estudos, portanto excluídos das análises
posteriores.
Por fim foram escolhidos 7 miRNAs (miR-1-1, miR-16, miR-31, miR-126, miR133a, miR-196b, miR-328) que foram expressos com um ciclo de quantificação (Cq)
inferior a 35 e que se destacaram dos demais por apresentarem possibilidade de
servir como biomarcadores. Todos os outros indivíduos deste estudo foram testados
para estes 7 miRNAs escolhidos e prosseguiu-se com as análises de normalidade
59
dos dados, tratamento para correção de outliers e aplicação do teste ANOVA one
way de acordo com o descrito na sessão 4 (Material e Métodos).
A partir da análise estatística, dentre os outros sete miRNAs analisados,
somente um foi diferencialmente expresso entre os grupos de indivíduos (miR-31). A
análise da expressão basal entre os indivíduos saudáveis mostrou um perfil
extremamente regular para todos os miRNAs selecionados, sugerindo que todos
esses miRNAs regulam situações nos pacientes transplantados renais que não
estão presentes nos indivíduos saudáveis. Lembrando que os transplantados renais
tiveram alguma doença de base que levou ao transplante, muitos fizeram diálise e
transfusões sanguíneas previamente ao transplante, alguns tiveram quadros de
rejeição aguda ou crônica, outras comorbidades diversas, entre tantas outras
variáveis passíveis de uma avaliação mais detalhada (ANEXO C).
A análise da expressão diferencial de miRNAs no contexto da tolerância
operacional do transplante renal humano é um novo caminho que começou a ser
explorado recentemente, haja vista que existe apenas um trabalho na literatura que
encontrou o miR-142-3p (DANGER et al., 2012) como um provável biomarcador da
tolerância operacional utilizando indivíduos com o mesmo contexto clínico que os
pacientes deste estudo. Contudo, este trabalho busca contribuir para a inserção de
fatores de extrema relevância científica.
5.4.1 Perfil de expressão do miR-31
O miR-31 já é bem estabelecido como supressor de tumor em câncer de
mama, com a sua expressão variando de acordo com o estágio de metástase do
tumor. Além de ser um possível alvo terapêutico para esse tipo de câncer
(MIRBASE, 2013b).
Já foram validados 34 alvos desse miRNA (DIANA TOOLS – TARBASE,
2013a), dentre eles o FOXP3 que é o maior regulador (fator de transcrição)
envolvido no desenvolvimento e função dos linfócitos TREG.
Como pode ser observado no Gráfico 1, o miR-31 é reprimido nos linfócitos T
de indivíduos transplantados em relação a indivíduos não transplantados com nível
de significância de p < 0.05.
60
Gráfico 1. Expressão do miR-31 em linfócitos T de indivíduos transplantados renais e não
transplantados. Pacientes com tolerância operacional (TO), pacientes com rejeição crônica (RC),
pacientes estáveis (ES) e indivíduos saudáveis (SA). *representa a expressão es estatisticamente
significativa dos indivíduos saudáveis em relação aos transplantados renais.
Estudos mostram que o miR-31 é significativamente reprimido em linfócitos
TREG Ele modula os níveis de expressão da proteína FOXP3 por se ligar diretamente
ao seu potencial alvo situado na região 3’ UTR do mRNA FOXP3. (ROUAS et al.,
2009; TY, 2011; SETHI et al., 2013). O papel imunomodulatório desses linfócitos T
CD4+CD25+FOXP3+ já é bem estabelecido, eles constituem 5-10% do repertório
total de linfócitos T CD4+ em humanos e camundongos e suprimem a expansão e
ativação de outros linfócitos T autorreativos que escaparam da seleção negativa no
timo (YAGI et al., 2004). Em humanos, mutações em FOXP3 causam desregulação
imunitária,
poliendrocrinopatia,
enteropatia,
síndrome ligada
ao
X,
que
é
caracterizada por alta incidência de doenças autoimunes incluindo o diabetes tipo 1
e tireoidite, doença inflamatória intestinal e alergias, tais como, dermatite atópica e
alergia alimentar (CHATILA et al., 2000; WILDIN et al., 2001; BENNETT et al., 2001).
O papel dos linfócitos TREG na tolerância de transplantes tem sido
extensivamente documentado (SAKAGUCHI, et al., 2001; WOOD e SAKAGUCHI,
2003; JONULEIT, ADEMA e SCHMITT, 2003). Estudos em medula óssea e
transplante de órgãos sólidos têm mostrado que os linfócitos TREG possuem
habilidade para regular a rejeição a aloenxertos por linfócitos T CD4+ e CD8+
alorreativos (HARA, et al., 2001 e GRACA et al., 2002). Assim linfócitos TREG têm
61
sido propostos como um importante fator que contribui para a manutenção da
tolerância ao enxerto.
A partir da supracitada relação direta desse miRNA com linfócitos T
imunorregulatórios, inferimos que quanto mais reprimido o miR-31 estiver, maior
será a expressão de FOXP3 nos linfócitos T CD4+, com consequente fenótipo e
função de imunorregulação por parte dessas células. Logo, os indivíduos
transplantados renais necessitam de mais regulação à células e tecidos alorreativos
por parte das TREG, do que os indivíduos saudáveis, se encaixando perfeitamente no
perfil encontrado em nossas análises.
Os miRNAs constituem hoje ferramentas valiosas para o diagnóstico e
prognóstico de várias doenças renais. Cada vez mais são encontrados miRNAs
exercendo papéis importantes na regulação do desenvolvimento, fisiologia, e
manutenção da microestrutura do rim. Embora os perfis de expressão de miRNAs
em várias doenças renais já tenham sido examinados, mais estudos são
necessários para uma compreensão profunda da função dos miRNAs na
fisiopatologia renal, principalmente no que tange o transplante renal. É necessária
ainda uma melhor caracterização dos genes, proteínas e moléculas associados com
o estado de tolerância operacional nos pacientes transplantados renais e dos fatores
codificantes ou não codificantes desses (SUI et al., 2008; ANGLICHEAU et al., 2009;
SCIAN et al., 2011).
5.4.2 Perfil de expressão do miR-1-1
A participação do miR-1-1 está bem estabelecida como um pivô no
desenvolvimento e na fisiologia de tecidos musculares, incluindo o coração. Sabe-se
que ele tem um papel importante em doenças cardiovasculares, tais como
hipertrofia, infarto do miocárdio e arritmias. Níveis desse miRNA no plasma já foi
caracterizado como um sensível biomarcador para infarto do miocárdio (MIRBASE,
2013c). Também foi caracterizada a relação desse miRNA em diversos tipos de
amostras cancerosas. Kanaan (2012) mostrou que esse foi um dos miRNAs por ele
analisado mais reprimidos em várias neoplasias, sugerindo também sua utilização
como um biomarcador para câncer.
Já foram validados inúmeros alvos regulados pelo miR-1-1 e já foram
descritos milhares de prováveis alvos. De acordo com miRecords (2013),
62
miRTarBase (2013) e DIANA TOOLS – Tarbase (2013b), já foram validados 118,
188 e 1016 alvos, respectivamente. Dentre os alvos validados o GATA3, um
importante regulador do desenvolvimento de linfócitos T e que promove um papel
importante na biologia celular de células endoteliais, é um gene importante nas
questões que envolvem a tolerância operacional (VIEIRA et al., 2011).
No entanto, neste trabalho ele não foi diferencialmente expresso entre os
grupos. Entretanto, a partir da análise estatística de variância ANOVA o miR-1-1,
com p >0,05, não apresentou perfil diferencial estatisticamente significativo entre os
grupos de indivíduos, apesar de aparentar expressão bastante reprimida nos
indivíduos tolerantes e nos indivíduos saudáveis quando comparado aos outros
grupos (Gráfico 2). Espera-se que os pacientes tolerantes operacionais apresentem
expressão gênica similar à dos indivíduos saudáveis, visto que no estado de
tolerância operacional o indivíduo leve uma vida saudável, sem necessidade de
medicamentos imunossupressores e/ou qualquer outro tratamento para evitar
rejeição ou disfunção renal. Sendo assim, o resultado obtido indica a necessidade
de uma pesquisa em um número maior de indivíduos.
Gráfico 2. Expressão do miR-1-1 em linfócitos T de indivíduos transplantados renais e não
transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA).
5.4.3 Perfil de expressão do miR-16
O miR-16 é um precursor pertencente à família do miR-15 juntamente com o
miR-195 e o miR-147. Eles são pequenos RNAs não codificantes que regulam a
expressão gênica. Parecem ser específicos para determinados vertebrados e vários
63
alvos já foram previstos ou validados em uma gama de vertebrados. Já foi mostrado
que a região no cromossomo 13 em que o miR-16 e o miR-15a está associada
aparece deletada em mais da metade das leucemias linfocíticas crônicas de
linfócitos B e a expressão desses miRNAs reprimida em dois terços dos casos nessa
doença (MIRBASE, 2013d). Esse miRNA foi validado em 1.007 alvos de acordo com
o DIANA TOOLS – Tarbase (2013c), porém nenhum desses alvos foram descritos
como relevantes para a tolerância operacional.
Landgraf et al. (2007) analisaram por clonagem e sequenciamento mais de
330.000 pequenos RNAs independentes, oriundo de 256 bibliotecas de cDNA, de 26
órgãos e linhagens celulares distintos de humanos e roedores. Quando analisaram a
frequência global dos miRNAs clonados, perceberam que vários miRNAs se
destacavam como constitutivos, inclusive em células e tecidos de linhagem
embrionária. Dentre eles, o miR-16 foi encontrado de forma mais abundante em
cada uma das mais de 250 amostras analisadas.
Salaun et al. (2011) demonstraram que o miR-16 foi altamente expresso em
todos os subtipos celulares de linfócitos T CD8+ de sangue periférico de indivíduos
saudáveis. A expressão deste miRNA se assemelhou à expressão apresentada pelo
miR-1-1 (Gráfico 2). Ele parece levemente reprimido em pacientes TO e SA em
relação aos indivíduos RC e ES, mas essa diferença não foi estatisticamente
significativa (Gráfico 3).
Gráfico 3. Expressão do miR-16 em linfócitos T de indivíduos transplantados renais e não
transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA).
64
5.4.4 Perfil de expressão do miR-126
O miR-126 é um miRNA capaz de regular a expressão gênica antes e depois
da transcrição. É expresso principalmente em células endoteliais, desde capilares
até vasos sanguíneos maiores, e atua sobre vários transcritos para controlar a
angiogênese (MIRBASE, 2013e). Só existem três alvos validados para esse gene
(SLC45A3, NM_033102 e PROSTEIN) (DIANA TOOLS – Tarbase, 2013d), nenhum
de relevância para a tolerância operacional.
Landgraf et al. (2007) verificaram ainda que o miR-126 era fortemente
expresso em precursor de linfócitos B na leucemia linfóide aguda e Brunner et al.
(2007) demonstraram a correlação desse miRNA com a geração de linfócitos Th2
em asma alérgica no modelo murino. Eles mostraram que a supressão na expressão
desse miRNA, nas vias áreas, resultou em baixa regulação de IL4, IL5 e IL13 por
linfócitos Th2 e aumento da regulação do fator de ligação OCT1 (OBF.1) que é um
regulador negativo do fator de transcrição PU.1. Esse fator de transcrição inibe
especificamente a expressão de GATA3 nos Th2. Sugerindo que essa pode ser a
via pela qual o miR-126 promove a geração de linfócitos Th2.
No contexto de linfócitos T dos indivíduos deste estudo, o miR-126 não
apresentou diferença significativa na análise estatística, apresentando expressão
praticamente linear em todos os grupos de indivíduos transplantados renais e
saudáveis, e com uma distribuição mais ampla dos pacientes tolerantes
operacionais (Gráfico 4).
Gráfico 4. Expressão do miR-126 em linfócitos T de indivíduos transplantados renais e não
transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA).
65
5.4.5 Perfil de expressão do miR-133a
O miR-133a é conhecido por ter sido o primeiro miRNA caracterizado em
camundongo. Desde então vários homólogos já foram descobertos em várias outras
espécies incluindo, invertebrados como a Drosophila melanogaster. Ele é expresso
em tecido muscular e parece ter expressão reprimida em genes que não são de
tecido muscular (MIRBASE, 2013f). No banco DIANA TOOLS – Tarbase (2013e)
constam 51 validações de alvos, mas nenhum correlacionado com os dados
analisados por este estudo.
Foi relatado também que o miR-133a e o miR-1-1 estavam significantemente
reprimido em linhagens celulares e em amostras clínicas de carcinoma renal celular
humanas, funcionando como um supressor do tumor. Sugerindo que uma alta
regulação do oncogene TAGLN2 acontece devido à baixa regulação do miR-1 e do
miR-133a na progressão da doença (KAWAKAMI et al., 2012).
Nas análises deste estudo não foi verificado diferença de expressão
significativa para esse miRNA, já que ele apresentou basicamente a mesma
expressão em todos os indivíduos transplantados renais e saudáveis (Gráfico 5).
Gráfico 5. Expressão do miR-133a em linfócitos T de indivíduos transplantados renais e não
transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA).
5.4.6 Perfil de expressão do miR-196b
O miR-196 é um miRNA que possui a característica de ser expresso
principalmente em humanos e camundongos, mas já foi previsto ou validado em
inúmeros vertebrados sugerindo, portanto, que ele é específico dos vertebrados
66
(MIRBASE, 2013g). Entretanto, foram validados apenas dois alvos para esse miRNA
de acordo com a DIANA TOOLS– Tarbase (2013f), HOXB8 e HOXC8.
É encontrado altamente expresso em câncer de pâncreas e colorretal e em
adenocarcinoma de esôfago, gliobastoma e em diversos tipos de leucemias. A sua
regulação alta correlaciona-se com a transição para a malignidade desses tipos de
neoplasias. miR-196 é um alvo potencial de sinais inflamatórios, uma vez que é
altamente expresso também em células epiteliais em indivíduos com doença
inflamatória intestinal. A indicação de que o aumento na expressão deste miRNA
está associado ao fenótipo maligno em tumores estromais gastrointestinais o torna
um potencial biomarcador para neoplasias gastrointestinais induzidas por quadros
inflamatórios (TILI et al., 2013).
Foi citado ainda a expressão do miR-196 em tecido renal (LI et al., 2010), mas
nas amostras deste estudo não houve diferença estatisticamente significativa desse
miRNA, apesar de parecer que a média de expressão dos indivíduos tolerantes
operacionais está reprimida em contraste com da média dos outros indivíduos que
mantiveram uma expressão praticamente idêntica como pode ser visualizado no
Gráfico 6. Sugerindo que se o número de indivíduos deste estudo fosse maior e a
expressão desse miRNA seguisse o mesmo apresentado no Gráfico 6, poderia
existir uma diferença estatisticamente significa e esse miRNA provavelmente seria
um bom marcador para a tolerância operacional. Para uma melhor caracterização da
expressão do miR-196b dentro do grupo TO outros testes estatísticos devem ser
feitos visando uma relação entre a expressão do grupo utilizando como variável os
estados clínicos dos pacientes.
67
Gráfico 6. Expressão do miR-196b em linfócitos T de indivíduos transplantados renais e não
transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA).
5.4.7 Perfil de expressão do miR-328
O miR-328 foi descrito como um regulador da expressão do gene PTPRJ,
cujo produto é uma proteína PTPRJ (receptor-type protein tyrosine phosphatase)
encontrada diminuída em diversos tipos de neoplasias (PADUANO et al., 2013),
potencial biomarcador para o câncer de pulmão (ULIVI et al., 2013), marcador
prognóstico de glioblastoma (WU et al., 2012) e encontrado ainda em câncer
colorretal. Segundo o DIANA TOOLS – Tarbase (2013g) foram validados 6 alvos
para esse miRNA (ABCG2, H2AX, CD44, BACE1, NM_004827, NM_001001390),
nenhum aparenta ter relação com o transplante renal humano ou com linfócitos T.
Na análise estatística das amostras do presente estudo não foram verificadas
diferenças significativas, visto que em todos os indivíduos a expressão basicamente
foi linear, com uma pequena expressão diferencial não significativa nos indivíduos
estáveis. O fato de o resultado apresentar uma amplitude de expressão para os
pacientes transplantados leva a cogitar que a expressão deste miRNA é influenciada
por fatores intrínsecos às condições clínicas destes pacientes (Gráfico 7).
68
Gráfico 7. Expressão do miR-328 em linfócitos T de indivíduos transplantados renais e não
transplantados. Tolerância operacional (TO), rejeição crônica (RC), estáveis (ES) e saudáveis (SA).
5.5
SEQUENCIAMENTO DE ALTO DESEMPENHO
Para
o
sequenciamento
de
alto
desempenho
foram
escolhidas,
primeiramente, as amostras pertencentes aos matchings 2 e 4, que apresentavam
as maiores quantificações de RNA e melhor qualidade. O sequenciamento de alto
desempenho foi realizado no centro de sequenciamento The Scripps Research
Institute (TSRI), conforme descrito na sessão 4 (Material e Métodos).
Após o sequenciamento foram avaliadas as quantidades e as qualidades das
reads obtidas. Logo, verificou-se a necessidade da retirada dos adaptadores. Na
tabela 4 constam os dados de números de reads antes e depois da retirada dos
adaptadores e os Gráficos 8 e 9 remetem as qualidades das reads antes e depois da
retirada dos adaptadores e das sequências com valores abaixo de 20, segundo a
escala PHRED. Os dados, a princípio, se mostravam de boa qualidade e quantidade
em relação ao número de reads mesmo após a retirada dos adaptadores.
69
Tabela 4. Número de reads antes e depois da retirada dos adaptadores e das sequências de baixa
qualidade.
Indivíduo - Barcode
Ltx08 (Mat. 2) TO - TTCAGC
Ltx04 (Mat. 2) RC - AAGGGA
Ltx09 (Mat. 2) ES - AAGACG
Ltx36 (Mat. 2) SA - TTCGCT
Ltx16 (Mat. 4) TO - CCTCGG
Ltx67 (Mat. 4) RC - TGTTGC
Ltx27 (Mat. 4) ES - GGATGT
Ltx37 (Mat. 4) SA - GTGGCC
Quantidade de reads
inicial
19.462.548
25.875.560
20.667.454
27.037.554
18.068.907
18.191.347
22.938.163
23.319.858
Quantidade de reads
final
12.455.850
11.077.357
11.316.570
10.062.600
13.446.753
15.229.226
12.681.304
9.789.617
Gráfico 8. Gráfico boxplot das qualidades das sequências obtidas inicialmente. Eixo X: posição nas
reads em pb. Eixo Y: escala de qualidade PHRED.
70
Gráfico 9. Gráfico boxplot das qualidades das sequências obtidas depois da retirada dos
adaptadores e das sequências com qualidade <20, segundo a escala PHRED. Eixo X: posição nas
reads em pb. Eixo Y: escala de qualidade PHRED.
A análise dos dados foi feito a partir do alinhamento de cada par de reads ao
conjunto de todos os cromossomos humanos (hg19p10) simultaneamente. O
próximo passo tinha a intenção de explorar dois conteúdos em paralelo: o primeiro,
quantitativo, utilizado para quantificar a expressão diferencial de éxons entre as
amostras (MARIONI et al., 2008); o segundo, qualitativo, referindo-se a diferentes
formas de splicing entre as amostras (SULTAN et al., 2008). Todavia, logo nas
análises inicias foi observado um problema no alinhamento das reads em relação ao
genoma referência. As reads não se alinhavam em regiões de éxons, e estavam
distribuídas ao longo de todos os cromossomos, incluindo em regiões intergênicas
(Figura 5).
71
Figura 5. Mapeamento das reads no gene CD28, localizado no cromossomo humano 21. Em cada
isoforma, as linhas mais grossas representam éxons e as mais finas, regiões de íntrons. A
visualização foi feita no UCSC Genome Browser.
Primeiramente, a suspeita foi que o problema era proveniente do programa
Segemehl, utilizado para o mapeamento, que acabara de ser implementado no
Laboratório de Bioinformática da Universidade de Brasília. Contudo, o problema
estava no material biológico que havia sido enviado ao centro de sequenciamento.
Sendo assim, o pipeline desenvolvido foi validado com dados públicos de RNA-seq
de linfócitos T que se encontravam disponíveis no SRA/NCBI, evidenciando o
alinhamento esperado principalmente nas regiões de éxons (Figura 6).
72
Figura 6. Mapeamento das reads advindas do banco de dados SRA/NCBI no gene CD28, localizado
no cromossomo humano 21. Em cada isoforma, as linhas mais grossas representam éxons e as mais
finas, regiões de íntrons. A visualização foi feita no UCSC Genome Browser.
Mais uma vez questionado, o centro de sequenciamento confirmou o
problema ocorrido e sugeriu que as amostras estavam contaminadas com DNA
genômico. Entretanto, as amostras deveriam ter passado por um tratamento com
DNase, no centro de sequenciamento, antes de serem sequênciadas. Em seguida,
houveram novas tentativas frustradas de se obter dados de qualidade como pode
ser visualizado no Gráfico 10 enviada pelo centro de sequenciamento.
73
Gráfico 10. Análise da qualidade das sequências obtidas por novas bibliotecas de cDNA. Eixo X:
tamanho das reads. Eixo Y: escala Phred.
Na tentativa de corrigir o problema, foram enviadas ao mesmo centro de
sequenciamento amostras provenientes dos matching 3 e 4, dessa vez em maior
quantidade (250ng) e tratadas com DNase utilizando a mesma metodologia
empregada para o envio anterior, sessão 4. Material e Métodos. Porém, a resposta
obtida foi de que as amostras chegaram com quantificações entre 130-150ng e que
por esse motivo não foi possível a obtenção de bibliotecas de cDNA de qualidade.
Atualmente estamos buscando uma forma de solucionar esse problema.
O entendimento da expressão dos miRNAs para determinados tipos celulares
específicos, é um passo importante para a elucidação da função dos miRNAs.
Atualmente um número crescente de estudos remetem miRNAs ao desenvolvimento
de órgãos, tecidos, células, sistemas e em várias doenças, necessitando de um
abrangente catálogo de sequências acuradas, validadas por sequenciamento de alto
desempenho, bioinformática e técnicas de biologia molecular como microarranjo,
qPCR e PCR array, capazes de gerar informações sobre expressão e conservação
desses inúmeros miRNAs encontrados.
74
6.
CONCLUSÃO E PERSPECTIVAS
Foi mostrado no trabalho que dentre os 7 miRNAs analisados somente o miR-
31 (Fig. 5) teve diferença de expressão estatisticamente significativa entre os grupos
de pacientes transplantados renais e o grupo de indivíduos saudáveis, mostrando
que esse miRNA se apresenta reprimido nos indivíduos que realizaram transplante
renal provavelmente por ter como alvo o gene FOXP3, peça fundamental para
aceitação e rejeição a enxertos. Mas como esse miRNA não apresentou diferença
significativa dentre os grupos transplantados renais, portanto novos experimentos e
novos pacientes terão que ser testados para que o mesmo possa ser considerado
um potencial biomarcador.
O estudo concluiu ainda que o miR-1-1(Fig. 6), o miR-16 (Fig. 7) e o miR196b (Fig. 10) mesmo não apresentando diferença estatisticamente significativa,
tiveram níveis de expressão diferenciais entre os indivíduos. A mesma análise em
um número maior de indivíduos seria necessária para a validação da expressão
diferencial e significativa destes miRNAs.
O RNA-seq ainda é uma perspectiva real para a conclusão deste trabalho. O
sequenciamento total do transcritoma de linfócitos T de todos os grupos de
pacientes supracitados é de grande importância para a validação dos dados deste
estudo, para elucidação das vias imunorregulatórias envolvidas no estado de
tolerância operacional, além da contribuição para a descoberta de novos alvos que
possam ser testados e possivelmente utilizados como biomarcadores da tolerância
operacional do transplante renal humano.
75
REFERÊNCIAS
ABBAS, A. K.; JANEWAY, C. A. Jr. Immunology: Improving on Nature in the TwentyFirst Century. Cell, v. 100, n. 1, p. 129-138, 2000.
ABBAS, A. K.; LICHTMAN, A. H.; PILLAI S. Cellular and Molecular Immunology. 6.
ed, Local: Philadelphia, Pensylvania, Editora Saunders, 2007.
AMBROS, V. The functions of animal miRNAs. Nature, v. 431, n. 7006, p. 350-355,
2004.
AMOS, B. D. Recollections of Dr. Peter Gorer. Immunogenetics, v. 24, n. 6, p. 341344, 1986.
ANGLICHEAU, D. et al. microRNA expression profiles predictive of human renal
allograft status. Proc Natl Acad Sci U S A, v. 106, n. 13, p. 5330-5335, 2009.
ANSARI, M. J. I.; SAYEGH, M. H. Clinical transplantation tolerance: The promise and
challenges. Kidney International, v. 65 p. 1560-1563, 2004.
ASHTON-CHESS, J.; BROUARD, S.; SOULILLOU, J. P. Is clinical tolerance realistic
in the next decade? Transpl int, v. 19, n. 7, p. 539-548, 2006.
AYALA-GARCÍA, M. A. et al. Tolerance in Renal Transplantation. In: RATH, T. (Ed.)
Current Issues and Future Direction in Kidney Transplantation. p. 463-478, 2013.
Cap. 21. Disponível em: <http://www.intechopen.com/books/current-issues-andfuture-direction-in-kidney-transplantation/tolerance-in-renal-transplantation>. Acesso
em: 03 junho de 2013.
BARTEL, D. P. miRNAs: Genomics, biogenesis, mechanism, and function. Cell, v.
116, n. 2, p. 281-297, 2004.
BENNETT, C. L. et al. The immune dysregulation, polyendocrinopathy, enteropathy,
X-linked syndrome (IPEX) is caused by mutations of FOXP3. Nat. Genet, v. 27, n. 1,
p. 20-21, 2001.
BRAZA, F.; SOULILLOU, J. P.; BROUARD, S. Gene expression signature in
transplantation tolerance. Clin Chim Acta, Nantes, v. 413, n. 17-18, p. 463-478, 2012.
BROUARD, S. et al. Identification of a peripheral blood transcriptional biomarker
panel associated with operational renal allograft tolerance. Proc Natl Acad Sci U S A,
Nantes, v. 104, n. 39, p. 15448-15453, 2007.
BROUARD, S. et al. Operationally tolerant and minimally immunosuppressed kidney
recipients display strongly altered blood T-cell clonal regulation. Am J Transplant, v.
5, n. 2, p. 330-340, 2005.
76
BROUARD, S. et al. The Natural History of Clinical Operational Tolerance After
Kidney Transplantation Through Twenty-Seven. Am J Transplant, Nantes, v. 12, n.
12, p. 3296-3307, 2012.
BRUNNER, C. et al. BOB.1/OBF.1 controls the balance of TH1 and TH2 immune
responses. EMBO J, v. 26, n. 13, p. 3191-3202, 2007.
CALDAS, C. et al. Cellular autoreactivity against heat shock protein60in renal
transplant patients: peripheral and graft-infiltrating responses. Clin Exp Immunol, São
Paulo, v. 146, n. 1, p. 66-75, 2006.
CALDAS, C. et al. T-Cell Response to Self HSP60 Peptides in Renal Transplant
Recipients: A Regulatory Role? Transplant Proc, São Paulo, v. 36, n. 4, p. 833-835,
2004.
CARTHEW, R. W.; SONTHEIMER, E. J. Origins and Mechanisms of miRNAs and
siRNAs. Cell, Evanston, v. 139, n. 4, p. 642-655, 2009.
CHANDRASEKARAN, K. et al. Role of microRNAs in kidney homeostasis and
disease. Kidney International, Singapore, v. 81, n. 7, p. 617-627, 2012.
CHATILA, T. A. et al. JM2, encoding a fork head-related protein, is mutated in Xlinked autoimmunity-allergic disregulation syndrome. J. Clin. Investig, v. 106, n. 12, p.
R75-81, 2000.
CHIKUMA, S.; BLUESTONE, J. A. Ctla-4 and tolerance: the biochemical point of
view. Immunol res, v. 28, n. 3, p. 241-253, 2003.
CHOMCZYNSKI, P.; SACCHI, N. Single-step method of RNA isolation by acid
guanidinium thiocyanate-phenol-chloroform extraction. Anal biochem, v. 162, n. 1, p.
156-159, 1987.
CHOWDHURY, P.; HERNANDEZ-FUENTES, M. P. Non-invasive biomarkers to
guide management following renal transplantation: the need for a multiplatform
approach. Curr Opin Organ Transplant, v. 18, n. 1, p. 1-5, 2013.
COELHO, V. et al. Evidence of Indirect Allorecognition in Long-Term Human Renal
Transplantation. Clin Immunol, São Paulo, v. 90, n. 2, p. 220-229, 1999.
COELHO, V.; RAMOS, C. C.; FILHO, J. E. K. Imunobiologia do alotransplante.
Temas de reumatologia clínica, v. 8, n. 2, p. 52-60, 2007.
COHEN, I. R. Peptide therapy for type I diabetes: the immunological homunculus and
the rationale for vaccination. Diabetologia, v. 45, n. 10, p. 1468-1474, 2002.
COHEN, I. R. Real and artificial immune systems: computing the state of the body.
Nat Rev Immunol, v. 7, n . 7, p. 569-574, 2007.
COHEN, I. R.; QUINTANA, F. J.; MIMRAN, A. Tregs in T cell vaccination: exploring
the regulation of regulation. J Clin Invest, v. 114, n. 9, p. 1227-1232, 2004.
77
COLVIN, R. B. Antibody-mediated renal allograft rejection: diagnosis and
pathogenesis. J Am Soc Nephrol, v. 18, n. 4, p. 1046-1056, 2007.
CORNELL, L. D.; SMITH, R. N.; COLVIN, R. B. Kidney transplantation: mechanisms
of rejection and acceptance. Annu R Rev Pathol, v.3, p.189-220, 2008.
CÔTÉ, I., ROGERS, N. J., LECHLER, R. I. Allorecognition. Transfus Clin Biol; v. 8, n.
3, p. 318-323, 2001.
COUSINEAU, D.; CHARTIER, S. Outliers detection and treatment: a review.
International Journal of Psychological Research, v. 3, n. 1, p. 58-67, 2010.
CRUVINEL, W. de M. et al. Immune system - Part I. Fundamentals of innate
immunity with emphasis on molecular and cellular mechanisms of inflammatory
response. Rev. Bras. Reumatol, São Paulo, v. 50, n. 4, p.434-461, 2010.
DANGER, R. et al. Upregulation of miR-142-3p in peripheral blood mononuclear cells
of operationally tolerant patients with renal transplant. J Am Soc Nephrol, v. 23, n. 4,
p. 597-606, 2012.
DELVES, P. J.; ROITT, I. M. The immune system: First of Two Parts. Advances In
Immunology, London, v. 343, n. 1, p. 37-49, 2000.
DIANA TOOLS – Tarbase. 2013. Disponível em: <http://diana.imis.athenainnovation.gr/DianaTools/index.php?r=tarbase/index&mirnas=MIMAT0000089>.
Acesso em: 17 de junho de 2013a.
DIANA TOOLS – Tarbase. 2013. Disponível em: <http://diana.imis.athenainnovation.gr/DianaTools/index.php?r=tarbase/index&mirnas=MIMAT0000416>.
Acesso em: 18 de junho de 2013b.
DIANA TOOLS – Tarbase. 2013. Disponível em: <http://diana.imis.athenainnovation.gr/DianaTools/index.php?r=tarbase/index&mirnas=MIMAT0000069>.
Acesso em: 19 de junho de 2013c.
DIANA TOOLS – Tarbase. 2013. Disponível em: <http://diana.imis.athenainnovation.gr/DianaTools/index.php?r=tarbase/index&mirnas=MIMAT0000444>.
Acesso em: 19 de junho de 2013d.
DIANA TOOLS – Tarbase. 2013. Disponível em: <http://diana.imis.athenainnovation.gr/DianaTools/index.php?r=tarbase/index&mirnas=MIMAT0000427>.
Acesso em: 20 de junho de 2013e.
DIANA TOOLS – Tarbase. 2013. Disponível em: <http://diana.imis.athenainnovation.gr/DianaTools/index.php?r=tarbase/index&mirnas=MIMAT0001080>.
Acesso em: 20 de junho de 2013f.
DIANA TOOLS – Tarbase. 2013. Disponível em: <http://diana.imis.athenainnovation.gr/DianaTools/index.php?r=tarbase/index&mirnas=MIMAT0000752>.
Acesso em: 21 de junho de 2013g.
78
FENG, X. M. et al. Interleukin-27 upregulates major histocompatibility complex class
II expression in primary human endothelial cells through induction of major
histocompatibility complex class II transactivator. Hum Immunol, v. 68, n. 12, p. 965972, 2007.
GARCIA, G.; HARDEN, P.; CHAPMAN, J. The global role of kidney transplantation. J
Nephrol, v. 25, n. 1, p. 1-6, 2012.
GRACA, L. et al. Both CD4+CD25+ and CD4+CD25− regulatory cells mediate
dominant transplantation tolerance. J Immunol, v. 168, n. 11, p. 5558-5565, 2002.
GRANJA, C. et al. T-cell autoreactivity to Hsp in human transplantation may involve
both proinflammatory and regulatory functions. Hum Immunol, São Paulo, v. 65, n. 2,
p. 124-134, 2004.
HALLORAN, P. F. Immunosuppressive drugs for kidney transplantation. N Engl J
Med, v. 351, n. 26, p. 2715-2729, 2004.
HALLORAN, P. F.; HUNSICKER, L. G. Delayed graft function: state of the art. Am J
Transplant, v. 1, n. 2, p. 115-120, 2001.
HARA, M. et al. IL10 is required for regulatory T cells to mediate tolerance to
alloantigens in vivo. J immunol, v. 166, n. 6, p. 3789-3796, 2001.
INUI, M.; MARTELLO, G.; PICCOLO, S. microRNA control of signal transduction. Nat
Rev Mol Cell Biol, v. 11, n. 4, p. 252-263, 2010.
JIANG, S.; HERRERA, O.; LECHLER, R. I. New spectrum of allorecognition
pathways: implications for graft rejection and transplantation tolerance. Current
Opinion in Immunology, v. 16, p. 550-557, 2004.
JONULEIT, H.; ADEMA, G.; SCHMITT, E. Immune regulation by regulatory T cells:
implication for transplantation. Transplant Immunol, v. 11, n. 3-4, p. 267-276, 2003.
JOOSTEN, S. A. et al. Chronic renal allograft rejection: pathophysiologic
considerations. Kidney Int, v. 68, n. 1, p. 1-13, 2005.
KANAAN, Z. et al. Plasma miR-21: a potential diagnostic marker of colorectal cancer.
Ann Surg, v. 256, n. 3, p. 544-51, 2012.
KAWAKAMI, K. et al. The functional significance of miR-1 and miR-133a in renal cell
carcinoma. European Journal Of Cancer, v. 48, n. 6, p. 827-836, 2012.
KEAN, L. S. et al. Transplant tolerance in non-human primates: progress, current
challenges and unmet needs. Am J Transplant, v. 6, n. 5, p. 884-893, 2006.
LANDGRAF, P. et al. A Mammalian microRNA Expression Atlas Based on Small
RNA Library Sequencing. Cell, Worcester, v. 129, n. 7, p. 1401-1414, 2007.
79
LEE, R. C.; FEINBAUM, R. L.; AMBROS, V. The C elegans heterochronic gene lin-4
encodes small RNAs with antisense complementarity to lin-14. Cell, v. 75, p. 843854, 1993.
LEWIS, B. P.; BURGE, C. B.; BARTEL, D. P. Conserved seed pairing, often flanked
by adenosines, indicates that thousands of human genes are microRNA targets. Cell,
v. 120, n. 1, p. 15-20, 2005.
LI, J. Y. et al. Review: The role of microRNAs in kidney disease. Nephrology,
Australia, v. 15, n. 6, p. 599-608, 2010.
LU, J. et al. miRNA expression profiles classify human cancers. Nature, v. 435, n.
7043, p. 834-838, 2005.
LUNA, E. et al. Diversity of physiological cell reactivity to heat shock protein 60 in
different mouse strains. Cell Stress Chaperones, São Paulo, v. 12, n. 2, p. 112-122,
2007.
MAGEE, C. C.; PASCUAL, M. Update in renal transplantation. Archives of internal
medicine, v. 164, n. 13, p. 1373-1388, 2004.
MARIONI, J. C. et al. RNA-seq: an assessment of technical reproducibility and
comparison with gene expression arrays. Genome Res, v. 18, n. 9, p. 1509-1517,
2008.
MARTÍNEZ-LLORDELLA M. et al. Using transcriptional profiling to develop a
diagnostic test of operational tolerance in liver transplant recipients. J Clin Invest, v.
118, n. 8, p. 2845-2857, 2008.
MATTHEWS, J. B.; RAMOS, E.; BLUESTONE, J. A. Clinical trials of transplant
tolerance: slow but steady progress. American Journal of Transplantation, v. 3, n. 7,
p. 794-803, 2003.
MEDZHITOV, R. Recognition of microorganisms and activation of the immune
response. Nature, v. 449, n. 7164, p. 819-826, 2007.
MESQUITA, J. D. et al. Immune system - part II: basis of the immunological response
mediated by T and B lymphocytes. Rev Bras Reumatol, v. 50, n. 5, p. 552-580, 2010.
MIRBASE. 2013. Disponível em: <http://www.mirbase.org/>. Acesso em: 03 de junho
de 2013a.
MIRBASE. 2013. Disponível em: <http://www.mirbase.org/cgibin/mirna_entry.pl?acc=MI0000089>. Acesso em: 17 de junho de 2013b.
MIRBASE. 2013. Disponível em: <http://www.mirbase.org/cgibin/mirna_entry.pl?acc=MI0000651>. Acesso em: 17 de junho de 2013c.
MIRBASE. 2013. Disponível em: <http://www.mirbase.org/cgibin/mirna_entry.pl?acc=MI0000070>. Acesso em: 19 de junho de 2013d.
80
MIRBASE. 2013. Disponível em: <http://www.mirbase.org/cgibin/mirna_entry.pl?acc=MI0000471>. Acesso em: 19 de junho de 2013e.
MIRBASE. 2013. Disponível em: <http://www.mirbase.org/cgibin/mirna_entry.pl?acc=MI0000450>. Acesso em: 20 de junho de 2013f.
MIRBASE. 2013. Disponível em: <http://www.mirbase.org/cgibin/mirna_entry.pl?acc=MI0001150>. Acesso em: 20 de junho de 2013g.
MIRECORDS. 2013. Disponível em:
<http://mirecords.biolead.org/interactions.php?targetgene_type=refseq_acc&v=yes&
mirna_acc=hsa-miR-1>. Acesso em: 18 de junho de 2013.
MIRTARBASE. 2013. Disponível em:
<http://mirtarbase.mbc.nctu.edu.tw/php/search.php?q=search_exact&searchword=hs
a-miR-1>. Acesso em: 18 de junho de 2013.
MITCHELL, P. S. et. al. Circulating miRNAs as stable blood-based markers for
cancer detection. Proc Natl Acad Sci U S A, v. 105, n. 30, p. 10513-10518, 2008.
MORRIS, P. J. Progress in the Induction of Tolerance to Allografts. Transplantation
Proceedings, v. 30, v. 5, p. 2427-2429, 1998.
NANKIVELL, B. J. et al. The natural history of chronic allograft nephropathy. N Engl J
Med, v. 349, n. 24, p. 2326-2333, 2003.
NEWELL, K. A. et al. Identification of a B cell signature associated with renal
transplant tolerance in humans. J Clin Invest, v. 120, n. 6, p. 1836-1847, 2010.
O’CONNELL, R. M. et al. Physiological and pathological roles for microRNAs in the
immune system. Nat Rev Immunol, v. 10, n. 2, p. 111-122, 2010.
PADUANO, F. et al. Protein tyrosine phosphatase PTPRJ is negatively regulated by
microRNA-328. Febs J, v. 280, n. 2, p. 401-412, 2013.
PAPIERNIK, M. et al. Regulatory CD4 T cells: expression of IL-2R alpha chain,
resistance to clonal deletion and IL-2 dependency. Int Immunol, Paris, v. 10, n. 4, p.
371-378, 1998.
PORTUGAL, K. et al. Renal transplant patients show variations in their self-reactive
repertories: a serial study. Int Immunol, São Paulo, v. 13, n. 6, p. 747-755, 2001.
RAISCH, J. et al. Role of microRNAs in the immune system, inflammation and
cancer. World J Gastroenterol, Clermont-ferrand, v. 19, n. 20, p. 2985-2996, 2013.
RAPAPORT, F. T. et al. Biological and ultrastrutural studies of leucocyte fractions as
transplantation antigens in man. Transplantation, v. 3, p. 490-500, 1965.
RODRIGUEZ, A. et al. Identification of mammalian miRNA host genes and
transcription units. Genome Res, v. 14, n. 10A, p. 1902-1910, 2004.
81
ROUAS, R. et al. Human natural Treg miRNA signature role of miRNA-31 and
miRNA-21 in FOXP3 expression. Eur J Immunol, v. 39, n. 6, p. 1608-1618, 2009.
ROUSSEY-KESLER, G. et al. Clinical operational tolerance after kidney
transplantation. Am J Transplant, v. 6, n. 4, p. 736-746, 2006.
SAGOO, P. et al. Development of a cross-platform biomarker signature to detect
renal transplant tolerance in humans. J Clin Invest, v. 120, n. 6, p. 1848-1861, 2010.
SAKAGUCHI, S. Conditional stability of T cells. Nature, v. 468, n. 7320, p. 41-42,
2010.
SAKAGUCHI, S. et al. Immunological tolerance maintained by CD25+CD4+
regulatory T cells: their common role in controlling autoimmunity, tumor immunity and
transplant tolerance. Immunol Rev, v. 182, n. 1, p. 18-32, 2001.
SAKAGUCHI, S.; WING, K.; YAMAGUCHI, T. Dynamics of peripheral tolerance and
immune regulation mediated by Treg. Eur. J. Immunol, v. 39, n. 9, p. 2331-2336,
2009.
SALAUN, B. et al. Differentiation associated regulation of microRNA expressionin
vivo in human CD8+ T cell subsets. Journal Of Translational Medicine, v. 44, n. 9, p.
1-8, 2011.
SCHOTT, J.; STOECKLIN, G. Networks controlling mRNA decay in the immune
system. Wiley Interdiscip Rev RNA, v. 1, n. 3, p. 432-456, 2010.
SCIAN, M. J. et al. Gene expression changes are associated with loss of kidney graft
function and interstitial fibrosis and tubular atrophy: Diagnosis versus prediction.
Transplantation, v. 91, n. 6, p. 657-665, 2011.
SEDDON, B.; MASON, D. The third function of the thymus. Immunology Today, Mill
Hill, v. 21, n. 2, p. 95-99, 2000.
SETHI, A. et al. Role of miRNAs in CD4 T cell plasticity during inflammation and
tolerance. Front Genet, v. 39, n. 6, p. 4-8, 2013.
SILVA, H. M. et al. Preserving the B-Cell Compartment Favors Operational Tolerance
in Human Renal Transplantation. Mol Med, São Paulo, v. 18, p.733-743, 2011.
SILVA, M. E. R.; MORY, D.; DAVINI, E. Marcadores genéticos e auto-imunes do
diabetes melito tipo 1: da teoria para a prática. Arq. bras. endocrinol. Metab, v. 52, n.
2, p. 166-180, 2008.
SIMPSON, E. Reminiscences of Sir Peter Medawar: in hope of antigen-specific
transplantation tolerance. Am J Transplant, London, v. 4, n. 12, p.1937-1940, 2004.
SOLEZ, K. et al. Banff '05 meeting report: differential diagnosis of chronic allograft
injury and elimination of chronic allograft nephropathy ('can'). Am j transplant, v. 7, n.
3, p. 518-526, 2007.
82
SOLEZ, K.; COLVIN, R. B.; RACUSEN, L. C. et al. Banff 07 Classification of Renal
allograft Pathology: Updates and Future Directions. American Journal of
Transplantation, v. 8, n. 4, p. 753-760, 2008.
SOULILLOU, J.; GIRAL, M. Controlling the incidence of infection and malignancy by
modifying immunosuppression. Transplantation, v. 72, Suppl 12, p. S89–S93, 2001.
SPADAFORA-FERREIRA, M. et al. CD4+CD25+FOXP3+ Indirect Alloreactive T cells
from Renal Transplant Patients Suppress Both the Direct and Indirect Pathways of
Allorecognition. Scand J Immunol, São Paulo, v. 66, n. 2-3, p. 352-361, 2007.
SPADAFORA-FERREIRA, M. et al. Indirect Alloreactivity and Cytokine Production to
HLA-DR Peptides in Human Renal Transplantation. Transplant Proc, São Paulo, v.
33, n. 1-2, p. 435-436, 2001.
SPADAFORA-FERREIRA, M. et al. Indirect Alloreactivity and Cytokine Production to
HLA-DR Peptides in Human Renal Transplantation. Clin Immunol, São Paulo, v. 101,
n. 3, p. 315-327, 2001.
STEPHENS, L. A. et al. Human CD4+CD25+ thymocytes and peripheral T cells have
immune suppressive activityin vitro. Eur. J. Immunol, Oxford, v. 31, n. 4, p. 12471254, 2001.
STUTMAN, O. Intrathymic and extrathymic T cell maturation. Immunol Rev, v. 42, p.
138-184, 1978.
SUI, W. et al. Microarray analysis of MicroRNA expression in acute rejection after
renal transplantation. Transpl Immunol, v. 19, n. 1, p. 81-85, 2008.
SULTAN, M. et al. A global view of gene activity and alternative splicing by deep
sequencing of the human transcriptome. Science, v. 321, n. 5891, p. 956-960, 2008.
TAI, X. et al. Cd28 costimulation of developing thymocytes induces FOXP3
expression and regulatory T cell differentiation independently of interleukin 2. Nat.
Immunol, v. 6, n. 2, p. 152-162, 2005.
TERASAKI, P. I. et al. High survival rates of kidney transplants from spousal and
living unrelated donors. N Engl J Me, v. 333, n. 6, p. 333-336, 1995a.
TERASAKI, P. I. et al. Proposed HLA matching scheme for improved cadaveric
kidney allocation. Transplant Proc, v. 27, n. 1, p. 61-63, 1995b.
TILI, E. et al. MicroRNAs play a central role in molecular dysfunctions linking
inflammation with cancer. Immunological Reviews, v. 253, n. 1, p.167-184, 2013.
TORRES, T. T. et al. Gene expression profiling by massively parallel sequencing.
Genome res, v. 18, n. 1, p. 172-177, 2008.
TY, H. A. The Role of MicroRNAs in Regulatory T Cells and in the Immune
Response. Immune Netw, v. 11, n. 1, p. 11-41, 2011.
83
ULIVI, P. et al. Peripheral blood MIR-328 expression as a potential biomarker for the
early diagnosis of nsclc. Int J Mol Sci, v. 16, n. 5, p. 10332-10342, 2013.
VIEIRA, P. M. et al. Differential Monocyte STAT6 Activation and
CD4+CD25+FOXP3+ T cell in Kidney Operational Tolerance Transplanted
individuals. Hum Immunol, v. 71, n. 5, p. 442-450, 2010.
VIEIRA, P. M. et al. GATA3 and a dominant regulatory gene expression profile
discriminate operational tolerance in human transplantation. Clin Immunol, v. 142, n.
2, p. 117-126, 2011.
VOLINIA, S. et al. Reprogramming of miRNA networks in cancer and leukemia.
Genome Res, v. 20, n. 5, p. 589-599, 2010.
WALDMANN, H.; COBBOLD, S. Regulating the Immune Response to Transplants: A
Role for CD4+ Regulatory Cells? Immunity, Oxford, v. 14, n. 4, p. 399-406, 2001.
WANG, Z.; GERSTEIN, M.; SNYDER, M. Rna-seq: a revolutionary tool for
transcriptomics. Nature rev. Genetics, v. 10, n. 1, p. 57-63, 2009.
WHITTAKER, J. R. et al. The fate of the renal transplant with delayed function. Surg
Gynecol Obstet, v. 136, n. 6, p. 919-922, 1973.
WILDIN, R. S. et al. X-linked neonatal diabetes mellitus, enteropathy and
endocrinopathy syndrome is the human equivalent of mouse scurfy. Nat. Genet, v.
27, n. 1, p. 18-20, 2001.
WING, K.; FEHÉRVÁRI, Z.; SAKAGUCHI, S. Emerging possibilities in the
development and function of regulatory T cells. International Immunology, v. 18, n. 7,
p. 991-1000, 2006.
WOOD, K. J.; SAKAGUCHI, S. Regulatory T cells in transplantation tolerance. Nat
Rev Immunol, v. 3, n. 3, p. 199-210, 2003.
WU, Z. et al. miR-328 expression is decreased in high-grade gliomas and is
associated with worse survival in primary glioblastoma. Plos One, v. 7, n. 10, [8 p.],
2012.
YAGI, H. et al. Crucial role of FOXP3 in the development and function of human
CD25+CD4+ regulatory T cells. Int Immunol, v. 16, n. 11, p. 1643-1656, 2004.
YEH, H. et al. Mechanisms of regulatory T cell counter-regulation by innate
immunity. Transplantation Reviews, Boston, v. 27, p. 61-64, 2013.
YU, X.; CARPENTER, P.; ANASETTI, C. Advances in transplantation tolerance. The
lancet, v. 357, n. 9272, p. 1959-1963, 2001.
ZHENG, S. G. et al. TGF-beta requires CTLA-4 early after T cell activation to induce
FOXP3 and generate adaptive CD4 +CD25+ regulatory cells. J Immunol, v. 176, n. 6,
p. 3321-3329, 2006.
84
ANEXO A - APROVAÇÃO DO PROJETO PELO COMITÊ DE ÉTICA.
85
ANEXO B - TERMO DE CONSENTIMENTO LIVRE
APROVAÇÃO DO PROJETO PELO COMITÊ DE ÉTICA.
ESCLARECIDO
E
HOSPITAL DAS CLÍNICAS DA FACULDADE DE MEDICINA
DA UNIVERSIDADE DE SÃO PAULO
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
(Instruções para preenchimento no verso)
I - DADOS DE IDENTIFICAÇÃO DO SUJEITO DA PESQUISA OU RESPONSÁVEL
LEGAL
1. NOME DO PACIENTE .:...........................................................................................
DOCUMENTO DE IDENTIDADE Nº: ........................................ SEXO: M
F
DATA NASCIMENTO: ......../......../......
ENDEREÇO: ................................................................Nº....................APTO: .............
BAIRRO: .......................... CIDADE: ...................... CEP:.............................................
TELEFONE: DDD (............)........................................................................................
2. RESPONSÁVEL LEGAL: ............................................................................................
NATUREZA (grau de parentesco, tutor, curador etc.)
............................................................
DOCUMENTO DE IDENTIDADE :.........SEXO: M F DATA NASCIMENTO: .../..../....
ENDEREÇO: ..................................................................... Nº ............... APTO: ...........
BAIRRO: .................................... CIDADE: ....................CEP: ............................ TELEFONE:
DDD (............).................................
____________________________________________________________________
II - DADOS SOBRE A PESQUISA CIENTÍFICA
TÍTULO DO PROTOCOLO DE PESQUISA: Estudo do Perfil imunológico transcricional
em pacientes transplantados com tolerância operacional. Este projeto faz parte do
projeto multicêntrico: Estudo do perfil imunológico regulador em pacientes com
longo tempo de transplante de órgãos sólidos, em estado de tolerância operacional:
bases para novas estratégias terapêuticas imunomoduladoras na clínica.
PESQUISADOR: Verônica Coelho (coordenadora e gerente do projeto)
CARGO/FUNÇÃO: Médica Pesquisadora do Laboratório de Imunologia do Instituto do
Coração - Professora Colaboradora da Disciplina de Imunologia Clínica e Alergia do
Hospital das
Clínicas da Faculdade de Medicina da USP.
INSCRIÇÃO CONSELHO REGIONAL Nº 45907
...............................................................................................................................
3. AVALIAÇÃO DO RISCO DA PESQUISA:
86
SEM RISCO RISCO MÍNIMO X RISCO MÉDIO
RISCO BAIXO RISCO MAIOR
(probabilidade de que o indivíduo sofra algum dano como consequência imediata ou tardia
do estudo)
4.DURAÇÃO DA PESQUISA : 3 anos
III - REGISTRO DAS EXPLICAÇÕES DO PESQUISADOR AO PACIENTE OU SEU
REPRESENTANTE LEGAL SOBRE A PESQUISA, CONSIGNANDO:
1. justificativa e os objetivos da pesquisa;
Neste projeto de pesquisa, estudaremos algumas diferenças no comportamento imunológico
entre as pessoas que foram transplantadas e que, com o tempo, ficaram muito bem (com
seu órgão transplantado funcionando bem), e aquelas que não evoluíram tão bem e
rejeitaram o enxerto, desenvolvendo rejeição crônica. Em todo mundo, médicos e
pesquisadores que trabalham com transplante estão estudando para tentar compreender as
diferenças nesses dois tipos de situação. Algumas pessoas que foram transplantadas
conseguem chegar a um melhor equilíbrio, precisando de apenas pequenas doses de
drogas imunossupressoras, que são os remédios que previnem a rejeição. Quase todos os
pacientes que param de tomar as os remédios
imunossupressores perdem o órgão
transplantado rapidamente, porém, existem alguns casos raros de pessoas que precisaram
suspender todas os remédios imunossupressores e que não perderam o enxerto. Nós
acreditamos que se conseguirmos compreender melhor essas diferenças, e saber como as
pessoas transplantadas que estão bem chegaram a este
estado de equilíbrio, nós
possamos usar este conhecimento em benefício de novos pacientes. Poderemos usar os
novos conhecimentos para identificar melhor (diagnosticar) o
estado de equilíbrio no
transplante e, desta forma, oferecer outras opções para diminuir os remédios para rejeição
de quem não precisa de tanto, e também para criar novos tratamentos para a rejeição no
futuro, que possam ajudar ao organismo da pessoa transplantada a desenvolver o estado de
melhor equilíbrio. Desta forma, esperamos que os conhecimentos conseguidos nessa
pesquisa possam ajudar pacientes no futuro. Este projeto de pesquisa conta com a
participação de vários centros de transplante no Brasil (estudo multicêntrico) e estudaremos
pacientes de transplante de rim, de coração e de fígado. Também teremos um grupo de
indivíduos sadios, não transplantados, como um grupo comparativo dos padrões
imunológicos.
87
2. procedimentos que serão utilizados e propósitos, incluindo a identificação dos
procedimentos que são experimentais;
Os nossos estudos serão feitos utilizando um pouco de sua urina e de seu sangue que será
colhido de uma veia do seu braço. Usaremos a sua urina para analisar proteínas e o seu
sangue para obter umas células chamadas linfócitos e também soro, e com esse material
faremos nossos estudos, analisando anticorpos e substâncias produzidas pelas células.
Também, se o seu médico, em algum momento, achar necessário fazer uma biópsia do seu
órgão transplantado para orientá-lo no seu tratamento (não por causa da pesquisa)
poderemos utilizar um fragmento do material retirado do enxerto para fazer a pesquisa. Mas,
a biópsia não será realizada por causa da pesquisa. Caso aceite participar deste estudo,
você deverá assinar este documento concordando que seja colhido o seu sangue para este
propósito, de acordo com o seguinte roteiro:
- Coleta de 20 ml de urina estéril.
- Coleta de 65 ml de sangue a ser feita de uma veia do seu braço, a cada 4 meses (3
coletas) e, mais uma (01) coleta se, em algum momento do estudo, você tiver rejeição ou
infecção. A coleta seqüencial programada será previamente agendada no momento do seu
ingresso na pesquisa.
3. desconfortos e riscos esperados;
O desconforto será de uma picada da agulha para a retirada do sangue. É importante
ressaltar que o você não é obrigado a participar desta pesquisa e que, se não quiser
participar, nada afetará o seu tratamento e acompanhamento neste hospital.
4. benefícios que poderão ser obtidos;
É importante dizer que esta pesquisa não prevê qualquer benefício direto para o seu
tratamento mas, poderá ajudar outros pacientes no futuro.
5. procedimentos alternativos que possam ser vantajosos para o indivíduo
Não se aplica.
88
IV - ESCLARECIMENTOS DADOS PELO PESQUISADOR SOBRE GARANTIAS DO
SUJEITO DA PESQUISA:
1. Acesso, a qualquer tempo, às informações sobre procedimentos, riscos e benefícios
relacionados à pesquisa, inclusive para dirimir eventuais dúvidas. Os riscos desta pesquisa
para o Sr ou Sra são mínimos, e estão relacionados à coleta de sangue. A coleta de sangue
será semelhante à coleta de exames, feita habitualmente pelo paciente no laboratório, para
os exames de rotina. O local da picada no seu braço pode ficar roxo no após a punção,
chamado hematoma, que desaparece com o passar dos dias. A coleta do sangue
necessária para a pesquisa vai sempre ser acompanhada pelo exame de hemograma e não
será colhido sangue do paciente que estiver com anemia que contra indique a retirada de
sangue. O pesquisador se responsabiliza por esclarecer os riscos e benefícios relacionados
a esta pesquisa e quaisquer outras dúvidas que o paciente tenha sobre a pesquisa.
2. Liberdade de retirar seu consentimento a qualquer momento e de deixar de participar do
estudo, sem que isto traga prejuízo à continuidade da assistência. O sujeito de pesquisa
está livre para retirar o seu consentimento a qualquer momento e desistir de participar desta
pesquisa. O fato de não querer participar desta pesquisa não vai trazer nenhum prejuízo
para o seu tratamento. O paciente vai receber todos os tratamentos disponíveis e
necessários para o seu caso.
3. Salvaguarda da confidencialidade, sigilo e privacidade. Todas informações obtidas dos
pacientes serão confidenciais e sigilosas durante toda a pesquisa e no momento em que
esta pesquisa for publicada nas revistas da área de saúde.
4. Disponibilidade de assistência no HCFMUSP, por eventuais danos à saúde, decorrentes
da pesquisa. Se ocorrer algum dano causado por esta pesquisa o paciente terá toda
assistência a sua saúde no hospital onde é acompanhado (Hospital das Clínicas da
Faculdade de Medicina da USP).
5. Viabilidade de indenização por eventuais danos à saúde decorrentes da pesquisa. Este
estudo prevê apenas riscos mínimos para o paciente, sem risco de dano à saúde do
paciente. Não existe remuneração ou indenização ao paciente que aceitar participar deste
estudo.
V. INFORMAÇÕES DE NOMES, ENDEREÇOS E TELEFONES DOS RESPONSÁVEIS
PELO ACOMPANHAMENTO DA PESQUISA, PARA CONTATO EM CASO DE
INTERCORRÊNCIAS CLÍNICAS E REAÇÕES ADVERSAS.
1. Coordenação do projeto
- Verônica Coelho - Laboratório de Imunologia – Instituto do Coração – Av. Dr. Enéas de
Carvalho Aguiar, 44 – 9o andar – bloco 2 -– cep: 05403-010 - fones: 3069-905 ou 3069
89
5180.
VI. OBSERVAÇÕES COMPLEMENTARES:
VII - CONSENTIMENTO PÓS-ESCLARECIDO
Declaro que, após convenientemente esclarecido pelo pesquisador e ter entendido o que me
foi explicado, consinto em participar do presente Protocolo de Pesquisa
São Paulo, ______de________de 20____.
____________________________________________
assinatura do sujeito da pesquisa ou responsável legal
_______________________________
assinatura do pesquisador coordenador
(carimbo ou nome Legível)
90
ANEXO C - TABELAS COM OS DADOS DEMOGRÁFICOS E CLÍNICOS DOS
SUJEITOS DA PESQUISA
Tabela 5. Dados demográficos e clínicos dos indivíduos em estado de tolerância operacional.
Paciente
Matching
Sexo
Idade
Doença de
Base
Nº de
Gestações
Tempo de
hemodiálise
(meses)
Nº de
transfusões
Nº de
Transplantes
Tempo de
Transplante
(anos)
Tipo de Doador
Disparidades
HLA
Tempo de
Isquemia
Função
Retardada do
Enxerto
Terapia de
Indução
Rejeição Aguda
Rejeição
Crônica
Terapia IS
Inicial
Ltx 03
Ltx 08
1
2
M
M
54
41
Glomerulonefrite
Glomerulonefrite
membrano
crônica
proliferativo
Ltx 10
3
F
42
Ltx 75
4
-
Nefropatia
diabética
-
Ltx 62
5
M
31
Glomerulonefrite
esclerose
segmentar focal
NA
NA
2
-
NA
ND
24
NA
-
ND
ND
2
0
-
ND
ND
2
1
-
1
25
7
9
-
14
Vivo não
Aparentado
Falecido
Vivo Aparentado
-
Vivo Aparentado
3
4
Idêntico
-
3
ND
16:00
01:00
-
01:00
NC
Sim
Não
-
Não
NC
Basilixmab
Não
-
Não
Não
Sim
Não
-
Não
Não
Não
-
Não
Cya, Aza, Pred
-
Cya, Aza, Pred
-
Sem IS desde
2005
-
Recidiva de
GESF no rim Tx
-
1,71
Não
NC
Pred, Tacro,
MMF
Sem IS desde
2006
Terapia IS Final
Sem IS desde
2002
Comorbidades
Hipertensão
Arterial;
Obesidade
HBV e HCV
Cretinina
Sérica
1,15
1,62
Sem IS desde
2003
Múltiplos
abcessos
perianal;
jan/2004 - Infarto
Agudo do
Miocárdio com
Angioplastia;
mar/08 Abcesso de
mama; ago/08 Infarto Agudo
Miocárdio
0,89
Ltx: Transplante; TO: Tolerância operacional; M: Masculino; F: Feminino; NA: não se aplica; ND: não
disponível; Basiliximab: Anticorpo monoclonal quimérico anti-CD25; Aza: Azatioprina; Cya:
Ciclosporina A; MMF: Micofenolato mofetil; Tacro: Tacrolimus; Pred: Prednisolona. HBV: Hepatite B;
HCV: Hepatite C; GESF: Gloméruloesclerose segmentar e focal. ND: não disponível; IS:
Imunossupressão.
91
Tabela 6. Dados demográficos e clínicos dos indivíduos em estado de Rejeição Crônica
Paciente
Ltx 25
Ltx 04
Ltx 13
Ltx 67
Ltx 05
Matching
1
2
3
4
5
Sexo
M
M
F
F
M
Idade
51
46
28
41
35
Doença de
Glomerulonefrite Glomerulonefrite Glomerulonefrite Glomerulonefrite Glomerulonefrite
Base
crônica
crônica
crônica
crônica
crônica
Nº de
NA
NA
0
0
NA
Gestações
Tempo de
hemodiálise
55
ND
12
25
60
(meses)
Nº de
2
8
1
ND
0
transfusões
Nº de
1
1
1
1
1
Transplantes
Tempo de
Transplante
15
6
12
13
9
(anos)
Tipo de Doador
Falecido
Falecido
Vivo Aparentado Vivo Aparentado
Falecido
Disparidades
6
6
2
1
6
HLA
Função
Retardada do
Sim
Sim
Sim
Não
Sim
Enxerto
Terapia de
Não
ND
Não
Não
ATG
Indução
Rejeição Aguda
Sim
Sim
Sim
Não
Não
Rejeição
Sim
Sim
Sim
Sim
Sim
Crônica
Última Biópsia
2007
2005
2006
2005
2004
(ano)
Arterioloescleros
NCE com
NCE Banf I,
e hialia extensa,
NCE Banf II,
glomerulopatia
arterioloescleros
Histologia
NCE Banff II
atrofia e fibrose
fibrose focal
do Tx, C4d
e hialia, C4d
focais
positivo
positivo
Terapia IS
Cya, Aza, Pred
ND
Cya, Aza, Pred
Cya, Aza, Pred
Cya, Aza, Pred
Inicial
2005 - ITU; 1999
- Cisto Ovariano
2008 - CMV;
esquerdo +
1999 Salpingectomia
HCV, Herpes
jan/96 e jul/97 Condiloma
esquerda;
Simples; 2001Pneumonia
Acuminado;
Endometriose;
Comorbidades
ND
Candidíase
lobar; jun/03 2005 Hipertensão
genital;
Herpes Zoster
Pneumonia;
Arterial;
Amidalite
2008 - Herpes
Dislipidemia;
Simples
2004 e 2006 Gota; 2007 Herpes Zoster
Cretinina
2,26
1,21
1,64
2,06
1,41
Sérica
Ltx: Transplante; RC: Rejeição Crônica; M: Masculino; F: Feminino; NA: não se aplica; ND: não
disponível; ATG: Timoglobulina Anti-timocitária; Aza: Azatioprina; Cya: Ciclosporina A; Pred:
Prednisolona; HCV: Hepatite C; ITU: Infecção do trato urinário; NA: não se aplica; ND: não disponível;
IS: Imunossupressão; NCE: Nefropatia crônica do enxerto.
92
Tabela 7. Dados demográficos e clínicos dos indivíduos com função estável do enxerto tomando
doses habituais de imunossupressores.
Paciente
Matching
Sexo
Idade
Ltx 28
1
M
56
Doença de
Base
Glomerulonefrite
crônica
Nº de
Gestações
Tempo de
hemodiálise
(meses)
Nº de
transfusões
Nº de
Transplantes
Tempo de
Transplante
(anos)
Tipo de Doador
Disparidades
HLA
Função
Retardada do
Enxerto
Terapia de
Indução
Rejeição Aguda
Rejeição
Crônica
Terapia IS
Inicial
Ltx 09
2
M
47
Insuficiência
Renal sem
Causa Definida
Ltx 14
3
F
45
Ltx 27
4
F
47
Nefropatia
diabética
Glomerulonefrite
crônica
Ltx 31
5
M
56
Insuficiência
Renal a
Esclarecer
NA
NA
2
ND
NA
2
18
24
60
26
ND
ND
0
>5
2
1
1
1
1
1
36
6
4
24
7
Falecido
Vivo
Falecido
Vivo
Vivo Aparentado
3
3
3
3
3
NC
ND
Não
NC
Nâo
Não
Basilixmab
Basilixmab
Não
Daclizumab
Não
Não
Não
Sim
Sim
Não
Não
Não
Não
Não
Pred, Aza
Pred, Tacro,
MMF
Pred, Tacro,
MMF
Pred, Aza
Comorbidades
Fev/2004 Celulite
Blastocistose
ND
ND
Cretinina
Sérica
1,23
0,89
0,88
0,86
Ltx: Transplante; ES: indivíduos com função
imunossupressores; M: Masculino; F: Feminino;
Anticorpo monoclonal quimérico anti-CD25.
antiCD25; Aza: Azatioprina; MMF: Micofenolato
não disponível; IS: Imunossupressão.
Pred, Tacro,
MMF
Abr/2008 Adenocarcinoma
de Próstata;
Candidíase
1,28
estável do enxerto tomando doses habituais de
NA: não se aplica; ND: não disponível; Basiliximab:
Daclizumab: Anticorpo monoclonal humanizado
mofetil; Tacro: Tacrolimus; Pred: Prednisolona; ND:
Tabela 8. Dados demográficos dos indivíduos saudáveis.
Paciente
Matching
Sexo
Idade
Ltx 41
1
M
39
Ltx 36
2
M
42
Ltx 40
3
F
34
Ltx 37
4
F
52
Ltx: Transplante (doador); SA: indivíduo saudável; M: masculino; F: feminino.
Ltx 43
5
M
30