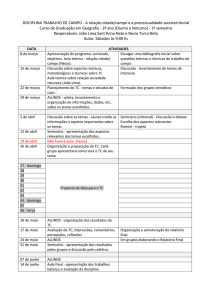
Química 3 – Apostila 2
Química 3 Apostila 2
Prof. Msc
Prof. Msc João Neto
I i
Ionizar: formar íons
f
í
Prof. Msc. João Neto
2
Prof. Msc. João Neto
3
Prof. Msc. João Neto
4
Prof. Msc. João Neto
5
Á id
Ácidos
• Arrhenius identificou ácido como sendo todo
composto
t que, quando
d colocado
l d na água,
á
se
ioniza,, fornecendo como cátion somente íons
H+.
Prof. Msc. João Neto
6
Atualização da teoria de
ç
Arrhenius
• O íon H+ que um ácido libera se combina com
uma molécula
lé l de
d água
á
(H2O) formando
f
d H3O+,
que se chama hidrônio ou hidroxônio.
q
Prof. Msc. João Neto
7
Prof. Msc. João Neto
8
Prof. Msc. João Neto
9
• O sabor azedo é uma das características
comuns aos ácidos,
á id
os quais,
i assim
i como
todas as substâncias azedas,, estimulam a
salivação.
• O uso do
d vinagre ou do
d suco de
d limão
l ã em
saladas está associado a esse fato. O aumento
da quantidade de saliva facilita a ingestão.
Prof. Msc. João Neto
10
Prof. Msc. João Neto
11
Prof. Msc. João Neto
12
Prof. Msc. João Neto
13
Prof. Msc. João Neto
14
Prof. Msc. João Neto
15
Prof. Msc. João Neto
16
Prof. Msc. João Neto
17
Prof. Msc. João Neto
18
Prof. Msc. João Neto
19
Prof. Msc. João Neto
20
Prof. Msc. João Neto
21
Prof. Msc. João Neto
22
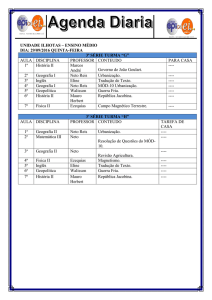
HIO ‐‐ Ácido HIO Ácido hipoiodoso
hipoiodoso HBrO4 – Ácido Ácido perbrômico
perbrômico
H2SO3 ‐ Ácido sulfuroso H3PO4 – Ácido fosfórico
Coluna 7A ‐ Halogênios
HX – Ácido
Á id _______
_______ídrico
íd i
ídrico
HXO – Ácido hipo_______oso
_______oso
HXO2 – Ácido _______oso
HXO3 – Ácido _______
_______ico
ico
HXO4 – Ácido per_______ico
H2S – Ácido sulfídrico
H2SO3 – Ácido sulfuroso
H2SO4 – Ácido sulfúrico
H3PO2 – Ácido hipofosforoso
H3PO3 – Ácido fosforoso
H3PO4 – Ácido fosfórico
HNO2 – Ácido nitroso
HNO3 – Ácido nítrico
Prof. Msc. João Neto
23
Prof. Msc. João Neto
24
HCl H2O
H3O Cl
Prof. Msc. João Neto
25
Prof. Msc. João Neto
26
Prof. Msc. João Neto
27
EXTRA
Prof. Msc. João Neto
28
EXTRA
Prof. Msc. João Neto
29
Prof. Msc. João Neto
30
Prof. Msc. João Neto
31
Prof. Msc. João Neto
32
Oxiácidos == nº de oxigênio = nº de oxigênio –
nº de oxigênio – nº de H
nº de H+
0 Fraco (H4SiO4)
1Moderado (H3PO4)
F t (HNO3)
2Forte
Hidrácidos
Forte:: HCl,
Forte
HCl, HBr e HI
Moderado:: HF
Moderado
Fraco:: RestoProf. Msc. João Neto
Fraco
33
Prof. Msc. João Neto
34
Prof. Msc. João Neto
35
Prof. Msc. João Neto
36
Prof. Msc. João Neto
37
Prof. Msc. João Neto
38
Prof. Msc. João Neto
39
Oxiácidos = nº de oxigênio = nº de oxigênio –– nº de H+
0 Fraco
1Moderado
2Forte
Hidrácidos
Forte:: HCl,
Forte
HCl, HBr e HI
Moderado:: HF
Moderado
Fraco:: Resto
Fraco
Prof. Msc. João Neto
40
Prof. Msc. João Neto
41
Prof. Msc. João Neto
42
Prof. Msc. João Neto
43
Prof. Msc. João Neto
44
Prof. Msc. João Neto
45
Prof. Msc. João Neto
46
Prof. Msc. João Neto
47
Prof. Msc. João Neto
48
2
Mg
g(OH)2( s ) H2O ( l ) Mg
g 2OH ( aq )
Prof. Msc. João Neto
49
2
Mg
g(OH)2( s ) H2O ( l ) Mg
g 2OH ( aq )
Prof. Msc. João Neto
50
Prof. Msc. João Neto
51
Prof. Msc. João Neto
52
Prof. Msc. João Neto
53
Prof. Msc. João Neto
54
Prof. Msc. João Neto
55
x
M(OH)x
M x(OH)
H2O
Prof. Msc. João Neto
56
Prof. Msc. João Neto
57
Prof. Msc. João Neto
58
Prof. Msc. João Neto
59
Prof. Msc. João Neto
60
Prof. Msc. João Neto
61
Prof. Msc. João Neto
62
Prof. Msc. João Neto
63
Prof. Msc. João Neto
64