“LOUCOS POR QUÍMICA”
Prof. Neif Nagib
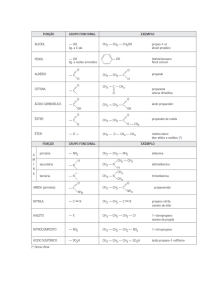
São dois ou mais compostos orgânicos diferentes que
apresentam a mesma fórmula molecular.
H3C
CH2 OH
Etanol
C2H 6O
H3C O CH3
Metoximetano
A isomeria se divide em:
Isomeria Plana ou Constitucional.
Isomeria Espacial ou Configuracional.
Ocorre
quando
duas,
ou
mais,
moléculas
orgânicas
possuírem a mesma fórmula molecular e apresentarem
diferentes fórmulas estruturais planas.
CLASSIFICAÇÃO DA ISOMERIA PLANA:
Função
Cadeia
Posição
Metameria ou compensação
Tautomeria
Este tipo de isomeria ocorre em compostos de funções
diferentes mas que apresentem a mesma fórmula molecular.
H3C
CH2
Álcool
H3C
CH2
Éster
C
C
O
H
Propanal
C 2H 6O
Metoximetano
H3C C
Cetona
CH3
O
Propanona
C 3H 6 O
O
O
CH3
Éter
Etanol
Aldeído
H3C
H3C O
OH
CH3
H3C
CH2 C
Etanoato de metila Ác. carboxílico
C 3H 6O2
O
OH
Ác. propanoico
Este tipo de isomeria ocorre em compostos de mesma função
química, porém diferem em pelo menos um critério na
classificação da cadeia carbônica.
CH3
H3C
CH2
Normal
CH2
CH3
CH2
pentano
Ramificada
C5H12
H2C
Aberta
CH
CH3
CH
H3C
CH2
CH3
Metilbutano
CH2
CH2 CH2
Fechada
Propeno
Ciclopropano
C 3H 6
H3C
CH2
Homogênea
CH2
NH2
Propilamina
H3C
CH2
Heterogênea
C3H 9 N
NH
CH3
Etil-metilamina
Este tipo de isomeria ocorre em compostos de mesma função
química e mesma cadeia, porém diferem pela posição de uma
ramificação, uma insaturação ou um grupo funcional.
1
H2C
2
3
CH
CH2
4
CH3
But-1-eno
OH
1
H2C
C4H 8
3
2
1
CH3
CH2
H3C
1
2
CH
4
5
H3C CH CH2 CH2 CH3
2-metil-pentano
CH
4
But-2-eno
OH
CH3
3
2
CH3
CH
C3H 8O
3
3
Propan-2-ol
Propan-1-ol
CH3
2
1
H3C
1
2
CH3
3
4
5
H3C CH2 CH CH2 CH3
C6H14
3-metil-pentano
Este tipo de isomeria ocorre em compostos heterogêneos de
mesma função química , porém diferem pela posição do
heteroátomo.
H3C O
CH2 CH2 CH3
metoxipropano
H3C CH2 O
CH2 CH3
etoxietano
C4H10O
H3C CH2 NH CH2 CH3
Dietilamina
H3C
C
O
metil-propilamina
C4H11N
O CH2 CH3
Etanoato de etila
H3C CH2 CH2 NH CH3
H3C
CH2 C
O
O CH3
Propanoato de metila
C4H 8O2
Tautomeria é o caso particular de isomeria funcional em que os
dois isômeros ficam em equilíbrio químico dinâmico.
Tautômeros
OH
H2C=C
CH3
Propen-2-ol
C3H 6 O
O
H3C C
CH3
Propanona
OH
H3C
CH=CH
Propen-1-ol
H3C
CH2
Propanal
C
O
H
01. Considere a nomenclatura IUPAC dos seguintes
hidrocarbonetos.
I. metil-ciclobutano.
IV. ciclo-hexano.
II. 3-metil-pentano.
V. pent-2-eno.
III. pentano.
A alternativa que relaciona corretamente compostos
isoméricos é
a) I e III.
b) III e V.
d) II e IV.
e) II e III.
c) I e V.
02. Relacione o tipo de isomeria com as estruturas apresentadas a
seguir. Depois, assinale a alternativa que corresponda a sequência
correta obtida:
1. Tautomeria
2. Isomeria de posição
3. Metameria
4. Isomeria funcional
a) 1, 3, 4, 2
b) 1, 3, 2, 4
d) 4, 1, 3, 2
e) 3, 4, 1, 2
c) 1, 4, 3, 2
Na isomeria espacial os isômeros espaciais possuem a mesma
fórmula molecular e também a mesma fórmula estrutural
plana,
diferenciando
apenas
nas
fórmulas
estruturais
espaciais.
Duas substâncias relacionadas através de uma isomeria
espacial são chamadas de estereoisômeros.
A isomeria espacial se divide em:
Na isomeria geométrica (cis-trans ou Z-E) os isômeros são
compostos que possuem a distribuição espacial diferente. Os
isômeros podem ser classificados como cis (Z) ou trans (E).
CONDIÇÃO:
R1
R3
C =C
R2
R4
Sendo:
R1 R 2
e
R1
R 3 R4
R2
R3
R4
Cis (Z) - quando os ligantes de maior número atômico (ou massa)
situam-se do mesmo lado da molécula.
Trans (E) - quando os ligantes de maior número atômico (ou
massa) não se situam do mesmo lado da molécula.
H3C
H
C =C
CIS
CH3
H
Cis-but-2-eno
H
H3C
C =C
CH2-CH3
CIS
CH2
H
H
H
CIS
C =C
TRANS
H
CH3
H3C
C =C
TRANS
H
H3C
Cl
CH2-CH3
C
CH2
C
CH3
H
Trans-but-2-eno
C
C
H3C
CH3
H3C
CH2
CH3
H
TRANS
Obs.: - Os isômeros geométricos apresentam densidade, ponto
de fusão e ebulição deferentes.
- Em geral, a forma TRANS é mais estável.
Na isomeria óptica os isômeros são compostos assimétricos
(quirais)
que,
apesar
de
possuirem
propriedades
físicas
semelhantes (como pontos de fusão e ebulição), apresentam efeito
fisiológico distinto e desviam diferentemente a luz polarizada.
CONDIÇÃO:
Apresentar carbono assimétrico (quiral).
X
Y
C
*
W
Z
Sendo:
X Y W Z
Os compostos que apresentam carbono assimétrico tem a
propriedade de desviar a luz polarizada.
A luz polarizada é obtida fazendo-se passar um feixe de luz
natural por dispositivos chamados de polarizadores. Um dos mais
comuns é o prisma de Nicol.
Luz Natural
Polarizador
Luz Polarizada
Os isômeros ópticos podem ser separados em dois
grupos, os levógiros e os dextrógiros.
Levógiros ("l" ou "-")
são os isômeros que desviam a luz
polarizada para a esquerda.
Dextrógiros ("d" ou "+")
polarizada para a direita.
são os isômeros que desviam a luz
Ex.:
Cl
H3C
C * CH2
H
CH3
Nº de carbonos
assimétricos
Isômeros ópticos ativos = 2n = 21 = 2
Misturas racêmicas = 2(n-1) = 20 = 1
1 dextrógiro
1 levógiro
Os isômeros ópticos são denominados antípodas ópticos,
enantiômeros ou enantiomorfos.