Qui.
Este conteúdo pertence ao Descomplica. Está vedada a
cópia ou a reprodução não autorizada previamente e por
escrito. Todos os direitos reservados.
Semana 4
Allan Rodrigues
Xandão
(Renan Micha)
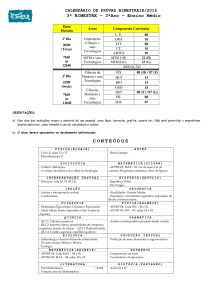
CRONOGRAMA
07/03
14/03
21/03
28/03
Distribuição
Eletrônica
Classificação
Periódica dos
Elementos
08:00
18:00
11:00
21:00
Propriedades
Periódicas e
Aperiódicas
Ligações Químicas:
teoria do octeto,
ligação iônica e
ligação metálica
08:00
18:00
11:00
21:00
Ligações Químicas:
ligação covalente
Geometria
molecular,
polaridade e forças
intermoleculares
08:00
18:00
11:00
21:00
Funções
inorgânicas: óxidos
Número de oxidação
- compostos
orgânicos e
inorgânicos
08:00
18:00
09:00
19:00
07
mar
Classificação periódica
dos elementos
01. Resumo
02. Exercício de Aula
03. Exercício de Casa
04. Questão Contexto
RESUMO
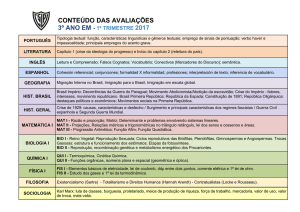
Breve histórico da Tabela Periódica - tentativas de organização das entidades químicas
→ 1871, Ordem pelas Massas Atômicas, Mendeleev (russo) e Meyer (alemão): Mendeleev anotou,
em fichas, as propriedades de todos os elementos
conhecidos na época, como massa, ponto de fusão,
→ 1817, Lei das Tríades, Dobereiner (alemão): or-
ponto de ebulição etc. As analisou e percebeu que
ganizou elementos em tríades (com propriedades
se organizasse em ordem crescente de massa have-
semelhantes), as chamadas ‘Tríades de Doberei-
ria certa regularidade entre os elementos. Guardava
ner’. Nesse trio, o elemento do meio teria a média
semelhanças com a classificação atual, mas ainda
das massas dos elementos anterior e posterior. Foi
apresentava problemas: isótopos, ou seja, um ele-
a primeira tabela, ou tentativa de organização, com
mento com duas massa distintas, como organizar?
alguma relevância.
Curiosidade: Mendeleev chegou a prever massa e
→ 1862, Parafuso Telúrico, Chancourtois (fran-
propriedades de elementos ainda não descobertos
cês): criou ‘tabela’ conhecida como ‘Parafuso Te-
à época. Anotou um ponto de interrogação e deter-
lúrico’, organizada pelas massas dos átomos. Era
minou algumas de suas propriedades. Futuramente
tridimensional e cilíndrica. Os átomos foram organi-
foram se confirmando suas previsões.
Qui. 136
zados em espiral nesse cilindro. Elementos da mesma coluna teriam propriedades semelhantes.
Problema: só funcionava até o elemento cálcio.
→ 1864, Lei das Oitavas, Newlands (inglês): ligou
a regularidade das propriedades químicas às oitavas na escala musical e disse que todo elemento tem
propriedades parecidas com o oitavo elemento da
sua sequência na tabela. Abaixo segue uma imagem
da referida tabela.
Exemplo da organização proposta por Mendeleev, que teve
grande influência
→ 1913, Ordem de Número Atômico, Moseley (inglês): Após resultado de trabalho de Moseley com
raios-X de cerca de 40 elementos, a tabela foi modificada: passou a ser orientada pelo número atômico dos elementos ao invés do peso. Ele associou as
propriedades dos elementos aos seus números atômicos.
Seabord: Acrescentou lantanídeos e actinídeos à tabela.
CLIQUE AQUI PARA VISUALIZAR
A TABELA ATUAL
Organização
Elementos dessas colunas terminam suas distribuições em ns2 (n-1)dx, onde x vai de 1 a 10 e depende
→ É feita em linhas e colunas
da coluna onde o elemento se encontra. Por exem-
→ As linhas recebem nomes: períodos ou séries.
plo: IIIB, x = 1; VB, x =3.
→ O período diz quantas camadas um átomo tem,
e elementos do mesmo período possuem o mesmo
→ Série dos lantanídeos e actinídeos (elementos
número de camadas
de transição interna): são aqueles que terminarão
→ Colunas são chamadas de grupos ou famílias
sua distribuição eletrônica no subnível f.
→ Elementos de uma mesma coluna irão apresentar
a mesma terminação na distribuição eletrônica e te-
Genericamente: ns2(n-2)fy, onde y vai de 1 a 14 de-
rão propriedades químicas semelhantes. Exemplos:
pendendo de qual posição está o elemento. O pri-
Si e C.
meiro da série tem y = 1 e o último, y = 14.
A tabela contém 18 colunas divididas em famílias. A
Divisão por propriedades
família A (elementos representativos), B (metais de
transição), lantanídeos e actinídeos.
Metais e ametais (fundamental conhecê-los para entender melhor ligações químicas)
→ Família A (grupos 1, 2, e de 13 a 18)
de eletricidade (em verde na tabela abaixo). Em ge-
onde n é o número do período)
ral, apresentam poucos elétrons na camada de va-
IIA: Metais alcalinos terrosos (terminam distribuição
lência e tendem a doar seus elétrons para alcançar
em ns2)
seus octetos.
IIIA: Família do Boro (terminam distribuição em ns2
- Ametais tem propriedades distintas das de cima
np1)
(elementos em amarelo na tabela abaixo). Em geral,
IVA: família do Carbono (terminam distribuição em
têm muitos elétrons na última camada e tendem a
ns2 np2)
receber elétrons ou compartilhar por ligação cova-
VA: Família do Nitrogênio (terminam distribuição em
lente normal ou dativa. Apresentam alta eletronega-
ns2 np3)
tividade.
VIA: Calcogênios (terminam distribuição em ns2 np4)
- H não é nem metal, nem ametal, nem gás nobre
VIIA: Halogênios (terminam distribuição em ns2 np5)
VIIIA: Gases Nobres (terminam distribuição em ns2
np6)
→ Família B (elementos de transição externa, grupos 3 ao 12)
1a coluna da família B até a última: IIIB, IVB, VB, VIB,
VIIB, VIIIB, IB, IIB.
Tabela para identificação de metais e ametais: elementos em
laranja são metais e os em azul são ametais.
Qui. 137
- Metais são dúcteis e maleáveis, ótimos condutores
IA: Metais alcalinos (terminam distribuição em ns1,
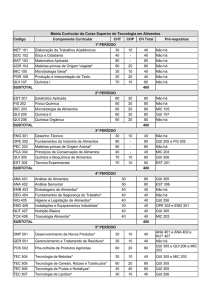
EXERCÍCIO DE AULA
mação, assinale a opção falsa.
T
2.
Q
a) calcogênio
gás nobre
b) enxofre
silício
c) gás nobre
alcalinoterroso
d) halogênio
alcalino
e) bário
cério
Os elementos químicos silício e germânio são ametais e constituem os chamados
semicondutores, usados para construir componentes eletrônicos, como iodos,
transistores e microprocessadores.
Algumas das qualidades desses elementos devem-se às suas estruturas atômicas.
Com relação ao silício e ao germânio e à posição que eles ocupam na tabela periódica, podemos afirmar que:
a) se situam no mesmo período da tabela periódica e apresentam configuração
final “ns2 np4”;
b) pertencem à mesma família da tabela periódica, possuindo, portanto, o mesmo número de níveis eletrônicos;
c) pertencem à classe dos elementos representativos da família do carbono, possuindo em comum o mesmo número de elétrons de valência;
d) são elementos de transição e apresentam subnível energético do tipo “p”;
e) apresentam o mesmo número de níveis eletrônicos, possuindo, portanto, o
mesmo raio atômico.
Qui. 138
1.
Um átomo T apresenta menos 2 prótons que um átomo Q. Com base nessa infor-
TEXTO PARA AS QUESTÕES 3 e 4
A tabela de Mendeleiev, ao ser apresentada à Sociedade Russa de Química, possuía espaços em branco, reservados para elementos ainda não descobertos. A
tabela foi assim organizada a partir da crença de Mendeleiev na existência de relações periódicas entre as propriedades físico-químicas dos elementos.
3.
Ao analisar a tabela de Mendeleiev, Berlikov, um jovem químico, criticou-a fazendo a seguinte pergunta:
“Pode a natureza ter espaços em branco?”
Do ponto de vista do método científico, a pergunta reflete a ausência de:
a) lei física
c) modelo matemático
d) observação experimental
e) todas as respostas
4.
Dois dos elementos, então representados pelos espaços em branco, hoje são conhecidos como gálio (Ga) e germânio (Ge).
Mendeleiev havia previsto, em seu trabalho original, que tais elementos teriam
propriedades químicas semelhantes, respectivamente, a:
a) estanho (Sn) e índio (In)
b) alumínio (Al) e silício (Si)
c) cobre (Cu) e selênio (Se)
d) zinco (Zn) e arsênio (As)
e) todas as respostas
Qui. 139
b) hipótese plausível
EXERCÍCIOS PARA CASA
1.
A tabela periódica dos elementos contém uma grande quantidade de informações e é utilizada na previsão das propriedades físicas e químicas dos elementos
e seus compostos, servindo de base para a compreensão das ligações químicas.
Assinale as alternativas corretas, consultando a tabela periódica:
01. Os elementos químicos são distribuídos na tabela periódica em ordem crescente de seus números atômicos, de forma que elementos possuidores de propriedades físicas e químicas semelhantes situem- se em colunas verticais denominadas grupos.
02. As propriedades periódicas dos elementos são, também, função das suas
massas atômicas. Portanto, excepcionalmente, as posições relativas de alguns
elementos, tais como Iodo e Telúrio, Argônio e Potássio, Cobalto e Níquel são
mantidas invertidas na tabela periódica moderna em homenagem a Mendellev.
04. Dentre os elementos: Mg, S, Al e Te, o que possui maior eletronegatividade
é o Te.
tada por [Ar]3d9.
16. O elemento de configuração eletrônica, no estado fundamental, [Ar]3d54s2
é o ferro.
Soma (
2.
)
“Quando todos os elementos são arranjados em ordem crescente de seus pesos
atômicos, elementos com propriedades semelhantes ocorrem em intervalos periódicos regulares.”
Essa maneira de se referir aos elementos químicos foi precursora da classificação atual e foi proposta por
a) A. Einstein e M. Planck.
b) L. Meyer e D. Mendeleev.
c) N. Bohr e E. Rutherford
d) J. Dalton e R. Boyle.
e) A. Lavoisier e J. Gay-Lussac.
3.
Os elementos I, II e III têm as seguintes configurações eletrônicas em suas camadas de valência:
I: 3s23p3
II: 4s24p5
III: 3s2
Qui. 140
08. A configuração eletrônica do íon Cu2+ no estado fundamental é represen-
Com base nestas informações, assinale a alternativa “errada”.
a) O elemento I é um não-metal.
b) O elemento II é um halogênio.
c) O elemento III é um metal alcalino terroso.
d) Os elementos I e III pertencem ao terceiro período da Tabela Periódica.
e) Os três elementos pertencem ao mesmo grupo da Tabela Periódica.
4.
Assinale a alternativa em que o elemento químico cuja configuração eletrônica,
na ordem crescente de energia, finda em 4s2 3d3:
a) grupo 3 e 2º período.
b) grupo 14 e 2º período.
c) grupo 14 e 5º período.
d) grupo 5 e 4º período.
Qui. 141
e) grupo 15 e 3º período.
QUESTÃO CONTEXTO
Novos elementos na tabela periódicas foram descobertos por americanos, japoneses e russos.
De acordo com o jornal online oglobocom,
“A União Internacional de Química Pura e Aplicada (Iupac, na sigla em inglês) e a União Internacional de Física Pura e Aplicada (Iupap) reconheceram a produção de quatro novos elementos químicos, que agora passam a
fazer parte oficialmente da tabela periódica. Provisoriamente batizados de
ununtrium (Uut), ununpentium (Uup), ununseptium (Uus) e ununoctium (Uuo),
eles têm como número atômico, isto é, a quantidade de prótons em seu núcleo, 113, 115, 117 e 118, respectivamente, e completam as lacunas que restavam na sétima linha da tabela.”
‘oglobo.com’ – 14/01/2016
Indique, observando a foto, a que família o elemento apontado poderia pertencer e qual seria a quantidade de elétrons em sua última camada.
GABARITO
01.
03.
1.a
a) Verdadeira, pois estes possuem o mesmo número
2.d
atômico (prótons).
3. Exercícios para aula
Questão contexto
e
b) Verdadeira, estes possuem o mesmo número de
4.b
elétrons (o numero de elétrons é igual ao numero de
5.c
prótons).
c) FALSA, ele não possui um próton a mais, o D₂O
02.
(deutério), possui 1 nêutron a mais que o hidrogênio.
Exercícios para casa
gênio (Massa = Prótons + Nêutrons).
1.b
e) Verdadeira, o deutério, possui 1 nêutron e 1 próton
2.a
(massa = 2), já o trítio possui 2 nêutrons e 1 próton
3.a
(massa = 3), portanto, é o dobro de nêutrons (2x1 =
4.a
2).
6.d
7.b
8.c
9.c
Qui. 142
5.c
d) Verdadeira, ambos tem massa maior que o hidro-
Qui. 143
CLIQUE AQUI PARA VOLTAR