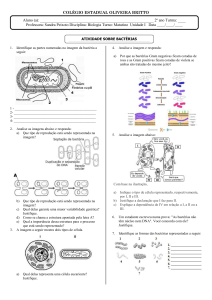
OLIMPÍADAS CEARENCE DE QUÍMICA
QUÍMICA I - 1º etapa / 96
1ª QUESTÃO - Os gregos acreditavam na TEORIA DOS QUATROS ELEMENTOS, que dizia ser o
universo formado pela água, ar, fogo e terra, aos quais denominaram de elementos.
Como você denominaria estes supostos elementos de acordo com a atual classificação da matéria . Justifique.
2ª QUESTÃO - Considere os seguintes dados, referente à reação:
Sulfeto de zinco + Oxigênio Óxido de zinco + Dióxido de enxofre.
MASSAS DE
REAGENTES
Sulfeto de zinco
Oxigênio
210,0g
96,0g
15,2g
Antes da reação
Após a reação
MASSAS DE PRODUTOS
Óxido de zinco
Dióxido de enxofre
162,8g
128,0g
Responda justificando as respostas ?
a)
b)
c)
d)
e)
Que substância foi colocada em excesso ?
Que massa de sulfeto de zinco reagiu ?
Houve conservação de massa ?
Quantas gramas de oxigênio seriam necessários para reagir totalmente com 250,0g de sulfeto de zinco ?
Enuncie com suas palavras, as leis utilizadas para resolver a questão.
3ª QUESTÃO - Complete a tabela e responda as questões abaixo:
Átomo
A
B
C
D
E
F
a)
b)
c)
d)
Nº atômico (Z)
1
8
Nº de massa Prótons
Neutros
Elétrons
Último nível
1
8
6
14
6
7
31
2s2 2p2
7
3s2 3p3
O que distingue os elementos químicos entre si ?
Quais átomos são os isóbaros ? Justifique.
Quais átomos apresentam as mesmas propriedades química e diferem nas físicas. Justifique.
Quais átomos são isótonos ? Justifique.
4ª QUESTÃO - Dois metais foram aquecidos: Ferro e magnésio.
O ferro em barra, depois de aquecido foi recolhido no estado líquido em uma forma esférica
transformando a barra em uma bola de ferro.
O magnésio quando aquecido, desprendeu uma fumaça, restando um pó branco.
Que tipo de fenômeno ocorreu em cada caso ? Justifique sua resposta.
5ª QUESTÃO - Baseado nas informações contidas na tabela abaixo que indica três propriedades físicas de
alguma substâncias, responda, justificando suas respostas.
Propriedades Ponto de
Substâncias
Ponto de
Fusão (em k)
Ebulição (em k)
Solubilidade
em água
Brometo de Sódio
1020
1663
solúvel
Óxido de Alumínio
2318
3273
insolúvel
Tolueno
178
384
insolúvel
Metano
91
113
insolúvel
Benzeno
278
353
insolúvel
a) Qual destas substâncias é um gás à temperatura ambiente (298 k) ?
b) Como poderíamos separar Benzeno de uma mistura de benzeno e água ?
c) A partir de uma mistura de óxido de alumínio e brometo de sódio, como recuperar o óxido de alumínio ?
d) Como separa benzeno de uma mistura de benzeno e Tolueno ?
QUÍMICA II - 1º etapa / 96
1ª QUESTÃO - Você tem diante de si um frasco com um pó branco que pode ser um dos seguintes sais:
cloreto de sódio (NaCl), carbonato de sódio (Na2CO3) ou carbonato de cálcio (CaCO3). Num livro de Química
você encontrou as seguintes informações :
a) “Todos os carbonatos em presença de ácido clorídrico produzem efervescência”.
b) “Todos os carbonatos são insolúveis, com exceção dos carbonatos de metais alcalinos e de amônio
(NH4+).”
c) “Todos os cloretos são solúveis, com exceção dos cloretos de chumbo, prata e mercúrio”.
d) Dispondo apenas de recipiente de vidro, água e ácido clorídrico, como você faria para identificar o sal
2ª QUESTÃO - A tocha olímpica que a partir de 27 de abril começou a se revezar entre as várias cidades
dos Estados Unidos (24.000 Km em 84 dias) é mantida por um pequeno tanque contendo 2 Kg de propano
que mantém a chama acesa de 30 a 40 minutos.
Dê as respostas do que se pede, justificando-as.
a)
b)
c)
d)
A reação balanceada que ocorre ao se queimar propano ao ar.
A composição percentual de C e H em uma molécula de propano.
A queima de 3 moles de propano produzirá quantos moles de gás carbônico ?
O rendimento percentual de CO2 se partirmos de 54g de C3H8 e 150g de O2 ? Qual o reagente em excesso
? Qual o limitante ?
e) Teria alguma vantagem em substituir os dois quilos de propano por dois quilos de metano ? Justifique.
Dados: Elementos
C
H
O
Nº atômico
6
1
8
Massa atômica
12
1
16
3ª QUESTÃO - Dada a tabela:
SOLUTO
NOME
FÓRMULA
Sulfato de potássio
K2SO4
Dicromato de potássio
K2Cr2O7
Sulfato de sódio
Na2SO4
SOLUBILIDADE EM ÁGUA (g/litro) Kps
293 K
313 K
333 K
111,1
147,6
181,7
131
292
505
488
453
Dados: Elementos
K
Cr
S
Na
O
Nº atômico
19
24
16
11
8
Massa atômica
39
52
32
23
16
Pede-se:
a) Calcule a quantidade de K2Cr2O7 que precipitou quando 1 litro de solução 1M passou de uma temperatura
de 333K para 293K.
b) Utilizando a tabela determine a molaridade da solução de K2SO4 a 313K.
c) Considerando as soluções da tabela a 313K, como você procederá para tornar supersaturada esta solução
sem adicionar soluto ? Justifique.
d) Distinga uma solução saturada de uma solução supersaturada.
4ª QUESTÃO - No Egito antigo, queimava-se estrume de camelo para obter um sal que foi chamado sal
ammoniacum (NH4Cl) em homenagem ao deus Amon. Decompondo-se este sal obtém-se o gás amônio (NH3)
cujo nome está relacionado ao deus egípcio.
Partindo das reações:
NH4 Cl(s) NH3(g) + HCl(g) , responda:
a)
b)
c)
Que volume de amônio você obterá nas seguintes condições:
Partindo de 3 moles de NH4Cl a CNTP
A temperatura de 373ºK e 53,5g de NH4Cl.
A CNTP que quantidade de NH4Cl seria necessária, em gramas, para obter 70,2 L de amônio ?
Se um mol de amônio estivesse em um frasco cujo volume fosse de 24,6 L a uma temperatura de 300ºK e
1,015 x 105 Pa, qual será a temperatura do gás no frasco se a pressão foi aumentada para 2,03 x 10 5 Pa ?
d) Com suas palavras, descreva quais as leis em que você se baseou para resolver as questões acima.
Dados (IUPAC):
P=105
Pa = 1 Bar
Vm (CNTP)= 22,71 1/mol
R= 8,314 J (Kmol)
1 ATM = 1,013 x 105 Pa
Dados:
Elementos
N
H
Cl
Nº atômico
7
1
17
Massa atômica
14
1
35,5
5ª QUESTÃO - O HClO (ácido hipocloroso) de fórmula eletrônica H O Cl , e os ácidos HClO2 (ácido
cloroso), HClO3 (ácido clórico) e HClO4 (ácido perclorico). São ácidos oxigenados, formados pelo cloro.
Examinando a fórmula do HClO, faça o que se pede:
a) Dê a estrutura eletrônica de Lewis para os outros ácidos da série.
b) Nomeie quais os tipos de ligações entre os átomos de cada um deles.
c) Dê a distribuição eletrônica da camada de valência para os elementos Cl, H e O dizendo a que período e
grupo cada um deles pertencem.
d) A ligação entre H + Cl HCl é uma ligação exclusivamente covalente, covalente com caráter iônico,
ou iônica ? Justifique sua resposta.
e) Diga o estado de oxidação do cloro em cada um dos compostos dado na questão.